Introducción
En México cada año se pierde superficie forestal, se estima que se pierden 775 800 ha por año de bosques y selvas (Jean-François et al., 2016). Su área de vegetación primaria se reduce constantemente para dar lugar a vegetación secundaria que, si bien cumple otras funciones ecológicas, en ocasiones son menos diversas, por lo que pueden tener funcionalidad limitada, lo que depende también de la historia de los disturbios en el sitio (Mesquita et al. 2015). Estos cambios tienen consecuencias ambientales, económicas y sociales (Chazdon, 2018, González et al., 2014; López-Hernández et al., 2017). Las características de la regeneración vegetal después de un disturbio reflejan la resiliencia del ecosistema para regresar a la estabilidad. La pérdida de biodiversidad y la respuesta de las comunidades vegetales son un criterio esencial para estimar los cambios que se generan y evaluar la capacidad productiva del bosque (Seidl et al., 2017), en especial en donde los ecosistemas han sido fragmentados (Ceccon et al., 2015; Haddad et al., 2015). Los disturbios pueden ser por causas naturales o provocados por diversas actividades antropogénicas, varían en extensión, intensidad, origen y frecuencia; la interacción entre la sociedad y la naturaleza constituyen un sistema socioecológico interdependiente. En especial en zonas marginadas en donde las personas que viven cerca del bosque aprovechan sus recursos para satisfacer necesidades básicas como la alimentación, a través de la colecta de plantas, frutos y leña; o el desmonte para actividades agrícolas y de pastoreo que en ocasiones son abandonadas, dando lugar a la regeneración natural. La estructura y composición de la vegetación varía de acuerdo con el tipo e intensidad del disturbio, así como de otros factores como la fauna dispersora, topografía, condiciones climáticas y capacidad de respuesta de las especies a condiciones adversas (Jadán et al., 2017). Cuando el factor de disturbio cesa, los procesos de regeneración requieren periodos largos para que se establezca la vegetación secundaria que da lugar a una comunidad diferente a la original, a partir de la que se recuperan algunas propiedades estructurales y funcionales del ecosistema (Chang y Turner, 2019). La dispersión de semillas por el viento y fauna silvestre, desde las áreas con vegetación aledañas son determinantes para la expansión de poblaciones (Capulín et al., 2010; Chandra y Kumar, 2015). Los estudios longitudinales entendidos, como el análisis de los cambios que ocasiona el mismo fenómeno a través de diferentes periodos en comunidades vegetales perturbadas, permiten comprender la dinámica del proceso de sucesión, que es esencial para determinar las acciones de restauración ecológica más adecuadas (Jacovak et al., 2015). Al mismo tiempo, permiten monitorear la cobertura vegetal, realizar inventarios florísticos, describir parámetros estructurales y funcionales para evaluar el estado de conservación del recurso e implementar planes de manejo orientados al aprovechamiento sostenible y conservación de los bosques (Tewari, 2016). Después de un disturbio, se crean espacios en el bosque que son aprovechados por especies pioneras que sustituyen a las plantas muertas o en decadencia e incrementan la cobertura en el sotobosque (Tobin, 2015). Por lo anterior, dominan especies anuales de porte pequeño como arbustos y herbáceas de rápido crecimiento con mayor éxito reproductivo. Sin embargo, la vegetación se comporta de manera diferente dependiendo del tipo de disturbio y del tiempo que ha transcurrido desde el evento hasta el momento del registro, además intervienen otro tipo de factores relacionados con el sitio como la topografía, el tipo de suelo y el clima, en general. En esta investigación, se estudiaron la diversidad alfa y beta, así como la estructura y composición de la vegetación en áreas afectadas en diferente tiempo por incendios, actividades agrícolas y pastoreo y en un área sin perturbaciones en la Sierra Sur de Oaxaca, México; que es una región montañosa con gran riqueza forestal en la que destaca la vegetación de pino-encino (Castillo et al., 2016).
La hipótesis de trabajo de este estudio fue que el tipo de disturbio y el tiempo que pasa después de este determina la estructura y diversidad vegetal en el sitio, considerando que cada especie responde de manera diferente a los disturbios, de acuerdo con sus características y sus mecanismos de regeneración, tales como su capacidad de rebrote, adaptación a condiciones adversas y presencia de estructuras reproductivas (Jaksic y Fariña, 2015).
La hipótesis principal planteada fue que la vegetación se modifica de acuerdo con el tipo de disturbio, el tiempo transcurrido desde su ocurrencia y su intensidad; y que este provoca la pérdida de la estructura vegetal, la disminución en la riqueza de especies locales y el aumento de especies.
Objetivos
El objetivo del estudio fue analizar la composición florística, la estructura de la vegetación y los cambios en la sucesión vegetal ocasionados por incendios forestales, descanso agrícola de tierras de cultivo y libre pastoreo en diferentes cronosecuencias comparadas con una zona no intervenida en un bosque de pino-encino.
Materiales y métodos
Área de estudio
El estudio se realizó en un bosque de pino-encino en la comunidad de San Francisco Sola, en la Sierra Sur de Oaxaca, México, en las coordenadas 16º 30’ 56.43” N y 96º 58’ 29.08” O. En el sitio predomina un clima (Aw) caliente subhúmedo con lluvias en verano. La precipitación oscila entre 700 mm y 1000 mm anuales, con temperatura entre 16 °C y 22 °C, según la clasificación de García (2004). La fisiografía presenta variaciones de altitud que van de 1300 m a 2800 m (Instituto Nacional de Estadística y Geografía [Inegi], 2010).
Establecimiento de cronosecuencias
Para analizar la composición florística, la estructura y los cambios en la sucesión de la vegetación, se utilizó el método de cronosecuencias descrito por Dupuy (2017). Se realizaron recorridos en los que se identificaron los lugares en donde habían ocurrido incendios forestales: un año (IF-1), cinco años (IF-5) y seis años (IF-6) antes; tierras de cultivo con descanso agrícola (DA), de ocho años (DA-8) y 20 años (DA-20); y tierras de libre pastoreo (PA). Las anteriores corresponden a siete cronosecuencias y se consideró también una zona de referencia sin intervención (CI). Usando un método de muestreo selectivo, como repeticiones, se establecieron 4 parcelas permanentes de 400m2 cada una, en cada condición (cuatro repeticiones). Los datos se registraron de manera independiente en la temporada de estiaje (noviembre-abril) y de lluvias (mayo-octubre) de 2018. En cada parcela se registró el número de individuos por especie y su forma de vida; con estos datos se calcularon los índices diversidad alfa y beta. Asimismo, se realizó la colecta y preparación de las muestras botánicas, para su determinación taxonómica en el herbario del Instituto Tecnológico del Valle de Oaxaca.
Análisis estructural de la vegetación
Las estructuras vertical y horizontal se analizaron con base en la densidad muestral, la riqueza por formas de vida y con el índice de valor de importancia (IVI) (Curtis y McIntosh, 1951). Este último se obtuvo con la suma de dominancia relativa (DR), abundancia relativa (AR) y frecuencia relativa (FR) (Zarco-Espinosa et al., 2010), para determinar las especies con mayor contribución a la estructura del bosque (Tabla 1).
Tabla 1 Índices de diversidad alfa, en zonas perturbadas por las diferentes condiciones estudiadas.
| C1 | PA | IF-1 | IF-5 | IF-6 | DA-8 | DA-20 | |
| Temporada de estiaje | |||||||
| H | 2.06 ± 0.20 ab | 2.18 ± 0.20 ab | 1.26 ± 0.20 b | 2.34 ± 0.20 a | 2.13 ± 0.20 ab | 2.14 ± 0.20 ab | 2.06 ± 0.20 ab |
| D | 0.23 ± 0.05 ab | 0.16 ± 0.05 b | 0.42 ± 0.05a | 0.13 ± 0.05 b | 0.16 ± 0.05 b | 0.18 ± 0.05 ab | 0.20 ± 0.05 ab |
| J | 0.64 ± 0.05 ab | 0.74 ± 0.10 a | 0.48 ± 0.05 b | 0.78 ± 0.10 a | 0.77 ± 0.05a | 0.70 ± 0.05ab | 0.68 ± 0.05ab |
| Temporada de lluvias | |||||||
| H | 2.12 ± 0.18 bc | 2.65 ± 0.18 ab | 1.60 ± 0.18 c | 2.97 ± 0.18 a | 2.31 ± 0.18 abc | 2.62 ± 0.18 ab | 2.87 ± 0.18 ab |
| D | 0.22 ± 0.04 ab | 0.12 ± 0.04 b | 0.31 ± 0.04 a | 0.067 ± 0.04 b | 0.13 ± 0.04 ab | 0.10 ± 0.04 b | 0.07 ± 0.04 b |
| J | 0.65 ± 0.04 ab | 0.77 ± 0.04 a | 0.55 ± 0.04 b | 0.82 ± 0.04 a | 0.72 ± 0.04 ab | 0.76 ± 0.04 a | 0.79 ± 0.04 a |
Los valores promedio + error estándar. Valores con la misma letra dentro de las filas no difieren estadísticamente (Tukey, P≤0.05); H: índice de Shannon; D: índice de dominancia de Simpson; J= equidad de Pielou; C1: área sin intervención; PA: pastoreo; IF-1, IF-5, IF-6: incendios forestales ocurridos hace 1, 5 y 6 años antes; DA-8, DA-20: áreas con descanso agrícola de 8 y 20 años.
Manejo y análisis de datos
La normalidad y homogeneidad de varianzas de los datos se verificó con la prueba de Shapiro Wilk y Bartlett, respectivamente. Con la información registrada en campo durante la temporada de lluvias, que incluye las especies que permanecen durante el estiaje, se calcularon los índices de diversidad alfa y beta por medio del programa Past 3.21®. Para la primera se usaron los índices: Shannon-Wiener (H'), dominancia de Simpson (σ) y equidad de Pielou (J'); mientras que, para la segunda, fue usado el índice de similitud de Jaccard (IJ). Para todos ellos se realizaron análisis de varianza y pruebas de comparación de medias de Tukey (p < 0.05) con el fin detectar diferencias entre cronosecuencias (Tabla 1). La prueba de Kruskal-Wallis (p<0.05) se realizó para las variables no paramétricas, densidad de población por formas de vida y riqueza. Asimismo, la contribución de las formas de vida en la disimilitud entre las áreas afectadas por los diferentes disturbios se determinó mediante el análisis de porcentajes de disimilitud (SIMPER) (Seaby y Henderson, 2014), utilizando el programa Past 3.21 ®. Los análisis estadísticos se realizaron con el programa InfoStat versión 2018 (InfoStat, 2008).
Resultados y discusión
Composición florística
Los disturbios estudiados no ocasionaron diferencias significativas (F = 0.2546) en la riqueza de especies registrada durante la temporada de estiaje (a). Por el contrario, dicha riqueza de especies sí presentó diferencias significativas (F = 0.0154) durante la temporada de lluvias (Fig. 1). Está ampliamente demostrado que la tolerancia a la sequía condiciona la presencia de especies ya que, incluso, algunas restringen su ciclo de vida a la estación de lluvias (Yan et al., 2015). Sin embargo, en este estudio, la mayor riqueza de especies (53) se registró en el área sin intervención (C1), durante la temporada de estiaje. Este comportamiento era esperado debido a que en un bosque conservado los estratos de vegetación permiten mantener estable su estructura y composición debido a la interacción planta-planta que se establece y que tiene tanto efectos positivos como negativos para cada una de ellas (Padilla y Pugnaire, 2006). Esta estructura forma una barrera de protección ya que la mayor intensidad de la luz se recibe en el dosel superior y se crea un microambiente en donde las condiciones son más favorables que en cualquier condición que haya sufrido algún disturbio, aun en la época de estiaje. Lo anterior, coincide con lo documentado por Pavón et al. (2012), al evaluar un bosque conservado y otro bajo manejo en Hidalgo, México, en donde el número de especies fue mayor en la zona conservada. La riqueza de especies varía de acuerdo con los estadios de sucesión, asociados al tipo de vegetación, a las condiciones topológicas y a las geológicas en el sitio (Zamora-Crescencio et al., 2011).
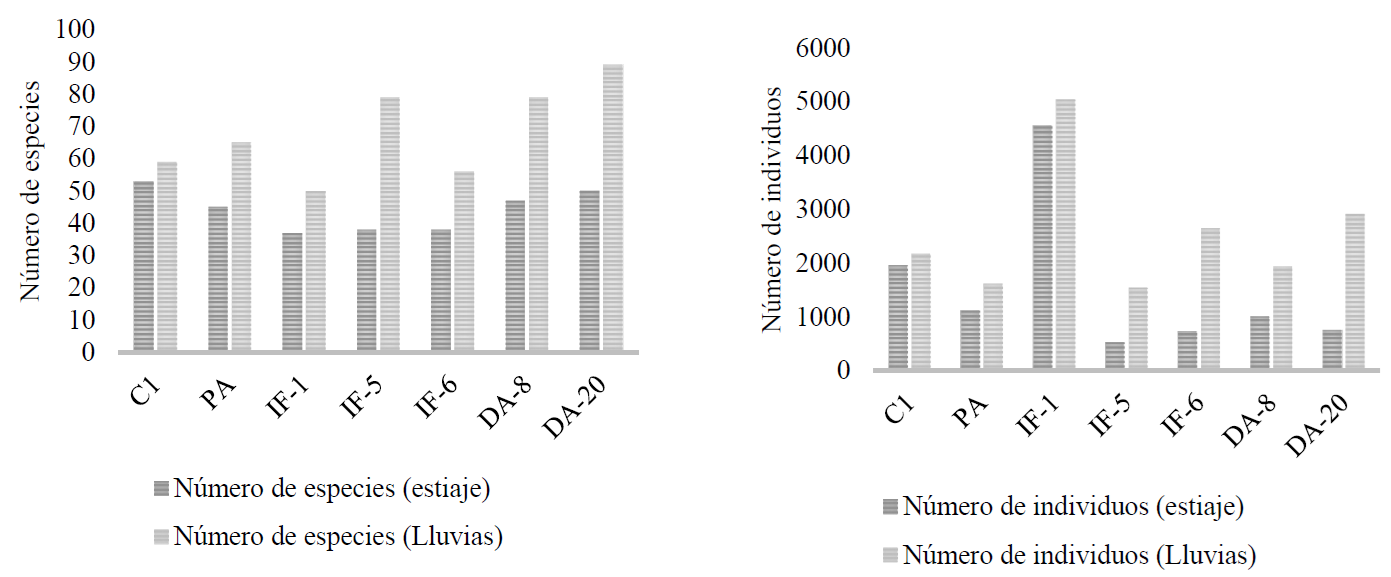
C1: área sin intervención; PA: pastoreo; IF-1, IF-5, IF-6: incendios forestales ocurridos hace 1, 5 y 6 años antes; DA-8, DA-20: áreas con descanso agrícola de 8 y 20 años.
Figura 1 Riqueza (a) y densidad (b) de individuos durante la temporada de estiaje y de lluvias.
Durante la temporada de lluvias, la mayor riqueza (89 especies) se registró en las áreas con descanso agrícola de 20 años (DA-20) y 8 años (DA-8), en donde la mayoría de las especies fueron herbáceas de la familia Asteraceae. Rzedowski (2006) indicó que los ecosistemas más ricos en la familia mencionada son los que se encuentran en estados tempranos de sucesión. Su presencia dominante se puede atribuir a las características de propagación de sus semillas que es anemocoria, por lo que se desplazan con mucha facilidad. Esto les permite mantener el hábito anual con una dinámica poblacional marcada y directamente relacionada con la disponibilidad de agua. Esto concuerda con lo señalado por Singh et al. (2013), quienes añaden que, debido a que su ciclo de vida es corto, su demanda de recursos es mínima.
La menor riqueza se encontró en ambas épocas en el área afectada un año antes por incendio (IF-1) con 37 y 50 especies, respectivamente. El grado de destrucción que causa el fuego ocasiona que se pierda la estructura del dosel (Mahdizadeh y Russell, 2021), por lo que los sitios quedan totalmente descubiertos y están disponibles hábitats extensos para todas las especies presentes (Capitanio y Carcaillet, 2008). Esto aplica tanto para los individuos de los estratos altos que no fueron consumidos totalmente, que pueden morir si perdieron su capacidad de rebrote, como para otros que pueden permanecer por rebrote de tocones o raíces (especies reclutadas asexualmente). En cualquier caso, el disturbio disminuye la diversidad y la capacidad funcional del ecosistema (Pradhan et al., 2018). Sin embargo, en el momento en que las especies pioneras pueden establecerse por germinación de semillas almacenadas en el banco del suelo del dosel o por cualquier otra forma de propagación, la densidad de especies tiende a ser más alta. Si la regeneración es intensiva, la vegetación cubre rápidamente el suelo, entonces la competencia por los recursos limita la germinación de nuevos individuos y elimina progresivamente a las especies menos competitivas; la densidad por especies, por lo tanto, disminuye (Capitanio y Carcaillet, 2008) y se incrementa la uniformidad en la vegetación (Moradizadeha et al., 2020). Los sitios sufren modificaciones físicas severas, por lo que la sucesión de la vegetación es el resultado de la interacción de muchos factores (Malik y Bhatt, 2016). En el caso de este estudio, la zona IF-1 quedó con escasa cobertura y espacios claros generados por el disturbio; la densidad total registrada fue de 4556 individuos durante la temporada de estiaje (F = 0.1083) y 5039 en lluvias (F = 0.1550) (Fig. 1). Autores como Chapungu y Nhamo (2016) coinciden en señalar que los cambios ambientales influyen en la fenología, la riqueza, la abundancia y la distribución de especies. Tanto la riqueza como la densidad de individuos en la temporada de estiaje estuvieron representadas por las familias Asteraceae, Fagaceae, Bromeliaceae, Orchidaceae, Fabaceae y Poaceae. Cada una de ellas cuenta con diferentes ventajas competitivas, por lo que pueden convivir aun en las condiciones limitantes que caracterizan a esta temporada. En cambio, durante la temporada de lluvias, la familia dominante fue Asteraceae, que cuenta con la mayor diversidad (1040 especies) en el estado de Oaxaca (Villaseñor, 2018), además de ser una de las más representativas a escala global, por la diversificación de su proceso evolutivo, que incluye sus exitosos mecanismos de dispersión (Panero y Crozier, 2016; Lohbeck et al. 2014; Villaseñor, 2018). Lo anterior concuerda con lo documentado por Martínez-Icó et al. (2015), en comunidades vegetales de pino-encino en Los Altos de Chiapas, México, donde Asteraceae, Poaceae, Orchidaceae y Fabaceae fueron las familias más abundantes. Según Llamas y Acedo (2016), las especies de la familia Fabaceae también tienen una amplia distribución geográfica (son comunes en vegetación secundaria) y éxito evolutivo, y mejoran la calidad del suelo al fijar nitrógeno. La familia Poaceae exhibe una ventaja fisiológica debido a su metabolismo de fotosíntesis y a algunas modificaciones fisiológicas y ecológicas (Giraldo-Cañas, 2010) que propician un uso más eficiente los recursos. Según Linder et al. (2018), esta familia se caracteriza por su persistencia, colonización, modificación de ambientes, alta flexibilidad ecológica y su resistencia a disturbios. Las especies del género Quercus de Fagaceae son resistentes al fuego debido a sus cortezas gruesas (Graves et al., 2014), por esta razón se asocian a ellas las especies epífitas de las familias Orchidaceae y Bromeliaceae (Espejo-Serna y López-Ferrari, 2018). En el área sin intervención, la diversidad alfa (índice de Shannon) durante ambas temporadas indicó una diversidad media (H = 2.06 durante el estiaje y H = 2.12 en lluvias, Tabla 1). Lo que puede relacionarse con el hecho de que en las áreas sin intervención las condiciones se mantienen uniformes respecto a otras, debido a que la hojarasca mantiene la humedad y temperatura del suelo (Kremer et al., 2014), además de que la estructura de la vegetación mantiene constante la intensidad de luz, la humedad relativa y la temperatura del ambiente, en especial las leñosas que están asociadas con la biodiversidad o la función del ecosistema en los bosques y afectan a otros taxones, al proporcionar microhábitats como las cavidades de los árboles (Remm y Lõhmus 2011; Larrieu et al., 2018). En la Tabla 1 se puede observar que, en el caso del índice de Shannon, los disturbios mostraron diferencias estadísticas en ambas temporadas (p< 0.05). En el caso de la temporada de estiaje, las mayores diferencias estadísticas (p < 0.05) se presentaron entre la zona con IF-1con un valor de diversidad bajo (H =1.26) y la IF-5 con valor medio (H = 2.34). Este valor es similar al obtenido por (Capitanio y Carcaillet, 2008) para un sitio con incendio seis años antes. El índice fue estadísticamente igual para los demás disturbios, incluida el área C1 (H = 2.06); esto indica que, a través del tiempo, la riqueza de especies se ha recuperado incluso hasta rebasar ligeramente a la zona sin disturbios. Al respecto, Odland et al. (2021) observaron que existe menor diversidad y riqueza de especies en sitios que no han estado expuestos al fuego y lo atribuyen a un efecto positivo de este al retroalimentar el sitio, lo que propicia el desarrollo del sotobosque. También mencionan que la severidad del incendio y las condiciones del sitio determinan el comportamiento posterior de la vegetación. Cabe hacer notar el contraste en la temporada de lluvias en donde los mismos disturbios provocaron diferencias estadísticas (p < 0.05). Al considerar los otros índices, tanto en la temporada de estiaje como en la de lluvias, las diferencias estadísticas mayores según la prueba de medias siguieron siendo las zonas IF-1 y IF5. Los valores del índice de dominancia de Simpson indicaron que la zona IF-1 fue la menos diversa con un valor de D = 0.42 durante el estiaje y D = 0.31 durante las lluvias; lo que indica que durante esta última temporada la diversidad se incrementó ligeramente. Aunque el valor (D = 0.13 en estiaje y D = 0.067 en lluvias) de la zona IF-5 indicó que era la más diversa durante ambas temporadas, durante el estiaje fue estadísticamente igual a la zona PA, mientras que durante las lluvias no existeron diferencias estadísticas con PA; DA-8 y DA-20. Al considerar la equidad (índice de Pielou) se puede notar la misma tendencia, en ambas temporadas la zona IF-1 fue la que mostró valores que reflejan menor equilibrio en la abundancia de las especies presentes, en ambos casos fue estadísticamente (p < 0.05) diferente a las demás zonas. Los resultados antes mencionados, coinciden con lo señalado por Moradizadeha et al. (2020), quienes mencionan que un incendio severo puede eliminar la mayoría de las plantas, sean sensibles o no al fuego, modificando la composición original de la comunidad, pero que con el paso del tiempo la diversidad aumenta, creando cierto grado de homogeneidad a pequeña escala y esta última lleva a la heterogeneidad a gran escala. Chandra y Kumar (2015) y Gagnon et al. (2015) mencionan que los incendios y actividades antrópicas determinan la diversidad en un sitio; Pritchett (1991) y Capulín et al. (2010) atribuyen este hecho a las modificaciones que un incendio provoca en el suelo, que se manifiestan por la presencia de un número significativo de individuos, pero baja diversidad, que fue el caso de IF-1 (Fig. 1). Aunque las zonas que fueron usadas para la agricultura y las zonas con incendio tienen en común la pérdida de la vegetación, el impacto de ambos disturbios en el suelo es diferente; en el primer caso, su estructura es modificada de forma severa: la extracción de nutrientes es rápida con una tasa de retorno mínima hasta que se agotan, además de que la erosión hídrica y eólica es constante. En el segundo caso, se modifican las comunidades microbianas en el suelo: los ciclos biogeoquímicos de algunos nutrientes se alteran de forma abrupta e, incluso, pueden abrirse sin que puedan completarse en el corto plazo; en el caso del N, su disponibilidad se vuelve alta de inmediato, en especial en épocas de estiaje, ya que la lluvia hace que se lixivie, por lo que después de un incendio las especies nitrófilas pueden ser exitosas (Rivas et al., 2012). En cambio, el libre pastoreo provoca efectos positivos y negativos en especies con diferentes mecanismos de propagación y formas de vida; ya que puede modificar la germinación de algunas semillas por pisoneo pero no elimina por completo la vegetación, el ramoneo provoca el consumo de ramas tiernas, eliminando los centros de dominancia apical y promoviendo la formación de ramas nuevas, lo que recupera el área foliar y genera mayor cobertura hacia estratos inferiores en donde estos individuos pueden actuar como nodrizas para especies menos resistentes, lo que puede explicar los valores obtenidos en este estudio. También durante ambas temporadas la zona IF-5 (J = 0.78 en estaje y J = 0.82 en lluvias) fue la que mostró los valores que reflejan el mayor equilibrio entre las especies registradas, aunque durante la temporada de estiaje fue estadísticamente igual a PA (J = 0.74) e IF-6 (J = 0.77); mientras que durante las lluvias fue igual a PA (J = 0.77), DA-8 (J = 0.76) y DA-20 (J = 0.79). Dicha dominancia y equidad estuvieron dadas por especies herbáceas que presentaron altas densidades poblacionales. Es importante destacar que la zona C1 reflejó valores intermedios en los tres índices referidos, muy similares a la IF-6 en la mayoría de los casos y a DA-8 y DA-20. A pesar de la severidad de los disturbios, las zonas llegaron a recuperar la riqueza y diversidad, por lo que recuperaron la composición vegetal. Dado que los valores encontrados fueron similares, se puede inferir que llegaron a un equilibrio análogo al de la zona sin intervención, aunque es imposible saber cuánto tiempo pasó en cada caso, ya que la sucesión ecológica es el resultado de factores de sitio como suelo, fisiografía, cobertura, microrganismos del suelo (diversidad funcional), pH, fauna y materia orgánica, y de factores ambientales como la lluvia, la temperatura, el viento, el efecto de borde y la estructura del paisaje (Cepelová y Münzbergová, 2012; Tian et al. 2015). Por su parte, López-Hernández et al. (2017) obtuvieron resultados similares al evaluar distintas fases de sucesión, donde la riqueza de especies mostró diferencias significativas (p < 0.01) en bosques templados mixtos de Puebla, México.
La diversidad beta (índice de Jaccard) difirió en todas las áreas en ambas temporadas. Se observaron porcentajes de 15.93% en IF-5 y 25.34% en el área con libre pastoreo. Estas variaciones están condicionadas por la afectación de los disturbios durante la temporada de estiaje y, según Norden (2014), también están dadas por la regeneración natural mediante la producción, dispersión y germinación de semillas, además de la capacidad de rebrote que muestran algunas especies. Asimismo, en el área con libre pastoreo, DA-8 y DA-20, se presentó una mayor disimilitud con porcentajes entre 10.51% y 19.93% en la temporada de lluvias, con diferencias no significativas (p > 0.05) (Fig. 2). Dichas variaciones se incrementan debido a la presencia de especies con ciclos de vida anuales y a que las áreas evaluadas presentan intervalos de tiempo entre 1 año y 20 años, después del disturbio. Además, Redondo et al. (2011) y Álvarez-Lopeztello et al. (2016) mencionan que los cambios en la vegetación y su restauración están determinados por la evolución de las características del suelo tanto físicas como químicas.
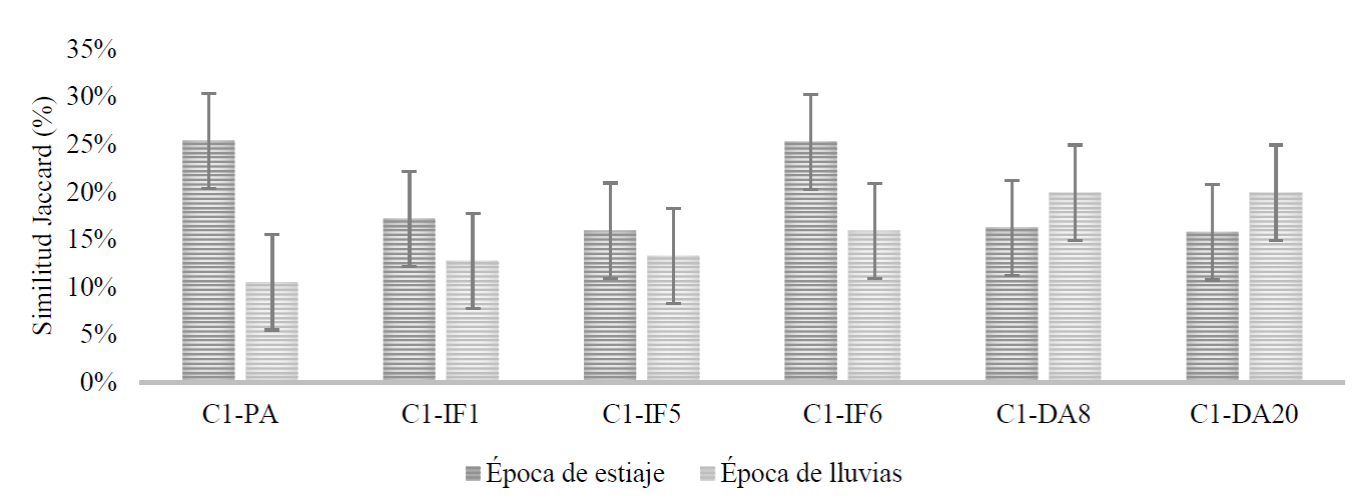
No existieron diferencias estadísticas significativas (Tukey, P≤0.05) por lo cual se omiten las letras en las barras; C1: área sin intervención; PA: pastoreo; IF-1, IF-5, IF-6: incendios forestales ocurridos hace 1, 5 y 6 años antes; DA-8, DA-20: áreas con descanso agrícola de 8 y 20 años.
Figura 2 Índice de similitud de Jaccard en las áreas en la temporada de estiaje (media ± 8.44 desviación estándar) y de lluvias (media ± 6.76 d.e.).
Estructura de la vegetación y cambios en la sucesión
En las zonas afectadas por los disturbios, se encontraron diferencias estadísticas entre todas las áreas durante ambas temporadas de estudio usando los niveles de significacncia de p = 0.05. Las especies herbáceas fueron el estrato con mayor presencia durante ambas temporadas, 14 spp en IF-1, 18 en DA-8 y 16 en DA-20 en estiaje (Fig. 3). Las especies herbáceas juegan un papel muy importante en la productividad primaria de cualquier sitio, Gómez-Romero et al. (2013) mencionan que, debido a su ciclo anual, no son competidoras fuertes; aunque, según Castro y Leverkus (2019), sí compiten con especies locales que se establecen mediante germinación, no obstante, su efecto desaparece algunos años después del disturbio. Además, contribuyen al aporte de materia fresca y seca, proveen cobertura y nutrientes al suelo, hacen menos bruscos los cambios de temperatura y humedad. En este estudio, se encontraron diferencias entre la estructura de la vegetación de la zona de referencia y las otras zonas después de los disturbios y periodos estudiados. Dicha estructura refleja las características particulares de cada disturbio y las consecuencias que produce. En las zonas afectadas tanto por pastoreo (PA) como por IF-1 la estructura es similar, a pesar de que en el primer caso el disturbio es permanente. El disturbio por pastoreo es selectivo y menos drástico que el ocasionado por fuego, ya que el ganado no tiene la misma afinidad por el consumo de todas las especies presentes en la zona, además de que su talla determina los estratos que se afectan siendo el herbáceo el más dañado por consumo o por pisoteo; durante este disturbio se deposita materia orgánica a través de los restos de vegetación y las heces, lo que repercute sobre la dinámica de nutrimentos y la flora microbiana (Rivas et al. 2012). En cambio, como se ha mencionado antes, el disturbio por fuego es abrupto y menos selectivo; durante este se consume la biomasa depositada en el piso forestal, los individuos de estratos bajos son consumidos totalmente y se modifica el ciclo del nitrógeno. Ball et al. (2010) también señalan que, dependiendo de las características del suelo antes del incendio, las tasas brutas y netas de nitrificación pueden modificarse significativamente. Los procesos de minera-lización de algunos nutrimentos y la composición de la vegetación y la temperatura que se alcance pueden acumular en el suelo cantidades importantes de calcio y potasio en forma de óxidos, además de que sus efectos más notables son sobre el N y el P (Capulín et al., 2010). Lo anterior puede explicar la similitud entre la estructura de las dos zonas referidas, en ambos casos es frecuente que sobrevivan los individuos de estratos altos y con ellos las especies epífitas. Menini et al. (2019) registraron 65% de especies epífitas arriba de 3 m de altura sobre forofitos vivos y muertos. Estos autores atribuyen este hecho a que, a esa altura, el calor y el fuego mismo causan menos daño que a nivel de las plantas herbáceas, además de que dichos forofitos pueden presentar grietas o espacios en sus ramas donde se puede acumular materia orgánica que provee los nutrientes necesarios a las epífitas. En este caso, no existió diferencia estadística entre la estructura vegetal de C1 (17 especies epífitas), del área de libre pastoreo (17 especies) y de IF-5 (12 especies); pero estas fueron significativamente diferentes (p = 0.007) con respecto a las demás áreas evaluadas.
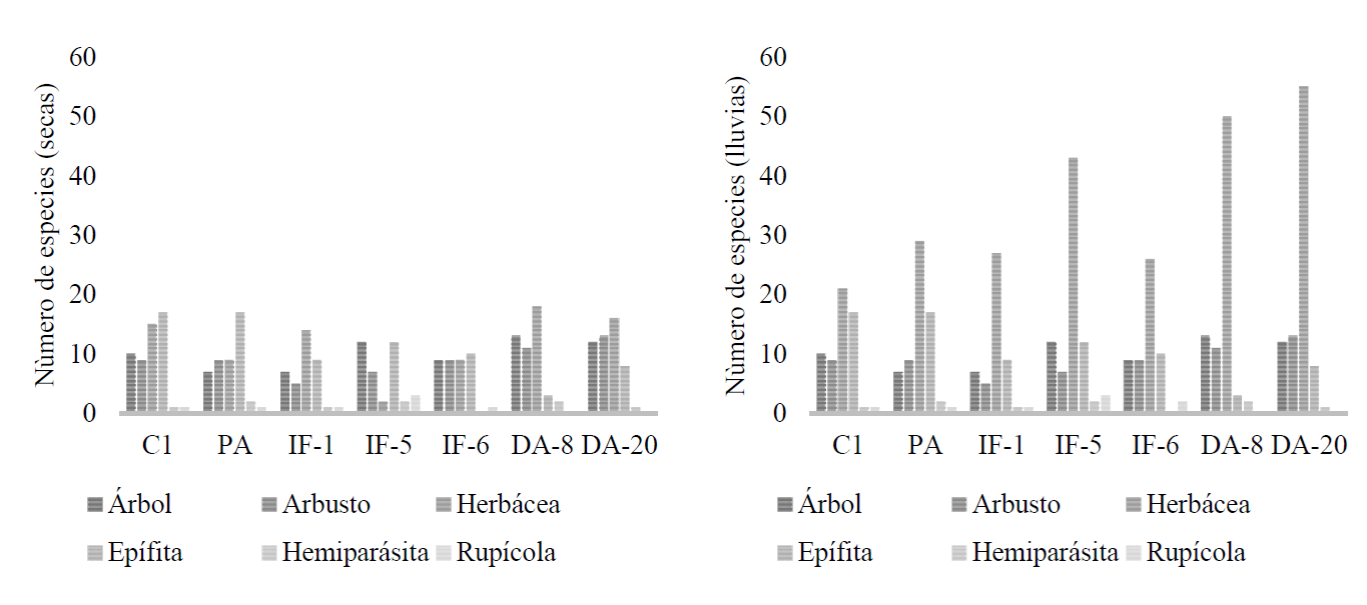
C1: área sin intervención; PA: pastoreo; IF-1, IF-5, IF-6: incendios forestales ocurridos hace 1, 5 y 6 años antes; DA-8, DA-20: áreas con descanso agrícola de 8 y 20 años.
Figura 3 Riqueza de especies entre las áreas evaluadas, de acuerdo con sus formas de vida.
En este estudio, la presencia de árboles y arbustos de menor altura en DA-8 ocasionó que las plantas epífitas se redujeran a solo tres especies. La estructura del dosel determina las variaciones en el microclima: de forma general, entre más abierto sea el dosel, la radiación fotosintéticamente activa y la temperatura son mayores y la humedad relativa es menor en comparación con un dosel más denso (Susan-Tepetlan et al., 2015). El análisis de porcentajes de disimilitud (SIMPER) mostró que epífitas y árboles contribuyeron con 60% y 30%, respectivamente, en C1 y PA; además, dichas áreas mostraron una disimilitud media (DM) de 10.42% (Tabla 2). En zonas sin intervención, existen árboles de mayor tamaño y son unidades de mayor riqueza de especies de hábito epífito (Flores-Palacios y García-Franco, 2006). De la misma forma, las plantas herbáceas (56.52%), las epífitas (21.74%), los árboles (8.69%), los arbustos (8.69%) y las hemiparásitas (4.34%) propiciaron una disimilitud media de 26.44%, entre C1 e IF-5 (Tabla 3). Como se ha mencionado anteriormente, los disturbios generan cambios en la composición y aumento en la riqueza de especies herbáceas, las cuales son importantes dado que son fuente de alimento de diversos organismos (O-Toris et al., 2012; Mushtaq et al., 2017). Por otro lado, las especies con los mayores índices de valor de importancia (IVI) fueron: Pinus pseudostrobus var. apulcensis (IVI = 36.01) y Quercus acutifolia Née (IVI = 21.28) en C1; Quercus acutifolia Née (IVI = 42.53) y Quercus peduncularis (IVI = 41.01) en PA. Pinus lawsonii Roezl, con IVI de 79.94, 86.55 y 35.85, sobresalió en IF-1, IF-6 y DA-8, respectivamente. Quercus peduncularis se registró en C1, PA, IF-5, IF-6 y DA-20. Dichas especies mostraron tolerancia a los disturbios estudiados y, mediante mecanismos de rebrote o germinación, incrementaron sus densidades poblacionales. Martin-Alcón y Coll Mir (2016) describen una tendencia similar en Pinus nigra, por su capacidad resiliente al fuego, lo cual es determinante en la futura regeneración de los sitios. Algunos estudios han señalado que Quercus magnoliifolia y Quercus rysophylla muestran resistencia a las quemas de baja intensidad, presentan capacidad de rebrote e incrementan su densidad poblacional después de algún disturbio (López et al., 2015; González-Tagle et al., 2008). Al respecto, Johnstone et al. (2016) mencionan que los rasgos de la historia de vida de una especie son un mecanismo de adaptación ante las perturbaciones y Bond y Keane (2017) señalan que dicha resistencia se debe a características propias de las especies tales como mayor producción de semillas, cortezas gruesas, copas abiertas, tolerancia a condiciones adversas o raíces profundas. Hierbas como Crotalaria incana L. (IVI = 44.29) en IF-1 (Tabla 3) aprovechan los espacios generados por el disturbio y su población es numerosa. Dicha especie es ruderal y característica de vegetación secundaria en bosques de pino y de pino-encino, es una especie leguminosa por lo que mejora la fertilidad del suelo. Por otra parte, en C1, Tillandsia calathyrsus se registró con un IVIde 9.21, en PA la misma especie obtuvo un IVI de 13, en IF-5 de 11.95 y en DA-20 de 7.29. Prostechea citrina con un IVI de 7.27 sobresale en IF-6. Dichas especies son responsables de albergar fauna y de mantener condiciones de humedad dentro de los bosques.
Tabla 2 Análisis SIMPER que muestra el porcentaje de similitud, la disimilitud media y porcentaje de contribución de cada estrato.
| Estratos vegetales | DM | C (%) | DM | C (%) | DM | C (%) |
| C1-PA | C1-IF1 | C1-IF5 | ||||
| Herbácea | 0 | 0 | 9.09 | 50 | 14.94 | 56.52 |
| Árbol | 30.12 | 30 | 4.54 | 25 | 5.74 | 21.74 |
| Hemiparásita | 1.04 | 10 | 3.40 | 18.75 | 2.29 | 8.69 |
| Epifita | 6.25 | 60 | 1.13 | 6.25 | 2.29 | 8.69 |
| Arbusto | 0 | 0 | 0.0 | 0 | 1.14 | 4.34 |
| PD (%) | 10.42 | 18.18 | 26.44 | |||
| C1-IF6 | C1-DA8 | C1-DA20 | ||||
| Herbácea | 1.12 | 6.66 | 2.02 | 8.69 | 0.98 | 6.25 |
| Árbol | 1.12 | 6.66 | 3.03 | 13.04 | 1.96 | 12.5 |
| Hemiparásita | 0 | 0 | 1.01 | 4.34 | 0 | 0 |
| Epifita | 7.86 | 46.67 | 14.14 | 60.87 | 8.82 | 56.25 |
| Arbusto | 6.74 | 40.0 | 3.03 | 13.04 | 3.92 | 25 |
| PD (%) | 16.85 | 23.23 | 15.69 | |||
DM= disimilitud media; C %: porcentaje de contribución; PD: porcentaje de disimilitud
Se utiliza una zona sin intervención (C1) como referencia.
Tabla 3 Dominancia relativa (DR), densidad relativa (DN), frecuencia relativa (FR) e índice de valor de importancia (IVI) de especies con mayores registros en áreas evaluadas durante dos temporadas anuales.
| Especie | DR (%) | DN (%) | FR (%) | IVI | DR (%) | DN (%) | FR (%) | IVI |
| C1 | PA | |||||||
| Pinus pseudostrobus var. apulcensis (Lindl.) Shaw | 2.39 | 2.61 | 31.00 | 36.01 | - | - | - | - |
| Quercus acutifolia Née | 13.55 | 4.38 | 3.34 | 21.28 | 27.87 | 11.01 | 3.64 | 42.53 |
| Rumfordia floribunda DC. | 0.08 | 14.96 | 1.43 | 16.49 | - | - | - | - |
| Quercus peduncularis Née | 8.74 | 2.65 | 3.34 | 14.75 | 28.50 | 8.85 | 3.64 | 41.01 |
| Quercus candicans Née | 12.91 | 0.57 | 0.95 | 14.44 | - | - | - | - |
| Tillandsia calothyrsus Mez | - | 6.82 | 2.39 | 9.21 | - | 10.4 | 2.60 | 13.00 |
| Pinus lawsonii Roezl ex Gordon | - | - | - | - | 26.32 | 7.08 | 2.60 | 36.02 |
| Quercus crassifolia Bonpl. | - | - | - | - | 7.66 | 7.01 | 3.12 | 17.80 |
| IF-1 | IF-5 | |||||||
| Pinus lawsonii Roezl ex Gordon | 69.16 | 7.57 | 3.20 | 79.94 | - | - | - | - |
| Crotalaria incana L. | - | 43.01 | 1.28 | 44.29 | - | - | - | - |
| Quercus candicans Née | 14.80 | 6.85 | 1.28 | 22.94 | - | - | - | - |
| Quercus crassifolia Bonpl. | 1.84 | 8.52 | 3.84 | 14.22 | - | - | - | - |
| Arbutus xalapensis Kunth | 8.29 | 1.10 | 4.48 | 13.88 | 3.81 | 2.12 | 5.07 | 11.00 |
| Quercus acutifolia Née | 3.64 | 0.90 | 4.48 | 9.03 | 36.66 | 12.56 | 5.07 | 54.30 |
| Quercus peduncularis Née | 51.47 | 21.59 | 5.07 | 78.12 | - | - | - | - |
| Tillandsia calothyrsus Mez | - | 7.61 | 4.34 | 11.95 | - | - | - | - |
| IF-6 | DA-8 | |||||||
| Pinus lawsonii Roezl ex Gordon | 62.66 | 21.11 | 2.77 | 86.55 | 21.63 | 11.26 | 2.95 | 35.85 |
| Pinus pseudostrobus var. apulcensis (Lindl.) Shaw | 18.50 | 1.76 | 2.77 | 23.05 | - | 13.29 | 2.95 | 16.24 |
| Baccharis salicifolia Nutt. | 1.79 | 10.87 | 3.33 | 16.00 | 11.45 | 7.86 | 3.55 | 22.86 |
| Juniperus flaccida var. flaccida | 2.78 | 7.20 | 3.33 | 13.32 | 1.71 | 13.29 | 2.95 | 17.96 |
| Quercus acutifolia Née | 3.58 | 5.81 | 3.88 | 13.28 | 7.01 | 1.62 | 4.14 | 12.77 |
| Quercus peduncularis Née | 7.21 | 1.76 | 3.88 | 12.87 | - | - | - | - |
| Euchile citrina (Lex.) Withner | - | 5.05 | 2.22 | 7.27 | - | - | - | - |
| DA-20 | ||||||||
| Quercus peduncularis Née | 39.78 | 10.89 | 3.70 | 54.38 | - | - | - | - |
| Quercus acutifolia Née | 25.69 | 5.75 | 3.70 | 35.15 | - | - | - | - |
| Calliandra houstoniana (Mill.) Standl. | 4.93 | 22.88 | 3.70 | 31.53 | - | - | - | - |
| Pinus pseudostrobus var. apulcensis (Lindl.) Shaw | 14.11 | 4.77 | 2.64 | 21.53 | - | - | - | - |
| Tillandsia calothyrsus Mez | - | 4.65 | 2.64 | 7.29 | - | - | - | - |
El signo “-“indica que no se registró la especie en el sitio evaluado
Las plantas epífitas son indicadoras de calidad en un determinado ecosistema, porque dependen de condiciones específicas para sobrevivir (Fernández et al. 2016). Por ello, es fundamental describir mecanismos de respuesta vegetal en ambientes con disturbios, para conocer el estado de conservación de bosques, comprender y describir características estructurales, además de generar bases y estas sean consideradas en futuras acciones de restauración y elaboración de programas de manejo forestal. Es evidente que las especies herbáceas marcan la dinámica en ambas temporadas, sus porcentajes de contribución son muy importantes en los casos de IF-1 e IF-5; lo anterior, comprueba que durante la recuperación de un ecosistema intervienen especies herbáceas pioneras que migran mediante diversos mecanismos y que son favorecidas por las lluvias y la escasa distribución de especies de mayor altura (Hernández Benalcázar, 2016).
Matayaya et al. (2017) y Wragget al. (2018) mencionan que los disturbios, y en particular el fuego, propician la riqueza de especies herbáceas. Por otra parte, la contribución de las epífitas en todos los disturbios estudiados da una idea general de la capacidad para reestablecer la diversidad funcional del ecosistema. Los resultados de este estudio pueden contribuir a comprender la dinámica de la sucesión y las características estructurales de la vegetación en los casos estudiados.
Conclusiones
Las variables estudiadas permitieron establecer que el disturbio ocasionado por fuego fue el que causó mayor daño a la estructura y diversidad de la vegetación, sin embargo, fue el que permitió que la vegetación se estableciera en menor tiempo después de su ocurrencia. Las áreas con descanso agrícola fueron las que tardaron más en presentar una recuperación similar a la zona no intervenida. El periodo que transcurre desde que sucede un disturbio hasta la recuperación de la estructura y diversidad de la vegetación depende de la severidad de este, ya que la sucesión vegetal presenta dinámicas diferentes relacionadas con el grado de daño ocasionado a los componentes bióticos y abióticos del ecosistema. La composición florística varió de acuerdo con el tipo, severidad y tiempo transcurrido después del disturbio, mientras que la riqueza de especies se relacionó con la estructura vegetal en el sitio, que determina las condiciones micro ambientales.











 nueva página del texto (beta)
nueva página del texto (beta)


