Introducción
La costa es una zona dinámica de transición entre ambientes terrestres y oceánicos que ha resultado de la acción de forzantes físicos (v. g. ríos, mareas y olas), evolución geomorfológica (v. g. balance entre tasas de erosión y sedimentación) e hidrológica (agua dulce superficial y subterránea, agua marina, evaporación, precipitación) (Rovai et al., 2018).
La variedad de combinaciones de estos forzantes físicos favorece la presencia de diferentes configuraciones costeras; en el caso de los humedales costeros, se presentan arreglos espaciales heterogéneos compuestos por un mosaico de comunidades biológicas variadas tales como ciénegas, marismas de agua dulce y marinas, bosques de agua dulce y manglares, pastos marinos y arrecifes de coral, entre los más relevantes. La distribución espacial de los humedales costeros obedece a gradientes espaciales de salinidad, niveles topográficos, hidroperiodo y fuente de agua dulce (superficial o subterránea) o marina (Herrera-Silveira y Comín, 2000; Flores-Verdugo et al., 2007; Hernández-Arana et al., 2015). Debido a la heterogeneidad espacial de las comunidades biológicas, la mejor aproximación a su estudio en las escalas local y regional es a través de un enfoque paisajístico estructurado en corredores transversales costeros.
Cada configuración, o unidad dentro del paisaje de humedal costero, tiene una huella ambiental específica de controladores y procesos responsables de las características de estructura y función que dan soporte a la diversidad de servicios ambientales que ofrecen. Las unidades funcionales del paisaje de humedal costero no están aisladas debido a la conexión transversal relacionada con la matriz hidrológica pudiéndose formar complejas conexiones con otras unidades dentro del paisaje (Bornette, Amoros y Lamouroux, 1998; Cohen et al., 2016; Thorslund et al., 2017).
La conservación y permanencia del paisaje costero está vinculado con el bienestar humano a través de diversos servicios ambientales (Calhoun et al., 2017; Creed et al., 2017; Yao et al., 2017) y constituyen una importante fuente de biodiversidad (Costanza, et al., 1997; Gibbs, 2000). Uno de estos servicios ambientales con relevancia local, regional y global es la regulación de gases de efecto invernadero a través de los almacenes y flujos de carbono orgánico aéreo y subterráneo (Bridgham, Megonigal, Keller, Bliss y Trettin, 2006; Intergovernmental Panel on Climate Change [IPCC], 2011; Mitsch et al., 2013; Herrera-Silveira et al., 2016).
El carbono contenido en la vegetación costera principalmente en manglares, praderas de pastos marinos y marismas de marea es denominado como "carbono azul" (Mcleod et al., 2011) y sus almacenes ya han sido evaluados como muy importantes. Sin embargo, están desapareciendo o empeorando su condición como resultado de las continuas presiones de desarrollo antrópico, lo que se traduce en emisiones de gases de efecto invernadero a la atmósfera (Pendleton et al., 2012).
La iniciativa de carbono azul es atractiva tanto en investigación como para los interesados en políticas de conservación. El carbono azul ofrece un marco de referencia como estrategia potencialmente rentable tanto para lograr reducciones genuinas en las emisiones de gases de efecto invernadero como para fortalecer los beneficios colaterales de los almacenes y flujos de carbono. Por otra parte, los ecosistemas de carbono azul proporcionan el hábitat para especies alimentarias valiosas, depuran la contaminación industrial y urbana y proporcionan una defensa eficaz contra las tormentas y los fenómenos meteorológicos extremos (Nellemann et al., 2009; Grimsditch, Alder, Nakamura, Kenchington y Tamelander, 2013). A pesar de los beneficios de mitigación y adaptación que resultan de la protección o restauración de los ecosistemas de carbono azul, la evaluación de los almacenes de carbono se ha centrado a un ecosistema de forma individual, o bien, en el componente aéreo o subterráneo en un solo ecosistema tal como el manglar (Walcker et al., 2018), los pastos marinos (Duarte et al., 2010; Fourqurean et al., 2012; Lavery, Mateo, Serrano y Rozaimi, 2013; Campbell, Lacey, Decker, Crooks y Fourqurean, 2015; Gullström et al., 2017), o las marismas (Bai et al., 2016; Macreadie et al., 2017; Sousa et al., 2017), sin considerar que forman parte de un paisaje a lo largo de un corredor transversal costero. En la literatura son escasos los trabajos que incluyen más de una comunidad en las evaluaciones de almacenes de carbono orgánico en paisajes de humedales costeros (Choi, Hsieh y Wang, 2001; Chmura, Anisfeld, Cahoon y Lynch, 2003; Adame et al., 2013; Huxham, Whitlock, Githaigay Dencer-Brown, 2018). Entre otros aspectos, estos estudios son escasos debido a que cada tipo de humedal requiere diferentes aproximaciones metodológicas (Howard, Hoyt, Isensee, Pidgeon y Telszewski, 2014).
Por otra parte, de los escenarios ambientales costeros los de tipo cárstico, como el de la Península de Yucatán, resultan de interés para la evaluación de los almacenes de carbono de los ecosistemas costeros. Esto es debido a que la fuente de agua dulce es casi exclusivamente subterránea, libre de materia particulada, con influencia marina por la cuña salina que se origina gracias a las cavidades formadas por la disolución de la roca calcárea (Bautista, Palacio-Aponte, Quintana y Zinck, 2011). Adicionalmente, la plataforma de Yucatán tiene escasa pendiente, por lo que en la zona costera existe marcada interacción entre elementos y características oceánicas (marea y oleaje) y terrestres (descargas de agua subterránea, acuífero somero), favoreciendo un paisaje de humedal costero cuya extensión puede abarcar más de 20 km tierra adentro (Rejmankova, Pope, Post y Maltby, 1996). En este contexto, la estructura del paisaje de humedal costero, en el escenario cárstico del norte de Yucatán, es ideal para la cuantificación y el registro de la variación que presentan los almacenes de carbono en las distintas unidades de paisaje a lo largo de un corredor transversal costero.
Objetivos
Evaluar las reservas de carbono en ocho humedales; pastos marinos en mar costero, asociaciones de herbáceas halófilas, manglar chaparro, manglar de ciénega, pastos marinos en laguna costera, manglar de cuenca, vegetación emergente alta y sabana que forman un corredor transversal costero continuo.
Materiales y métodos
El área de estudio comprendió un transecto paralelo a la carretera federal 103 Sierra Papacal-Chuburná, en la costa norte de la península de Yucatán, México (Fig. 1) en la cual fueron ubicados ocho unidades del paisaje de humedal, de estos, seis fueron muestreados vía terrestre: la sabana inundable, la vegetación acuática emergente, el manglar de cuenca, el manglar de ciénega, manglar chaparro y la asociación de vegetación halófila; y dos por vía acuática: la vegetación acuática sumergida de la laguna y la del mar costero.
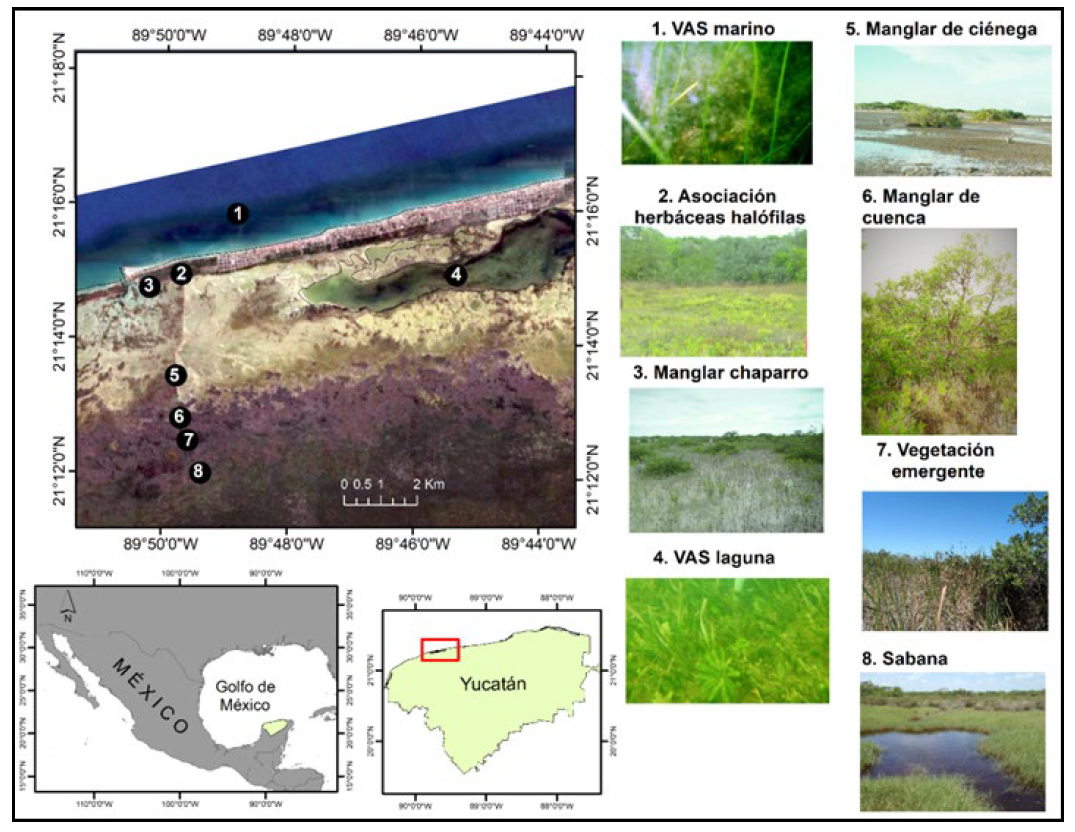
Figura 1 Localización de los ocho humedales estudiados en el corredor costero de la Península de Yucatán al sureste de México.
Durante el periodo 2013-2014 se establecieron en cada sitio (unidad de paisaje) cinco parcelas de acuerdo con el diseño de muestreo (Fig. 2). En cada sitio fueron tomados datos a escala de parcela: la profundidad del suelo con ayuda de una varilla metálica graduada (m), registros de pH mediante un medidor portátil (MP-6p, HACH, USA), la salinidad intersticial medida con refractómetro óptico (ATAGO, Japón), registrada en ups y, finalmente, el nivel de inundación medido con una regla para el caso de los humedales terrestres (cm); para el caso de vegetación sumergida se midió el nivel de profundidad, mediante un profundímetro (Hondex ps-7) (m).
El perfil topográfico se realizó mediante un sistema diferencial con el método stop and go (GPS LEICA, modelo GS09, GS14 y GS15) registrado en alturas ortométricas, lo cual para la región es equiparable a la altitud sobre el nivel del mar (m s.n.m.).
La cuantificación de los almacenes de carbono aéreo y subterráneo de pastos marinos y manglares fue realizada según los métodos propuestos en Fourqurean et al., (2014). En el caso de los humedales no contemplados en el manual y dominados por herbáceas, se procedió a la identificación de las especies presentes y a la determinación de su cobertura, posteriormente se realizó la colecta de biomasa por el método de cosecha en pie (Milner y Hughes, 1968).
La colecta de sedimento se realizó con un nucleador metálico de 100 cm por 7 cm de diámetro interno. En todos los casos los núcleos obtenidos fueron seccionados sistemáticamente para obtener perfiles cada 10 cm. Se realizó la caracterización de los núcleos por perfil, la cual incluyó la identificación del color en húmedo (de acuerdo con la escala de las tablas Munsell), así como su contenido (raíces finas, rocas calcáreas, conchas, etcétera).
Las muestras de vegetación y sedimentos fueron secadas en un horno con circulación forzada de aire (Thermo Scientific™) a 70 °C por 72 h. Para ara la vegetación, se midió la biomasa seca (g m-2) y para los sedimentos, la densidad aparente. El contenido de materia orgánica en el sedimento fue determinado por el método de pérdida por ignición (LOI, por sus siglas en inglés) (Sanders et al., 2012), utilizando un factor de conversión de 1.724 para convertir el resultado del LOI a carbono orgánico (Schumacher, 2002).
Las muestras de biomasa seca y las de sedimento fueron maceradas, tamizadas y encapsuladas en celdas de estaño para la determinación de carbono total (CT) y nitrógeno total (NT) en un autoanalizador elemental Thermo Quest (Flash EA 1112), los resultados fueron expresados como porcentaje. En el caso del sedimento se realizó el análisis del fósforo total de acuerdo con los métodos de Aspila, Agemian y Chau (1976), el resultado se registró en porcentaje.
El almacén de carbono de la vegetación fue estimado como el producto del porcentaje de carbono (C) y la biomasa; mientras que para el suelo se estimó a partir de la densidad aparente seca y el contenido estimado de carbono orgánico. Los resultados del almacén fueron expresados en megagramos por hectárea.
El almacén aéreo de cada paisaje estuvo conformado por la sumatoria de los elementos de la vegetación tales como hojas, ramas, tallos, neumatóforos, hojarasca; mientras que el almacén subterráneo resultó de la suma entre la biomasa subterránea (raíces y rizomas) y el contenido del sedimento. Las estimaciones del almacén de carbono por unidad de paisaje fueron realizadas utilizando aproximaciones de las extensiones conocidas de cada tipo de humedal de acuerdo con el Programa de Ordenamiento Ecológico del Territorio Costero del Estado de Yucatán [Poetcy] (2007) y para la vegetación acuática sumergida (VAS) utilizando como referencia las áreas observadas por Palafox-Juárez y Liceaga-Correa (2017).
Resultados
Características ambientales de los humedales costeros
De acuerdo con la tabla 1, los humedales terrestres se encontraron distribuidos en el gradiente de tierra a mar en niveles topográficos entre negativos y positivos. Esto indica que se presentaron algunos sitios con inundación permanente como los pastos marinos, mientras que en otros las fluctuaciones fueron frecuentes (manglares chaparros y manglar de ciénega), periódicas (manglar de cuenca y vegetación emergente) o estacionales (sabana).
Tabla 1 Valores promedio ± desviación estándar (min-máx) de las características ambientales de los humedales costeros cársticos tropicales de la costa norte de Yucatán.
| Unidad del Paisaje | Nivel topográfico (m s.n.m.) | Nivel de inundación (cm) | Salinidad superficial (ups) | Salinidad intersticial (ups) | pH | Profundidad del sedimento/suelo (cm) |
| Sabana |
+ 0.38 a + 0.29 |
5.5 ± 8.6 (0-26) |
7.7 ± 2.7 (4.9-15) |
13.6 ± 7.5 (5.6-30) |
6.5 ± 1.2 (6-7.8) |
12.5 |
| Vegetación emergente |
+ 0.26 a + 0.29 |
11.8 ± 7.4 (0-34) |
8.6 ± 7.6 (1.5-43) |
13.4 ± 8.3 (2.9-35.8) |
6.7 ± 1.3 (6.1-7.9) |
(5-20) |
| Manglar de cuenca | + 0.16 a + 0.22 |
11.1 ± 10.3 (0-45) |
26.2 ± 22.6 (10-65) |
44.2 ± 25.8 (14.6-120) |
7.6 ± 1.2 (6-8.7) |
20.6 ± 7.7 (11-29) |
| VAS lagunar | -0.4 a -1.5 |
111.3 ± 77.5 (50-280) |
38.8 ± 3.1 (35.7-43.8) |
38.8 ± 3.1 (35.7-43.8) |
8.13 ± 0.11 (7.9-8.2) |
34.3 ± 16.7 (17-58) |
| Manglar de ciénega | -0.28 a -0.35 |
11.3 ± 12.2 (0-30) |
21.9 ± 19.4 (1.4-65) |
54.2 ± 24.1 (9.2-93) |
7 ± 0.19 (6.3-7.8) |
30-50 |
| Manglar chaparro | -0.0 a -10.0 |
3.1 ± 5.4 (0-15) |
25.8 ± 24.7 (2-66.9) |
54.8 ± 21.8 (2.2-100) |
8.1 ± 0.4 (7.6-8.7) |
45.3 ± 5 (40-50) |
| Asociación halófila | -0.27 a -0.30 |
3.6 ± 3.7 (0-10) |
14.4 ± 7.8 (6.3-31.5) |
39.2 ± 26.2 (4.7-102) |
8.3 ± 0.14 (8.1-8.4) |
54.3 ± 24.3 (33-100) |
| VAS marina | < -1.52 |
251.4 ± 103.3 (160-500) |
34.9 ± 1.1 (34.4-38.8) |
35 ± 1.09 (34.4-38.8) |
8.02 ± 0.14 (7.7-8.2) |
25 ± 6.5 (15-31) < 30 |
El sitio de sabana fue el menos influenciado por los procesos marinos, presentándose en el nivel topográfico más alto del corredor transversal y en suelo escaso (Tabla 1). Este humedal está sobre roca impermeable que favorece la acumulación de agua de lluvia, sin embargo, la roca llega a fracturarse facilitando la intrusión de la cuña salina y registrándose niveles de inundación bajos (< 5 cm), pero continuos en el tiempo y con variación en la salinidad intersticial (5 ups - 30 ups).
Por lo que respecta al humedal de vegetación emergente, este se caracterizó por estar en suelo escaso, pero rico en materia orgánica y amplia cobertura vegetal (Tablas 1, 2 y 3); recibe influencia tanto del agua subterránea como marina reflejándose en salinidades intersticiales que van de muy bajas a marinas (de 2.9 ups a 35.8 ups).
Tabla 2 Especies principales y coberturas en las unidades de paisaje del corredor transversal de humedales cársticos del norte de Yucatán.
| Paisaje | Especie(s) dominate (s) | Cobertura (%) |
| Sabana | Spartina spartinae (Trin) (Merr) | 40-100 |
| Distichlis spicata (l) E. Greene. var. spicata | 20 | |
| Vegetación emergente | Typha domingensis Pers | 40 |
| 20 | ||
| Conocarpus erectus var sericeus E Frorst ex D.C Avicennia germinans (L.) L.T | 10 | |
| Manglar de cuenca | Avicennia germinans (L.) L. | 80-90 |
| VAS lagunar | Halodule wrightii (Asch.) | 0-30 |
| Thalassia testudinum Bank ex König | 5-10 | |
| Algas | 30-40 | |
| Manglar de ciénega | Rizophora mangle (L.) C. DC | 10 |
| Avicennia germinans (L.) L.T | 60 | |
| Laguncularia racemosa (L.) C.F. Gaerth | 2 | |
| Manglar chaparro | Avicennia germinans (L.) L.T | 80-90 |
| Rizophora mangle (L.) C. DC | <1 | |
| Distichlis spicata (l) E. Greene. var. Spicata | 70-80 | |
| Asociación halófila | Fimbristylis spadicea (L.) Vahl | 20-45 |
| Monanthochloe littoralis Engelm | 20-30 | |
| Salicornia bigelovii (Torr) | 35 | |
| Sesuvium portulacastrum (L) L | 10 | |
| VAS marina | Halodule wrightii (Asch.) | 5-10 |
| Syringodium filiforme Kützing | < 5 | |
| Thalassia tesstudinum Bank ex König | 4-20 | |
| Algas | 20-30 |
Tabla 3 Valores promedio ± desviación estándar (mín-máx) de las características de los sedimentos en los primeros 30 cm de profundidad en humedales costeros cársticos de la costa norte de Yucatán.
| Paisaje | DA (g cm3) | MO (%) | PT (%) | NT (%) | N:P | CI (%) | CO (%) |
| Sabana | 0.33 ± 0.11 | 32.1 ± 1.41 | 0.05 ± 0.01 | 0.47 ± 0.03 | 9.47 ± 0.50 | 4.91 ± 0.18 | 9.3 ± 0.35 |
| (0.24-0.45) | (30.83-33.62) | (0.05-0.05) | (0.45-0.50) | (9.00-10.00) | (4.74-5.10) | (9.09-9.70) | |
| Vegetación emergente | 0.52 ± 0.12 | 27.4 ± 8.87 | 0.07 ± 0.01 | 0.65 ± 0.33 | 9.53 ± 3.58 | 1.94 ± 0.30 | 8.84 ± 1.05 |
| (0.32-0.62) | (20.6-31.05) | (0.05-0.08) | (0.33-1.17) | (5.71-14.63) | (1.49-2.29) | (7.66-10.28) | |
| Manglar de cuenca | 0.65 ± 0.08 | 15.66 ± 2.68 | 0.09 ± 0.03 | 0.53 ± 0.37 | 7.88 ± 8.23 | 3.09 ± 1.20 | 6.33 ± 2.87 |
| (0.51-0.74) | (11.62-18.45) | (0.05-0.12) | (0.15-1.26) | (1.50-25.20) | (0.75-4.32) | (1.97-8.58) | |
| VAS lagunar | 0.47 ± 0.37 | 18.22 ± 7.45 | 0.05 ± 0.01 | 0.50 ± 0.10 | 11.48 ± 2.99 | 5.11 ± 2.68 | 2.00 ± 1.05 |
| (0.11-1.23) | (7.16-29.93) | (0.03-0.06) | (0.31-0.62) | (6.20-15.50) | (1.91-9.67) | (0.75-3.79) | |
| Manglar de ciénega | 0.59 ± 0.10 | 31.59 ± 8.34 | 0.07 ± 0.01 | 0.62 ± 0.45 | 8.61 ± 4.81 | 2.48 ± 0.75 | 8.64 ± 1.18 |
| (0.48-0.71) | (18.65-38.98) | (0.05-0.08) | (0.26-1.22) | (5.17-15.25) | (1.46-3.30) | (6.83-9.55) | |
| Manglar chaparro | 0.79 ± 0.13 | 5.6 ± 2.63 | 0.08 ± 0.01 | 0.35 ± 0.26 | 4.72 ± 3.94 | 3.63 ± 0.86 | 6.72 ± 1.02 |
| (0.71-0.99) | (2.20-8.18) | (0.07-0.09) | (0.14-0.72) | (1.75-10.29) | (2.71-4.37) | (5.30-7.52) | |
| Asociación halófila | 0.67 ± 0.26 | 7.53 ± 7.52 | 0.09 ± 0.06 | 1.41 ± 1.20 | 23.50± 34.37 | 7.33 ± 7.08 | 14.75± 13.47 |
| (0.37-1.65) | (3.49-20.96) | (0.03-0.17) | (0.12-2.51) | (1.5-83.67) | (0.38-15.31) | (0.54-30.60) | |
| VAS marina | 1.58 ± 0.06 | 3.83 ± 0.58 | 0.06 ± 0.02 | 0.08 ± 0.01 | 1.46 ± 0.61 | 0.39 ± 0.03 | 0.55 ± 0.05 |
| (1.46-1.64) | (3.20-4.93) | (0.03-0.09) | (0.07-0.11) | (0.89-2.67) | (0.34-0.43) | (0.47-0.62) |
Respecto al manglar de cuenca, este se desarrolló en suelos orgánicos con profundidades de hasta 35 cm; su nivel topográfico (+ 0.16 m s.n.m. a + 0.22 m s.n.m.) le confiere cierto aislamiento para el intercambio de agua, por lo que se registró una de las más amplias variaciones en la salinidad intersticial (14 ups - 120 ups) (Tabla 1).
En el caso del manglar de ciénega, este se presentó en suelos cuya profundidad promedio fue de 45 cm; está constituido en su mayoría por materia orgánica y su nivel topográfico (-0.28 m s.n.m. y -0.35 m s.n.m.) le confiere características de largos tiempos de inundación y amplias variaciones en la salinidad intersticial (Tabla 1). En el humedal de manglar chaparro la profundidad promedio del suelo fue de 54 cm y estuvo compuesto por materia orgánica mezclada con arena; topográficamente fue relativamente homogéneo (Tabla 1), pero con amplia variación de la salinidad intersticial (2 ups a 66.9 ups) (Tabla 1). Por último, el humedal de herbáceas halófilas se presentó en suelos con profundidades promedio de 25 cm, principalmente compuesto de arenas con un registro de niveles de inundación bajos (< 5 cm), pero con amplias variaciones de salinidad intersticial (4.7 ups-102 ups) (Tabla 1).
De los humedales que se encuentran en niveles topográficos negativos (Tabla 1), el nivel del agua siempre los cubre independientemente de la época del año. Entre estos el humedal de VAS lagunar está a profundidades de - 1.5 m s.n.m. a -0.4 m s.n.m. Los sedimentos son poco profundos (Tabla 1) y presenta influencia marina de acuerdo con la variación de su salinidad (33 ups-43 ups). En el caso del humedal de VAS marina la cobertura vegetal está a profundidades de entre 2 m y 6 m en áreas de sedimentos someros (≤ 30 cm) y arenosos sin evidencia de materia orgánica. La salinidad presentó escasa variación tanto en la laguna como en el mar (Tabla 1).
Biomasa y carbono aéreo de los humedales costeros
En la figura 3 y en la tabla 4 se presenta la variabilidad de biomasas y almacenes de carbono aéreo y subterráneo registrada entre las unidades dentro del paisaje del humedal que componen el corredor transversal costero del norte de Yucatán. De forma esquemática está representado el gradiente de salinidad y la variación del nivel topográfico.
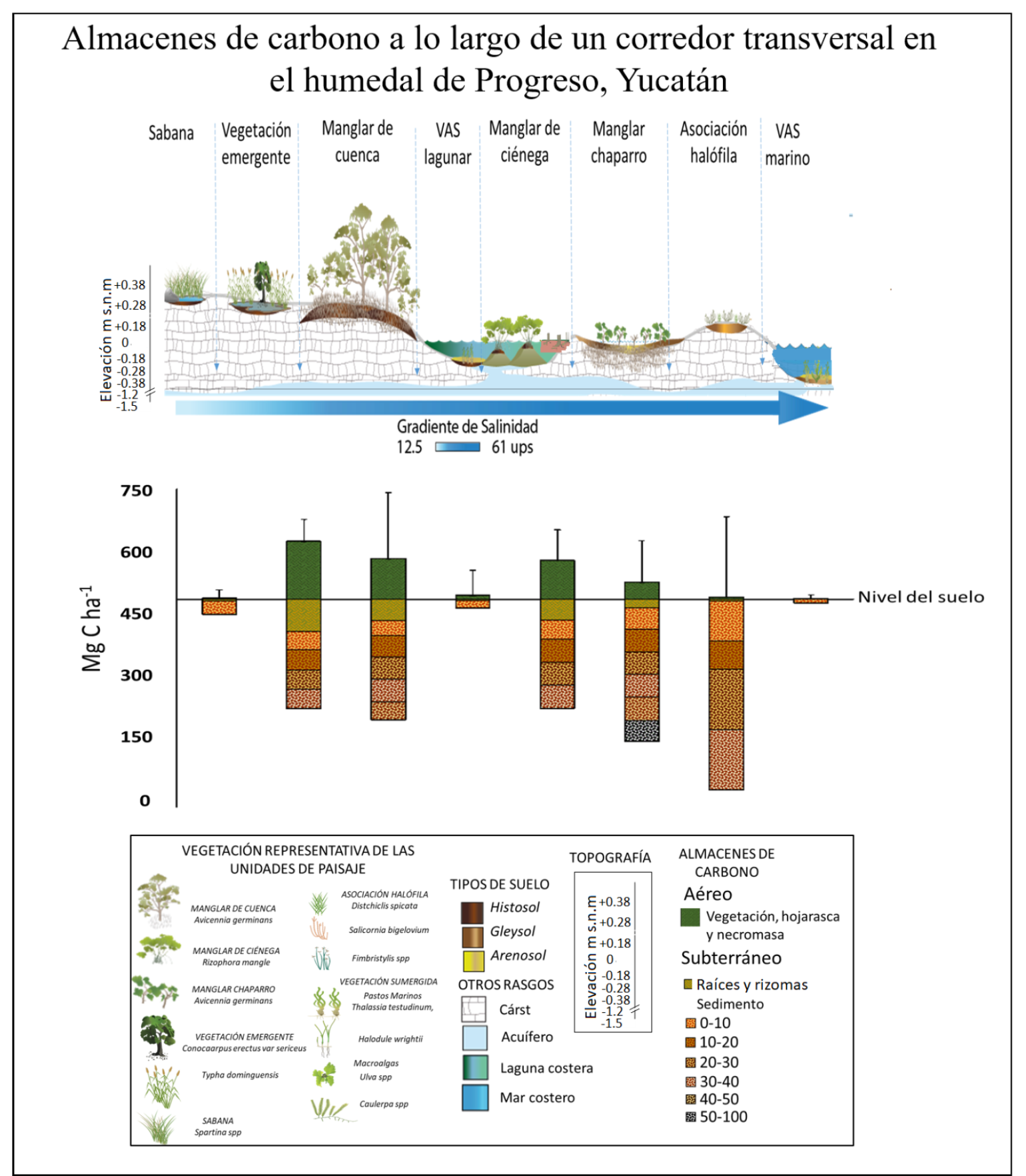
La barra indica la desviación estándar a través de los diferentes estratos de cada componente y por la suma de ellos.
Figura 3 Representación del carbono total (Mg C ha-1) almacenado en los diferentes tipos de humedales en el corredor costero cárstico de Yucatán.
Tabla 4 Promedio y desviación estándar de la biomasa aérea (BAer), biomasa subterránea (B Sub), carbono orgánico aéreo (CAer), subterráneo (CSub), contribución de raíces (CRai), total (CTot) y ecosistémico (CEco).
| Paisaje | Extensión (ha) | BAer (Mg ha-1)* | BSub (Mg ha-1)* | CAer (Mg C ha-1) | CSub (Mg C ha-1) | CRai (%) | CTot (Mg C ha-1) | CEco (Mg C ha-1) |
| Sabana | 200 | 4.76 | 18.27 | 2 | 35 | 11.6 | 37 | 7335 |
| (± 3.17) | (± 16.6) | (± 0.65) | (± 1.29) | (± 20.5) | ||||
| Vegetación emergente | 161 | 193.05 | 17.36 | 136 | 212 | 35.6 | 348 | 56 152 |
| (± 360.75) | (± 7.53) | (± 48.9) | (± 34.37) | (± 52) | ||||
| Manglar de cuenca | 2937 | 265.66 | 208.83 | 95 | 266 | 18.6 | 361 | 1 060 479 |
| (± 212.5) | (± 174.78) | (± 19.2) | (± 11.22) | (± 156.5) | ||||
| VAS lagunar | 810 | 18.22 | 7.12 | 9 | 20 | 11.9 | 29 | 23 354 |
| (± 19.4) | (± 4.21) | (± 3.9) | (± 0.79) | (± 59.4) | ||||
| Manglar de ciénega | 906 | 220.04 | 103.77 | 91 | 244 | 19.9 | 335 | 303 946 |
| (± 147.35) | (± 98.07) | (± 69.5) | (± 41.31) | (± 72.7) | ||||
| Manglar chaparro | 5220 | 64.27 | 43.42 | 13 | 331 | 6 | 371 | 1 936 240 |
| (± 45.48) | (± 30.56) | (± 1.3) | (± 0.74) | (± 98.2) | ||||
| Asociación halófila | 1416 | 12.58 | 17.37 | 5 | 307 | 1.2 | 311 | 441 035 |
| (± 6.81) | (± 8.53) | (± 1.1) | (± 1.05) | (± 189.8) | ||||
| VAS marina | 941 | 0.51 | 0.15 | 0.4 | 9 | 1.0 | 9 | 86 020 |
| (± 0.24) | (± 0.14) | (± 0.13) | (± 0.04) | (± 10.3) | ||||
| Almacén en humedales costeros | 3 837 160 | |||||||
* Peso seco
De entre los humedales emergidos, el de sabana está dominado por Spartina spartinae con coberturas de 25% a 100% y alturas promedio menores a 1.5 m, registrándose también Distichlis spicata. (l), E. Greene. var. spicata. El humedal de vegetación emergente estuvo codominado por Typha domingensis (altura ≈2.5 m) y dos especies de manglar (Conocarpus erectus var. sericeus y Avicennia germinans) con coberturas de 40% y 20% del área respectivamente; la altura promedio del manglar fue de 2.5 m ± 0.09 m y diámetro a la altura del pecho (DAP) de 4.4 cm ± 0.27 cm, siendo C. erectus var. sericeus la especie con mayor contribución a la biomasa aérea (91 kg peso seco m-2) mientras que T. dominguensis solo aportó 4.1 kg de peso seco por metro cuadrado. De entre los humedales de manglar el de cuenca estuvo dominado por A. germinans con coberturas entre 80% y 90% mezclado con C. erectus var. sericeus (<10%); la altura promedio fue de 3.1 m ± 0.1 m y DAP de 4.8 cm ± 0.17 cm, siendo el mangle negro el de mayor contribución a la biomasa (154 kg de peso seco por metro cuadrado). En el caso del manglar de ciénega, este fue dominado por A. germinans con presencia de R. mangle y L. racemosa; la altura promedio fue de 3.2 m ± 0.12 m y DAP de 4.88 cm ± 0.17 cm, siendo también el mangle negro la especie con mayor contribución a la biomasa aérea con 46 kg de peso seco por metro cuadrado. El último de los manglares que corresponde al de tipo ecológico chaparro fue dominado por A. germinans de altura promedio a 0.95 m ± 0.04 m, con estructura arbustiva y coberturas de 80% a 90%, DAP de 4.4 cm ± 0.27 cm y biomasa de 8.7 kg de peso seco por metro cuadrado; se observaron individuos aislados de R. mangle (altura 0.45 m y DAP 1.5 cm); en el sotobosque se presentaron Salicornia bigelovii Torr. y la herbácea halófita Distichlis spicata, estas dos últimas en las áreas más elevadas del terreno. En el caso del humedal conformado por la asociación de vegetación halófila estuvo dominado por herbáceas como Distichlis spicata (L), E. Greene. var. spicata, Fimbristylis spadicea (L.) Vahl, Monanthochloe littoralis Engelm y Salicornia bigelovii Torr. y Sesuvium portulacastrum (L) con coberturas de 60% a 90% y alturas promedio menores a 50 cm.
De los humedales que están completa y constantemente sumergidos, la VAS de la laguna presentó baja cobertura del pasto marino Thalassia testudinum (10%), mientras que Halodule wrightii cubrió aproximadamente 30%, además de macroalgas (Caulerpa sp. y H. incrassata) y rodofitas (Laurencia sp.); pastos y macroalgas aportan bajas biomasas respecto a los otros humedales (Tabla 4). La VAS del ambiente marino, fue dominado por T. testudinum, con valores de biomasa aún más bajos que los de la laguna (Fig. 3, Tabla 4).
Biomasa y carbono subterráneo de los humedales costeros
De los humedales que permanecen por arriba del nivel medio del mar en la sabana, el sedimento presentó coloración de marrón oscuro a negro con rocas, raíces finas y conchuela, registrándose baja densidad aparente, almacén de carbono subterráneo de 35 Mg C ha-1 ± 1.29 Mg C ha-1 y contribución de biomasa subterránea (raíces finas y rizomas) menor a 15% (Tabla 3); además de que la relación NT:PT fue menor de 16 indicando limitación aparente por nitrógeno. El sitio de vegetación emergente presentó sedimento de coloración gris muy oscuro a negro, con alto contenido de material en descomposición y concentraciones promedio de carbono subterráneo de 212 Mg C ha-1 ± 34.4 Mg C ha-1 y alto porcentaje de contribución de biomasa subterránea (35.6%); también con bajos valores de la relación NT:PT y porcentaje de carbono inorgánico (Tabla 3).
Los sedimentos de los humedales de manglar presentaron los almacenes de carbono subterráneo más altos entre los sitios estudiados (> 240 Mg C ha-1; Tabla 4).
La coloración de los sedimentos de los manglares varió de grises (rosáceo, rojizo, parduzco) a café obscuro con abundantes raíces finas (Tabla 3). En el manglar de cuenca el porcentaje de materia orgánica del sedimento no fue tan alto como en otros humedales (Tabla 3), pero el carbono orgánico alcanzó niveles de 266 Mg C ha-1 ± 11.22 Mg C ha-1, a pesar de que la relación NT:PT fue de las más bajas (< 9). Para el manglar de ciénega, el contenido de materia orgánica fue alto al igual que el carbono orgánico (244 Mg C ha-1 ± 41.31 Mg C ha-1), la contribución de la biomasa subterránea al carbono subterráneo fue de las más altas (20%), no obstante que presentó limitación de nitrógeno de acuerdo con las relaciones NT:PT (< 9). En el caso del sedimento del manglar chaparro, este registró la concentración de carbono orgánico más alta de todos los paisajes del corredor transversal costero (331 Mg C ha-1 ± 0.74 Mg C ha-1) y presentó valores bajos de contribución de la biomasa de raíces al carbono subterráneo, al igual que de la relación NT:PT (Tablas 3 y 4).
La zona con vegetación halófila presentó suelos arenosos con alta densidad aparente y bajo contenido de materia orgánica. En este sitio el almacén de carbono subterráneo fue de 307 Mg C ha-1 ± 1.05 Mg C ha-1, siendo la contribución de la biomasa de raíces muy baja (< 2%). Fue la única unidad de paisaje que podría estar limitada por fósforo, de acuerdo con la relación NT:PT (Tabla 4).
Respecto a los humedales con VAS, los sedimentos en el ambiente lagunar y en el marino son de tipo arenoso de color claro (casi blanco) con bajos contenidos de materia orgánica y concentraciones de carbono (Tabla 4). El humedal de VAS lagunar presentó concentraciones de carbono subterráneo mayores (20 Mg C ha-1 ± 0.79 Mg C ha-1) que las de la VAS del ambiente marino (9 Mg C ha-1 ± 0.04 Mg C ha-1). En ambos casos el contenido de materia orgánica y la relación NT:PT dieron bajos valores, pero con diferencias en la contribución de la biomasa subterránea, la cual fue mayor para el humedal de VAS lagunar (Tabla 3).
Respecto al carbono orgánico total de los humedales que componen el paisaje del corredor transversal costero del escenario cárstico del norte de Yucatán, los de manglar de cuenca y chaparro fueron los de mayor concentración de carbono total por unidad de área (361 Mg C ha-1 y 371 Mg C ha-1 respectivamente), mientras que los de VAS tanto lagunar como marina son los que menor carbono orgánico total presentaron (Tabla 4). El carbono ecosistémico de este paisaje de humedales costeros, cuando se pondera por la superficie ocupada por cada humedal, es de 3 837 160 Mg C, siendo los manglares de cuenca (28%) y chaparro (50%) los que mayor contribución tienen y la menor corresponde al humedal de sabana con < 1%.
Discusión
La estimación del carbono almacenado en humedales con diferencias en productividad, nivel topográfico y salinidad intersticial permitió identificar la variación en los procesos que caracterizan a cada unidad de paisaje y proporciona una línea de base para medir los impactos del cambio ambiental, incluyendo el cambio climático.
El gradiente en el almacén de C aéreo se ha relacionado con patrones de la zonificación que resulta de la interacción entre la inundación, la elevación del humedal, la salinidad intersticial y la tolerancia particular de las especies presentes en cada ecosistema (Pennings y Silliman, 2005; Battaglia, Woodrey, Peterson, Dillon y Visser, 2012). En este estudio y a diferencia de las marismas de marea ampliamente abordados en la literatura (Barbier, 2011; Mcleod et al., 2011; Drake, Halifax, Adamowicz y Craft, 2015; Starr, Jarnigan, Staudhammer y Cherry, 2018), los humedales de sabana y vegetación emergente del corredor transversal costero de Yucatán no presentan inundación superficial por efecto directo de las mareas. Las características de salinidad y nivel de inundación resultan de la acumulación de la precipitación, la evaporación y posiblemente de fenómenos a nivel subterráneo tales como la intrusión salina y recarga del acuífero.
Durante la época de lluvias, el agua de las precipitaciones de la zona costera se puede acumular en la superficie debido a la presencia de una roca impermeable localizada a escasa profundidad (< 1 m) denominada caliche o laja. Se ha registrado que debajo del caliche existe agua subterránea parcialmente confinada y con las fisuras o grietas de la roca se favorece que las aguas contenidas emerjan y mantengan inundados los humedales o broten en forma de manantiales a lo largo de la costa (Marín, Perry, Essaid y Steinich, 2001; Perry, Velazquez-Oliman y Socki, 2003; Rocha et al., 2015). Por lo tanto, el hidroperiodo de estos humedales sería más complejo y susceptible a las fluctuaciones del agua subterránea ocasionadas por la recarga del acuífero que se origina tierra adentro y durante la época de lluvias, al que se le suma la intrusión salina ocasionada por el adelgazamiento de la capa de agua dulce durante la época de secas y la presión de la marea, la cual puede transmitirse al agua subterránea de 20 km hasta 90 km tierra adentro (Marín et al., 2001; Graniel et al., 2010).
Este comportamiento hidrológico y el corto ciclo de vida de las plantas favorecen que el contenido de materia orgánica del sedimento sea alto y que posiblemente predomine el de origen autóctono; al estar tierra adentro el intercambio de materia con otras unidades del paisaje es bajo y el reciclamiento de nutrientes alto. Las plantas de tipo C4, como en el caso del género Spartina que caracterizan a la sabana, son más eficaces para transformar el carbono en biomasa, además de que presentan un uso más eficiente del nitrógeno, en comparación con las C3, como el caso de Typha dominguensis presente en el humedal de vegetación emergente. Los humedales herbáceos de baja salinidad solo son eficientes en el almacén de C en el corto plazo (Odum, Smith III, Hoover y McIvor, 1984; De Deyn, Cornelissen y Bardgett, 2008).
En el humedal de asociaciones halófilas pudo ser un factor de impulso a la dinámica de carbono del ecosistema, a través de sus efectos sobre la productividad, el hecho de que el agua tenga valores más altos de salinidad y las plantas están adaptadas a tal estrés. Adicionalmente, las condiciones anaeróbicas promovidas por los suelos inundados con agua salada y durante largos periodos de tiempo, favorecieron la acumulación de C en los suelos. Esto puede extremarse al no haber exportación de materia, ya que se encuentra aislado de la influencia directa de la marea. Numerosos estudios han demostrado relación entre la salinidad intersticial, la concentración de materia orgánica y la hidrología (Langenheder y Ragnarsson, 2007; Berga, Székely y Langenheder, 2012), sin embargo, aún no se ha determinado bajo qué circunstancias la salinidad y tiempo de inundación aumentan o disminuyen las tasas de descomposición en los humedales (Roache, Bailey y Boon, 2006; Weston, Dixon y Joye, 2006; Craft, 2007; Neubauer, Franklin y Berrier, 2013). Al respecto, se ha documentado que algunos humedales localizados a lo largo de los tramos río asociados a estuarios que normalmente no son considerados al determinar la cantidad de carbono almacenado, presentan reservorios importantes de C que son de suma importancia para el intercambio o exportación de este desde ecosistemas terrestres hacia la costa por la subida de nivel de los ríos y bajo tiempo de inundación (Krauss et al., 2018).
En cuanto al almacén de carbono aéreo en los humedales dominados por manglar, la zonificación de las especies y distribución de los tipos ecológicos dentro del corredor costero estuvo en concordancia con los niveles, frecuencia y tiempos de inundación que se han registrado para cada tipo ecológico de manglar (Castañeda-Moya, Twilley y Rivera-Monroy, 2013). Avicennia germinans presentó plasticidad y domina los humedales de tipo chaparro, de cuenca y el de ciénega, donde las altas salinidades (>70 ups) solo son toleradas por esta especie. En este sentido, se reconoce que la plasticidad de la vegetación para adaptarse a los cambios en el medio ambiente y a distintos grados de estrés ambiental (v. g variaciones de salinidad, el pH, el potencial redox, interacción con las mareas, nivel de inundación y presiones antropogénicas) favorece una alta biomasa (Neue, Wassmann, Kludze, Wang y Lantin, 1997).
En el caso del manglar de cuenca, localizarse en la parte alta del corredor le es favorable para acumular carbono subterráneo ya que las inundaciones periódicas por mareas reducen biogeoquímicamente el ambiente inhibiendo la respiración aeróbica y reduciendo la descomposición de la materia orgánica, lo cual se traduce en C orgánico incorporado al almacén subterráneo, el cual puede mantenerse almacenado en el largo plazo debido a las condiciones de inundación, salinidad y pH (Twilley, Chen y Hargis, 1992; Chmura et al., 2003; Donato et al., 2011; Ouyang y Lee, 2014). Este manglar de cuenca soporta vegetación arbustiva bien desarrollada y con abundancia de raíces aunque el suelo es escaso, esto que sugiere que la producción de ácido sulfhídrico en condiciones anaeróbicas durante la descomposición de la materia orgánica posiblemente induce la disolución del suelo carbonatado, lo que a su vez permite el desarrollo y penetración de las raíces hasta el agua subterránea, rica en nitratos (Herrera-Silveira y Morales-Ojeda 2009), sin requerir nutrientes del sedimento.
En lo referente al manglar de ciénega, este tipo de humedal costero se presenta en condiciones ambientales particulares como periodos completamente ausentes de agua que lo cubra, esto favorece la oxidación de material orgánico superficial, formándose una costra (seca, negra y agrietada) debajo de la cual se conserva la humedad y el agua intersticial es retenida permitiendo que prosigan los procesos de descomposición lenta en el medio anóxico.
El manglar chaparro es el tipo morfológico más extendido en la península de Yucatán (Adame et al., 2013), generalmente es asociado a deficiencias de nutrientes, particularmente fósforo en los suelos cársticos de Yucatán. Sin embargo, en este estudio la mayoría de los sitios registró limitación por nitrógeno y no por fósforo, esto puede deberse a fuentes biológicas (reciclado de nutrientes por procesos de la ciénega, mortalidad de peces atrapados en la temporada de secas) o antropogénicas (a través del agua subterránea). De acuerdo con Adame, Cherian, Reef y Stewart-Koster (2017), los manglares de bajos valores de diámetros de tronco invierten más C en la producción de biomasa de raíces por área, en comparación con otras plantas terrestres, debido a que estas son vitales para sobrellevar las condiciones de anoxia, hipersalinidad y falta de nutrientes a las que están expuestos (Ball, 1988; Reef, Feller y Lovelock, 2010). Por otra parte, factores como disponibilidad de nutrientes inorgánicos, sedimento mineral y la frecuencia de inundación puede influir en la acumulación de materia orgánica en suelos de humedales de tipo arbustivo como el manglar chaparro (Baustian et al., 2017; Valiela, Teal y Persson, 1976), además de que se ve favorecida una baja tasa de descomposición y mayor acumulación de carbono en sus sedimentos (Turner, Brouwer y Georgiou, 2009), siendo el mayor de todos los humedales analizados (Tabla 3).
Finalmente, por lo que respecta a la vegetación acuática sumergida constituida principalmente por pastos marinos y algunas macroalgas, si bien los procesos costeros de corrientes y mareas de la región son considerados poco dinámicos (Enriquez, Mariño-Tapia y Herrera-Silveira, 2010), se observa el flujo de materia y energía en sentido bidireccional entre la tierra y el mar, especialmente como pulsos durante eventos de alta energía como huracanes y nortes que caracterizan a la región, con lo cual se podría estar subsidiando de materia orgánica alóctona a este humedal costero. En el caso de la vegetación acuática sumergida marina, las mareas y las olas constituyen un subsidio de energía auxiliar que probablemente no permite a los pastos marinos almacenar carbono, pero sí que el producido in situ sea transportado hacia fuera del sistema, por lo que más que un almacén podría ser una fuente de carbono para otros ecosistemas. En el caso de la laguna costera, la baja transparencia y resuspensión producto de la hidrodinámica, podría limitar el desarrollo de la vegetación al interior de la laguna costera, al igual que los cambios de fase de una comunidad dominada por pastos H. wrightii o T. testudinum a una dominada por Rupia marítima o algas filamentosas oportunistas (verdes o rojas) promovidos por el suministro excesivo de materia orgánica de origen antrópico.
Los mayores valores de carbono orgánico total registrado en este estudio correspondieron a los humedales de manglar de cuenca y chaparro (361 Mg C ha-1 y 371 Mg C ha-1 respectivamente). Estas concentraciones de carbono están en el intervalo de la media nacional estimada por diferentes autores (364 Mg C ha-1 en Herrera-Silveira et al., 2016; 442 Mg C ha-1 en Adame et al., 2018), pero son mayores a la media observada para bosques terrestres (62 Mg C ha-1 en Vega-López, 2008). No obstante, el clima semiárido donde se localizan los humedales de este corredor transversal costero y las condiciones ambientales que podrían estar experimentando algún tipo de impacto por la modificación hidrológica a causa de una carretera que atraviesa a los ocho humedales estudiados (Teutli-Hernández y Herrera-Silveira, 2018), los almacenes de carbono de estos representan una opción para medidas de mitigación de los efectos del cambio climático y es probable que contribuyan de manera importante a los servicios ambientales locales y regionales.
Conclusiones
El contenido de carbono determinado para las ocho unidades de paisaje presentó una contrastante variación en los almacenes por unidad de área desde 9 Mg C ha-1 (VAS marina) hasta 371 Mg C ha-1 (manglar chaparro). Respecto a la contribución por tipo de humedal, considerando su extensión, el manglar chaparro presentó mayor almacén, seguido por el manglar de cuenca y la vegetación herbácea halófila. Estos almacenes son resultado de la interacción entre hidroperiodo (nivel y frecuencia de inundación) y salinidad intersticial principalmente alta, que si bien no favorecen alta productividad reflejada en baja biomasa aérea, sí contribuye al almacenamiento a largo plazo por la lenta descomposición de la materia orgánica. En este sentido, es importante destacar el papel de la vegetación halófila por evitar las emisiones de gases de efecto invernadero hacia la atmósfera.
El estudio simultáneo del C almacenado en humedales contiguos a lo largo de un gradiente de salinidad y vegetación de diferente tipo de desarrollo (herbáceas y leñosas), son un precedente para analizar la conectividad y su efecto en el tipo y magnitud de los servicios ambientales de cada humedal. En este caso, los resultados fortalecen el valor como almacenes de carbono para el paisaje que conforma el conjunto de humedales costeros del corredor transversal y permiten mejorar la identificación de sitios prioritarios de protección y restauración.
Conocer la variabilidad en la capacidad para almacenar C de distintos humedales que forman parte de un paisaje costero, así como los factores que la determinan, es el primer paso para identificar las posibles afectaciones regionales en el mediano y largo plazo ocasionados por impactos naturales y antropogénicos, como es el caso del cambio climático actual.
Los resultados de este estudio, con el enfoque de paisaje como corredor costero, permiten avanzar en el entendimiento de los patrones naturales del almacén de C aéreo y C subterráneo. Este tipo de estudios realizados en un gradiente salino y topográfico natural abre la posibilidad de plantear preguntas que ayuden mejorar la comprensión de la biogeoquímica de los almacenes de C en escenario cársticos. Este tipo de aproximaciones permitirán comprender mejor los posibles efectos de la alteración del ciclo hidrológico, disminución del insumo de agua dulce por vía subterránea, incremento en la intrusión de agua salada, cambios en la vegetación, en el ciclo de nutrientes y modificación de la relación producción-respiración, muchos de estos efectos relacionados con el cambio climático.











 nueva página del texto (beta)
nueva página del texto (beta)



