Introducción
En México, la reforestación es la principal actividad que se promueve para recuperar e incrementar la cobertura arbórea que se pierde a una tasa aproximada de 217 000 ha por año (Global Forest Watch, 2019). Cada año diversos proyectos se emprenden con ese propósito, en donde los viveros forestales tienen una participación determinante como proveedores de la planta (Comisión Nacional Forestal [Conafor], 2014).
A la fecha, la supervivencia baja es la problemática que prevalece en los programas de reforestación. Las estadísticas señalan que la mortalidad oscila en 50% en el primer año después de la plantación (Conafor, 2014). Algunos factores que influyen en la supervivencia baja son sequías, competencia con vegetación, pastoreo y baja fertilidad en los suelos. Además, la calidad deficiente de la planta es otra causa que contribuye a esos niveles bajos de supervivencia (Conafor, 2014). A este segundo aspecto se ha dado mayor atención debido a que es posible modificar con prácticas culturales las características morfológicas y fisiológicas de las plantas para aumentar la probabilidad de supervivencia en campo (Grossnickle, 2012; Grossnickle y MacDonald, 2018).
La fertilización en vivero es reconocida como una práctica esencial para mejorar la calidad de la planta que se produce en un sistema de envase con sustratos inertes (Chirino et al., 2009; Cortina, Vilagrosa y Trubat, 2013). La fertilización ha sido evaluada en diversas especies forestales y los resultados confirman que esta mejora las características morfológicas y fisiológicas de las plantas y aumenta la probabilidad de un desempeño favorable en campo (Luis et al., 2009; Villar-Salvador, Peñuelas, Nicolás-Peragón, Benito y Domínguez-Lerena, 2013; Villar-Salvador et al., 2012). Sin embargo, un manejo nutrimental adecuado depende de las necesidades de la especie, el tipo de fertilizante y la dosis, para propiciar un estado nutrimental que incrementen las reservas nutrimentales para el crecimiento de las plantas sin provocar toxicidad ( J. A. Oliet, Puértolas, Planelles y Jacobs, 2013); por lo tanto, es importante determinar regímenes de fertilización para una nutrición correcta de las plantas (J. A. Oliet et al., 2013; Rose, Haase y Arellano, 2004). Actualmente, la mayoría de los viveros forestales usan fertilizantes hidrosolubles de liberación controlada. Sin embargo, no se conocen los niveles adecuados de fertilizantes que se deben aplicar a una especie específica. Aunque existe información sobre los niveles óptimos de fertilización en vivero para varias especies forestales, la información es escasa para las especies de la Selva Baja Caducifolia, lo cual limita el conocimiento para su propagación en el contexto de calidad de planta (Bonfil y Trejo, 2010).
Este trabajo se enfoca a Pithecellobium dulce (Roxb.) Benth porque esta especie es un elemento arbóreo característico de la selva baja caducifolia de la cuenca del Balsas (Fernández N., Rodríguez J., Arreguín S. y Rodríguez J., 1998) con la cual se pretende intensificar las reforestaciones porque es una leguminosa pionera de crecimiento rápido con usos múltiples. Los usos principales de P. dulce son como árbol de sombra, leña, cerco vivo, forraje y madera. También es fuente de alimento para el humano y vida silvestre (Olivares-Pérez, Avilés-Nova, Albarrán-Portillo, Rojas-Hernández y Castelán-Ortega, 2011; Palma García y González-Rebeles Islas, 2018).
Objetivos
El objetivo del presente trabajo fue determinar el efecto de regímenes de fertilización sobre la calidad de planta de Pithecellobium dulce en vivero. La hipótesis fue que los regímenes de fertilización el que se emplean dos tipos de fertilizante, FLC y FHS, en distintas dosis, incrementan la calidad de las plantas de P. dulce a través de la modificación de las características morfológicas y fisiológicas de estas.
Materiales y métodos
Ubicación del experimento
El estudio se realizó en condiciones controladas en un invernadero ubicado en el vivero forestal del Colegio de Postgraduados Campus Montecillo (Montecillo, Texcoco, Estado de México, México). La temperatura máxima y mínima promedio fue 35 °C y 18 °C, respectivamente, dentro del invernadero. La humedad relativa osciló entre 25% durante el día y 70% en la noche.
Material biológico y condiciones del experimento
Se recolectaron semillas de árboles de P. dulce en la comunidad La Bajada, Coyuca de Catalán en la Región de Tierra Caliente, Guerrero, México. Posteriormente, en el laboratorio, las semillas se seleccionaron con base en el tamaño y morfología similares. Las semillas, previamente desinfectadas en una solución de hipoclorito de sodio al 0.5%, y remojadas durante 18 h como tratamiento pregerminativo, se sembraron directamente en tubos de plástico rígido (polipropileno) de 380 mL en un sustrato que se elaboró con una mezcla de turba de musgo (“peat moss”), perlita y vermiculita en proporciones 2:1:1, y se adicionaron 4 g L-1, 6 g L-1 y 8 g L-1 de fertilizante de liberación controlada Multicote (8)® 18-6-12+2MgO+ME (Haifa Chemicals Ltd.). Durante la etapa de crecimiento rápido, se aplicó una dosis de 0 mg, 375 mg y 750 mg de fertilizante hidrosoluble de propósito general 20-20-20+microelementos (Peters Professional® Special Purpose) con el riego, para obtener una concentración de nitrógeno de 0 mg L-1, 75 mg L-1 y 150 mg L-1, respectivamente. Se aplicaron tres riegos complementarios a capacidad de campo por semana. El pH se mantuvo entre 5.5 y 6.5, y la conductividad eléctrica entre 2.0 dS m-1 y 3.0 dS m-1.
Aplicación de tratamientos y diseño experimental
Nueve regímenes de fertilización se evaluaron con base en el fertilizante de liberación controlada (FLC) en tres dosis (4 g L-1, 6 g L-1 y 8 g L-1 de sustrato) y una fertilización complementaria con el material hidrosoluble (FHS) en la etapa de crecimiento rápido en las dosis previamente descritas para obtener una concentración de nitrógeno de 0 mg L-1, 75 mg L-1 y 150 mg L-1 (Tabla 1). El crecimiento rápido, considerado en el momento en que las plántulas perdieron sus cotiledones, fue a partir de la cuarta semana que se sembró. Dos aplicaciones de FHS por semana se realizaron durante ocho semanas.
Tabla 1 Descripción de los niveles o regímenes de fertilización aplicados para evaluar su efecto en la calidad de planta de Pithecellobium dulce en vivero.
| Régimen de fertilización | Descripción | ||
| Dosis de FLC (g L-1 de sustrato | Dosis de FHS (mg) | Concentraciónde nitrógeno aplicada con el FHS (mg L-1) | |
| R1 | 4 | 0 | 0 |
| R2 | 4 | 375 | 75 |
| R3 | 4 | 750 | 150 |
| R4 | 6 | 0 | 0 |
| R5 | 6 | 375 | 75 |
| R6 | 6 | 750 | 150 |
| R7 | 8 | 0 | 0 |
| R8 | 8 | 375 | 75 |
| R9 | 8 | 750 | 150 |
FLC= fertilizante de liberación controlada Multicote (8)® 18-6-12; FHS= fertilizante hidrosoluble 20-20-20 (Peters Professional® Special Purpose).
El R1 fue el tratamiento testigo por ser el nivel menor de fertilización. Cada tratamiento tuvo cuatro repeticiones, la unidad experimental estuvo constituida por 15 plantas, dispuestas en mesas de plástico diseñadas para los tubos de 380 mL. Se colocaron algunas plantas extra para descartar el efecto borde. Los tratamientos se establecieron en un diseño completamente al azar.
Medición de variables morfológicas y fisiológicas
A plantas de cuatro meses de edad de P. dulce se les determinaron diversas variables morfológicas y fisiológicas relacionadas con índices de calidad de planta. El tamaño de muestra fue de 15 plantas por tratamiento. Las variables morfológicas fueron: altura de la parte aérea (APA; cm) y el diámetro al cuello de la raíz (DCR; mm); la primera se determinó con una regla milimétrica y la segunda con un calibrador Mitutoyo® Digimatic CD-4” AX; el peso seco (cuasi anhidro)de la parte aérea de las plantas (PSA), su raíz (PSR) y el total (PST) se registraron con una balanza analítica (AND GR-120, A&D Company, Ltd), previo secado de cada parte en una estufa con circulación forzada de aire (FELISA® FE291-D) a 70 °C durante 72 h. Con los datos anteriores, se determinaron los índices morfológicos de calidad, como la relación parte aérea/raíz (R: PA/R) y el índice de calidad de Dickson (ICD), este último a partir de la fórmula siguiente (Birchler, Rose, Royo y Pardos, 1998):
En cuanto a las variables fisiológicas, se determinó la eficiencia fotosintética en términos de tasa de asimilación neta (TAN; mg cm-2 dia-1). El cálculo de la TAN requirió el muestreo destructivo de 15 plantas de cada tratamiento, al primer mes de edad y al final del experimento. En cada muestreo, se registró el peso seco de las plantas, siguiendo el procedimiento señalado anteriormente, también se les determinó el área foliar utilizando un medidor de área foliar (LI 3100C, LI-COR, Inc.). Los datos obtenidos se utilizaron para estimar la TAN conforme a la siguiente ecuación (Hunt, Causton, Shipley y Askew, 2002):
Donde:
PST= peso seco total (g) de las plántulas
AF= área foliar (cm-2) de las plántulas en valores absolutos y logarítmicos (ln)
T= tiempo
En todos los casos 1 y 2 se refiere a la evaluación inicial y final respectivamente, con un intervalo entre ellas de 88 días.
También se analizó el estado nutrimental de nitrógeno (N), fósforo (P) y potasio (K), valorado mediante la concentración (%) y el contenido (miligramo por planta) de cada nutrimento. El análisis nutrimental se hizo en hojas. Se analizaron tres muestras por tratamiento. La concentración del N se determinó mediante el método de micro-Kjeldahl; la concentración del P a través de determinación colorimétrica con complejo amarillo vanadato-molibdato y la concentración del K con espectrofotometría de emisión de flama. El contenido se estimó con los valores de concentración y peso seco total de las plantas. El estado nutrimental de las plántulas se diagnosticó con el método gráfico de vectores. La construcción de los gráficos se hizo con base en el procedimiento descrito por Haase y Rose (1995) donde se emplean valores relativos normalizados a 100 con respecto a los valores de referencia de concentración, contenido y biomasa del tratamiento testigo (R1). La interpretación de los nomogramas de vectores se respaldó en los trabajos de López-López y Alvarado-López (2010) y Timmer (1997).
Prueba de calidad de planta
Al término de la etapa de producción planta; es decir, a los cuatro meses de edad de las plantas, se estableció una prueba para evaluar la calidad de las plantas en el invernadero. La prueba consistió en trasplantar las plantas en un medio con baja o nula disponibilidad de nutrientes y posteriormente someterlas a estrés por pérdida de biomasa aérea (poda severa). Las plantas se enfrentan, comúnmente, a este tipo de condiciones cuando se reforestan sitios degradados por el alto pastoreo. Grossnickle y MacDonald (2018) establecieron que para evaluar el potencial de desempeño de una planta se deben considerar los atributos que corresponden a una condición anticipada del sitio. Para simular las condiciones descritas, el trasplante se hizo en bolsas negras de polietileno de 15 L. Estas bolsas se llenaron con piedra volcánica (tezontle) de granulometría de 3 mm - 5 mm. Dos semanas después del trasplante, 50% de la biomasa de cada planta se removió para simular herbivoría. Durante la prueba, las plantas se regaron únicamente dos veces por semana.
El desempeño de las plantas se determinó en función de la capacidad de rebrote y crecimiento. Los rebrotes se contaron después de un mes de haberse podado. También, se calcularon las tasas de crecimiento absoluto en diámetro (TCAD) en un intervalo de cuatro y nueve meses con la fórmula TCAD = diámetro a la base del tallo en la evaluación final-diámetro a la base del tallo en la evaluación inicial/tiempo (4 meses y 9 meses). En esta prueba, las plantas se colocaron en hileras de nueve plantas conforme a un diseño experimental de bloques completos al azar con seis repeticiones. La unidad experimental fue una planta.
Análisis estadístico
El efecto de los regímenes de fertilización en las variables morfológicas y fisiológicas de calidad de planta se determinó con un análisis de varianza no paramétrico con la prueba Kruskal-Wallis. Mientras que, para la prueba de calidad, se hizo un análisis de varianza no paramétrico con la prueba de Friedman. La prueba de hipótesis utilizó un nivel de significancia α = 0.05. En casos de diferencias estadísticas, se hizo una comparación de las medias de los rangos en pares conforme al procedimiento descrito en InfoStat versión 2012 (Di Rienzo et al., 2012), el cual fue el software utilizado para los análisis estadísticos. Las medias de las variables se representan con los valores originales.
Resultados
Índices morfológicos y fisiológicos de calidad
A los cuatro meses de edad, la prueba Kruskal-Wallis indicó diferencias (p ≤ 0.0001) entre regímenes de fertilización para los índices morfológicos de calidad (APA, DCR, PSA, PSR, PST, ICD y R: PA/R) y TAN (característica fisiológica) de las plantas de P. dulce. Además, esta prueba mostró diferencias (p<0.01) entre tratamientos para el contenido de N, P y K.
Con base en las medias de los tratamientos, se tuvieron dos grupos de respuestas. Valores inferiores correspondieron a los regímenes R1, R2 y R3 y valores superiores al resto (R4-R9). De este segundo grupo, en las variables morfológicas cuyos valores altos se relacionan con características mejores de calidad, se tuvo un efecto sobresaliente con el R9, este incrementó en las plantas los valores de DCR, PSA, PST e ICD (Tabla 2). En DCR ese régimen propició, al tener un valor de 5.66 mm, una diferencia de 1.74 mm en comparación con el valor de 3.92 mm obtenido por las plantas del R1, que fue el más bajo. Asimismo, para las variables PSA y PST las diferencias entre los valores del R9 (3.60 g y 4.70 g, respectivamente) fueron superiores en más de 200% al compararlos con los valores de las plantas del R2 que presentaron los valores más bajos en dichas variables (1.12 g en PSA y 1.56 g en PST). En ICD, las plantas del R9 tuvieron un índice de 0.39, mismo que fue 2.2 veces mayor al índice más bajo de 0.17 mostrado por las plantas del R2. Con respecto a las variables APA y PSR en las que también valores altos denotan características mejores de calidad, la respuesta mayor perteneció al R4. Para el caso de altura de planta, con el R4 las plantas presentaron un tamaño de 49.50 cm, el cual es 81% superior a las plantas testigo (R1) las cuales obtuvieron una altura de 27.28 cm. En la raíz, la cantidad de biomasa seca formada por las plantas del R4 (1.15 g) fue 159% superior a los valores de biomasa seca obtenidos en el R2 cuyo valor promedio fue de 0.44 g. Finalmente, para el índice R: PA/R, que, a diferencia de las otras variables, valores bajos significan mejor calidad, las plantas del R1 (testigo) tuvieron el valor más bajo (2.59) dentro de un intervalo en el que el valor mayor fue de 3.33 registrado en las plantas del R8.
Tabla 2 Valores promedio ± desviación estándar de variables relacionadas con índices morfológicos y fisiológicos de calidad de planta de Pithecellobium dulce, en respuesta a nueve regímenes de fertilización en vivero.
| Regímenes de fertilización¶¶ | Variables | |||||||
| APA (cm) |
DCR
(mm) |
PSA
(g) |
PSR
(g) |
PST (g) |
ICD | R: PA/R | TAN (mg cm-2 día-1) |
|
| R1 | 27.28 ± 6.15a | 3.92 ± 0.44a | 1.26 ± 0.26a | 0.50 ± 0.14a | 1.76 ± 0.38a | 0.19 ± 0.04a | 2.59 ± 0.42a | 0.32 ± 0.07a |
| R2 | 27.43 ± 4.81a | 4.17 ± 0.62a | 1.12 ± 0.33a | 0.44 ± 0.13a | 1.56 ± 0.45a | 0.17 ± 0.06a | 2.62 ± 0.46a | 0.27 ± 0.13a |
| R3 | 27.55 ± 8.14a | 4.39 ± 0.48ab | 1.48 ± 0.50a | 0.56 ± 0.13a | 2.04 ± 0.55a | 0.23 ± 0.06a | 2.73 ± 1.06a | 0.38 ± 0.08a |
| R4 | 49.50 ± 8.27c | 5.36 ± 0.53d | 3.36 ± 0.98b | 1.15 ± 0.29b | 4.51 ± 1.18b | 0.37 ± 0.09b | 2.94 ± 0.62ab | 0.59 ± 0.09b |
| R5 | 47.33 ± 8.45bc | 4.85 ± 0.64b | 2.92 ± 0.69b | 1.04 ± 0.31b | 3.96 ± 0.95b | 0.32 ± 0.10b | 2.89 ± 0.49ab | 0.62 ± 0.28b |
| R6 | 39.68 ± 6.68b | 5.09 ± 0.60cd | 2.67 ± 0.63b | 0.96 ± 0.23b | 3.63 ± 0.79b | 0.34 ± 0.07b | 2.84 ± 0.63ab | 0.56 ± 0.07b |
| R7 | 49.45 ± 7.86c | 5.55 ± 0.48d | 3.49 ± 0.69b | 1.09 ± 0.22b | 4.58 ± 0.8b | 0.38 ± 0.08b | 3.21 ± 0.41bc | 0.59 ± 0.06b |
| R8 | 45.95 ± 8.62bc | 5.28 ± 0.69cd | 3.18 ± 0.99b | 0.98 ± 0.36b | 4.16 ± 1.33b | 0.35 ± 0.14b | 3.33 ± 0.38c | 0.55 ± 0.09b |
| R9 | 48.45 ± 8.05bc | 5.66 ± 0.94d | 3.60 ± 0.77b | 1.10 ± 0.20b | 4.70 ± 0.80b | 0.39 ± 0.08b | 3.14 ± 0.54bc | 0.59 ± 0.07b |
¶APA: altura de la parte aérea; DCR: diámetro al cuello de la raíz; PSA: peso seco aéreo; PSR: peso seco de raíz; PST: peso seco total; ICD: índice de calidad de Dickson; R: PA/R: relación parte aérea/raíz; TAN: tasa de asimilación neta. ¶¶R1= 4 g de FLC+ 0 mg de FHS; R2= 4 g de FLC+ 375 mg de FHS; R3= 4 g de FLC+ 750 mg de FHS; R4= 6 g de FLC+ 0 mg de FHS; R5= 6 g de FLC+ 375 mg de FHS; R6=6 g de FLC+ 750 mg de FHS; R7=8 g de FLC+ 0 mg de FHS; R8=8 g de FLC+ 375 mg de FHS; R9=8 g de FLC+ 750 mg de FHS. FLC= fertilizante de liberación controlada Multicote (8)® 18-6-12; FHS= fertilizante hidrosoluble 20-20-20 (Peters Professional® Special Purpose). Valores con una letra común no son significativamente diferentes (α=0.05).
Por otra parte, en la tasa de asimilación neta (TAN), se registró un efecto positivo con el R5, con un valor de 0.62 mg cm-2 día-1, mismo que al compararse con el valor mínimo de TAN obtenido en el R2 (0.27 mg cm-2 día-1) se tuvo una diferencia de 130% (Tabla 2).
En lo referente al estado nutrimental, los valores de concentración no presentaron diferencias estadísticas y oscilaron entre 3% y 4% para N, 0.2% y 0.5% para P y 1.1% y 1.5% para K. En el contenido de los nutrimentos, donde sí se presentaron diferencias (N, p = 0.0021; P, p = 0.0018; K, p = 0.0021), los valores mayores fueron obtenidos en el R9 para N (184.2 mg por planta), el R4 para P (17.9 mg por planta) y el R7 para K (57.2 mg por planta) (Fig. 1). En general, en esos regímenes de fertilización las plantas presentaron más del doble en cantidad de nutrimentos en comparación con las plantas tanto del tratamiento testigo y de los tratamientos R2 y R3 (Fig. 1).
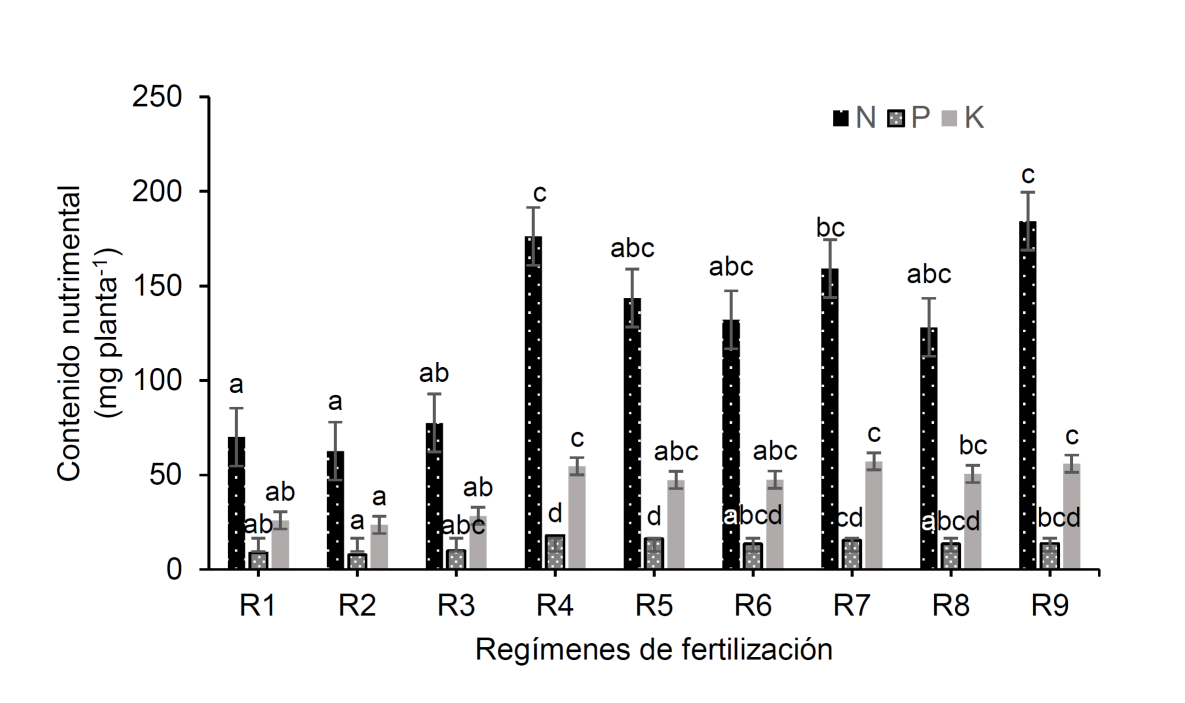
R1 = 4 g de FLC + 0 mg de FHS; R2 = 4 g de FLC + 375 mg de FHS; R3 = 4 g de FLC + 750 mg de FHS; R4 = 6 g de FLC + 0 mg de FHS; R5 = 6 g de FLC + 375 mg de FHS; R6 = 6 g de FLC + 750 mg de FHS; R7 = 8 g de FLC + 0 mg de FHS; R8 = 8 g de FLC + 375 mg de FHS; R9 = 8 g de FLC + 750 mg de FHS. FLC = fertilizante de liberación controlada Multicote (8)® 18-6-12; FHS = fertilizante hidrosoluble 20-20-20 (Peters Professional® Special Purpose). Barras con letras iguales no son significativamente diferentes (α = 0.05).
Figura 1 Contenido (valores promedio ± desviación estándar) de nitrógeno (N), fósforo (P) y potasio (K) en plantas de Pithecellobium dulce de cuatro meses de edad, en respuesta a nueve regímenes de fertilización en vivero.
En los nomogramas de vectores destacaron dos tipos de respuestas: 1) un incremento en el contenido del nutrimento y en la formación de biomasa, pero manteniéndose estable la concentración del elemento y 2) un aumento de biomasa, pero sin incrementos en la concentración y contenido del nutrimento (Fig. 2; A, B, C). Para el caso del N, la primera respuesta se tuvo con los regímenes 4 y 9, mientras que la segunda con los regímenes 5, 6, 7 y 8 (Fig. 2 A). En P y K, todos los regímenes, excepto el 2, causaron la segunda respuesta, aunque en diferente magnitud (Fig.2B y C).
Prueba de calidad de planta
Los resultados obtenidos en la prueba de calidad presentaron diferencias significativas en el número de rebrotes (p = 0.0072) y en la tasa de crecimiento absoluto en diámetro solo durante los primeros cuatro meses después de plantado (p = 0.0156). Las plantas con capacidad mayor de rebrote fueron las del R8, con un número promedio de 14.67 rebrotes; por el contrario, el régimen con número menor de rebrotes fue el R2, cuyo valor promedio fue de 6.17 (Fig. 3). El crecimiento mayor en diámetro se tuvo en plantas del R4 con 0.88 mm por mes, siendo este valor 115% superior a los 0.41 mm por mes registrado por el R2, cuyo crecimiento fue mínimo (Fig. 4).
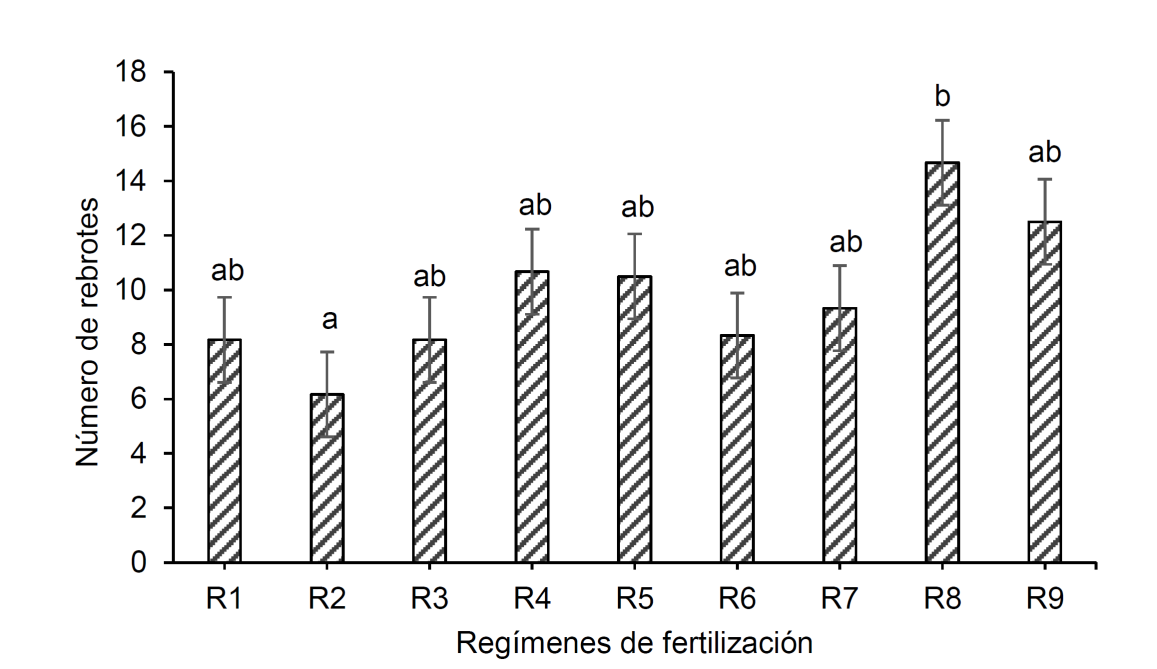
R1 = 4 g de FLC + 0 mg de FHS; R2 = 4 g de FLC + 375 mg de FHS; R3 = 4 g de FLC + 750 mg de FHS; R4 = 6 g de FLC + 0 mg de FHS; R5 = 6 g de FLC + 375 mg de FHS; R6 = 6 g de FLC + 750 mg de FHS; R7 = 8 g de FLC + 0 mg de FHS; R8 = 8 g de FLC + 375 mg de FHS; R9 = 8 g de FLC + 750 mg de FHS. FLC = fertilizante de liberación controlada Multicote (8)® 18-6-12; FHS = fertilizante hidrosoluble 20-20-20 (Peters Professional® Special Purpose). Barras con letras iguales no son significativamente diferentes (α = 0.05).
Figura 3 Número de rebrotes (valores promedio ± desviación estándar) de plantas de Pithecellobium dulce trasplantadas en un medio infértil y sometidas a pérdida de biomasa aérea (poda severa) como prueba para evaluar su calidad en respuesta a nueve regímenes de fertilización en vivero.
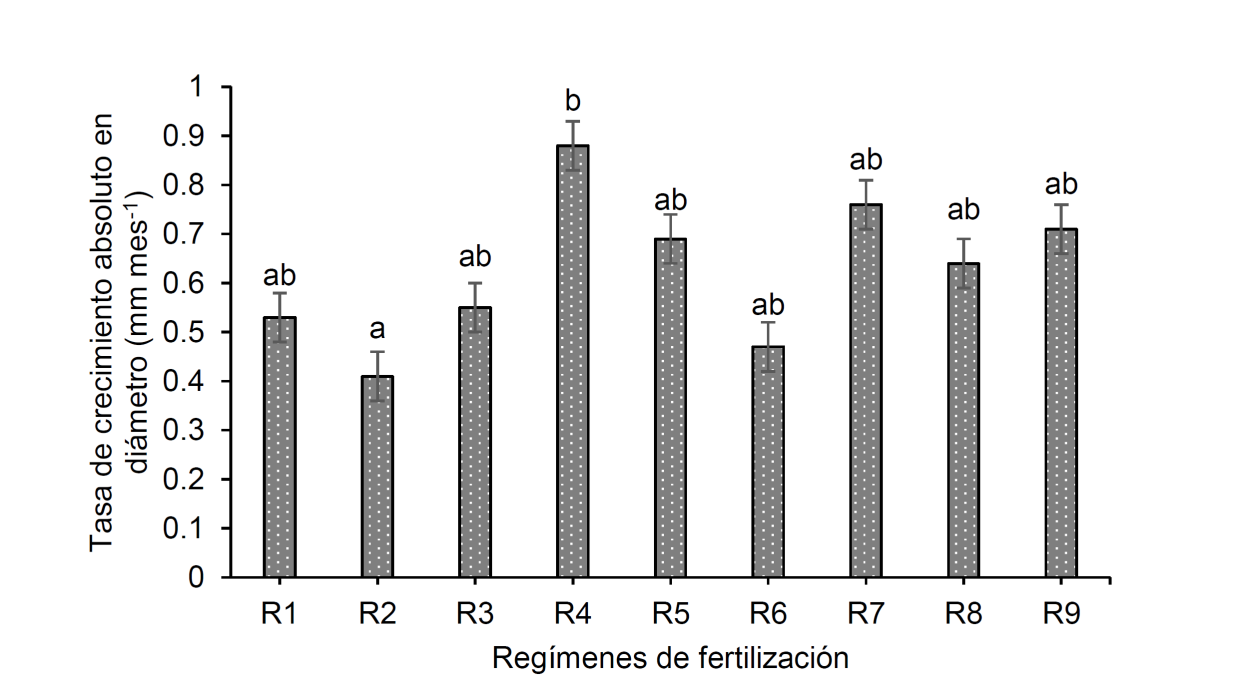
R1 = 4 g de FLC + 0 mg de FHS; R2 = 4 g de FLC + 375 mg de FHS; R3 = 4 g de FLC + 750 mg de FHS; R4 = 6 g de FLC + 0 mg de FHS; R5 = 6 g de FLC + 375 mg de FHS; R6 = 6 g de FLC + 750 mg de FHS; R7 = 8 g de FLC + 0 mg de FHS; R8 = 8 g de FLC + 375 mg de FHS; R9 = 8 g de FLC + 750 mg de FHS. FLC = fertilizante de liberación controlada Multicote (8)® 18-6-12; FHS = fertilizante hidrosoluble 20-20-20 (Peters Professional® Special Purpose). Barras con letras iguales no son significativamente diferentes (α = 0.05).
Figura 4 Crecimiento en diámetro (valores promedio ± desviación estándar) de plantas de Pithecellobium dulce trasplantadas en un medio infértil y sometidas a pérdida de biomasa aérea (poda severa) como prueba para evaluar su calidad en respuesta a nueve regímenes de fertilización en vivero.
Discusión
La fertilización en vivero es necesaria para el crecimiento y desarrollo de las plantas, principalmente cuando se producen en contenedores que limitan el desarrollo radical y con sustratos en los que el aporte de nutrimentos puede ser bajo o nulo y no cubren sus necesidades metabólicas. Por lo tanto, la fertilización como práctica cultural tiene potencial para modificar positivamente las características morfológicas y fisiológicas como lo señala Cortina et al. (2013). Los resultados de este trabajo ratifican lo anterior, ya que los regímenes de fertilización afectaron los índices morfológicos y fisiológicos de calidad de planta de P. dulce durante su producción en vivero. En general, un incremento de las características de calidad evaluadas estuvo asociada con los regímenes cuyo aporte de nutrimentos fue mayor (Tabla 2, Fig. 1). Este efecto coincide con resultados obtenidos en otros trabajos, en donde la práctica de fertilización ha tenido un efecto positivo en mejorar la calidad de planta de otras especies tropicales como Cassia grandis L. f., Peltophorum dubium Spreng. Taub. (Soares et al., 2017) y Plathymenia foliolosa benth. (Freitas et al., 2017).
Resultados con fertilizantes de liberación controlada ya se han registrado en algunas especies por ejemplo Anadenanthera peregrina (L.) Speg, Schinus terebinthifolius Raddi (Rossa et al., 2015), Cabralea canjerana (Vell.) Mart. (Carpenedo Aimi et al., 2016) y Tectona grandis L. f. (Escamilla-Hernández et al., 2015). En las dos primeras especies, se evaluó el efecto de la aplicación de Basacote® 6 M (13-6-16) en un intervalo de 0 kg m-3 - 10 kg m-3, y se encontró que dosis de 6 kg m-3- 10 kg m-3 favorecen un crecimiento mayor de las plantas durante 189 días de producción en vivero. Los resultados de Rossa et al. (2015), coinciden con los de este trabajo, ya que en el intervalo evaluado (4 g L-1-8 g L-1), los regímenes con las dosis mayores en general derivaron en plantas de calidad mejor (Tabla 2). En contraste, las plantas de las dos últimas especies mejoraron su calidad, pero con dosis que están por encima de las aplicadas en las plantas de P. dulce y en las de Anadenanthera peregrina y Schinus terebinthifolius. En Tectona grandis, la morfología de plantas de dos meses de edad se mejoró con la aplicación de 20 kg m-3 - 30 kg m-3 de Osmocote® 8 M (18-6-12) y en plantas de siete meses de Cabralea canjerana la mejor respuesta en variables morfológicas se consiguió con el aporte de 11.5 g L-1 de Osmocote® 6 M (15-9-12). Esta discrepancia podría deberse a las diferencias en las necesidades de cada especie de acuerdo con sus ciclos de crecimiento, a la variedad de formulaciones de los fertilizantes y a las condiciones de cultivo, particularmente las del medio de crecimiento, puesto que la disponibilidad de los nutrimentos en los fertilizantes de liberación controlada es sensible a la temperatura y humedad del sustrato (Wilkinson et al., 2014).
Por otro lado, el hecho de que el régimen 9 (R9=8 g de FLC+ 750 mg de FHS [20-20-20]), haya presentado los valores mayores y con significancia estadística en la mayoría de las variables morfológicas evaluadas (DCR, PSA, PST e ICD [Tabla 2]), sustenta la idea de que la adición de fertilizante hidrosoluble durante el crecimiento exponencial contribuyó a mejorar la calidad de las plantas de P. dulce. Esta respuesta coincide con las ventajas que se atribuyen en el diseño de rutinas fertilización involucrando tanto materiales solubles como sólidos (Rose et al., 2004). Al respecto, un trabajo realizado por Reyes et al. (2018) en plantas de Prosopis laevigata (Humb. et Bonpl ex Wild. M. C. Johnst. confirma que una mejora de las características morfológicas de plántulas de cuatro meses se logra combinando 6 g L-1 de un FLC Multicote® 8-9 M (18-6-12) con un hidrosoluble 19-19-19 en dosis constante de 100 mg L-1. La respuesta positiva documentada con el estudio de Reyes et al. (2018) y con lo registrado en este trabajo en cuanto al uso de ambos tipos de materiales, podría derivarse de la complementariedad entre las ventajas y desventajas que presentan ambos fertilizantes en factores tales como: tasa de liberación de nutrientes, uniformidad de aplicación, ajuste de tasas y relaciones de nutrientes, y eficiencia en el consumo de nutrientes (Oliet et al., 2008; Wilkinson et al., 2014), los cuales son aspectos que convendría fueran analizados más a detalle en trabajos de este tipo.
En relación con las variables fisiológicas, las plantas del R5 tuvieron la eficiencia fotosintética mayor al tener un valor de TAN de 0.62 mg cm-2 día-1; no obstante, este valor no difirió estadísticamente con las cifras presentadas por los regímenes 4 a 9 con valores superiores (Tabla 2). La respuesta en TAN ejercida por los regímenes en los que el aporte de fertilizante fue más elevado, ratifica la importancia, ampliamente aceptada que tienen los nutrientes minerales en los procesos fisiológicos de las plantas, especialmente la fotosíntesis, tanto en ambientes de vivero (Luis et al., 2009) como de campo (Pasquini y Santiago, 2012). Tasas altas de fotosíntesis derivan en una ganancia mayor de carbono que propician la producción de plantas grandes, las cuales según Luis et al. (2009) y Villar-Salvador et al. (2012) tienen oportunidad mayor de sobrevivir en campo. Sin embargo, para tener un crecimiento elevado las plantas deben destinar los suficientes recursos para soportar el continuo crecimiento tanto de raíces como de biomasa aérea, y esto se consigue con niveles suficientes de reservas nutrimentales que deben ser generadas por un adecuado aporte de nutrientes (Villar-Salvador et al., 2012; Basave Villalobos et al., 2014), ya que la formación de reservas compite por recursos con el crecimiento (Berendse et al., 2007). En este trabajo se observó que los contenidos de reservas nutrimentales mayores en las plantas de P. dulce se lograron con el R9 para el caso del nitrógeno, con el R4 para fósforo y con el R7 para potasio (Fig. 1); no obstante, al observar los nomogramas de vectores, las condiciones que en general presentaron las plantas fueron de suficiencia y dilución (Fig. 2 A, B, C). La suficiencia se registró en N con los regímenes 4 y 9. Un aporte extra de este nutrimento podría haber derivado en un consumo de lujo, lo cual a menudo se trata de propiciar con los programas de fertilización (Timmer, 1997; Oliet et al., 2013; Uscola et al., 2015), debido a las ventajas que se tienen en crecimiento de las plantas cuando estas se establecen en ambientes de escasa fertilidad (Basave Villalobos et al., 2015). En cambio, la dilución manifestada en P y K por la mayoría de los regímenes sugiere que hubo un desbalance de P y K con respecto a N, en el que los nutrimentos presentaron concentraciones subóptimas en el sustrato, que condujeron a una condición de deficiencia (López-López y Alvarado-López, 2010).
Según la prueba de calidad (Fig. 3 y 4), las reservas generadas por los regímenes en cuestión soportaron el rebrote y crecimiento de las plantas tras haber experimentado pérdida de biomasa y trasplante en un medio pobre de nutrientes, pero estas agotaron sus reservas, lo cual se explica por la ausencia de diferencias estadísticas en crecimiento a los nueve meses de evaluación. El R9 mostró un rebrote mayor pero una tasa menor de crecimiento, por el contrario, el R4 si tuvo un crecimiento mayor, aunque a expensas de un rebrote menor (Fig. 3 y 4). Este efecto indica una competencia entre la formación de reservas para el rebrote y el crecimiento, lo cual concuerda con la ecología del almacenamiento (F. Stuart, Ernst-Detlef y Harold A., 1990). A menudo, las plantas no acumulan la suficiente cantidad de reservas debido a que el aporte de nutrientes no excede las demandas del crecimiento, y esto puede darse cuando las raíces tienen una capacidad alta de absorción y la disponibilidad de nutrientes en el medio es baja o hay pérdidas de nutrientes a través de absición o herbivoría y no se aprovechan por retraslocación (F. Stuart Chapin III, 1980; Berendse et al., 2007). Experimentalmente, este fenómeno se presentó en una plantación de Cedrela odorata L. en donde se evaluó la influencia de la fertilización en el crecimiento y susceptibilidad de la especie en presencia del barrenador Hypsipyla grandella Zeller (Calixto et al., 2015). Probablemente, las condiciones simuladas a las que fueron sometidas las plantas de P. dulce en la prueba de calidad ejercieron un efecto similar de poca disponibilidad y pérdida de nutrientes, y de ahí las limitaciones presentadas en crecimiento o rebrote.
Finalmente, dado que el establecimiento de plantas con características de alta calidad incrementa la oportunidad de un mejor desempeño en campo como lo puntualizan Grossnickle y MacDonald (2018), los valores obtenidos en los índices de calidad determinados, son una base referencial para proyectos de producción o de investigación con la especie, principalmente por la falta de antecedentes como los hay en otras especies forestales, varias de ellas incluidas en la norma NMX-AA-170-SCFI-2016 ̏ Certificación de la operación de viveros forestales ̋ (Diario Oficial de la Federación [DOF], 2016), donde numéricamente se pretenden definir las características que una planta debe reunir para ser consideradas como de calidad buena para proyectos de reforestación o restauración.
Conclusiones
Los regímenes de fertilización diseñados a partir de materiales de liberación controlada e hidrosoluble muestran potencial para modificar las características morfológicas y fisiológicas en plantas de P. dulce durante la etapa de vivero. Particularmente, la adición de 8 g de fertilizante de liberación controlada Multicote (8)® 18-6-12 y fertilizante hidrosoluble 20-20-20 (Peters Professional® Special Purpose) en una concentración base de nitrógeno de 150 mg L-1, promueve en general la producción de plantas con las mejores respuestas en índices morfológicos de calidad evaluados. Fisiológicamente, también en ese nivel de fertilización las plantas presentan mejoras en su eficiencia fotosintética y estado nutrimental de nitrógeno, fósforo y potasio, aunque en este último caso únicamente se tiene un efecto de suficiencia en nitrógeno y de dilución en el resto de los nutrimentos, condición que podría mejorarse con un aporte extra de fertilizante. En la prueba de calidad donde las plantas fueron sometidas a estrés por pérdida de biomasa y trasplante en un medio con disponibilidad limitada de nutrientes, las reservas nutrimentales generadas por los niveles de fertilización no son suficientes para cubrir ambas demandas del rebrote y crecimiento.











 nova página do texto(beta)
nova página do texto(beta)



