Introducción
En la actualidad la degradación y destrucción de muchos ecosistemas en el mundo, está acelerando la crisis ambiental debido a la reducción de los múltiples servicios ambientales que estos prestan, como lo son la producción de agua, fijación de CO2, productividad del suelo, biodiversidad, entre otros (Vargas-Ríos, 2011). Las posibles causas de esta degradación a nivel global son múltiples y diversas, entre ellas se encuentran los fenómenos naturales de gran impacto, como terremotos y huracanes, así como las causas antropogénicas, en donde las actividades humanas como la deforestación y el uso inadecuado de suelos, juegan un papel decisivo (Montoya-Greenheck, 2005).
En México, las principales problemáticas que enfrentan los ecosistemas terrestres es la deforestación y el cambio de uso de suelo, que implican una reducción de la cobertura vegetal, ocasionando modificaciones en los ciclos hídricos y cambios regionales de los regímenes de temperatura y precipitación (Challenger y Dirzo, 2009; Comisión Nacional Forestal [Conafor], 2009). Entre 1976 y 2007 se deforestó anualmente una superficie de 534 707 ha, con una tasa anual de -0,08% para bosques, -0,41% para selvas y -0,36% para matorrales y mezquitales juntos, lo cual ha llevado a considerar a México como un país deteriorado (Carabias, Arriaga y Cervantes-Gutiérrez, 2007; Rosete-Vergés et al., 2014; Calva-Soto y Pavón, 2018).
A causa de lo anterior, el manejo forestal y ambiental enfrentan el reto de generar esquemas que garanticen el mantenimiento de la diversidad biológica, la conservación de la variabilidad genética y de ecosistemas, así como todas las funciones ecológicas, antes de que el deterioro continúe aumentando por causas antropogénicas (Aguirre-Calderón, 1997; Carabias et al., 2007). Una solución relativamente simple es a través de la reintroducción de especies nativas: resiembras de pastizales, trasplantes de arbustivas o reforestación en áreas boscosas (Melgoza et al., 2007). Es conveniente elegir las especies de la región que mejor se adapten a las condiciones actuales del ecosistema en cuanto a suelo, clima, topografía, disponibilidad de agua, vegetación natural y los objetivos de la plantación, entre otras, seleccionando aquellas con posibilidades de cubrir más rápidamente las superficies desprovistas de vegetación (Comisión Nacional Forestal [Conafor], 2010). Para recuperar los ecosistemas dañados, en el caso de las áreas boscosas se sugiere llevar a cabo prácticas de reforestación y restauración que incluyen coníferas y latifoliadas (Hernández-Cuevas, Guerra-de la Cruz, Santiago-Martínez y Cuatlal-Cuahutencos, 2011). No obstante, a fin de fundamentar medidas y prácticas para la conservación, restauración y aprovechamiento racional, es necesario aumentar el conocimiento ecológico y biológico, generando información aplicable para la restauración ecológica, siendo una disciplina emergente en México (Calva-Soto y Pavón, 2018).
Forestiera phillyreoides (Benth.) Torr. es una especie nativa de México, perteneciente a la familia Oleaceae, que se distribuye desde el sur de Estados Unidos hasta el sur de la república mexicana (Villaseñor, 2016; Rzedowski y Calderón, 2004). Es un arbusto o árbol pequeño de hasta de 6 m de alto, facultativamente caducifolio, su tronco principal puede medir hasta 20 cm de diámetro, con ramillas tomentosas a glabrescentes en la juventud, presenta hojas angostas a anchamente elípticas, a veces oblongas, lanceoladas u oblanceoladas, de 1 cm a 2.5 cm de largo y 0.3 cm a 1.6 cm de ancho, densamente tomentosas a glabras en ambas caras; sus flores son pequeñas, apétalas, de color verde o amarillentas, y sus frutos son carnosos, elipsoides, de color negro y algo azulados cuando son maduros (Felger y Rutman, 2016; Rzedowski y Calderón, 2004). Se trata de una especie de apariencia austera que puede adecuarse a cualquier tipo de suelo (Secretaría de Medio Ambiente y Desarrollo Sustentable [Semadesu], 2013) y además soporta heladas y sequías (De la Cerda-Lemus y González-Adame, 2009). En México forma parte de matorrales xerófilos, pastizales, bosques tropicales caducifolios, así como de algunos encinares, pinares contiguos y a menudo en vegetación secundaria, en altitudes entre 1700 m y 2400 m snm (Rzedowski y Calderón, 2004).
A pesar de su amplia distribución y presencia en diversos ecosistemas, F. phillyreoides ha sido poco estudiada y no se tienen datos sobre la germinación de sus semillas y como mejorar sus porcentajes de germinación, así mismo no se cuenta con datos sobre su crecimiento y cultivo en viveros, información importante para su propagación y posible uso en reforestación.
Objetivos
Debido a la falta de información sobre la especie de estudio, el objetivo de esta investigación fue generar información sobre el tiempo de fructificación de la especie en la zona de estudio, medir su germinación bajo distintos tratamientos pregerminativos, así como evaluar el crecimiento de las plántulas para el uso posterior en viveros forestales y en la restauración de zonas degradadas.
Materiales y métodos
Fructificación y colecta de material biológico
Se realizó una consulta de ejemplares depositados en el herbario de la Universidad Autónoma de Aguascalientes (HUAA) y una consulta bibliográfica (Siqueiros-Delgado, Rodríguez-Avalos, Martínez-Ramírez, Sierra-Muñoz y García-Regalado, 2017), con el fin de contar con información de la distribución de F. phillyreoides en el estado de Aguascalientes (Tabla 1). Además, por medio de los ejemplares depositados en HUAA tener una primera aproximación a los meses en que fructifica la especie. Posteriormente se realizaron salidas de campo a las localidades de colecta, dos veces por mes a partir del mes de floración, con la finalidad de identificar los meses en que se presentan frutos maduros.
Tabla 1 Nombre común, usos y distribución de F. phillyreoides en el estado de Aguascalientes.
| Nombres comunes en la zona de estudio | Mimbre y palo blanco |
| Usos locales | Alimentación de cabras y elaboración del mango de las herramientas (Barba-Ávila, De la Cerda- Lemus y Hernández-Duque, 2003). |
| Distribución por tipo de vegetación | Bosque de encino, bosque tropical bajo caducifolio, matorral subtropical, matorral espinoso crasicaule, mezquital, matorral inerme rosetófilo, matorral desértico micrófilo, pastizal natural, bosque de galería (Siqueiros et al 2017, HUAA). |
| Distribución altitudinal | 1600 m - 2180 m (HUAA) |
| Datos climatológicos en sitios de colecta | Precipitación media anual: 453 mm; Temperatura media anual: 17.6 °C (Sistema Meteorológico Nacional [SMN], 2017) |
| Tipo de suelo en sitios de colecta | Regosol y leptosol (Secretaría de Sustentabilidad Medio Ambiente y Agua [Ssmaa], 2019) |
Se colectaron frutos maduros de cinco diferentes ejemplares de F. phillyreoides por localidad. La colecta se realizó durante el mes de mayo en dos localidades: Arroyo Seco, en el municipio de Jesús María, Aguascalientes (21° 58' 1.49" N; 102° 22' 53.50" W, 1950 m snm) y en El Garabato, en el municipio de Pabellón de Arteaga, Aguascalientes (22° 4' 43.40" N, 102° 21' 41.97" W, 2007 m snm). Los frutos fueron colectados directamente del arbusto para evitar daños a la semilla, seleccionando aquellos frutos bien desarrollados.
Para la caracterización del fruto, se midió el ancho, el largo y el peso de 100 frutos recién colectados. Posteriormente a cada fruto se le retiró manualmente el mesocarpio y se dejó secar la semilla. Las semillas obtenidas de los frutos anteriormente medidos fueron caracterizadas morfológicamente, midiendo el ancho, el largo y el peso de cada semilla.
Germinación
Para el desarrollo del experimento de germinación se utilizaron cuatro réplicas de 25 semillas por tratamiento. Los ocho tratamientos pregerminativos evaluados fueron: control, inmersión en agua por 24 h, inmersión en ácido sulfúrico a 96% (H2SO4) por tres, seis, nueve y doce minutos, remoción manual de endocarpio más 24 h de inmersión en agua e inmersión en 500 ppm de ácido giberélico (GA3) por 24 h. Se utilizaron tratamientos con ácido sulfúrico a diferentes tiempos cortos, debido a que se observó en campo el consumo de los frutos por aves y excretas con semillas de F. phillyreoides. De esta forma encontrar el tiempo necesario para lograr una mayor germinación.
Las semillas que presentaron daños por insectos fueron retiradas antes de la siembra, posteriormente las semillas restantes fueron lavadas con hipoclorito de sodio a 10% de concentración durante un minuto. Las unidades experimentales constaron de cajas petri de 90 mm × 15 mm, donde se sembraron 25 semillas sobre papel filtro y algodón, a cada semilla se le agregó una gota de fungicida Interguzan 30 - 30® y posteriormente fueron colocadas a una temperatura de 25 °C ± 2 °C con un fotoperiodo de ocho horas. El número de semillas germinadas se contabilizó cada dos días, removiendo las semillas germinadas.
El experimento de germinación se concluyó a los 40 días después de la siembra (DDS) cuando se dejó de observar germinación. Al finalizar el experimento se midió el porcentaje de germinación, se calculó el índice de germinación (IG) siguiendo la siguiente fórmula (Peng, Xiao, Wang y Yu, 2018):
Donde:
G t = número de semillas germinadas en t días.
D t = número de días transcurridos después de la siembra.
Se calculó el tiempo medio de germinación (TMG):
Donde:
Xi = número de semillas germinadas por observación.
Ti = días transcurridos después de la siembra.
Crecimiento de la plántula
Para evaluar la supervivencia y crecimiento de las plántulas, se extrajeron plántulas emergidas o próximas a emerger procedentes del experimento de germinación (n = 50), y fueron trasplantadas a raíz desnuda en tubetes forestales intercambiables con capacidad de 380 cm3, el sustrato fue elaborado a partir de una mezcla de 50% de suelo cercano a la zona de colecta (Tabla 2), 40% de peat moss y 10% agrolita. Se colocaron en vivero con malla sombra del 50% (temperatura media anual, 18.8 °C, max. 27.2 °C, min. 10.4 °C), regándose dos veces por semana y con fertilización agregada al riego cada siete días por medio de 19-19-19 usando una dosis de un gramo por litro. Se tomaron mediciones de altura de la plántula cada cuatro semanas durante siete meses. Al finalizar el periodo de los siete meses, se midió la altura final y diámetro del cuello por medio de un vernier, posteriormente se colocaron en bolsas de papel y se secaron por 72 h a 70 °C para obtener el peso seco de la parte aérea (PSA) y peso seco radicular (PSR).
Tabla. 2 Características del suelo cercano a la zona de colecta utilizado en el sustrato.
| Tipo de suelo | Textura | Arenas | Limos | Arcillas | Pt | MOS |
| % | ||||||
| Regosol | Franca | 44 | 32.4 | 23.6 | 52.8 | 2.5 |
Pt = porosidad total, MOS =Materia orgánica del suelo.
Con los datos obtenidos se calculó el índice de robustez (IR) de las plántulas.
Relación biomasa seca aérea/biomasa seca raíz
El índice de calidad de Dickson (ICD):
Se categorizó la calidad de las variables calculadas en alta, media y baja, a partir de lo mencionado por Rueda-Sánchez et al. (2014) para especies latifoliadas, con excepción de la supervivencia.
Análisis estadístico
Se calcularon medias y desviaciones estándar (ds) de los valores obtenidos de tamaño y peso para los 100 frutos y semillas medidas al igual que para los datos de crecimiento. Para evaluar el efecto de los tratamientos pregerminativos en la germinación, los porcentajes fueron normalizados por medio de la función Arc sen con el fin de cumplir los supuestos de normalidad y homogeneidad de varianzas. Posteriormente se comparó por medio un análisis ANOVA de una vía con comparación de medias mediante el método Tukey (p < 0.05) usando el programa InfoStat (Di-Rienzo et al. 2016)
Resultados y discusión
Fructificación y colecta de material biológico
La fructificación de F. phillyreoides se lleva a cabo de finales de marzo a principios de junio, comenzándose a observar frutos maduros a partir de la última semana de marzo y siendo las últimas dos semanas de abril y primeras de mayo donde se observó mayor cantidad de frutos maduros (Tabla 3, Fig. 1). Esto difiere con lo mencionado por Rzedowski y Calderón (2004), donde ellos reportan fructificación desde marzo hasta el mes de octubre para la flora del bajío y zonas adyacentes. La temporada de fructificación observada en F. phillyreoides coincide con la época de sequía, antes del inicio de la temporada de lluvia, esto es importante para su dispersión y su rol ecológico, ya que sus frutos son abundantes y presentan alto contenido de agua, representando una fuente de alimento y de agua para las especies de fauna que las consumen durante la época de sequía. La fructificación en regiones semiáridas suele ser durante la época de lluvia (Griz y Machado, 2001). Las especies que producen frutos maduros durante la temporada de lluvias por lo regular poseen frutos carnosos dispersados por animales y suelen estar presentes durante un largo período, en contraste con las especies que producen frutos maduros en la estación seca, que tienden a tener frutos secos dispersados por medio de anemocoria y cortos periodos de fructificación (Du, Mi, Liu, Chen y Ma, 2009; Griz y Machado, 2001; Núñez-Cruz, Meave y Bonfil, 2018).
Tabla. 3 Tiempo de fructificación, características morfométricas y valores promedio ± ds de los frutos y semillas de Forestiera phillyreoides.
| Fructificación | |
| Tiempo de fructificación: | Marzo a Junio |
| Ancho (mm): | 7.05 ± 0.57 |
| Largo (mm): | 12.33 ± 1.58 |
| Peso (g): | 0.39 ± 0.10 |
| Forma: | Elipsoide - Falcada |
| Tipo de fruto: | Drupa |
| Características de la semilla | |
| Ancho (mm): | 3.14 ± 0.033 |
| Largo (mm): | 9.19 ± 0.849 |
| Peso (g): | 0.043 ± 0.006 |
| Forma: | Elipsoide - Falcada |
| Tipo de germinación: | Epigea |

Figura 1 Fructificación y semilla de F. phillyreoides. A) Ejemplar en campo, B) Floración durante la cuarta semana de febrero. C) Frutos verdes durante la primera semana de marzo. D) Frutos en maduración durante la primera semana de abril. F) Frutos maduros durante la primera semana de mayo. F) Semilla con endocarpio. G) Semilla con remoción manual de endocarpio.
Los ejemplares presentan frutos en distintas etapas de maduración, y pueden encontrarse además frutos que no logran desarrollarse por completo que están desprovistos de mesocarpio y que poseen endocarpio rígido. Los frutos colectados presentaron una longitud de 12.33 mm ± 1.58 mm y las semillas de 9.19 mm ± 0.849 mm, mientras que en la literatura se registra una longitud de 7 mm a 11 mm para el fruto y 4.5 mm a 5.5 mm para la semilla (Felger y Rutman, 2016; Rzedowski y Calderón, 2004). Estas diferencias morfométricas en las semillas y frutos pueden estar directamente ligadas con las condiciones ambientales en las que se desarrollaron cada población de la especie (Pozo-Gómez, Orantes-García, Rioja-Paradela, Moreno-Moreno y Farrera-Sarmiento, 2019). Aunque cabe mencionar que estas diferencias, especialmente en el fruto, también puedan deberse a que los frutos y semillas mencionados en la descripción de la especie provengan de ejemplares que pasaron por un proceso de herborización y fueron posteriormente medidos, a diferencia de los mencionados en el presente estudio que fueron medidos inmediatamente después de ser colectados directamente de la planta y sin ser deshidratados y herborizados.
Germinación
El mayor porcentaje de germinación fue alcanzado por el tratamiento de remoción de endocarpio + 24 h en H2O (95 ± 4.08), mientras que el tratamiento con 500 ppm de GA3 presentó el menor porcentaje de germinación (12.50 ± 6.45), de igual manera para el índice de germinación (IG), con valores de 2.87 ± 0.13 para el tratamiento de remoción de endocarpio + 24 h en H2O y 0.19 ± 0.12 para el tratamiento con 500 ppm de GA3, presentando diferencias significativas con los demás tratamientos. En el análisis se observa que los tratamientos con H2SO4 de 6 min, 9 min y 12 min fueron estadísticamente similares, con porcentajes de germinación de 70% - 76.25% e IG de 1.09 - 1.24. El tratamiento control fue similar al tratamiento de inmersión en H2O × 24 h e inmersión en H2SO4 × 3 min, obteniendo valores de 35% - 52.5% de germinación (Tabla 4).
Tabla 4 Efecto de los tratamientos pregerminativos en semillas de F. phillyreoides.
| Tratamiento | Germinación (%) | IG | TMG |
| Control | 35 ± 10.80 d | 0.39 ± 0.12ed | 20.14 ± 0.98a |
| Inmersión en H2O × 24h | 48.75 ± 8.54 cd | 0.62 ± 0.12d | 17.17 ± 1.25abc |
| Inmersión en H2SO4 × 3 min | 52.50 ± 11.90cd | 0.67 ± 0.19cd | 17.74 ± 1.33ab |
| Inmersión en H2SO4 × 6 min | 70 ± 10 bc | 1.12 ± 0.22bc | 14.53 ± 1.07cd |
| Inmersión en H2SO4 × 9 min | 76.25 ± 11.09 b | 1.24 ± 0.33b | 14.01 ± 1.85d |
| Inmersión en H2SO4 × 12 min | 72.50 ± 5 bc | 1.09 ± 0.15bc | 14.82 ± 0.75bcd |
| Remoción manual de endocarpio + 24h H2O | 95 ± 4.08 a | 2.87 ± 0.13a | 7.24 ± 0.15e |
| Inmersión en 500 ppm de GA3 × 24h | 12.50 ± 6.45 e | 0.19 ± 0.12 e | 14.17 ± 1.67d |
*Medias ± desviación estándar. IG: índice de germinación; TMG: tiempo medio de germinación. Medias con una letra en común no son significativamente diferentes (p > 0.05)
Los porcentajes de germinación obtenidos con los tratamientos pregerminativos de inmersión en H2SO4 de 6 min, 9 min y 12 min, así como remoción de endocarpio + 24 h en H2O, fueron mayores en la especie estudiada a los encontrados para otra especie del mismo género, Forestiera acuminata, donde se encontraron porcentajes de 55% - 66%, con semillas que fueron consumidas por peces y colectadas sumergidas en agua de un lago en su hábitat (Adams et al., 2007), aunque los porcentajes y velocidad de germinación en esta fueron similares al tratamiento control, inmersión en H2O durante 24 h e inmersión en H2SO4 tres minutos.
El GA3 presentó un efecto negativo sobre las semillas, el tratamiento con 500 ppm de GA3 presentó el valor más bajo de geminación, 12.50% ± 6.45% (Tabla 4). A pesar de que se han mencionado en otros estudios los efectos positivos del GA3 sobre la germinación y el rompimiento de la latencia, reemplazando la necesidad de un estímulo ambiental específico como la temperatura o luz (García-Martínez y Gil, 2002; Tilki and Guner 2007), los efectos obtenidos con el GA3 concuerdan con lo encontrado por Amador-Alférez, Díaz-González, Loza-Cornejo y Bivián-Castro (2013), quienes mencionan una reducción en la germinación de especies de Ferocactus al utilizar una concentración de 500 ppm de GA3, mencionando que el resultado puede deberse a que las semillas son de reciente colecta, las condiciones del experimento fueron adecuadas y en consecuencia las semillas no requieran un estímulo externo. Los resultados sugieren que las semillas de F. phillyreoides no presentan latencia morfológica o fisiológica y no requieren estímulos externos como la luz o la temperatura para su germinación cuando son recientemente colectadas.
El tiempo medio de germinación entre tratamientos presentó diferencias significativas. El tratamiento que presentó el menor tiempo de germinación fue el tratamiento de remoción manual de endocarpio + 24 h H2O, el cual comenzó su germinación a partir del cuarto día y teniendo como TMG 7.24 ± 0.15, siendo estadísticamente diferente a los demás tratamientos. Los tratamientos restantes, en su mayoría, comenzaron su germinación a partir del día 8, presentando un TMG mayor de 14. Los tratamientos de inmersión en H2O × 24 h, inmersión en H2SO4 × 3 min y control presentaron los mayores valores de TMG (Fig. 2, Tabla 4).

Figura 2 Curva de germinación acumulada de semillas de F. phillyreoides sometidas a los ocho tratamientos estudiados.
El porcentaje mayor de germinación así como la mayor velocidad, que se observaron en las semillas sin endocarpio y en las semillas expuestas a periodos de cortos de ácido sulfúrico es similar a lo encontrado en otros grupos de plantas, mayormente en leguminosas y especies forestales con frutos carnosos, donde se ha logrado incrementar el porcentaje de germinación por medio de tratamientos de ácido sulfúrico a distintos tiempos (Narbona, Arista, & Ortiz, 2003; Medina-Sánchez y Lindig-Cisneros, 2005; Peng et al., 2018; Villarreal-Garza et al., 2013). Aunque el tratamiento de remoción de endocarpio + 24 h H2O presentó una mayor velocidad, los tratamientos de H2SO4 podrían mejorar su velocidad de germinación si después de la inmersión en ácido sulfúrico se colocaran por 24 horas en agua. El porcentaje de germinación y TMG son una respuesta positiva de los tratamientos pregerminativos que reducen el endocarpio. Al reducir o eliminar la capa del endocarpio se facilita la entrada de agua al embrión para iniciar la imbibición y consecuentemente la germinación, así mismo ayuda a que la radícula rompa la barrera física que puede representar el endocarpio, facilitando su emergencia con mayor velocidad, por consecuencia adquiriendo un mayor vigor que las semillas sin tratamientos que degraden o remuevan esta capa.
La reacción de las semillas a los tratamientos con ácido sugiere que el consumo de los frutos por parte de dispersores podría jugar un papel importante en la amplia distribución de F. phillyreroides, ayudando a su dispersión y aumentando su germinación, ya que gran parte de las semillas de especies forestales son dispersadas por medio de zoocoria (Du et al., 2009). La dispersión por medio de zoocoria se ha estudiado anteriormente en F. acuminata y especies del género Ligustrum, que al igual que la especie estudiada forman parte de la familia Oleaceae, en estos estudios se encontró que las semillas de F. acuminata son dispersadas por medio de peces y aves, mientras que las semillas de Ligustrum sp. son consumidas y dispersadas por medio de las aves (Adams et al., 2007; Montaldo, 1993), al igual que en nuestras observaciones para F. phillyreroides. Aunque cabe resaltar que en los estudios mencionados no se encontró un aumento significativo en los porcentajes de germinación, no todos los casos suelen ser beneficioso para las semillas debido a las diferentes concentraciones de ácido en el estómago del consumidor y tiempo en que tardan en ser desechadas, sirviendo solo como dispersores (Montaldo, 1993).
Crecimiento de la plántula en vivero
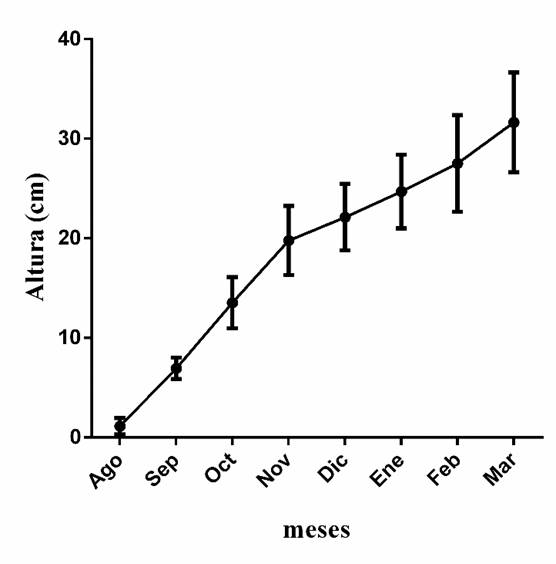
Las plántulas presentaron un porcentaje de supervivencia de 100%, llegando a alcanzar una altura de 31.65 cm ± 5.01 cm y un diámetro de 5.13 mm ± 0.34 mm en los siete meses de crecimiento (Tabla 5). El crecimiento fue mayor en los primeros meses y en el último mes de cultivo, los meses intermedios tuvieron un crecimiento menor debido a que pertenecen a la temporada invernal en la región (Fig. 3). La altura y diámetro que presentó la especie de estudio fue mayor al mencionado para Prosopis laevigata producido en 21 semanas (Prieto-Ruiz, Rosales-Mata, Sigala-Rodríguez, Madrid-Aispur y Mejía-Bojorques, 2013), especie que llega a convivir con F. phillyreroides y que de igual manera presenta una amplia distribución en la región.
Tabla 5 Variables de calidad de planta de F. phillyreroides producida en siete meses de crecimiento.
| Variable | Media ± DS | Calidad |
| Supervivencia (%) | 100 | - |
| Altura (cm) | 31.65 ± 5.01 | Alta |
| Diámetro (mm) | 5.13 ± 0.34 | Alta |
| Índice de robustez | 6 ± 1.31 | Media |
| PSA/PSR | 1.02 ± 0.17 | Alta |
| ICD | 0.34 ± 0.09 | Media |
* Parámetros de calidad de acuerdo con lo mencionado por Rueda-Sánchez et al. (2014) para especies latifoliadas. DS: desviación estándar; ICD: índice de calidad de Dickson; PSA/PSR: relación biomasa seca aérea/biomasa seca raíz.
La altura y diámetro que presentó cumplen con los requerimientos de calidad mencionados por la Comisión Nacional Forestal (Conafor, 2015), donde indican una altura de 25 cm a 35 cm de altura y un diámetro mínimo de 4 mm para especies latifoliadas, alcanzando una calidad alta en estas dos variables (Tabla 5). Se ha llegado a mencionar el diámetro como una variable importante, ya que plantas con diámetro mayor a 5 mm son más resistentes al doblamiento y toleran mejor los daños causados por depredadores (Mexal y Landis, 1990; Prieto, García, Mejía, Huchín y Aguilar, 2009).
La relación PSA/PSR presentó valores de 1.02 ± 0.17, lo que indica una calidad alta en esta variable. Este parámetro puede ser de gran importancia cuando la plantación tiene lugar en sitios con estaciones difíciles y poca disponibilidad de agua (Bierchler, Rose, Royo y Pardos, 1998; Thompson, 1985). Las plantas con valores menores de relación PSA/PSR pueden tener un mejor estado hídrico y un consumo de agua más eficiente bajo condiciones de sequía, con valores altos puede haber problemas en campo debido al incorrecto balance hídrico, como consecuencia las plantas con valores bajos de PSA/PSR tendrían mayores posibilidades de sobrevivir en campo aun en condiciones poco favorables (May, 1984; Reyes-Reyes, Aldrete, Cetina-Alcalá y López-Upton, 2005). Lo anterior indica que las plántulas de F. phillyreroides tendrían mayores posibilidades de sobrevivir en campo en condiciones de climas semiáridos.
El ICD presentó valores de 0.34 ± 0.09, por lo tanto, de calidad media. El ICD combina el índice de robustez y de PSA/PSR y los ajusta por el efecto del tamaño de la planta, entre más alto sea el valor la calidad que presenta la planta es mejor, lo cual implica que el desarrollo de la planta es bueno y que la parte aérea y radical están equilibradas (Oliet, 2000; Reyes-Reyes et al., 2005). Los valores de este índice fueron mayores a los presentados por P. laevigata con valores de 0.07 a 0.11 (Prieto-Ruiz et al., 2013). El ICD en F. phillyreroides, como en P. laevigata, puede haberse visto afectados por la cantidad de biomasa y robustez, ya que ambas llegan a presentar poca biomasa seca y menor robustez en etapa de plántula.
Es común observar a F. phillyreoides en asociación con Eysenhardtia polystachya y otras especies de leguminosas como, P. laevigata, Acacia schaffneri y Dalea bicolor en Matorrales xerófilos (Siqueiros et al. 2016). Estas tres especies de leguminosas han sido mencionadas como especies que se pueden usar para la restauración de zonas degradadas, en especial E. polystachya, que se menciona como un elemento de sucesión intermedia (González y Camacho, 2000; Hernández-Cuevas et al., 2011; Gelviz-Gelvez, Pavón, Illoldi-Rangel, & Ballesteros-Barrera, 2015; Núñez-Cruz et al., 2018). Lo anterior es importante, en relación cercana de asociaciones con E. polystachya, nos indicaría que la especie estudiada también puede ser un elemento de sucesión intermedia y que tiene un potencial importante en la restauración de zonas degradadas en la región centro del país, especialmente en zonas semiáridas.
Conclusiones
Forestiera phillyreoides fructifica de marzo a junio, antes del periodo de lluvias. La germinación se ve beneficiada por los tratamientos pregerminativos que remueven el endocarpio, el mejor tratamiento consiste en la remoción manual de endocarpio más 24 h de inmersión en agua, en segundo lugar, la inmersión en H2SO4 de 6 min a 12 min. No se recomienda el uso de GA3 en las semillas con poco tiempo de colecta debido a que llega reducir el porcentaje de germinación. En siete meses de cultivo en vivero, alcanzó los parámetros de calidad necesarios para el uso en reforestación, con calidad alta en diámetro, altura y relación PSA/PSR y calidad media para índice de robustez e ICD.
Debido a su amplia distribución, presencia en diversos ambientes y tipos de vegetación, en especial zonas de vegetación xerófila y subtropical, F. phillyreoides es una opción viable para encausar estrategias de reforestación, pues es una especie con fácil adaptación a varios tipos de clima y suelo, así como su asociación con especies forestales de gran importancia. Sin embargo, es importante la evaluación previa del suelo antes de realizar trabajos de reforestación, por ello se recomienda realizar futuras investigaciones sobre los factores que determinan la distribución de la especie, que sirva como complemento del presente estudio y de esta manera lograr reforestaciones exitosas.











 nova página do texto(beta)
nova página do texto(beta)