Introducción
Las selvas tropicales protegen la mayor diversidad biológica del planeta y brindan servicios ecosistémicos fundamentales (Celentano et al., 2011), ya que regulan la atmósfera a nivel global, el sistema hidrológico a nivel local y regional, la escorrentía superficial, la fotosíntesis (Yadav y Gupta, 2006) y con el reciclaje de sus nutrimentos permiten la fertilidad natural del suelo. Además, brindan a las poblaciones rurales y urbanas, maderas útiles en la construcción de viviendas, forraje, combustible, plantas alimenticias y medicinales (Granielo-Vásquez, 1985; Sánchez-Aguilar y Rebollar-Domínguez, 1999; Martínez-Ramos y Gargía-Orth, 2007).
Los estudios de las comunidades vegetales son fundamentales para el desarrollo de planes de conservación y para hacer un uso sostenible de sus componentes, por lo que su conocimiento, cuantificación y análisis, es conveniente en el contexto actual ante las fuertes presiones antrópicas (Villarreal et al., 2004), tales como la tala clandestina para madera y leña, el crecimiento de tierras para cultivos y los incendios que cada año devastan grandes extensiones de selvas, disminuyendo la mayor parte de las características originales de estas comunidades (Khesoh y Kumar, 2017). Los efectos de estas presiones afectan la estructura de las comunidades vegetales, composición, fisonomía, riqueza de especies (Milchunas y Lauenroth, 1993; Murphy, Lugo, Murphy y Nepstad, 1995; Dunphy, Murphy y Lugo, 2000; Pykälä, 2003; Baquero, Gómez y Orozco, 2011), y la diversidad y distribución (Proulx y Mazumder, 1998). La vegetación es un factor clave en la determinación de la estructura de cualquier ecosistema (Bhatt y Purohit, 2009; Khali y Bhatt, 2014). La pendiente, la altitud, la lluvia y la humedad también juegan un papel importante en la formación de comunidades vegetales y su composición (Kharkwal, Mehrotra, Rawat y Pangtey, 2005).
Para el manejo de las comunidades vegetales, tanto perturbadas como no perturbadas es importante la caracterización cuantitativa de las especies leñosas ya que es un primer paso para entender la estructura de la vegetación, composición y la diversidad (Williams-Linera, 2002; Durán, Meave, Lott y Segura, 2006; Neelo, Teketay, Kashe y Masamba, 2015). La caracterización es fundamental ya que la distribución de las especies no es homogénea y el status de una especie puede ser rara o abundante o tener restricciones ecológicas por algún factor como el suelo y la humedad (White y Hood, 2004 y Vargas-Rodríguez, Vázquez-García y Williamson, 2005).
Existen trabajos que han contribuido al conocimiento de la composición y estructura de la vegetación en la Península de Yucatán. Entre ellos destacan los de Rico-Gray (1982); Thien, Bradburn y Welden (1982); Olmsted y Durán (1986); Olmsted y Durán (1990); Rico-Gray et al. (1988 y 1991); White y Darwin (1995); Mizrahi, Ramos-Prado y Jiménez-Osornio (1997); Sánchez (2000); González-Iturbe, Olmsted y Tun-Dzul (2002); Schultz (2003); White y Hood (2004); Zamora-Crescencio et al. (2007); Leirana-Alcocer, Hernández-Betancourt, Salinas-Peba y Guerrero-González (2009); Dupuy et al. (2012); Gutiérrez-Báez, Ortiz-Díaz, Flores-Guido y Zamora-Crescencio (2012a); Navarro-Martínez, Durán-García y Méndez-González (2012); Carreón-Santos y Valdez-Hernández (2014) y Hernández-Ramírez y García-Méndez (2015). En Campeche, aunque existen trabajos que aportan información sobre estudios cuantitativos de la vegetación (Durán, 1987, 1995; Martínez y Galindo, 2002; Díaz-Gallegos, Castillo-Acosta y García-Gil, 2002; Echeverría, Arreola, Esparza-Olguín, Morales y López, 2014; García-Licona, Esparza-Olguín y Martínez-Romero, 2014; Zamora-Crescencio et al., 2015) pocos estudios han examinado la estructura y composición de la selva mediana subcaducifolia (Gutiérrez-Báez, Zamora-Crescencio y Hernández-Mundo, 2012b; Gutiérrez-Báez, Folan, Folan, Gallegos y Zamora-Crescencio 2017; Dzib-Castillo, Chanatásig-Vaca y González-Valdivia, 2014).
En la Península de Yucatán, la selva mediana subcaducifolia se distribuye en el centro y norte de la península (Flores y Espejel, 1994; Pennington y Sarukhán, 2005) y hacia el sur del municipio de Campeche, su composición florística es característica de cada lugar (Miranda, 1978). Esta selva se caracteriza porque entre 50% y 75% de los árboles que la conforman pierden las hojas en tiempo de sequía (Flores y Espejel, 1994). La altura de sus árboles oscila entre 10 m y 20 m (Flores y Espejel, 1994). Se presenta en terrenos pedregosos ya sea de ladera o planos con suelo somero. Las especies que caracterizan a la selva mediana subcaducifolia son: Vitex gaumeri, Piscidia piscipula, Enterolobium cyclocarpum, Vachellia pennatula, Caesalpinia gaumeri, Lysiloma latisiliquum, Metopium brownei, Bursera simaruba, Guettarda combsii, Coccoloba cozumelensis, Semialarium mexicanum, Sabal mexicana (Miranda, 1978; Flores y Espejel, 1994). Para el área de estudio, esta comunidad vegetal ha sido afectada por las actividades humanas principalmente para cultivar maíz (lugares planos) y para la extracción de algunas especies como ja´abin (Piscidia piscipula) que se utiliza para hacer carbón, el boox káatsim (Senegalia gaumeri) para leña, el k´anchunuup (Thouinia paucidentata) para construcción, para techo de las casas, tasta´b (Guettarda combsii) para construcción de techo de las casas (com. pers. Miguel Mex May).
Objetivos
El objetivo de este trabajo fue obtener información sobre la estructura y la composición florística de la selva mediana en el ejido de Hobomó, Campeche, que sirva de base para plantear estrategias de protección y conservación del germoplasma local.
Materiales y métodos
Área de estudio
El estudio se desarrolló en el Ejido de Hobomó, localizado en la parte sur del municipio de Campeche, Campeche, México. Se seleccionaron dos sitios separados entre sí por 5.5 km de distancia. El sitio 1 se encuentra entre las coordenadas 19° 37’ 05’’ N y 90° 27’ 06’’ W, mientras que el sitio 2 entre 19° 35’ 38’’ N y 90° 29’ 50’’ W (Fig. 1). Su topografía es de lomeríos suaves, el sitio 1 con una altitud de 50 m snm, mientras que el sitio 2 es de 70 m snm (Instituto Nacional de Estadística y Geografía [Inegi], 2000). Las rocas en ambos sitios son sedimentarias del Cenozoico y de formación caliza de edad Eocénica del Terciario Inferior (Inegi, 2000). El suelo en los dos sitios es de tipo rendzina combinado con litosol, presenta un horizonte mólico, con reacción al HCl; la estructura es granular de tamaño fino y con moderado desarrollo. Con frecuencia presenta pedregosidad con afloramiento de roca madre. Este tipo de suelo es el más productivo, de textura fina arcillosa y asociados a selva mediana subcaducifolia (Inegi, 1984; Flores y Espejel, 1994). El clima de la región es del tipo Aw0, cálido subhúmedo, con precipitación media anual de 1094.1 mm y temperatura promedio de 27 °C (Comisión Nacional del Agua [CNA], 2009). Actualmente el uso del suelo en las áreas cercanas a los dos sitios de estudio se utiliza para ganadería caprino y agricultura (cultivo de maíz) a pequeña escala, siendo este último para autoconsumo de la población de Hobomó (com. pers. Carlos Mex May). En el sitio 1 la vegetación es intervenida para extraer algunas especies (Senegalia gaumeri, Thouinia paucidentata, Erythroxylum rotundifolium y Cordia alliodora) para leña y para construcción usan especies como Psidium sartorianum, Caesalpinia sp., Krugiodendron ferreum, entre otras) (com. pers. Carlos Mex May). En el sitio 2 la vegetación es utilizada para colocar apiarios y, afectada por extraer especies para leña (Piscidia piscipula, Thouinia paucidentata, Caesalpinia sp.), especies para construcciones menores (corrales de ganado caprino, cocinas y gallineros) y para hacer carbón utilizan principalmente árboles de ja´abin (Piscidia piscipula) (com. pers. Miguel Mex May). Ambos sitios están libres de ganado doméstico.
Procedimiento de muestreo, determinación de materiales y análisis de datos
Para la selección de los sitios de muestreo se evitaron áreas perturbadas (Parthasarathy, 1999) por el hombre (basadas en presencia/ausencia de tocones) o por causa natural. El muestreo de la vegetación se llevó a cabo en los meses de septiembre y octubre de 2010. En cada sitio de muestreo, en forma aleatoria, se delimitaron 10 parcelas de forma cuadrada de 10 m × 10 m (100 m2, total 1000 m2,Fig. 2), según la metodología propuesta por Gentry (1982) y discutida por Phillips y Miller (2002), que consiste en el levantamiento de la vegetación en unidades de 0.1 ha, metodología utilizada por otros autores (Thomas, 2009, Alvear, Betancur y Francisco-Rosselli, 2010). En cada parcela se consideraron todos los individuos leñosos con diámetros a la altura del pecho (DAP = 1.3 m) DAP ≥ 1 cm.
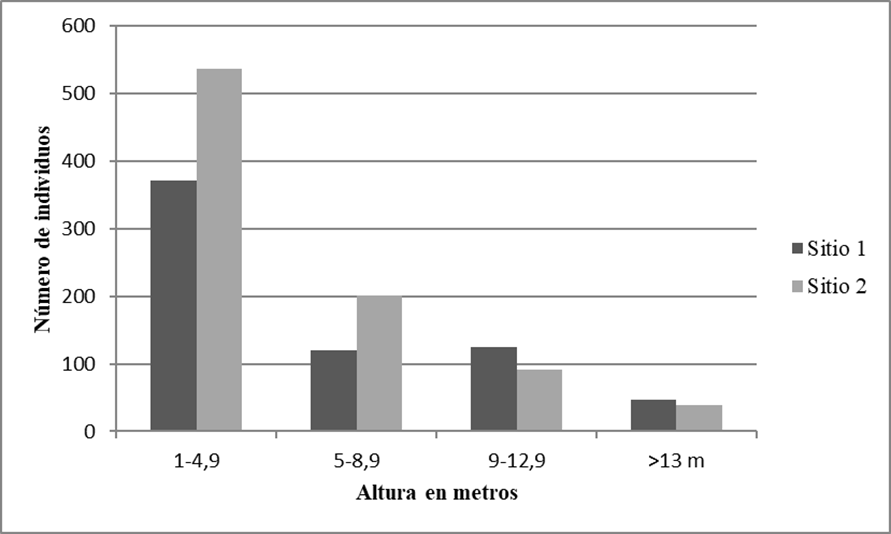
Figura 2 Distribución de las clases de altura de los individuos con DAP ≥ 1.0 cm de los 20 cuadros de selva mediana subcaducifolia en el ejido de Hobomó, Campeche, México.
La determinación de las especies se hizo in situ, cuando fue posible, o se recolectó material botánico para su determinación mediante comparación con ejemplares depositados en el herbario UCAM y literatura disponible (Standley y Steyermark, 1946, 1949; Ortiz, 1994; Pennington y Sarukhán, 2005; Borhidi, 2006). Los ejemplares fértiles fueron depositados en el herbario (UCAM) del Centro de Investigaciones Históricas y Sociales de la Universidad Autónoma de Campeche, Campeche, México. Posteriormente, otros juegos de ejemplares fueron enviados a herbarios con los que se tiene convenio. La clasificación taxonómica fue efectuada según lo propuesto por el Grupo para la Filogenia de las Angiospermas (APG 2009) y la actualización nomenclatural de las especies por Villaseñor (2016).
El análisis cuantitativo de la estructura de la vegetación leñosa para cada uno de los sitios se basó en el cálculo de la densidad, área basal y frecuencia. Donde la densidad es el número de individuos por área de muestreo, el área basal es la superficie de una sección transversal del tallo del individuo a determinada altura y la frecuencia se refiere a las unidades de muestreo en la cual ocurre una especie (McCune y Grace, 2002). La estructura vertical se analizó utilizando un histograma de frecuencias de alturas para todos los individuos censados. Las distintas clases de diámetro y altura fueron definidas considerando los valores de estos dos parámetros y el número total de individuos. Para obtener el valor de importancia por especie en cada sitio, se calcularon y sumaron la densidad relativa (número de individuos por especie/total de individuos de las especies × 100), la frecuencia relativa (número de unidades de muestra en el que se encontró una especie/el número total de unidades de muestra × 100) y dominancia relativa (área basal de cada especie/total del área basal de todas las especies × 100) (Mueller-Dombois y Ellenberg, 2002). La diversidad alfa se estimó usando el índice de Shannon-Wiener (H’) (Magurran, 1988).
Donde:
Pi = proporción de la muestra que pertenece a la especie i
La uniformidad o equidad se calculó con el índice de Pielou, el cual se obtiene al dividir el índice de Shannon entre el logaritmo natural del número de especies. Los cálculos se realizaron con el paquete PAST (Hammer, Harper y Ryan, 2001), versión 2.17.
Resultados
Composición florística
En los dos sitios estudiados, se registró un total de 1528 individuos pertenecientes a 79 especies, 67 géneros y 30 familias de plantas leñosas (Suplementos 1 y 2). Fabaceae fue la familia con mayor riqueza (13 especies), seguido de Rubiaceae (10), Ebenaceae, Malvaceae, Polygonaceae y Sapotaceae cada una con cuatro especies, que en conjunto representan 49.4% de la riqueza de especies registrada en ambos sitios. Las familias con mayor número de géneros fueron Fabaceae (11), Rubiaceae (siete) y Malvaceae (cuatro), aportando 32.8% del total de los géneros encontrados. Los géneros más ricos fueron Diospyros (cuatro), Coccoloba y Guettarda con tres cada una. Las especies más abundantes fueron Malpighia glabra con 114 individuos, Machaonia lindeniana (109), Coccoloba cozumelensis (84), Lonchocarpus xuul (78), Coccoloba barbadensis (62), Mosannona depressa y Guettarda combsii con 54 cada una, que representaron 36.3% del total de individuos encontrados en los sitios.
En cuanto al análisis de cada uno de los sitios, se tiene que en el sitio 1 se registró un total de 661 individuos de 63 especies, 54 géneros y 29 familias (Tabla 1). Las familias con mayor número de especies fueron: Fabaceae y Rubiaceae con nueve cada una y Polygonaceae con cuatro. Tres especies incluyeron 19.4% de los individuos: Malpighia glabra con 7.7% (51 individuos), Guetarda combsii con 6.5% (43) y Lonchocarpus xuul con 5.1% (34). En el sitio 2 se encontró un total de 867 individuos agrupados en 62 especies, 55 géneros y 27 familias (Tabla 1). Las familias más diversas fueron: Fabaceae con 12 especies, Rubiaceae (8), Ebenaceae y Polygonaceae con cuatro cada una. Tres especies incluyeron 24.1% de los individuos: Machaonia lindeniana con 9.5% (82 individuos), Coccoloba cozumelensis con 7.4% (64) y Malpighia glabra con 7.3% (63). El índice de Shannon mostró que la diversidad de especies del sitio 2 (H’ = 3.59) es muy similar a la diversidad del sitio 1 (H’ = 3.68), mientras que en términos de la uniformidad ambos sitios tienen valores semejantes (0.88 para el sitio 1 y 0.87 para el sitio 2).
Estructura de la vegetación
Se registraron 15 680 ind/ha en los dos sitios, 6610 ind/ha en el sitio 1 y 8670 ind/ha en el sitio 2. Para el sitio 1, Malpighia glabra fue la especie con mayor densidad (510 ind/ha), seguida de Guettarda combsii (430 ind/ha) y Lonchocarpus xuul (340 ind/ha), que juntas agrupan 19.4% del total de individuos encontrados. Para el sitio 2, Machaonia lindeniana fue la especie con mayor densidad (820 ind/ha), seguida de Coccoloba cozumelensis (640 ind/ha) y Malpighia glabra (630 ind/ha), representando 24.1% del total de individuos encontrados. Las diferencias en las densidades de las cinco especies entre los sitios, también se reflejan en los valores totales de área basal. El sitio 1 acumuló 34.13 m2/ha de área basal, mientras que el sitio 2 fue de 49.27 m2/ha (Tabla 1).
Con respecto a la estructura vertical por clases de altura, en el sitio 1, 56.1% de los individuos (371) se localizan en la primera clase (1 m - 4.9 m); mientras que, en el sitio 2, 61.8% de los individuos (536) están en esta misma clase (Fig. 3). En el sitio 1, las especies representativas que tuvieron mayor proporción de individuos en esta clase (1 - 4.9 m) de altura fueron Malpighia glabra (46 individuos), Guettarda gaumeri (25), Diospyros anisandra (19) y Mosannona depressa (18). Malpighia glabra fue una especie común en las primeras tres clases de altura. La última clase (> 13 m) la componen 10 especies y las mejor representadas por abundancia fueron Bursera simaruba, Lonchocarpus xuul, Platymiscium yucatanum y Vitex gaumeri. Las especies mejor representadas en el sitio 2 dentro de la clase de menor altura (1 m - 4.9 m) y en función de su abundancia fueron: Machaonia lindeniana (59 individuos), Malpighia glabra (59) y Coccoloba cozumelensis (51). Mientras que la clase de mayor altura (> 13 m) estuvo representada por ocho especies y las mejores representadas por sus abundancias fueron Lysiloma latisiliquum, Lonchocarpus xuul, Vitex gaumeri y Bursera simaruba.
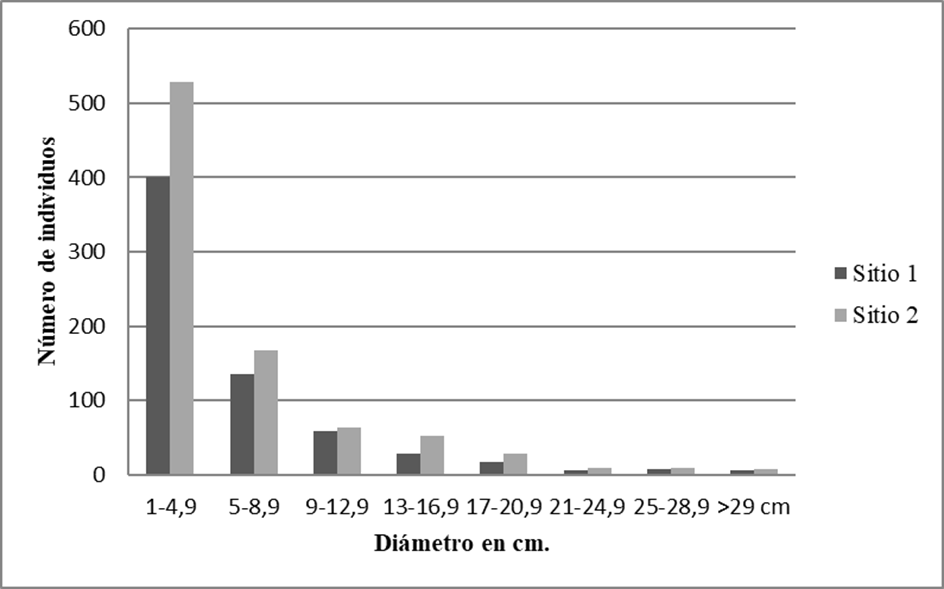
Figura 3 Distribución de las clases diamétricas de los individuos con DAP ≥ 1 cm de los 20 cuadros de selva mediana subcaducifolia en el ejido de Hobomo, Campeche, México.
La representación de la distribución general y por sitio de los individuos en las diferentes clases diamétricas revela una forma de J-invertida, con la mayor frecuencia de individuos en la clase de tamaño pequeño (Fig. 4). El sitio 1 aportó una densidad de 6610 ind/ha con diámetros de 1 cm- 4.9 cm (60.5%), siendo Malpighia glabra, Guettarda gaumeri, Diospyros anisandra, Guettarda combsii y Psidium sartorianum que aportaron una elevada cantidad de individuos (> 20) en esta clase, mientras que las especies que alcanzaron la última clase diamétrica (> 29 cm) fueron Bursera simaruba y Lysiloma latisiliquum. El sito 2 está caracterizado por una densidad de 5280 ind/ha que corresponden a los diámetros de 1 cm - 4.9 cm (60.9%), destacan Machaonia lindeniana, Malpighia glabra, Coccoloba cozumelensis, Mosannona depressa y Coccoloba barbadensis al aportar una elevada cantidad de individuos (> 20) en la primera clase diamétrica, mientras que las especies que alcanzaron la última clase diamétrica (> 29 cm) fueron Vitex gaumeri, Trichilia sp., Bursera simaruba, Coccoloba acapulcensis y Thouinia paucidentata.
En los suplementos 1 y 2 se señalan los componentes y el valor de importancia (VI) de las especies que conforman la estructura de la selva mediana subcaducifolia en los sitios analizados. De las 63 especies registradas en el sitio 1, Bursera simaruba, Lonchocarpus xuul, Guettarda combsii, Platymiscium yucatanum y Malpighia glabra sumaron 28.4% del VI (Suplemento 1). En el sitio 2, 31.3% del VI estuvo representado por Lysiloma latisiliquum, Bursera simaruba, Vitex gaumeri, Lonchocarpus xuul y Machaonia lindeniana de las 62 allí registradas (Suplemento 2). Bursera simaruba fue la más importante en el sitio 1 (Suplemento 1), su alto VI está dado por su área basal más que por su densidad y frecuencia colocándola en la primera posición, mientras que en el sitio 2 su VI fue bajo, esto indica que los individuos de Bursera simaruba en este sitio tienen diámetros menores que los individuos del sitio 1, lo que permite suponer que se trata de individuos con mayor edad en el sitio 1. Lysiloma latisiliquum fue la segunda especie en importancia estructural en el sitio 2 (Suplemento 2), su VI está dado por su área basal más que por su densidad y frecuencia relativa, mientras que en el sitio 1 sus parámetros estructurales son bajos reflejándose en su VI más bajo, ocupando la trigésima quinta posición (Suplemento 1).
Discusión
El resultado encontrado en este estudio acerca de la composición florística en ambos sitios estuvo representada por especies de las familias Fabaceae y Rubiaceae, lo cual coincide a los citados por varios autores en selvas medianas subcaducifolias de otros sitios. Por ejemplo, varios autores han registrados que las familias mejor representadas por el número de especies son Fabaceae y Rubiaceae; resultado similar en este estudio (Zamora-Crescencio, García-Gil, Flores-Guido y Ortiz, 2008; Gutiérrez-Báez et al., 2012a; Gutiérrez-Báez et al., 2012b, Escobar, 2013; Echeverría et al., 2014; Dzib-Castillo et al., 2014; García-Licona et al., 2014). El hecho de que la familia Fabaceae sea la mejor representada se debe a que es la más diversa y más ampliamente distribuida en todas las comunidades vegetales presentes en la península de Yucatán (Flores, 2001) y en todo el territorio nacional (Sousa y Delgado, 1998) y mundial (Gentry, 1988, 1992).
En términos de la flora leñosa, comparado con estudios similares (Gutiérrez-Báez et al. 2012; Gutiérrez-Báez, Zamora-Crescencio y Hernández-Mundo, 2014; Zamora-Crescencio et al., 2008) la riqueza específica de plantas encontradas en este estudio fue mayor. Estas diferencias podrían explicarse a que en este estudio se incluyeron las plantas con DAP ≥ 1 cm. En otros trabajos, Zamora-Crescencio, Gutiérrez-Báez, Villegas, Domínguez-Carrasco y Barrientos-Medina (2016); Gutiérrez-Báez et al. (2017), que incluyeron esta misma medida de diámetro, los valores también fueron bajos, lo que puede estar relacionado con la alteración antropogénica de la vegetación en el pasado (Marcelo-Peña, Reynel-Rodríguez, Zevallos-Pollito, Bulnes-Soriana y Pérez-Ojeda del Arco, 2007). Esto muestra que, a pesar de las modificaciones de la selva mediana subcaducifolia en estos sitios sostienen una gran riqueza de especies, por lo que es importante resaltar que estas comunidades vegetales deben manejarse con cautela para no agotar el recurso vegetal local, ya que ofrecen una gran variedad de bienes como leña para cocinar y madera para construir casas y de servicios ambientales como captura de carbono y estabilidad del suelo.
Con relación al índice de diversidad, se observa que no hubo variación en los dos sitios (sitio 1 H’ 3.68, 63 spp. y sitio 2 H’ 3.59, 62 spp.), lo que indica que ambos son similares por su riqueza de especies, al igual que por su uniformidad o equidad (0.88, 0.87). Sin embargo, comparado con otros estudios de la región con el mismo tipo de vegetación [(Gutiérrez-Báez et al. (2014) (H’ 4.3, 49 spp.), Gutiérrez-Báez et al. (2012) (H’ 4.5, 54 spp.)], la diversidad registrada en este estudio es notablemente baja. Estos valores nos indican que están mayormente relacionados con la distribución de abundancias de las especies más que a su riqueza específica, y no por las condiciones ambientales (Granados-Victorino, Sánchez-González, Martínez-Cabrera y Octavio-Aguilar, 2017).
La presencia de Machaonia lindeniana, Malpighia glabra, Coccoloba cozumelensis, Guettarda combsii con altas densidades en este estudio también fueron mencionadas por Gutiérrez-Báez et al. (2012a; 2014), sin alcanzar valores importantes para ser consideradas como elementos sobresalientes de la selva mediana subcaducifolia. Así mismo, se registraron para la región de Calakmul a Malpighia glabra, Machaonia lindeniana y Coccoloba cozumelensis, las cuales no destacan por tener bajas densidades y tamaños de diámetros pequeños (Zamora-Crescencio et al., 2012, García-Licona et al., 2014). Mientras especies como Coccoloba cozumelensis y Guettarda combsii con altas densidades también fueron registradas para selvas de los Ejidos de Bethania, Campeche, el Carmen II, Calakmul y Pachuitz, Hopelchen (Zamora-Crescencio et al., 2016, 2018; García-Licona et al., 2014 y Echeverría et al., 2014).
El resultado del análisis de las áreas basales agrupadas en clases diamétricas para ambos sitios refleja que las comunidades vegetales están en pleno crecimiento. Se observa que la estructura por la magnitud de diámetros corresponde a una curva en forma de una J- invertida (Fig. 4), lo que indica que el mayor número de individuos se encuentran en las clases menores. Este patrón de distribución es un ejemplo de una comunidad vegetal en crecimiento (Macario, Torres y Cabrera, 1998), además garantiza la supervivencia de las comunidades vegetales, ya que aquellos árboles eliminados ocasionalmente, serán sustituidos por los individuos en las clases de diámetros menores mediante regeneración natural (León, Vélez y Yepes, 2009; Zamora-Crescencio et al., 2012).
Al realizar la comparación del valor de importancia relativa (VIR) de los dos sitios, se observó que solo Bursera simaruba y Lonchocarpus xuul se encuentran en ambos sitios entre las primeras cinco especies más importantes: Lochocarpus xuul, Guettarda combsii, Platymiscium yucatanum y Malpighia glabra en el sitio 1 y Bursera simaruba, Vitex gaumeri, Lonchocarpus xuul y Machaonia lindeniana en el sitio 2. Para el sitio 1, la especie con mayor VIR fue Bursera simaruba registrando 28.97% y para el sitio 2 Lysiloma latisiliquum con 24.83%. Estas especies con altos valores (más de 12%) de VIR se consideran más importantes ecológicamente que aquellas con valores bajos (Zegeye et al., 2011), debido a sus altos valores de densidad, frecuencia y dominancia.
Conclusiones
En general, para ambos sitios se registraron 79 especies (9.3% de la flora vascular estimada para el municipio de Campeche), 67 géneros y 30 familias y a nivel de sitios son similares (sitios 1 63 spp. y 62 spp. en el sitio 2). Las familias más importantes presentes en la selva mediana subcaducifolia por el número de especies en ambos sitios son Fabaceae, Rubiaceae y Polygonaceae. La vegetación del sitio 1 se encuentra conformada por Malpighia glabra, Guettarda combsii y Lonchocarpus xuul que fueron las más abundantes; en el sitio 2 por Machaonia lindeniana, Coccoloba cozumelensis y Malpighia glabra. La especie con mayor valor de importancia ecológica del sitio 1 fue Bursera simaruba y para el sitio 2 lo fue Lysiloma latisiliquum. Finalmente, se puede decir que la escasez o abundancia de las especies, está relacionada con la actividad humana (extracción de madera), la cual afecta la estructura y composición florística.











 nueva página del texto (beta)
nueva página del texto (beta)



