Introducción
La franja costera de las regiones tropicales está dominada frecuentemente por los manglares, uno de los ecosistemas biológicamente más importantes por su alta productividad primaria y secundaria (Barbier, 2016; Kuenzer, Bluemel, Gebhardt, Quoc y Dech, 2011). Su estructura forestal brinda bienes y servicios ecosistémicos como la captura de carbono, estabilización de la línea de costa y protección de las comunidades costeras contra la marea y oleaje generados por tormentas (Gedan, Kirwan, Wolanski, Barbier y Silliman, 2011); además, es hábitat de aves que anidan, se alimentan y se resguardan en ellos (Buelow y Sheaves, 2015).
La estructura forestal de los manglares se caracteriza por atributos como la riqueza de especies, la altura, el área basal; así como el desarrollo del sotobosque (Lugo y Snedaker, 1974; Tomlinson, 1986). En la Laguna de Términos se encuentran las especies Rhizophora mangle, Avicennia germinans y Laguncularia racemosa; encontrándose manglares tipo cuenca, tipo franja y tipo ribereño. Los manglares de la Isla del Carmen, ubicada dentro de la Laguna de Términos, se han caracterizado por presentar altura del dosel entre 5 m y 12.5 m, el área basal entre 8.6 m2 ha-1 y 9.9 m2 ha-1 y la densidad de árboles entre 1670 y 3095 árboles por hectárea (Coronado-Molina et al., 2012). Los procesos ecológicos determinantes de la estructura y función de los manglares están condicionados principalmente por el hidroperíodo (la frecuencia, el nivel y la duración de las inundaciones), por la disponibilidad de nutrientes en el suelo (Twilley y Rivera-Monroy, 2005) y por las variaciones de salinidad, temperatura, potencial de óxido reducción y concentración de sulfuro, que actúan como reguladores del crecimiento de este tipo de vegetación (Lewis et al., 2015).
La alteración del hidroperíodo por la pérdida de la conectividad hidrológica entre un cuerpo de agua y una zona de manglar ocasiona el incremento en la salinidad del suelo y la temperatura del agua, afectando la estructura forestal del ecosistema al disminuir el vigor y la densidad de las especies del manglar (Lewis et al., 2015), lo que conlleva a una marcada reducción en las concentraciones de oxígeno, un aumento de la concentración de sulfuros y alteraciones en los ciclos de los nutrientes (McKee, Mendelssohn y Hester, 1988; Vovides, Bashan, López-Portillo y Guevara, 2011). Lo anterior resulta en la rápida degradación de la vegetación y pérdida de las funciones del ecosistema.
Dentro de las estrategias de manejo de los manglares, la restauración ecológica es un componente clave para la sostenibilidad a largo plazo, especialmente cuando están altamente degradados o amenazados (Aronson y Alexander, 2013). Específicamente la restauración hidrológica, mediante el desazolve de los canales de marea, permite el flujo de agua hacia zonas degradadas y el acarreo de propágulos desde fuentes de germoplasma (Hastuti, Anggoro y Pribadi, 2012; Vogt et al., 2014). La restauración hidrológica modifica el hidroperíodo y ha demostrado ser el método más eficiente para mejorar la calidad del suelo en zonas de manglar en México (Pérez-Ceballos, Echeverria-Avila, Zaldívar-Jiménez, Zaldívar-Jiménez y Herrera-Silveira, 2017; Zaldívar-Jiménez, Guevara, Pérez-Ceballos, Díaz y Rosado, 2017), brindando condiciones biogeoquímicas favorables para facilitar los procesos de reclutamiento de propágulos provenientes de la vegetación adyacente con escaso o nulo disturbio (Duke, 2001; Sousa, Quek y Mitchell, 2003). En otros países la restauración hidrológica también ha sido un método exitoso, por ejemplo en Florida, EE.UU. (Turner y Lewis III, 1997), Colombia (Jaramillo et al., 2018) e Indonesia (Brown, Fadillah, Nurdin, Soulsby y Ahmad, 2014).
La evolución y el éxito de las actividades de restauración hidrológica aplicadas a zonas degradadas, pueden evaluarse a través del monitoreo de características como la estructura de la vegetación y del suelo (Salmo, Lovelock y Duke, 2013). Estos indicadores deben ser evaluados en diferentes niveles temporales de la restauración (Zhao et al., 2016).
Objetivos
Los objetivos de la presente investigación fueron:
1. Evaluar la influencia de la restauración hidrológica sobre la regeneración natural de manglares en restauración.
2. Analizar la dispersión, reclutamiento y crecimiento de la regeneración de manglar en las zonas de restauración.
3. Identificar la relación de factores ambientales sobre la regeneración natural del manglar en diferentes etapas de la restauración hidrológica.
Materiales y métodos
Área de estudio
El área de estudio se localiza en Isla del Carmen, Campeche; al sur del Golfo de México, dentro del área natural protegida Laguna de Términos 18° 40' 18.37" N, 91° 40' 24.93" O (Fig. 1). La Laguna de Términos es considerada como el sistema lagunar estuarino de mayor volumen y extensión en México con 20 114.10 ha (Comisión Nacional para el Conocimiento y Uso de la Biodiversidad [Conabio], 2007), además de ser un área de protección de flora y fauna (Secretaría de Desarrollo Social [Sedesol], 1994) y sitio Ramsar como humedal de importancia internacional (Venegas, 2003).
Dentro del sistema lagunar de Términos se localiza la Isla del Carmen que es un isla de barrera constituida principalmente por carbonatos de calcio (Bach et al., 2005), con un sistema deltaico, bordeada principalmente por vegetación de manglar y pequeñas lagunas asociadas. La distribución y condición de los manglares de la Isla del Carmen están determinados por las mareas (Coronado-Molina et al., 2012), donde la amplitud vertical del intervalo de marea registrado fue de 0.34 m (Contreras, Douillet y Zavala-Hidalgo, 2014). El clima es tropical húmedo y se presentan tres estaciones climáticas: la estación seca de febrero a abril, la estación de lluvias de junio a septiembre y la temporada de frentes fríos de octubre a marzo (Guerra y Kahl, 2017).
El área de estudio fue una zona de manglar con pérdida de conectividad hidrológica debido al bloqueo por árboles derribados sobre los canales de marea durante el paso de los huracanes Opal y Roxana en el año 1995. Principalmente en el año 2010, se realizó la restauración hidrológica, mediante el desazolve de 7826 m lineales de canales de marea y la modificación de la topografía, con el propósito de restaurar 160 ha de manglares (Zaldívar-Jiménez et al., 2017). Las acciones de restauración hidrológica y mantenimiento han sido realizadas por la comunidad de Isla Aguada (Carmen, Campeche) y se han continuado hasta el año 2017.
Diseño del muestreo
Se establecieron cuatro sitios de muestreo: tres localizados dentro de la zona de restauración hidrológica y uno como sitio de referencia (control) en un manglar natural de una zona adyacente al área degradada. Los tres sitios ubicados en la zona de restauración se categorizaron en función de las acciones de la restauración que fueron aplicadas: sitio 1 (dos años después), sitio 2 (tres años), sitio 3 (cuatro años) y el sitio 4 fue establecido como referencia. La evaluación de la estructura forestal para los sitios en restauración se realizó en las zonas adyacentes. Para la evaluación de la regeneración natural dentro de las zonas en restauración, tomando como criterio la variación de los niveles de inundación, se llevaron a cabo tres muestreos durante un año del 2014 al 2015. El primer muestreo se realizó en el mes de mayo (mínimas inundaciones), el segundo en octubre (máximas inundaciones) y el tercero en febrero (inundación intermedia). Además, se evaluaron las características ambientales de cada sitio donde se midieron los fisicoquímicos, los nutrientes inorgánicos del agua del suelo y la densidad aparente del suelo.
Características biológicas
Estructura forestal de la zona adyacente. En cada sitio se establecieron dos unidades de muestreo de 10 m × 10 m, en las que se midió el diámetro a la altura del pecho (dap; cm) y la altura (m) de todos los árboles con diámetros mayores a 2.5 cm. Se calculó el área basal (m2 ha-1), la densidad (árbol ha-1) y el índice de valor de importancia (VI) de cada especie forestal presente (Curtis y McIntosh, 1951).
Regeneración natural en las zonas de restauración. Para estimar el reclutamiento se establecieron dos subunidades permanentes de muestreo de 1 m2, dentro de las cuales se registraron todas las plántulas presentes, a estas se les colocó una placa de identificación individual para dar seguimiento a los cambios en altura (cm) y calcular la tasa relativa de crecimiento en altura (TRCA, cm día-1) con la fórmula: TRCA = (H2 - H1) / n, donde: n = número de días entre mediciones, H1 = altura de la planta en el tiempo 1, H2 = altura de la planta en el tiempo 2 (Rodríguez, Nivia y Garzón, 2004). También la sobrevivencia (%) se calculó con las plántulas marcadas, por diferencia del número de plántulas vivas en el T2 menos las registradas en el T1. La densidad de las plántulas se calculó sobre una parcela de 25 m2 para disminuir el error de sobre estimación y posteriormente se convirtió a densidad por cada 0.01 ha, para fines comparativos.
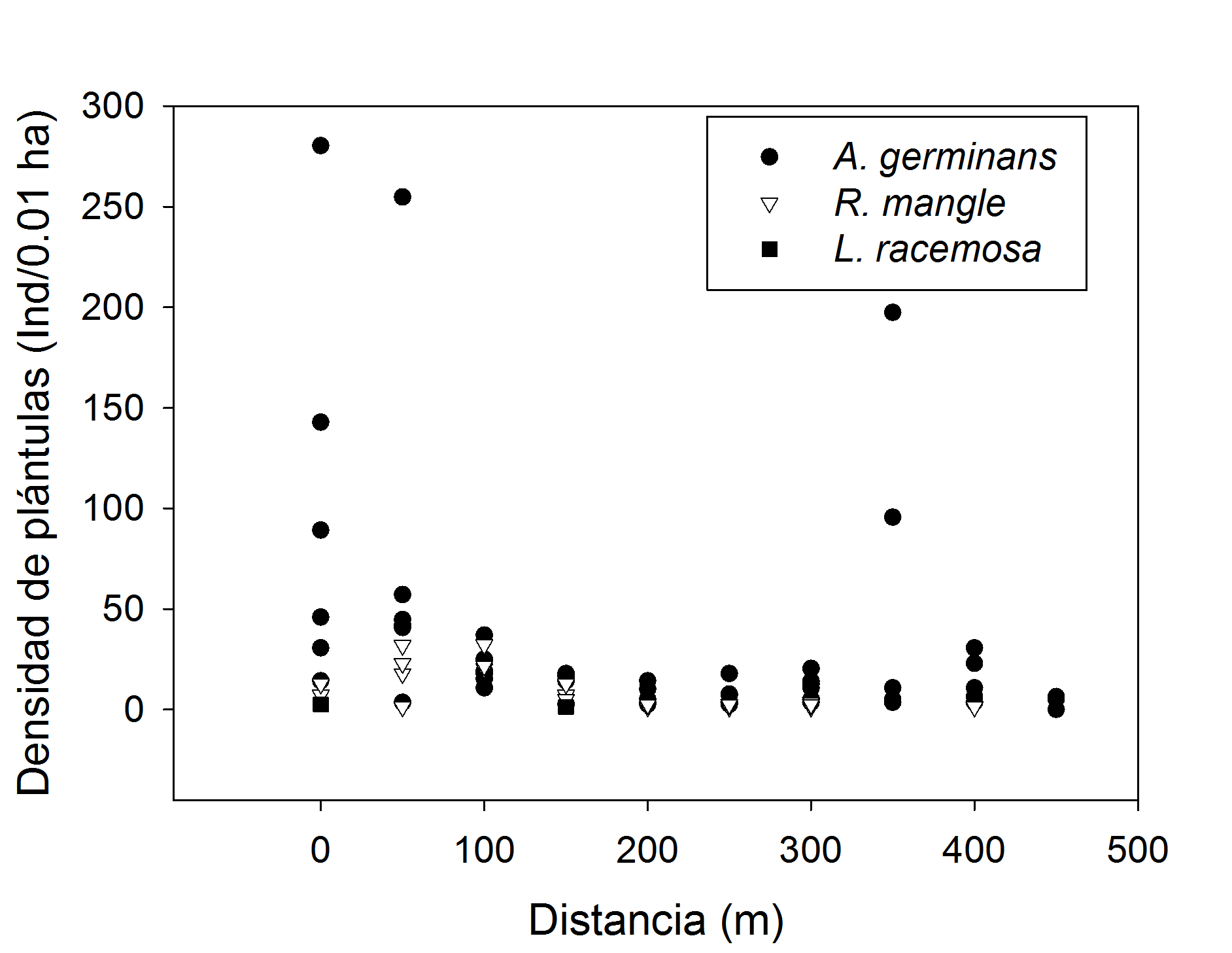
Dispersión y reclutamiento de plántulas en la zona de restauración. Para determinar si las zonas adyacentes (sin disturbio) a la zona degradada eran importantes para la regeneración natural, se realizaron tres muestreos en los años de 2014 al 2016 sobre dos transectos de 450 m cada uno, desde las zonas de manglares naturales hacia los sitios en restauración. En cada transecto se establecieron estaciones separadas a una distancia de 50 m entre ellas, se estimó la densidad de plántulas de cada especie como una medida de la dispersión de los propágulos producida por la fuerza hidrológica.
Características ambientales
Para determinar la densidad aparente del suelo, se extrajeron dos muestras de suelo en cada sitio con un nucleador de acero inoxidable de 10 cm de diámetro y 30 cm de alto. La determinación se realizó a tres diferentes profundidades (0 cm - 10 cm, 10 cm - 20 cm y 20 cm - 30 cm), analizándose mediante la técnica descrita por Chen y Twilley (1999).
Para las muestras del agua intersticial, se extrajo agua del suelo a una profundidad de 30 cm usando jeringas y tubos acrílicos. Se midió in situ la salinidad y la temperatura del agua del suelo, se colocaron tres muestras de agua colectadas en cada sitio, utilizando una sonda multiparamétrica (YSI modelo-30). El Eh se midió utilizando un electrodo HI9126 (HANNA) que fue corregido añadiendo + 222 (Bohn, 1971). La determinación de las concentraciones de los iones se realizó in situ, por lo que no se requirió fijar la muestra. La determinación de los nitritos se hizo con el método del clorante azoico, los nitratos se determinaron por el método de reducción de cadmio, para el amonio se empleó el método de nesslerización directa, los fosfatos se determinaron mediante el método de cloruro de estaño y los sulfuros utilizando el método azul de metileno (American Public Health Association [APHA], 2005). Estas determinaciones se realizaron utilizando un kit de prueba para cada ion y un V-2000 multi-analyte photometer (CHEMetrics, Inc., Calverton, VA, USA).
La determinación del hidroperíodo se realizó en cada sitio, instalando un medidor de presión (HOBO, Onset Corporation) que midió cada hora de manera continua durante un año, de marzo de 2014 a febrero de 2015.
Análisis estadísticos
La variación de los datos medidos entre sitios y tiempo de muestreos no cumplió con el supuesto de normalidad, por lo que se analizaron a través una prueba de Kruskal Wallis. Se aplicó una prueba a posteriori de Tukey y Kramer (Nemenyi). La asociación entre las variables biológicas de las plántulas (densidad, altura, tasa de crecimiento y sobrevivencia) con las ambientales (salinidad, temperatura, Eh, pH, NO3 - + NO2 -, PO4 -3, NH4 + y S-2) se analizó mediante regresiones lineales simples. Estos análisis se llevaron a cabo utilizando R 2.11.1 (R Development Core Team, 2008).
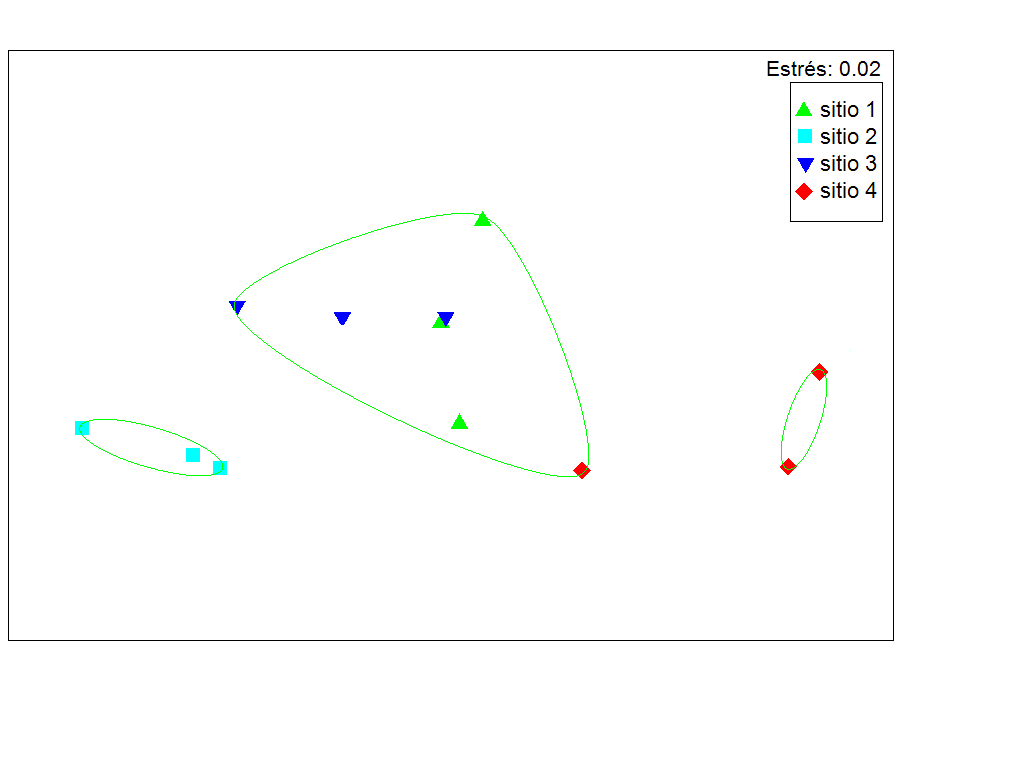
Las semejanzas entre los sitios se analizaron mediante el escalado multidimensional no métrico (NMDS), con el fin de identificar grupos que compartieran características, además de los cambios y tendencias que presentaron con respecto a las etapas de restauración. El NMDS mide la distancia entre objetos; la interpretación del gráfico depende de qué tan bajo es el valor del estrés. Los objetos unidos por los tramos más cortos son los más cercanos y los separados por lapsos más largos son más lejanos (Clarke y Ainsworth, 1993; Quinn y Keough, 2002). Para este análisis se utilizó una matriz de datos biológicos transformados (LogV + 1) y normalizados. Este análisis se llevó a cabo mediante el programa estadístico Primer v6.
La dispersión y reclutamiento de las plántulas en la zona de restauración se analizó utilizando un modelo lineal mixto tomando como variable de respuesta la densidad de plántulas. La densidad de las especies fue usada como efectos fijos y la distancia y el año como efectos aleatorios. Este análisis se llevó a cabo utilizando R 2.11.1 (R Development Core Team, 2008).
Resultados
Características biológicas
El desarrollo de la vegetación que bordea la Laguna de Términos tiene como especie dominante Avicennia germinans. El sitio 1, con dos años en restauración, registró las especies: Avicennia germinans, Rhizophora mangle y Laguncularia racemosa con densidad de 3800 individuos por hectárea (ind ha-1) en total. El sitio 2 registró menor densidad con 1450 ind ha-1 y menor dap con valor de 1.86 cm. La mayor altura se registró en el sitio 4 con 6.86 m (Tabla 1).
Tabla 1. Estructura forestal de los árboles adultos en las zonas adyacentes a los sitios de restauración (sitios de 1 al 3) y el manglar de referencia (sitio 4).
| Sitio y tipo de manglar | Especie | Altura (m) | Densidad (ind ha-1) | Área basal (m2 ha-1) | Diámetro a la altura del pecho (cm) | Valor de importancia |
|---|---|---|---|---|---|---|
| Sitio 1: franja | Avicennia germinans | 5.61 | 950 | 2.64 | 3.64 | 26.03 |
| Laguncularia racemosa | 4.49 | 850 | 1.80 | 4.23 | 20.71 | |
| Rhizophora mangle | 4.91 | 2000 | 4.59 | 3.57 | 53.27 | |
| Total | 5.00 | 3800 | 9.94 | 3.73 | 100 | |
| Sitio 2: Cuenca | Avicennia germinans | 4.26 | 1450 | 13.01 | 1.86 | 100 |
| Sitio 3: Cuenca | Avicennia germinans | 3.21 | 3750 | 2.22 | 6.17 | 100 |
| Sitio 4: Cuenca | Avicennia germinans | 6.86 | 3400 | 16.85 | 5.58 | 100 |
Se encontraron diferencias significativas en la densidad de plántulas entre sitios (Kruskal-Wallis χ2 = 19.647, g.l. = 3, p < 0.001). El sitio 4 presentó una mayor densidad promedio respecto a los sitios 2 y 3 (prueba de Nemenyi, p = 0.001). Respecto a la altura, los sitios difirieron significativamente (Kruskal-Wallis χ2 = 9.280 g.l. = 3, p = 0.02), específicamente entre los sitios 3 y 4 (prueba de Nemenyi, p = 0.017). La tasa de crecimiento presentó diferencia significativa (Kruskal-Wallis χ2 = 3.182 g.l. = 3, p = 0.036). El porcentaje de sobrevivencia no tuvo diferencias entre sitios (Kruskal-Wallis χ2 = 1.745, g.l. = 3, p = 0.062). En el sitio 1 se registraron 148 plántulas en 0.01 ha, de las cuales A. germinans registró 109, R. mangle 32 y L. racemosa presentó menor densidad con 7 plántulas. En este sitio también se presentó más crecimiento, registrándose alturas de 64.22 cm y presentando mayores valores de TRCA con 0.15 cm día-1. El sitio 2 presentó menor densidad con 26 plántulas en 0.01 ha de A. germinans; mientras que el sitio 3 presentó una densidad de 79 plántulas, de las cuales 78 correspondieron a A. germinans y solamente un individuo correspondió a R. mangle; en este sitio se observó el mayor porcentaje de sobrevivencia con 88%. El sitio 4 presentó la mayor densidad con 783 plántulas en 0.01 ha, de las cuales 25 eran de R. mangle y el resto de A. germinans; sin embargo, fue el sitio con menor altura con 32.59 cm (Tabla 2).
Tabla 2. Características biológicas de la regeneración natural de los sitios en restauración (sitios 1, 2 y 3) y el sitio de referencia (sitio 4) en el estero de Laguna de Términos.
| Variables | Sitio 1 | Sitio 2 | Sitio 3 | Sitio 4 | Valor de P |
|---|---|---|---|---|---|
| Densidad (individuos en 0.01 ha) | 148 ± 22.80 | 26 ± 4.93 | 79 ± 19.12 | 783 ± 197.24 | <0.001 |
| Altura (cm) | 64.22 ± 23.99 | 39.04 ± 3.97 | 55.36 ± 3.36 | 32.59 ± 1.91 | 0.002 |
| TRCA (cm dia-1) | 0.15 ± 0.01 | 0.03 ± 0.01 | 0.03 ± 0.01 | 0.05 ± 0.01 | 0.036 |
| Sobrevivencia (%) | 80.91 ± 8.48 | 80.56 ± 9.04 | 87.84 ± 4.59 | 69.28 ± 10.88 | 0.062 |
Los valores indican la media ± error estándar. La última columna representa diferencias significativas a nivel (p ≤ 0.05). Los valores de Kruskal-Wallis corresponde el análisis entre sitios. TRCA: tasa relativa de crecimiento en altura.
En los transectos se observó que existió mayor densidad de plántulas de A. germinans en los primeros 100 m de distancia con respecto al manglar natural. La especie R. mangle presentó una densidad menor a 50 plántulas en 0.01 ha en los primeros 150 m y después de esta distancia disminuyó su densidad (t = -2.40, p > 0.038, df = 9.38). La especie L. racemosa registró la menor densidad y se encontró únicamente en los primeros 50 m del transecto (t = -2.62, p > 0.026, df = 9.34). El modelo lineal mixto sugirió que la distancia a la cual se establecieron las plántulas tuvo un efecto negativo sobre la densidad (t = 5.279, p < 0.001), estimando que L. racemosa y R. mangle disminuyeron su densidad respecto a la distancia en un intervalo entre 26 y 29 plántulas en 0.01 ha por cada 50 m de distancia respecto al manglar natural (Fig. 2). El factor año tuvo un efecto positivo respecto al incremento en la densidad plántulas de manglar, este efecto fue pequeño y estadísticamente marginal (t = 1.81, p = 0.07). Por otro lado, se observó que a la distancia de 350 m se incrementó la densidad de A. germinans de 95 a 197 plántulas en 0.01 ha, debido a su cercanía con parches de manglar remanentes en el área de restauración.
Características ambientales
Se observó un patrón inverso de la densidad aparente del suelo con respecto al tiempo de restauración (Tabla 3). La salinidad no mostró diferencias significativas entre sitios, pero sí en los tiempos del muestreo (Kruskal-Wallis χ2 = 7.274, g.l. = 2, p < 0.026), durante la temporada de mínimas inundaciones (0.07 m) se registraron 62.57 ups en el sitio 4 (prueba de Nemenyi, p = 0.045). Los valores medios de salinidad para el agua intersticial en los sitios 1 a 3 (47.53 ups a 51.51 ups, respectivamente) fueron inferiores a los registrados en el sitio 4 (55.21 ups). La temperatura no presentó diferencias entre sitios y tiempo de muestreo. El sitio 2 presentó la temperatura más elevada con 30.77 °C. Los valores de Eh no presentaron diferencias entre sitios, ni entre tiempos. Los sitios 1 al 3, presentaron los valores de Eh negativos (máximo = -61.20 mV), mientras que el sitio 4 registró solamente valores positivos (Tabla 3). El pH registró diferencias entre sitios y entre el tiempo del muestreo (Kruskal-Wallis χ2 = 15.172, g.l. = 2, p < 0.001); la prueba de Tukey y Kramer (prueba de Nemenyi, p = 0.05) identificó el mayor pH en la temporada de inundaciones intermedias, con 6.44 para el sitio 3. Se observaron diferencias entre sitios y en tiempo (p < 0.05) para las variables de PO4 -3 (fostatos) y S-2 (sulfuro) (prueba de Nemenyi, p = 0.045), pero para las concentraciones de NO2 -(nitritos) + NO3 - (nitratos) y NH4 + (amonio) no se presentaron diferencias entre sitios ni entre tiempos.
Tabla 3. Características ambientales del suelo y el agua intersticial en Bahamitas, Laguna de Términos durante el período del estudio.
| Variables | Sitio 1 | Sitio 2 | Sitio 3 | Sitio 4 | Kruskal-Wallis test | Valor de P |
|---|---|---|---|---|---|---|
| Densidad aparente (g cm-3) | 0.62 ± 0.10 | 0.30 ± 0.05 | 0.27 ± 0.04 | 0.23 ± 0.02 | 11.02 | 0.012 |
| Salinidad (ups) | 47.53 ± 7.04 | 51.51 ± 8.41 | 48.08 ± 2.11 | 55.21 ± 4.12 | 3.11 | 0.374 |
| Temperatura (°C) | 28.84 ± 1.10 | 30.77 ± 1.13 | 27.97 ± 0.55 | 29.05 ± 1.03 | 6.62 | 0.085 |
| Eh (mV) | -36.26 ± 25.64 | -15.14 ± 42.72 | -83.64 ± 22.90 | 18.11 ± 35.9 | 8.71 | 0.033 |
| pH | 6.27 ± 0.53 | 6.23 ± 0.45 | 6.44 ± 0.44 | 6.12 ± 0.13 | 2.74 | 0.433 |
| S-2 (mg l-1) | 7.68 ± 3.31 | 8.54 ± 5.55 | 24.78 ± 14.63 | 16.31 ± 5.21 | 10.79 | 0.012 |
| NO2 - + NO3 - (mg l-1) | 1.30 ± 0.57 | 1.37 ± 0.32 | 2.54 ± 0.43 | 1.56 ± 0.54 | 0.87 | 0.831 |
| NH4 + (mg l-1) | 82.77 ± 19.78 | 64.85 ± 19.26 | 101.80 ± 36.54 | 58.14 ± 8.6 | 0.71 | 0.869 |
| PO4 -3 (mg l-1) | 5.43 ± 2.84 | 2.72 ± 1.11 | 3.86 ± 1.28 | 2.48 ± 0.06 | 13.067 | 0.004 |
Los valores son la media ± error estándar. Concentración de amonio (NH4 +); concentración de fosfatos (PO4 -3); concentración de nitratos más nitritos (NO2 -+ NO3 -); concentración de sulfuro (S-2). Los valores de Kruskal-Wallis corresponde el análisis entre sitios.
Con respecto a las variables del hidroperíodo, los sitios presentaron diferencias entre sitios respecto a la frecuencia de inundación (Kruskal Wallis χ2 = 28.81, g.l = 3, p < 0.001), también se observaron diferencias en el tiempo de inundación (Kruskal Wallis χ2 = 22.63, g.l = 3, p < 0.001) y en el nivel de inundación (Kruskal Wallis χ2 = 20.53, g.l = 3, p = 0.001). Los sitios 3 y 4, así como los sitios 1 y 2, presentaron patrones del hidroperíodo similares entre ellos. Las mayores frecuencias de inundación fueron en los sitios 3 y 4 (23 y 24 inundaciones al mes respectivamente) durante el mes de septiembre. Los sitios 1 y 2 permanecieron inundados más de 600 h al mes, el sitio 1 presentó este comportamiento todos los meses del año y el sitio 2 lo presentó de junio 2014 a enero 2015. Los mayores niveles de inundación se registraron de septiembre 2014 a enero 2015 para todos los sitios, los sitios 1 y 2 fueron los que presentaron los mayores niveles con 0.16 m y 0.25 m, respectivamente. Los sitios 3 y 4 presentaron niveles de inundación entre 0.084 m y 0.086 m en promedio, respectivamente (Tabla 4).
Tabla 4. Hidroperíodo de los sitios de manglar de Bahamitas en Laguna de Términos en el período de estudio.
| Variables | Sitio 1 | Sitio 2 | Sitio 3 | Sitio 4 | Kruskal-Wallis test | Valor de P |
|---|---|---|---|---|---|---|
| Frecuencia (# mareas mes-1) | 2.58 ± 0.75 | 3.66 ± 1.36 | 13.25 ± 1.66 | 12.41 ± 1.53 | 28.81 | < 0.001 |
| Periodo (h mes-1) | 695.11 ± 14.81 | 631.36 ± 44.88 | 339 ± 78.27 | 334.20 ± 66.00 | 22.63 | < 0.001 |
| Nivel de inundación (m) | 0.16 ± 0.01 | 0.25 ± 0.03 | 0.084 ± 0.01 | 0.086 ± 0.01 | 20.53 | < 0.001 |
Las diferencias entre sitios fueron probadas con la significancia de Kruskal-Wallis (p < 0.05). Los valores son la media ± error estándar. Los valores de Kruskal-Wallis corresponde el análisis entre sitios.
Proceso de la regeneración natural y su relación con las variables ambientales
La densidad de plántulas mostró una relación negativa con la concentración de NH4 + en el suelo (r2 = 0.86, p < 0.05, Fig. 3A). También se observó una tendencia negativa de la densidad de plántulas en función de la concentración de S-2 (Fig. 3B). Por otro lado, la sobrevivencia de las plántulas fue mayor en sitios con concentraciones más altas de PO4 -3 (r2 = 0.98, p < 0.05, Fig. 2C). En forma similar, la temperatura del agua intersticial y la sobrevivencia de las plántulas mostraron una relación positiva (r2 = 0.98, p < 0.05, Fig. 3D).
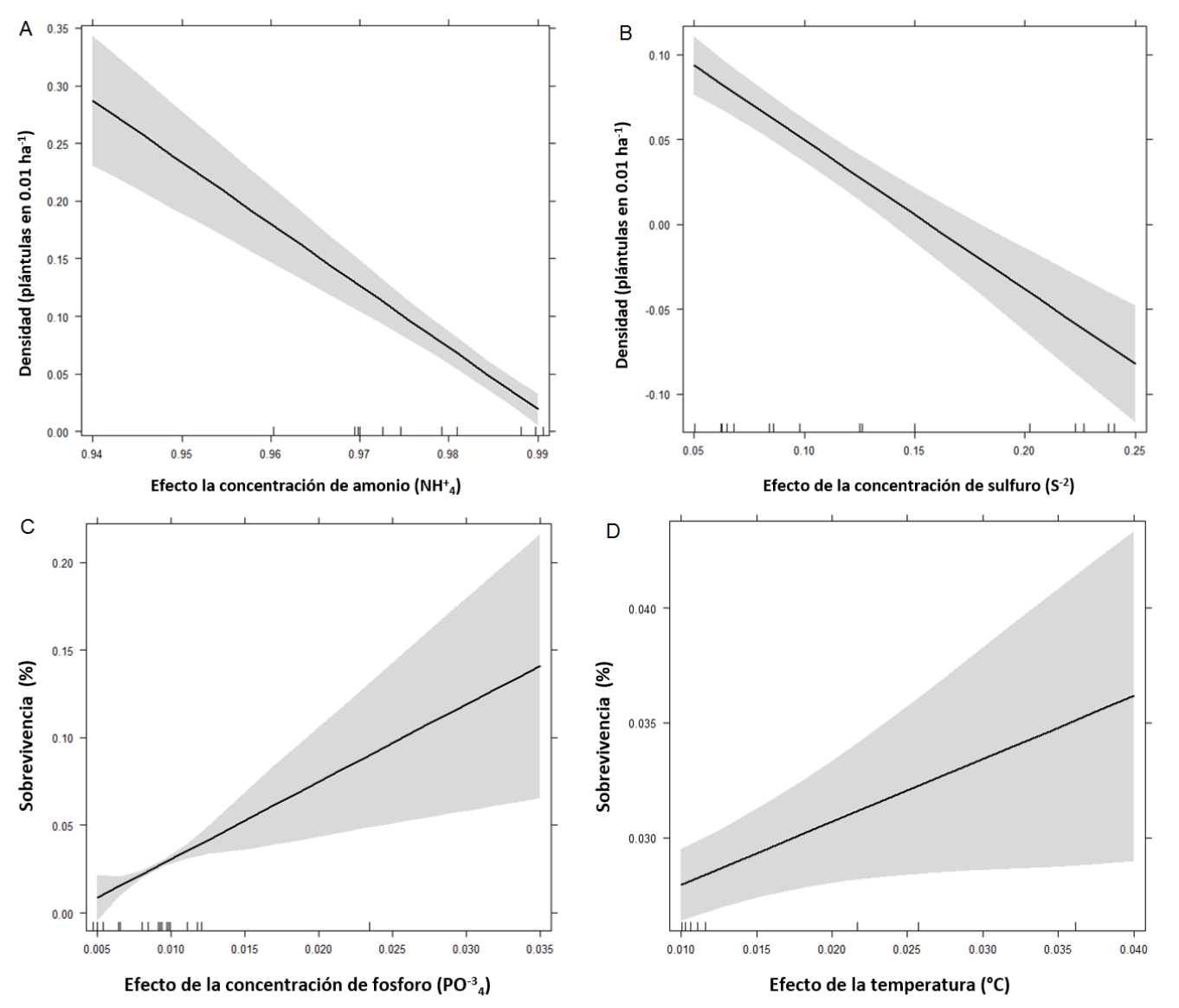
Figura 3. Efecto de la concentración de NH4 + (A) y S-2 (B) sobre la densidad de plántulas y de la concentración de PO4 -3 (C) y de la temperatura (D) del agua intersticial sobre la sobrevivencia de plántulas.
El análisis NMDS mostró que pueden distinguirse tres grupos con similitudes cercanas a 93% en sus características biológicas (densidad, altura, TRCA y sobrevivencia), que pueden indicar las posibles trayectorias de los sitios restaurados de acuerdo con el reclutamiento observado (Fig. 4). Los sitios 1 y 3 conformaron un grupo, pero compartieron similitudes con el sitio 4. El sitio 2, por sí mismo, conformó otra agrupación; este sitio de manglar es de tipo cuenca y la regeneración presentó valores bajos de densidad, altura y tasa de crecimiento en comparación con los otros sitios en restauración (Tabla 2). Por último, un tercer grupo fue conformado por el sitio 4 donde las características de la estructura de la vegetación fueron de manglares de cuenca (Tabla 1).
Discusión
La restauración hidrológica en el estero Bahamitas, modificó el patrón del hidroperíodo en las áreas degradadas, relacionándose con el tiempo de la restauración. El resultado de la reconexión hidrológica fue el incremento de la dispersión y la incorporación de especies de manglar a las áreas de restauración. En un principio, cuando los niveles de inundación fueron menores (mes de mayo), el establecimiento de las especies fue dominado por A. germinans; R. mangle se estableció durante el período de mayor inundación (mes de octubre) y L. racemosa lo hizo con inundaciones intermedias (mes de febrero). Se ha determinado que la diversidad y la estructura forestal de los sitios naturales de manglar son un factor clave en el proceso de recuperación de la regeneración natural en áreas degradadas y adyacentes a estos sitios. La estructura forestal de árboles en el sitio 1 fue representada por las tres especies de manglar; entre ellas R. mangle fue la que registró mayor densidad de árboles (Tabla 1); a pesar de esto, el número de plántulas de esta especie en el área de restauración fue menor en comparación con A. germinans. Las diferencias en la dispersión de las especies de manglar determinaron la regeneración en las zonas degradadas. Otros estudios determinaron que la marea tiene un efecto diferencial en la dispersión de propágulos y establecen que los propágulos más pequeños pueden dispersarse a mayor distancia de los árboles madre (Sousa, Kennedy, Mitchell y Ordóñez, 2007). En el área de restauración, A. germinans fue la que mejor se dispersó debido al tamaño de sus propágulos que les permitió moverse con las inundaciones en toda el área (McKee, 1995; Sousa et al., 2007, 2003). Con este estudio se estableció que es necesario mantener y rehabilitar los canales de marea para restablecer la comunicación entre las zonas de manglar natural y el manglar degradado para facilitar el establecimiento de las diferentes especies de manglar.
La restauración hidrológica cambió positivamente las condiciones fisicoquímicas del suelo, debido al ingreso y salida frecuente de agua de la laguna hacia las zonas de restauración a través de los canales de marea rehabilitados; las variables ambientales de los sitios de restauración presentaron valores cercanos al sitio de referencia (Tabla 3). En el caso de la salinidad del agua intersticial, los sitios en restauración fueron ligeramente menores a 49 ups, en comparación con los registrados en el sitio de referencia (55 ups). Adicionalmente, la concentración máxima de S-2 fue de 24.78 mg/l, menor a los niveles determinados en otras islas cársticas con valores entre 32 mg/l y 128 mg/l Mckee (1993); los cuales representan niveles tóxicos para A. germinans y R. mangle. El aumento de la frecuencia de inundación, como resultado de la restauración, favoreció la oxidación de los sulfuros por la incorporación del oxígeno al suelo, disminuyendo los niveles de concentración del S-2. El mejoramiento de las condiciones fisicoquímicas en relación con el tiempo de restauración ayudó al establecimiento de L. racemosa hacia el final del estudio, es por esto que la densidad de esta especie fue menor en comparación con las otras. Este proceso de colonización ha sido observado en otros humedales en condiciones de degradación (McKee, 1995).
El modelo lineal mixto demostró que la variación espacial de la colonización del manglar estuvo en función de la fuerza hidrológica que transportó propágulos desde el sitio de referencia hacia el interior de los sitios en restauración. Las tasas más altas de reclutamiento para A. germinans y R. mangle se observaron dentro de los primeros 100 m de distancia respecto al manglar natural. El desarrollo de la estructura forestal de los árboles madre determinó la vigorosidad de los propágulos que fueron clave para la dispersión (Amir, 2012; Clarke, 2004); para el establecimiento de estos propágulos son importantes las condiciones del agua y el suelo de cada sitio (Ravishankar & Ramasubramanian, 2004). Los resultados de este estudio sustentaron la necesidad de incluir sitios naturales y en buen estado de su estructura forestal en el desarrollo de proyectos de restauración.
Las áreas en restauración (desprovistas de árboles) registraron las mayores temperaturas del agua intersticial, pero no hubo diferencias significativas entre los sitios; sin embargo, hubo relación positiva de la sobrevivencia de las plántulas con la temperatura. Esta relación se explica por la interacción de esta variable con otros agentes modulares como la irradiación solar, luz y movimiento del agua. Las mayores sobrevivencias fueron registradas en los sitios en restauración, en contraste con el sitio de referencia, donde se presentó la mayor densidad de plántulas de A. germinans y R. mangle. A pesar de ello, solo se registraron plántulas con alturas menores a 40 cm y valores de sobrevivencia por debajo de 70%. La falta de crecimiento en altura de las plántulas se explica por la disponibilidad de recursos como luz y nutrientes (Berger y Hildenbrandt, 2000); y por la competencia intra e interespecífica de las plantas (Maestre, Callaway, Valladares y Lortie, 2009).
En la relación de los nutrientes con el desarrollo de las plántulas se observó una tendencia positiva. El NH4 + es el principal nutriente que utilizan las plántulas, aproximadamente 90% de amonio es absorbido a través del sistema de raíces (Alongi, 1996). Este nutriente influyó directamente en el aumento de la población de plántulas de manglar en los sitios restaurados. El PO4 -3 es reconocido como un elemento limitante del desarrollo estructural de los manglares (Lovelock, Feller, Ball, Engelbrecht y Ewe, 2006; Naidoo, 2006). En este estudio, las plantas con mayor altura y sobrevivencia fueron registradas en los sitios donde las concentraciones de PO4 -3 fueron mayores. Los sitios con mayor tiempo de restauración registraron niveles de PO4 -3 más cercanos a los del sitio de referencia. La reconexión hidrología de las áreas de restauración con la Laguna de Términos favoreció la importación de subsidios de nutrientes a través de las mareas (Rivera-Monroy, Day, Twilley, Vera-Herrera y Coronado-Molina, 1995).
El análisis de NMDS permitió identificar tres agrupaciones de los sitios con base en el comportamiento de la regeneración natural: intermedio, referencia y divergente. En este trabajo se identificó que los sitios 1 y 3 presentaron características de regeneración intermedia, con densidades entre 111 y 82 plántulas en 0.01 ha y alturas entre 44 cm y 55 cm, por lo cual presentan una trayectoria de recuperación hacia un hábitat muy similar al sitio de referencia (Suding y Hobbs, 2009). En contraste, el sitio 2 tomó una trayectoria divergente (Suding, 2011), la cual se asocia con una pobre estructura forestal, bajas densidades y menor altura de plántulas. La divergencia en este sitio se debe a que tiene diferentes condiciones fisicoquímicas. El sitio 2 presentó mayores valores de salinidad y permaneció más tiempo inundado, lo cual influyó sobre la dispersión y el reclutamiento. Es posible que este sitio esté desviándose hacia otro estado, lo que podría resultar en un hábitat regenerado pero distinto al sitio de referencia y seguir una trayectoria del paisaje diferente a lo esperado (Matthews, Spyreas y Enderess, 2009; Weinstein, Teal, Balletto y Strait, 2001). La altura se vio afectada por la defoliación causada por insectos; por lo que la herbivoría fue otro factor involucrado en el proceso de reclutamiento, (Monie, Florentine y Palmer, 2013). La divergencia observada podría contribuir a la sostenibilidad del área de estudio debido a la heterogeneidad adicional en el ecosistema, que le confiere resiliencia (Zedler, Doherty y Miller, 2012).
Conclusiones
Las acciones de restauración reestablecieron la conexión hidrológica entre las zonas de manglar degrado y la Laguna de Términos. Las acciones llevadas a cabo mejoraron las variables fisicoquímicas del suelo, lo que propició el establecimiento e incorporación de nuevas especies de manglar en el área de restauración.
La inclusión de áreas naturales de manglar con buena estructura forestal fue una estrategia clave para la dispersión y reclutamiento de propágulos hacia las zonas de restauración. Los árboles madre fueron proveedores de propágulos de todas las especies presentes en el área, contribuyendo a incrementar la diversidad. La dispersión, establecimiento y crecimiento de plántulas de manglar estuvieron en función de la distancia respecto a los manglares naturales.
Los resultados generados en este estudio respecto a los cambios ambientales y la respuesta de la regeneración natural del manglar contribuyen al conocimiento para la implementación de programas de restauración de manglares.











 nova página do texto(beta)
nova página do texto(beta)