Introducción
México es el país con la mayor diversidad de especies de pinos (Pausas, 2015), estos tienen gran importancia ecológica, económica y social (Ramírez-Herrera, Vargas-Hernández y López-Upton, 2005; Sánchez-González, 2008). Según cifras de la Secretaria de Medio Ambiente y Recursos Naturales (Semarnat), 45% del territorio nacional presenta algún tipo de degradación, principalmente por el cambio de uso del suelo destinado para actividades agropecuarias; México ocupa el quinto lugar mundial en deforestación actualmente (Semarnat, 2014).
La producción de plántula forestal es una actividad que ha recobrado gran importancia en las últimas décadas, debido a la necesidad de restablecer la cobertura vegetal mediante actividades de reforestación (García, Alcantar, Cabrera, Gavi y Volke, 2001; Benítez, Equihua y Pulido, 2002). Se sabe que los ecosistemas sostenibles a través del tiempo son aquellos con mayor abundancia en biodiversidad, ya que se generan una serie de sinergismos que mantienen su funcionalidad (Altieri y Nicholls, 2013), es ahí donde radica el interés por la producción de plántula forestal nativa de cada región.
En México, 94% de la producción de planta forestal se encuentra en viveros, haciendo uso de una mezcla de materiales orgánicos -principalmente la turba (Peat-Moss)- e inorgánicos como agrolita y vermiculita, incrementando de manera significativa los costos de producción en los viveros forestales. Además se ha usado la tierra de monte para la producción de plántulas, pero esta práctica tiene la limitante de que genera un impacto ambiental indeseable y enfermedades fitosanitarias en la producción forestal (Sánchez-Córdova, Aldrete, Cetina-Alcalá y López-Upton, 2008; Wightman y Santiago, 2013). Por este motivo surge la necesidad de evaluar sustratos alternativos, los cuales produzcan plántula sana, de buena calidad y además, reduzca los costos de producción en vivero.
Dentro de este contexto, la producción de hongos comestibles ha mostrado un incremento anual promedio de 11% durante las últimas décadas. A escala mundial, las especies más cultivadas y comercializadas son: Agaricus spp. (champiñones), con un nivel de producción que supera los dos millones de toneladas métricas anuales; Lentinula edodes (Shiitake), en segundo lugar con más de 1.5 millones de toneladas; seguido por Pleurotus ostreatus (hongo seta) con cerca de 1 millón de toneladas anuales (Romero-Arenas, Martínez, Damián, Ramírez y López-Olguín, 2015). México es el mayor productor de hongos comestibles en Latinoamérica, generando alrededor de 80.8% de la producción total de esta región, con un crecimiento de 25.4% del año 1986 al 1997 (Martínez-Carrera, Morales, Sobal, Bonilla y Martínez, 2007; Martínez-Guerrero et al., 2012).
La comercialización del hongo Shiitake se ha extendido desde países asiáticos hasta Europa y América, debido principalmente a sus excelentes propiedades medicinales y nutricionales (Yaoqi, Wei, Yueqin, Yanling y Yu-Cheng, 2014). Está demostrado que el consumo regular del hongo Shiitake otorga ciertos beneficios a la salud humana por su alto contenido de proteínas, vitaminas esenciales como B1, B2, B6, B12 y minerales, además de poseer propiedades anticancerígenas, antivirales, antioxidantes y activar el sistema inmune (Cheung, 2010; Nieto-Ramírez, Rojas-Luna y Suarez, 2012).
La cadena de producción de hongos comestibles, incluyendo el hongo Shiitake, puede catalogarse de importancia económica y social, ya que sus niveles de producción son similares a otros productos convencionales (Piccinin, Di Piero y Florentino, 2010). Particularmente, el hongo Shiitake ha tenido una evolución importante en México, alcanzando una producción significativa y por ende una generación considerable de residuos de este proceso productivo. Los principales residuos que se generan a partir de este cultivo son de carácter orgánico, ya que el sustrato para el desarrollo y crecimiento del cultivo del hongo Shiitake conlleva el uso de materiales como troncos de árboles, aserrín y otros subproductos agrícolas o agroindustriales disponibles en la región (Romero-Arenas et al., 2015).
Ante este panorama, es necesario contemplar un uso alterno a los residuos generados en la producción de hongos comestibles ya que, de no ser así, se contribuye ampliamente a la contaminación ambiental. Se han llevado a cabo estudios que demuestran que los sustratos residuales de la producción de hongos comestibles son materiales que pueden tener diversas aplicaciones en otros procesos productivos, tales como: abono orgánico, nematicida y principalmente como sustrato para la bioremediación in situ de suelos contaminados por hidrocarburos aromáticos, pesticidas y bifenolespolicloradados (Robles, González, Crawford y Chun, 2008; Rojas, 2013). El sustrato residual de hongos comestibles presenta una gran cantidad de enzimas hidrolíticas y oxidativas que liberan los hongos para la obtención de nutrientes (Tuomela, Vikman, Hattaka e Itävaara, 2000).
Objetivos
El presente trabajo de investigación tuvo como objetivo caracterizar las propiedades físicas, químicas y bacteriológicas de la composta a base de residuos de la producción del hongo Shiitake y evaluar sus características como sustrato en la producción de Pinus pseudostrobus Lindl., en vivero.
Materiales y métodos
Elaboración de composta
Los sustratos residuales empleados en la presente investigación provienen de la planta piloto de hongos comestibles del Centro de Agroecología-BUAP. Los residuos se colocaron en un contenedor de plástico negro de 3 m × 8 m. Posteriormente se adicionó 1 kg de activador biológico a base de levaduras y actinomicetos disueltos en 10 L de agua, se realizaron tres riegos por día para mantener la humedad a 60%; los riegos se realizaron cada semana, a través de movimientos oscilatorios. Este material se cubrió con plástico de color negro para incrementar la temperatura a 65 °C. Al cabo de seis meses se obtuvo un material color obscuro y de olor agradable, el cual fue secado y tamizado a 2.5 mm para la obtención de un material homogéneo (Rodríguez, 2008).
Caracterización físico, química y microbiológica
La composta a base de residuos de la producción del hongo Shiitake fue analizada utilizando la metodología establecida en la Norma Mexicana NOM-021 (Semarnat, 2002), para determinar los macronutrientes (N, P, K,), los cuales intervienen en el desarrollo de las plantas, al igual que lo hacen la retención de humedad, la materia orgánica, la capacidad de intercambio catiónico, la densidad aparente, el pH, la conductividad eléctrica y el porcentaje de humedad. Los análisis bacteriológicos se realizaron en el Centro de Investigaciones Microbiológicas ICUAP de la BUAP, de acuerdo con la Norma Oficial Mexicana NOM-092-SSA1 (Semarnat, 1995), para establecer un recuento de unidades formadoras de colonias (UFC); el método se basa en que cada organismo presente desarrollará una colonia visible. Para ello se diluyó un gramo de composta en 10 mL de caldo nutritivo contenido en un tubo de ensayo, se mantuvo un movimiento circular por 5 min; después se tomó 1 mL de la solución contenida en este tubo para ser diluido en 9 mL de caldo nuevamente, así consecutivamente hasta completar 10 repeticiones incluyendo la primera. Al término de este proceso de dilución, se tomaron 10 µL por cada dilución y se colocaron en el centro de cajas Petri con medio de cultivo Infusión Cerebro Corazón (ICC), el procedimiento se realizó por duplicado en tres ocasiones. El conteo de células se efectuó contando las UFC que crecieron en la superficie del medio de cultivo después de un periodo de incubación de 24 h a 37 °C para transformarse a UFC por gramo de composta. Finalmente, se aislaron 50 colonias de acuerdo con su morfología para ser identificadas por medio de cultivo CHROMagar Orientación BD®. Se sembraron por el método de picadura y posteriormente se incubaron durante 48 h a una temperatura de 37 °C.
El reconocimiento de los microorganismos se realizó siguiendo las especificaciones del productor, planteadas en la tabla 1 (Merlino et al., 1996).
Tabla 1. Apariencia de los microorganismos presentes en la composta mediante CHROMagar OrientaciónBD®.
| Microorganismo | Apariencia de las colonias | Pruebas confirmatorias |
|---|---|---|
| E. coli | Colonias rosadas, transparentes, de tamaño medio con o sin halos alrededor. | - |
| Grupo KES * | Colonias de tamaño medio y pigmento azul oscuro. | BBL Crystal E/NF, Indol |
| Grupo PMP ** | Colonias beige o crema redondeadas por halos marrón. | BBL Crystal E/NF, Indol |
| Enterococcus sp. | Colonias verde azul de tamaño pequeño. | - |
| Streptococcus agalactiae | Colonias pequeñas con pigmento verde, azul claro. | - |
| Staphylococcus saprophyticus | Colonias pequeñas color púrpura, opacas con o sin halos. | Disco de 5 µg novobiocina |
| Otros (Incluyendo Salmonella sp.) | Colonias sin pigmento, color crema. | Colonias sin pigmento, color crema |
* Klebsiella sp., Enterobacter sp. y Serratia sp.
** Proteus sp., Morganella sp. y Providencia sp.
Trasplante
Las plántulas de 30 días de germinación en almácigo se colocaron en un recipiente con agua limpia durante 20 min, para evitar el contacto con el aire y rayos solares los cuales pudieran provocarles daños. Se trasplantaron a tubetes estériles de polipropileno estabilizador ultra violeta, de 137 cm3, cuyas dimensiones fueron: largo 16.7 cm, diámetro superior 4.6 cm y diámetro inferior 2.8 cm. El trasplante se realizó con humedad adecuada para poder insertar el sembrador (estaca de madera con una punta). La plántula se tomó de la base del tallo para colocar la raíz derecha en el orificio hecho por el sembrador en el sustrato del tubete; se cubrió la raíz con el cuidado de no dejar espacios con aire entre la raíz y el sustrato, el sustrato se dejó lo más nivelado posible. Los tubetes se colocaron en charolas fabricadas de polipropileno con 30% de fibra de vidrio, cuyas dimensiones son 37 cm, 34 cm y 18.4 cm de largo, ancho y alto respectivamente. Cada charola contiene 49 cavidades, donde se colocaron las plántulas correspondientes a cada uno de los tratamientos (Tabla 2) y sus respectivas repeticiones, hasta un total de 784 plántulas en 16 charolas con una distribución completamente al azar en condiciones de vivero.
Tabla 2. Proporciones de los componentes a probar utilizando composta a base de residuos de la producción de Shiitake como sustituto del Peat Moss.
| Componentes para la mezclas, % | |||||
|---|---|---|---|---|---|
| Tratamientos | Composta de Shiitake | Peat Moss | Agrolita | Vermiculita | Total |
| T1* | 33.3 | 33.33 | 33.33 | 100 | |
| T2 | 80 | 10 | 10 | ||
| T3 | 50 | 25 | 25 | ||
| T4 | 33.33 | 33.33 | 33.33 | ||
T1* = Testigo, mezcla utilizada comúnmente en el vivero forestal de “Flor de Bosque” para la siembra en almácigo.
Manejo de plántulas de Pinus pseudostrobus en vivero
Los riegos se realizaron cada tercer día por la mañana durante 6 meses, el deshierbe cada 30 días y para la fertilización se siguieron las prácticas realizadas comúnmente por el personal del vivero forestal “Flor de Bosque”, donde se realizó el experimento. Se dio el mismo manejo a todas las plántulas, la única variación se realizó en la composición de los sustratos. Durante el desarrollo inicial de las plántulas en vivero, se realizaron fertilizaciones en tres etapas constituidas con nitrógeno (N), fosforo (P) y potasio (K): iniciador, crecimiento y endurecimiento. El iniciador estaba constituido por (9-45-15) y las proporciones utilizadas fueron 0.83 g L-1 (75 ppm), en la etapa de crecimiento se utilizó (20-10- 20) con una proporción de 0.60 g L-1 (120 ppm) y endurecimiento con (4-25-35) 1.25 g L-1 (50 ppm). Como preventivo para el ataque de algún hongo se aplicaron fungicidas: Captan®, Tecto®, Previcur®, Derosal® y Foley® para el control de plagas.
Evaluación de las variables
Para la determinación de atributos morfológicos, se tomaron en cuenta cuatro mediciones con respecto al periodo de abril-julio 2015, de las cuales solamente se tomó una muestra representativa de 25 plántulas por charola, de manera sistemática (Reyes-Reyes, Aldrete, Cetina-Alcalá y López-Upton, 2005). A las plántulas seleccionadas se les midió altura y diámetro para observar el comportamiento en el desarrollo inicial del Pinus pseudostrobus en los diferentes tratamientos. Al cabo de 180 días del experimento, se procedió a determinar los índices de calidad de las plántulas y, para ello, se tomaron datos de diámetro en la base del tallo, altura de la planta y biomasa aérea y radical.
La altura se midió en centímetros desde la base del tallo hasta la yema apical (regla graduada), el diámetro se midió en milímetros en la base del tallo mediante el uso de un vernier. Para evaluar la biomasa seca se extrajeron las plántulas de los contenedores y se les quitó cuidadosamente todo el sustrato adherido a la raíz. Para obtener masa de la parte aérea y radicular, las muestras se colocaron en bolsas de papel, separando la parte aérea y la radical y se secaron en estufa con circulación forzada de aire a 70 °C, hasta obtener una masa constante (48 h); transcurrido este periodo, se pesaron en una balanza digital con resolución de 0.01 g (Rodríguez et al., 2010; Lázaro-Dzul et al., 2012).
A partir de las variables altura, diámetro, masa seca aérea y radicular de la planta, se estimaron la relación parte aérea/raíz, el índice de esbeltez y el índice de calidad de Dickson (ICD). La relación parte aérea/raíz se estimó como el cociente entre la masa aérea seca (g) y la masa radical seca (g). El índice de esbeltez se calculó mediante el coeficiente de la altura y el diámetro del tallo (Romero-Arenas et al., 2012).
El ICD resultó de integrar los valores de masa seca total e índice de esbeltez y la relación parte aérea/raíz (Dickson, Leaf y Horsen, 1960).
donde:
ICD: |
Índice de calidad de Dickson |
PST: |
masa seca total de la planta (g) |
PSA: |
masa seca de la parte aérea de la planta (g) |
PSR: |
masa seca de la parte radical de la planta (g) |
A: |
altura de la planta (cm) |
D: |
diámetro de la planta (mm) |
Los datos obtenidos se procesaron en el paquete estadístico SPSS Statistics versión 17 (Statistical Package for the Social Sciences-IBM) para realizar el análisis de varianza (ANOVA) y, posteriormente, se aplicó la prueba de comparación múltiple de Tukey (p < 0.05) para determinar diferencias entre los tratamientos.
Resultados y discusión
Caracterización física y química
La composta a base de residuos de la producción del hongo Shiitake presenta una densidad aparente menor a 1 g cm-3 y se encuentra dentro de los valores óptimos de un buen sustrato (Handreck y Black, 1994). Asimismo, esta composta presenta 25% de porosidad, debido al material con el que fue elaborada: 60% de aserrín de encino, 10% de rastrojo de maíz y 28.5% de olote de maíz, los cuales en general son materiales muy porosos. De acuerdo con Cabrera (1999), los valores para la porosidad no deben ser inferiores a 10% y 20% ya que, de ser así, la planta no tendrá suficiente aireación y más cuando se trata de una siembra en recipientes como el caso de viveros forestales con el uso de conos.
En cuanto a humedad, presenta un valor de 33% y 40.1% de capacidad de retención de agua, estos valores se encuentran dentro de los óptimos para que se aprovechen la disposición de nutrientes necesarios para que la semilla germine y que la plántula emplea en su crecimiento y desarrollo en el vivero forestal (Ortega-Martínez, Sánchez, Díaz y Ocampo, 2010).
El pH de la composta es ligeramente alcalino con un valor de 7.3, esto se debe al carácter básico del material orgánico que ha sufrido un proceso de degradación (aserrín de encino); Pérez, Céspedes y Núñez (2008) encontraron un pH de 8.13 para diferentes mezclas de materiales orgánicos y aserrín de pino en el proceso de germinación.
La conductividad eléctrica (CE) obtenida para la composta de residuos del hongo Shiitake es de 3.82 dS / m. García et al. (2001) recomiendan un valor máximo de CE de 3 dS / m para sustratos, por otro lado Mateo-Sánchez, Bonifacio-Vázquez, Pérez-Ríos, Mohedano-Caballero y Capulín-Grande (2011) establecen un valor que oscile entre 2 dS / m y 4 dS / m para una composta de buena calidad.
La presencia de nitrógeno, fósforo y potasio mayor a 1% en un sustrato determina un desarrollo saludable de una planta (Garcia et al., 2001). Los resultados de la presente investigación son de N 1.14%, P 0.18% y K 0.80%. Castillo, Quarín e Iglesias (2000) mencionan un contenido de N entre 0.57% y 1.25%, P de 0.03% y K entre 0.11% y 0. 77%, para distintas compostas a base de residuos urbanos y estiércol. En el caso de la composta a base de residuos de la producción de café con estiércol, Pierre, Rosell, Quiroz y Granda (2009) muestran valores de N 1.44%, P 0.5% y K 0.86%, valores muy similares obtenidos en la presente investigación.
Los materiales orgánicos presentan una alta capacidad de intercambio catiónico (CIC), relacionada con la disponibilidad de nutrientes para las plantas. Un sustrato debe contener un mínimo de 30 Meq / 100 g (Pérez, Pérez y Vertel, 2010). La composta a base de residuos de la producción del hongo Shiitake presenta 3256 Meq / 100 g, lo que asegura un depósito de reserva de nutrientes disponibles y garantiza el proceso de desarrollo de plántula (Zapata, Guerrero y Polo, 2005).
La cantidad de materia orgánica presente en la composta es de 41.8%, este valor se encuentran dentro del promedio (25% - 70%) establecido en el proceso de composteo (Pierre et al., 2009). En el caso de la composta de aserrín mezclado con estiércol en diferentes proporciones, los valores oscilan entre 46% y 57%, lo cual se asemeja a los resultados obtenidos en la presente investigación (Zapata et al., 2005). En la tabla 3 se muestra los valores que se obtuvieron para cada parámetro físico-químico evaluado.
Tabla 3. Caracterización físico-química del residuo de la producción del hongo Shiitake (Lentinula edodes) al termino del proceso de composteo.
| Parámetro | Método analítico | Unidades | Resultados |
|---|---|---|---|
| Retención de humedad | NOM-021-SEMARNAT-2000 AS-06 | % | 40.1 |
| Humedad | NOM-021-SEMARNAT-2002 AS-05 | % | 33 |
| Densidad aparente | NOM-021-SEMARNAT-2002 AS-03 | g cm-3 | < 1.0 |
| Porosidad | Método Interno | % | 25 |
| Nitrógeno total | NOM-021-SEMARNAT-2000 | % | 1.14 |
| Contenido de materia orgánica | NOM-021-SEMARNAT-2000 AS-07 | % | 41.8 |
| Capacidad de intercambio catiónico | NOM-021-SEMARNAT-2002 AS-13 | Meq/100g | 3256 |
| Conductividad eléctrica | NOM-021-SEMARNAT-2002 AS-18 | dS m-1 | 3.82 |
| Fósforo total | EPA 6010 | % | 0.18 |
| Potasio total | EPA 6010 | % | 0.8 |
| Ca ++ | EPA 6010C | % | 0.42 |
| Mg ++ | EPA 6010C | % | 0.06 |
| Na+ | EPA 6010C | % | 0.03 |
| pH | NOM-021-SEMARNAT-2002 AS-02 | pH | 7.3 |
Meq/100g = ppm del catión /(masa equivalente × 10)
Caracterización microbiológica
Las condiciones microbiológicas presentes en la composta dependen en gran medida de las condiciones físico-químicas de la misma. Los factores que más influyen en el metabolismo microbiano son el pH, la temperatura, el oxígeno y la humedad, los cuales a su vez dependen del material orgánico y del manejo del proceso (Pérez et al., 2010). A través de los análisis microbiológicos se logró establecer una cantidad de 3.6 × 104 UFC g-1, la cual al ser comparada con los valores establecidos por Pérez et al. (2008), resulta ser ligeramente baja, hecho que se atribuye al material usado ya que los materiales provenientes de animales contienen una mayor población microbiana; estos materiales no fueron utilizados en el proceso de composteo.
Las bacterias identificadas (Tabla 4) corresponden a microorganismos, comúnmente encontrados en el proceso de compostaje (Arbeit et al., 1990).
Tabla 4. Bacterias identificadas de la composta del residuo de la producción del hongo Shiitake (Lentinula edodes).
| Género | No. Total de colonias | % total | Gram +/- | 3.6×104 UFC g-1 |
|---|---|---|---|---|
| Klebsiella | 15 | 30 | - | 1.08 a |
| Pseudomonas | 15 | 30 | - | 1.08 a |
| Proteus mirabilis | 7 | 14 | - | 0.5 b |
| Citrobacter | 6 | 12 | - | 0.4 b |
| Enterococus | 7 | 14 | + | 0.5 b |
UFC = Unidades formadoras de colonias.
Evaluación de calidad de planta
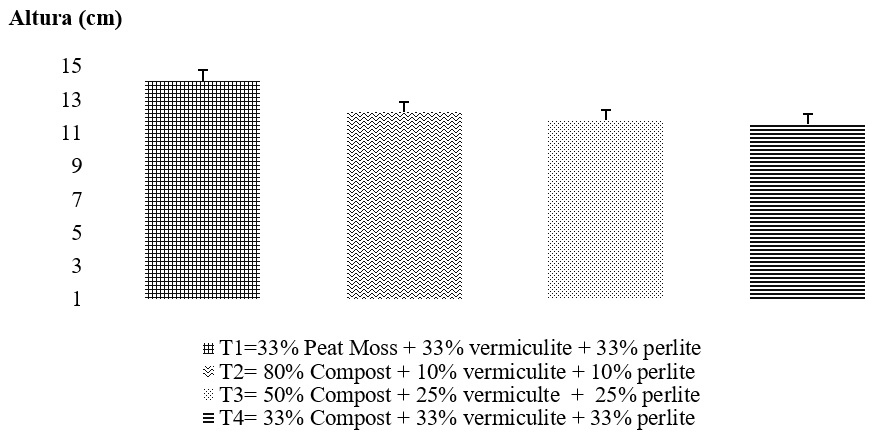
El desarrollo inicial de plántulas de Pinus pseudostrobus en vivero, presentó la mayor altura (14.11 cm) en las plántulas desarrolladas en el tratamiento testigo compuesto por Peat Moss 33% + vermiculita 33% + agrolita 33% (Fig. 1). La menor altura (11.55 cm) se presentó en el tratamiento 4 (Composta 33% + vermiculita 33% + agrolita 33%). De acuerdo con Mexal y Landis (1990), la altura de la planta es un buen predictor de la altura futura en campo, aunque no lo es para la supervivencia; se considera un indicador insuficiente y es conveniente relacionarlo con otros criterios para que refleje su utilidad real (Rodríguez, 2008).
El diámetro de una plántula forestal es quizás la variable más importante a evaluar ya que está relacionada directamente con la capacidad de supervivencia de la planta. El diámetro define la robustez del tallo por lo que se asocia con el vigor y la supervivencia de la plantación. Se menciona que plantas con diámetro mayor a 5 mm son más resistentes al doblamiento y toleran mejor los daños por plagas y fauna nociva, aunque esto varía de acuerdo con las especies (Mexal y Landis, 1990). Es importante mencionar que el diámetro adecuado de 5 mm corresponde a plantas que se han desarrollado en vivero durante 8 meses, lo cual no sucedió en la presente investigación ya que la evaluación se llevó a cabo a los 6 meses de edad de la planta, esto debido al ciclo de producción del vivero, por lo que los tratamientos no alcanzaron a sobrepasar los 4 mm de diámetro (Fig. 2).
Dentro de las variables indicadoras de calidad de planta, el valor más alto de la relación parte aérea/raíz (3.68) se presentó en plántulas que se desarrollaron en el tratamiento 4, que supera a la mezcla testigo, presentando diferencias estadísticas para los tratamientos probados (Tabla 5). Los valores promedio del índice de esbeltez muestran el desbalance entre la parte aérea y la raíz. El mayor índice de esbeltez (5.61) se presentó en plántulas desarrolladas en el tratamiento 4 (Composta 33% + vermiculita 33% + agrolita 33%) y el más bajo (3.98) en el tratamiento testigo. Este índice relaciona la resistencia de la planta con la capacidad fotosintética de la misma (Sánchez-Córdova et al., 2008).
Tabla 5. Comparación de Medias en respuesta a los tratamientos para el crecimiento inicial de Pinus pseudostrobus.
| Tratamiento | RPA/R | IE | ICD |
|---|---|---|---|
| T1 = 33% Peat Moss + 33% Agrolita +33% Vermiculita | 3.629a | 3.998c | 0.245a |
| T2 = 80% Composta + 10% Agrolita +10% Vermiculita | 2.679b | 5.280ab | 0.255a |
| T3 = 50% Composta + 25% Agrolita +25% Vermiculita | 3.087ab | 4.268bc | 0.277a |
| T4 = 33% Composta + 33% Agrolita +33% Vermiculita | 3.680a | 5.618a | 0.138b |
* Medias con letras iguales no son estadísticamente diferentes (Tukey = 0.05).
ICD = índice de calidad de Dickson.
El índice de calidad de Dickson combina la información de los índices anteriores y los ajusta por el efecto del tamaño de la planta, por lo que un aumento en este índice significa plantas de mejor calidad, lo cual implica que por una parte el desarrollo de la planta es grande y que al mismo tiempo las fracciones aérea y radicular están equilibradas (Lázaro-Dzul et al., 2012).
Se han efectuado diferentes experimentos en donde se evalúa el índice de calidad de Dickson a la planta y, una vez establecida en campo, se evalúa su porcentaje de supervivencia; de acuerdo con los resultados obtenidos se establece un valor óptimo mayor a 0.2.
El valor más alto del índice de calidad de Dickson (0.27) fue para el tratamiento a base de Composta 50% + vermiculita 25% + agrolita 25%, seguido por el tratamiento 2; estos tratamientos no presentaron diferencias significativas con el grupo testigo (0.24). Los valores obtenidos se pueden comparar con los de Maldonado (2010), en la producción de Pinus greggii Engelm, que van de 0.20 a 0.28. Mateo-Sánchez et al. (2011) encontraron, para Cedrela odorata L., valores de ICD que van de 0.17 a 0.30; menores a los observados por Reyes-Reyes et al. (2005).
CONCLUSIONES
La composta obtenida a partir de los residuos de la producción del hongo Shiitake cuenta con las características físico-químicas para ser utilizada como sustrato en sustitución del Peat Moss, ya que promueve más de 90% de producción de plántulas en vivero.
La composta mostró buen contenido de N de 1.14%, K de 0.80% y P de 0.18%, macroelementos necesarios para el desarrollo y crecimiento de las plantas.
La composta presenta un total de 3.6×104 UFC, siendo Klebsiella y Pseudomonas los géneros más representativos del total de la carga bacteriana.
Las plántulas de Pinus pseudostrobus (Lindl) que se desarrollaron en composta de Shiitake 50% + vermiculita 25% + agrolita 25%, presentaron el mejor ICD con respecto a los demás tratamientos, además muestra la formación de un buen cepellón.











 nueva página del texto (beta)
nueva página del texto (beta)