Introducción
Las zonas áridas se caracterizan por ser ambientes en donde la perdida de agua por evaporación es mucho mayor que la entrada por la precipitación, las temperaturas son extremas y, en general, la disponibilidad de nutrientes en el suelo es baja (Whitford, 2002; Montaño et al., 2016). A pesar de su apariencia desolada e improductiva, los ecosistemas áridos muestran una alta diversidad biológica y contienen una red importante de interacciones biológicas y de movimiento de materia y energía entre las especies y el medio abiótico. Las zonas áridas y semiáridas han provisto de recursos y servicios ambientales (i.e., forraje para el ganado, productos alimenticios y medicinales, conservación de la biodiversidad, provisión de agua dulce, producción de energía, turismo y recreación) a una tercera parte de la humanidad (White y Nackoney, 2003). Esas zonas son uno de los principales reservorios terrestres de carbono y su capacidad de almacenamiento de carbono puede rivalizar con algunos ecosistemas forestales (Schlesinger, Belnap y Marion, 2009). En México, las zonas áridas y semiáridas cubren más de la mitad del territorio y se localizan principalmente en las regiones norte y centro. Sustentan una variada vegetación compuesta principalmente por plantas lenosas de porte bajo, asi como por plantas suculentas y gramineas que forman matorrales xerofilos y pastizales (Rzedowski, 1978).
Por sus características climáticas y biológicas, las zonas áridas y semiáridas de México fueron reconocidas a mediados del siglo pasado como Sonorense, Chihuahuense, Hidalguense y Poblana, así como la Tamaulipeca, Guerrerense, Tehuantepeca, Veracruzana y Yucateca. Las primeras cuatro zonas presentan un clima caliente y seco con una precipitación anual menor a 500 mm y fueron posteriormente reconocidas por Rzedowski (1973). Las últimas cinco zonas presentan un clima caliente seco y semiseco, con una precipitación anual de hasta 900 mm y una vegetación fisonómicamente similar a las asociaciones vegetales con menor precipitación del bosque tropical seco (Rzedowski, 1978). Las zonas áridas y semiáridas coinciden en lo general con las zonas climáticas áridas y semiáridas delimitadas con el Índice de Aridez (IA) estimado con el método de Penmann (Comisión Nacional Forestal [Conafor] - Universidad Autónoma Chapingo [UACh], 2013). Al calcularse como el cociente entre la precipitación media anual y la evapotranspiración potencial, el IA expresa la disponibilidad hídrica para los ecosistemas. Las zonas áridas hiperáridas (IA < 0.05) cubren 0.67%; las áridas (IA = 0.05 - 0.20), 18.91%; y semiáridas (IA = 0.20 - 0.50), 34.77% de los 1 960 189 km2 del país (Conafor- UACh, 2013). La productividad primaria es el resultado de la cantidad de dióxido de carbono (CO2) que las hojas absorben a través de la fotosíntesis y es el proceso por el cual el carbono (C) y la energía entran al ecosistema. La productividad primaria neta (PPN) es la ganancia neta de C por la vegetación y es un indicador del balance de C entre la cantidad que ingresa al ecosistema y la cantidad liberada por las plantas durante la respiración (Chapin, Manson y Mooney, 2011). La PPN en los ecosistemas terrestres se correlaciona fuertemente con la precipitación y la asociación entre ambas variables es más estrecha en los ecosistemas áridos (Noy-Meir, 1985; Mares, 2017). Sin embargo, esa asociación puede modificarse por la intensidad, frecuencia y estacionalidad de la precipitación, infiltración y escurrimiento del agua de lluvia, evaporación, temperatura, fertilidad del suelo, topografía, densidad y composición de la vegetación y potencial de producción de las especies (Hadley y Szarek, 1981; Whitford, 2002; Mares, 2017). La evaluación de la PPN de las zonas áridas es de suma importancia dada su relevancia en términos de la superficie global que ocupan, la distribución heterogénea de la productividad y su efecto modificador en los modelos sobre la dinámica del C y calentamiento global (Búrquez, Martínez-Yrízar y Nuñez, 1999; Schlesinger y Bernhardt, 2013; Weathers, Strayer y Likens, 2013). La evaluación directa de la productividad primaria neta aérea (PPNA) y subterránea (PPNB) se realiza con base en cosechas múltiples de la biomasa. Sin embargo, la evaluación directa de la PPN regional o nacional es impráctica y costosa, por lo que también se han utilizado técnicas indirectas con base en modelos con variables climáticas o imágenes de satélite calibradas con mediciones directas de PPN en campo (Huete, Solano-Barajas, Glenn y Restrepo-Coupe, 2011; Mendez-Estrella, Romo-Leon y Castellanos, 2017). Los escasos trabajos a escala global sobre PPNB (10% de los estudios sobre productividad en el planeta) han generado esfuerzos para la compilación de información en bases de datos y el uso de aproximaciones, tales como caracteres de las plantas, para realizar estimaciones de la PPNB (Chapin et al., 2011; McCormack et al., 2015; Iversen et al., 2017).
La biomasa es la masa de los organismos vivos por unidad de superficie en un momento dado (Chapin et al., 2011). La biomasa varía en función de la composición florística y la estructura de la vegetación y, al igual que la mayoría de los procesos ecosistémicos, está ligada a la disponibilidad de agua. La biomasa ha sido utilizada para cuantificar las entradas y salidas de C y de los gases de efecto de invernadero en el ecosistema (Escobar et al., 2008; Chapin et al., 2011). La determinación adecuada de la biomasa de un ecosistema permite determinar los almacenes de C y otros elementos químicos en cada uno de sus componentes y representa la cantidad potencial de C que puede ser liberado a la atmósfera o conservado y fijado en determinada superficie (Escobar et al., 2008).
En los ecosistemas terrestres la producción de hojarasca (caída de hojas, ramitas, cortezas, flores, frutos), raíces finas muertas y su descomposición es la ruta principal de transferencia del carbono proveniente de la productividad primaria al suelo (Chapin et al., 2011; Weathers et al., 2013). Por ello, es fundamental conocer los factores físicos y biológicos que modifican la magnitud y velocidad del flujo del C de la vegetación al suelo, debido a que todos los procesos biológicos del suelo están sustentados por la entrada de energía a través de la hojarasca y raíces muertas y su subsecuente descomposición (Martínez-Yrizar, Núñez y Burquez, 2007; Montaño et al., 2016). El patrón de precipitación y cantidad de lluvia, la temperatura, la heterogeneidad espacial, el tiempo de caída y la calidad de hojarasca (cocientes C:N, lignina:N) han sido reconocidos como factores determinantes en la descomposición de hojarasca en ambientes áridos (Montaña, Ezcurra, Carrillo y Delhoume, 1988; Whitford, 2002; Schlesinger y Bernhardt, 2013). La descomposición es un proceso por el cual la biomasa muerta de los organismos autótrofos y heterótrofos es degradada tanto por factores físicos como por la fauna y microorganismos del suelo y es un proceso fundamental del ciclo del C en los ecosistemas que tiene como consecuencia la liberación de nutrientes en el suelo y CO2 a la atmosfera (Montaño et al., 2016).
La respiración de los microbios y las raíces del suelo es la principal fuente de emisiones de C de los ecosistemas terrestres a la atmósfera (Weathers et al., 2013). En los ecosistemas limitados por agua, la variación en el flujo estacional del CO2 a la atmósfera -como otros procesos del ecosistema- depende de la sincronización e intensidad de la lluvia, la temperatura del suelo y la fenología de la vegetación, pero el tipo de vegetación, cobertura vegetal y textura y materia orgánica del suelo contribuyen con variación espacial (Schlesinger y Bernhardt, 2013).
A pesar de la importancia ecológica y económica de las zonas áridas mexicanas, los trabajos sobre la productividad primaria y la biomasa han sido escasos y se encuentran dispersos. Esfuerzos recientes de revisión sobre ambos temas en México son los de Escobar et al. (2008) sobre la dinámica energética de los ecosistemas, de Montaño et al. (2016) sobre los almacenes y flujos del carbono y de Cueva-Rodríguez, Robles-Zazueta, Garatuza-Payan y Yépez (2016) sobre la respiración del suelo.
Objetivos
El objetivo de este trabajo es compilar y sintetizar la información sobre las magnitudes y procesos que determinan la biomasa y la productividad primaria de los ecosistemas de las zonas áridas de México, así como la de sus destinos, la producción de hojarasca, descomposición y respiración microbiana del suelo. El conocimiento sobre cuáles han sido las regiones estudiadas, qué compartimentos y procesos del ecosistema han sido investigados y cuál ha sido la intensidad de los muestreos y duración de los estudios, permitirán identificar vacíos de información, planificar y dirigir los esfuerzos de investigación a escala regional y nacional.
Materiales y métodos
Se realizó una búsqueda de los artículos, libros, memorias en extenso, tesis e informes técnicos hasta diciembre del año 2017 en los siguientes motores de búsqueda: Web of Science (WoS, periodo 1980 - 2017, https://apps.webofknowledge.com), Red de Revistas Científicas de América Latina y el Caribe, España y Portugal (http://www.redalyc.org/), Scientific Electronic Library Online Mexico (http://www.scielo.org.mx/scielo.php?lng=es), Red Mexicana de Repositorios Institucionales (http://www.remeri.org.mx/portal/index.html) y Google Académico (https://scholar.google.com.mx/). Las palabras clave utilizadas en español e inglés fueron productividad, biomasa, hojarasca, descomposición, respiración de suelo, mineralización de carbono, desierto, zona árida y México. Los documentos se clasificaron en revistas, revistas indizadas en WoS, libros y capítulos de libro, memorias en extenso, informes técnicos y tesis. Se capturó la información en bases de datos para su análisis y diagnóstico.
Resultados y discusión
La búsqueda arrojó 58 estudios con datos para las zonas áridas Sonorense, Chihuahuense, Tamaulipeca, Hidalguense y Poblana. Del total de estudios, 84% se produjeron en el presente siglo. Casi el doble de los estudios tuvo datos sobre biomasa, en comparación con los estudios sobre productividad primaria (Fig. 1). Ochenta y seis por ciento de los estudios fueron revisados por pares anónimos durante el proceso de publicación (60% revistas indizadas WoS, 21% otras revistas, 3% memorias en extenso y 2% libros).

Figura 1. Número de estudios sobre la biomasa, productividad primaria, hojarasca, descomposición y respiración de suelo en las zonas áridas de México. Barras vacías y grises: publicados de 1995 a 2017 y de 2000 a 2017, respectivamente.
Biomasa aérea y subterránea
La cosecha directa de la biomasa de las plantas de una parcela y/o su estimación con ecuaciones alométricas han sido los métodos utilizados para estimar la biomasa aérea de las zonas áridas. La cuantificación de la biomasa de raíces se ha basado en la extracción de monolitos y cilindros de suelo (Jackson, Mooney y Schulze, 1997; Norby y Jackson, 2000; Pavón, 2005). Un método indirecto no destructivo para cuantificar la biomasa aérea y subterránea de la vegetación se basa en la relación entre el tamaño (diámetro, altura y densidad de la madera) y la biomasa de las plantas. Intentos recientes para reunir las ecuaciones alométricas de las especies mexicanas han sido los de Návar (2009) y Rojas-García, De Jong, Martínez-Zurimendi y Paz-Pellat (2015). Ludwig, Reynolds y Whitson (1975), Gutierrez y Whitford (1987) y Whitford (2002) enlistaron ecuaciones alométricas para especies de las zonas áridas de los Estados Unidos que crecen en México, incluyendo ecuaciones alométricas para estimar la biomasa bajo el suelo a partir de la excavación del sistema radicular (Ludwig, Reynolds y Whitson, 1975). La biomasa aérea ha sido medida en una amplia variedad de ecosistemas de las zonas áridas Sonorense, Chihuahuense y Tamaulipeca, incluyendo matorrales micrófilos, espinosos, inerme parvifolios, crasirosulifolios y espinosos tamaulipecos, así como pastizales gipsófilo y halófilo (Suplemento 1). El esfuerzo de muestreo ha sido muy variable, dado que se han realizado estimaciones basadas en un solo cuadro de 600 m2 y desde tres hasta 22 cuadros de 25 m2 por sitio. La biomasa aérea promedio de los estudios realizados en la zonas áridas de México fue 23.2 Mg ha-1 (error estándar, e.e. = 4.15 Mg ha-1, n = 23 sitios); muy superior al intervalo de 2 Mg ha-1 a 5 Mg ha-1 registrado para los ecosistemas desérticos del mundo (Ehleringer y Mooney, 1982). Esta amplia diferencia se explica parcialmente por los valores de biomasa de los ecosistemas de los desiertos intertropicales mexicanos, que podrían ser considerados semiáridos y cálidos en comparación con los desiertos áridos e hiperáridos de latitudes mayores (Noy- Meir, 1985). La biomasa aérea del matorral espinoso tamaulipeco (MET) mostró rápida capacidad de regeneración después del abandono del uso agrícola de la vegetación (Yerena-Yamallel et al., 2015) y tuvo casi dos veces la biomasa aérea de los matorrales xerófilos de las zonas áriáridas Sonorense y Chihuahuense y más de 10 veces la biomasa aérea de los pastizales desérticos Chihuahuenses.
Los valores de biomasa aérea de cuatro sitios del MET (obtenidos de la cosecha de tres cuadros de 5 m × 5 m) están en el intervalo de biomasa aérea del bosque tropical seco en México (37 Mg ha-1 - 117 Mg ha-1; Martínez- Yrízar, Búrquez y Maass, 2000) y uno de ellos en el intervalo de valores registrados para los bosques tropicales secos del mundo (78 Mg ha-1 - 320 Mg ha-1; Murphy y Lugo, 1986). El MET se distribuye en regiones de baja elevación y alta exposición a los vientos del Golfo de México, con abundancia de pastos y hierbas y denso crecimiento de arbustos y árboles bajos, que le otorgan una fisonomía intermedia entre el bosque tropical caducifolio y el matorral xerófilo (Búrquez y Martínez-Yrízar, 2010). Con base en los estudios en las zonas áridas mexicanas que han determinado el contenido de nutrientes en la hojarasca, principalmente carbono y nitrógeno y, excluyendo valores registrados menores a 30% de C por ser muy bajos, el promedio de la proporción del contenido de C en las hojas de 30 especies desérticas fue 0.44, mientras que en los tallos fue 0.45 (Suplemento 2). El pastizal gipsófilo de la zona árida Chihuahuense mostró 293 mg C g-1 peso seco de la raíz (Perroni, García-Oliva y Souza, 2014). El promedio de la proporción del contenido de nitrógeno en las hojas fue 2.3% y en el tallo fue 1.3%. Si la cantidad de C almacenado en la vegetación fue alrededor de 44.6% del peso de la biomasa, el carbono almacenado promedio en las zonas áridas mexicanas fue 10.3 Mg ha-1 (e.e. = 1.84 Mg ha-1). Excluyendo los datos de biomasa aérea para sitios en estado sucesional, se observó que la biomasa aérea aumentó significativamente con el incremento en la lluvia y en la temperatura en las zonas áridas de México (Fig. 2a, b). Sin embargo, con la lluvia y la temperatura también aumentó la variabilidad en la biomasa aérea entre sitios, indicando que la importancia de otros factores, especialmente la topografía y el tipo de suelo, etc., aumentan a medida que disminuyen las limitaciones hídricas y térmicas para la producción de biomasa (Chapin et al., 2011; Weathers et al., 2013). Específicamente para los desiertos, el nitrógeno en el suelo puede ser un controlador de la producción de biomasa una vez que la limitación hídrica disminuye (Whitford, 2002). Contrasta que la biomasa aérea de los pastizales no se incrementó con la lluvia o con la temperatura, aunque el tamaño de muestra fue muy bajo. También que con casi la misma cantidad de precipitación anual, la biomasa aérea del pastizal de Distichlis spicata creciendo en un suelo salino en la zona árida Chihuahuense fue 28 veces menor en comparación con un MET creciendo en los valles de Linares, Nuevo León (Long et al., 1989). La fertilidad del suelo, luz, fuego y herbívora, así como factores intrínsecos a la especie (asignación de recursos a tejidos aéreos y subterráneos, longevidad, ruta fotosintética e interacciones con microorganismos del suelo) son importantes para determinar la productividad y, por tanto, la biomasa aerea de los pastizales (Chapin et al., 2011). Las cactáceas columnares forman comunidades tipo bosque y son un componente importante en la estructura de muchas de las zonas áridas en México; sin embargo, por su forma, tamaño y complicaciones logísticas para estudiarlas, poco se sabe acerca de su aporte en biomasa y contenido de carbono. La cactácea columnar Isolatocereus dumortieri fue dominante en el matorral crasicaule de la Barranca de Metztitlán, Hidalgo, con alrededor de 250 plantas ha-1 y una biomasa aérea de 16.75 kg ± 7.07 kg por planta, correspondiendo a 1.25 kg C m-2 (Pavón, Ayala y Martínez-Falcón, 2016). En un matorral xerófilo de la subdivisión Planicies de Sonora, la biomasa aérea de cactáceas (desde pequeñas y globosas hasta arbustivas) fue 124.3 g m-2 (e.e. = 63.9 g m-2) en sitios cercanos a arroyos, mientras que sitios planos y laderas tuvieron 2.5 g m-2 (e.e. = 1.5 g m-2) y 15.0 g m-2 (e.e. = 12.2 g m-2), respectivamente (Búrquez, Martínez-Yrízar, Núñez, Quintero y Aparicio, 2010). En los matorrales crasicaules de Sonora y norte de Sinaloa, las cactáceas columnares presentaron densidades superiores a 400 individuos ha-1 y valores de biomasa cercanos a 3 kg m-2 (Búrquez y Martínez-Yrízar, datos no publicados). Valores similares de biomasa se esperarían en los densos matorrales con cactáceas columnares en otras regiones limitadas por agua, como el Valle de Tehuacán y la depresión del Balsas.

Figura 2 Relación entre la biomasa aérea con la precipitación media anual (a) y temperatura media anual (b) en matorrales xerófilos y pastizales de las zonas áridas Sonorense (rombo), Chihuahuense (matorrales cuadro vacío, pastizales cuadro lleno) y Tamaulipeca (triángulo). Los datos se ajustaron significativamente a los modelos de regresión lineal: log biomasa (Mg ha-1) = 0.5099761 + 0.0012051 × Precipitación (mm), r2 = 0.23, P = 0.0434, n = 18; log biomasa (Mg ha-1) = -0.859569 + 0.0946758 × Temperatura (°C), r2 = 0.27, P = 0.0252, n = 18.
La biomasa subterránea promedio en seis estudios realizados en las zonas áridas Chihuahuense, Tamaulipeca, Hidalguense y Poblana fue 11.2 Mg ha-1 (e.e. = 3.54 Mg ha-1) (Tabla 1). Este promedio no considera el valor de biomasa estimado para el pastizal semiárido de Bouteloua gracilis en la zona árida Chihuahuense (Medina-Roldán, Arredondo, García-Moya y Huerta, 2007) por ser un valor atípicamente alto (23 Mg ha-1) para este tipo de eco sistema. La biomasa subterránea de los matorrales crasicaules con cactáceas columnares de los desiertos Hidalguense y Poblano fue tres veces inferior a la registrada para el MET en el noreste de México. Los matorrales xerófilos tuvieron una biomasa subterránea un poco superior al promedio, mientras que los pastizales tuvieron la mitad. El intervalo de valores de la biomasa subterránea de las zonas áridas mexicanas es mayor al valor global para los desiertos estimado en 2.7 Mg ha-1 (Jackson et al., 1997). Los valores de biomasa subterránea de la zonas áridas mexicanas están dentro del intervalo estimado para el bosque tropical seco en el mundo (8 Mg ha-1 - 50 Mg ha-1, Murphy y Lugo, 1986) y la biomasa subterránea más alta documentada en la zona árida Tamulipeca fue casi igual a la registrada para el bosque tropical seco de Jalisco (31 Mg ha-1; Castellanos, Maass y Kummerow, 1991). Finalmente, el cociente biomasa subterránea:biomasa aérea (Suplemento 1, Tabla 1) fue 0.9 y 0.6 en un matorral micrófilo y un matorral espinoso de las zonas áridas Chihuahuense y Tamaulipeca, respectivamente, pero en los pastizales halófilo y gipsófilo ese cociente fue mayor a la unidad (1.39 y 1.15), por lo que estos últimos pueden ser importantes sumideros de carbono. El cociente biomasa subterránea/biomasa aérea de un MET fue un poco más alto que un bosque tropical caducifolio de Jalisco (0.42; Castellanos et al., 1991).
Tabla 1 Biomasa y productividad primaria neta subterranea en los pastizales y matorrales xerofilos de las zonas aridas mexicanas. ZA = Zona arida, Ch = Chihuahuense, Ta = Tamaulipeca, Hi = Hidalguense, Po = Poblana.
| ZA | Vegetación |
Biomasa (Mg ha-1) |
Carbono (Mg ha-1) |
Productividad (Mg ha-1 año-1) |
Ref. |
|---|---|---|---|---|---|
| Ch | Matorral micrófilo | 02.230 | ---- | ---- | 1 |
| Ch | Pastizal gipsófilo | 07.510 | ---- | ---- | 1 |
| Ch | Pastizal halófilo | 03.890 | ---- | 06.780 | 2 |
| Ch | Pastizal semiárido | 23.000 | ---- | ---- | 3 |
| Ta | Matorral espinoso tamaulipeco | 27.300 | 13.600 | ---- | 4 |
| Hi | Matorral submontano | 21.000 | 10.500 | 02.740 | 5 |
| Hi | Matorral crasicaule | 06.600 | 03.600 | 03.760 | 6 |
| Po | Matorral crasicaule | 09.710 | 04.580 | 00.346 | 7 |
Donde: Ref. = Referencia: 1, Perroni, García-Oliva y Souza (2014); 2, Long et al. (1989); 3, Medina-Roldán, Arredondo, García-Moya y Huerta (2007); 4, Návar, Méndez y Dale (2002); 5, Pavón (2007); 6, Pavón (2005); 7, Pavón y Briones (2000).
---- Sin dato.
Biomasa: Ref. 1, 2 extrajeron cilindros de suelo entre 0-0.15 m de profundidad; Ref. 4, 5, 6, 7 extrajeron monolitos de suelo entre 0-0.5, 0-0.6, 0-0.5, 0-1.0 m, respectivamente. Productividad: Ref. 2 extrajeron cilindros de suelo entre 0-0.15 m de profundidad; Ref. 5, 6 entre 0-0.2 m, Ref. 7 colocaron trampas para raíces entre 0.07-0.14 m.
Productividad primaria neta aérea y subterránea
Las estimaciones de la productividad primaria neta aéreo (PPNA) realizadas por el método de cosecha de la biomasa en las zonas áridas de México han sido sumamente escasas. La PPNA entre 1.6 m y 2.2 m de altura de un matorral sarcocaulescente oscilo estacionalmente entre 0.07 Mg ha-1 y 0.133 Mg ha-1 durante el otoño seco y entre 0.166 Mg ha-1 y 0.65 Mg ha-1 en la primavera relativamente mésica (Osuna-Villavicencio, 2015). La PPNA de un matorral desértico en el Valle de México, que debe su aridez al sustrato rocoso y no a la precipitación media anual (814 mm - 925 mm), oscilo entre 5.69 Mg ha-1 ano-1 y 6.8 Mg ha-1 ano-1 en sitios planos y abruptos (Cano- Santana, 1994). En un pastizal introducido de Penisetum ciliaris libre de pastoreo y sin arbustos en el noroeste de Sonora, la producción de biomasa aéreo vario de 3.045 Mg ha-1 en un verano con lluvia superior al promedio, a 0.465 Mg ha-1 en el verano siguiente con precipitación menor al promedio (Martin-R., Cox e Ibarra-F., 1995). La PPN estimada como una función de la evapotranspiración real fue menor a 0.5 Mg ha-1 año-1 en las regiones más áridas de la zona árida Sonorense, pero en las regiones menos áridas de la zona árida Sonorense y en el norte y centro de la zona árida Chihuahuense fue mayor (0.5 Mg ha-1 año-1 - 1 Mg ha-1 año-1). En la porción sur de las zonas áridas Chihuahuense y Poblana y sus regiones colindantes con montañas, la PPN fue de 1 Mg ha-1 año-1 a 7.5 Mg ha-1 año-1, mientras que en las restantes zonas áridas, relativamente más mésicas y colindantes con el bosque tropical caducifolio, la PPN fue de 7.5 Mg ha-1 año-1 a 10 Mg ha-1 año-1 (Gómez, Monterroso, Toledo y Tinoco, 2008). La PPN estimada a través del Índice Espectral de Vegetación de Diferencia Normalizada (NDVI) durante un año cuando la precipitación fue similar a la media de largo plazo mostró valores similares: menores a 0.1 Mg ha-1 año-1 en las regiones más áridas de la zona árida Sonorense, de 0.1 Mg ha-1 año-1 a 1.6 Mg ha-1 año-1 en las regiones menos áridas de la zona árida Sonorense y norte y centro de la zona árida Chihuahuense, de 1.6 Mg ha-1 año-1 a 3.4 Mg ha-1 año-1 en la porción sur y regiones colindantes con montañas de las zonas áridas Chihuahuense y Poblana y de 3.4 Mg ha-1 año-1 a 9.7 Mg ha-1 año-1 en las restantes y relativamente mésicas zonas áridas del país (Conafor- UACh, 2013). Con base en imágenes de satélite MODIS se encontró que las áreas agrícolas en el estado de Sonora tuvieron valores más altos de PPN (≥ 3.0 Mg ha-1, promedio 10 años) en comparación con la vegetación potencial nativa y que el matorral xerófilo tuvo los valores más bajos de PPN (≤ 1.0 Mg ha-1, promedio 10 años; Benítez, Yépez, Pérez-Ruíz, Garatuza y Encinas, 2011). Sin embargo, con un modelo calibrado con valores de NDVI y tasas de crecimiento de pasturas con arbustos del suroeste de Australia e imágenes de satélite LANDSAT y MODIS, Franklin et al. (2006) mostraron que la productividad aérea estimada de la vegetación nativa (2.64 Mg ha-1 año-1 en tierras planas; 5.78 Mg ha-1 año-1 en colinas) fue mayor a la del pastizal introducido de Pennisetum ciliaris (1.58 Mg ha-1 año-1) en la zona árida Sonorense y la PPN estuvo significativamente relacionada con la precipitación. En el matorral xerófilo de Baja California Sur, las mediciones de los índices NDVI e Índice Mejorado de Vegetación (EVI) de MODIS se correlacionaron con los valores de la producción bruta del ecosistema estimada con un sensor de CO2 en una torre de flujo turbulento (Huete et al., 2011). Mendez-Estrella et al. (2017) también usaron los valores de NDVI de MODIS como un índice de la productividad del matorral desértico de la región centro- norte de Sonora y encontraron que la productividad disminuyó gradualmente durante el periodo 2001-2012, posiblemente por el incremento en la temperatura del aire y la reducción de la precipitación anual observada en ese periodo. Por otro lado, la biomasa e índice de área foliar estuvieron linealmente relacionados con los valores de NDVI en pastizales de Bouteloua en el norte de Sonora (Cayrol et al., 2000). La biomasa y cobertura vegetal en zona de pastizal y matorral en el centro del país también estuvieron relacionados con el NDVI y otros índices espectrales de vegetación (Chávez-Castillo, Bolaños-González y Paz-Pellat, 2014). En el pastizal introducido de P. ciliaris en Sonora, se observó con el índice NDVI de imágenes MODIS que el periodo con mayor entrada neta de C coincidió con el pico de desarrollo fenológico del pastizal en el verano (Hinojo-Hinojo et al., 2016). La diferencia en NDVI de julio a noviembre usada como estimador del desarrollo del dosel estuvo linealmente relacionada con la cantidad de precipitación en el matorral sarcocaulescente de Baja California (Bell, Menzer, Troyo-Diéquez y Oechel, 2012). Considerando la información anterior, se observa que los valores de PPN en la región norte de las zona áridas Sonorense y Chihuahuense de México son similares a los valores hallados por Le Houérou (1984; en Smith, Monson y Anderson, 1997) para el Desierto Sonorense (0.52 Mg ha-1 año-1) y Chihuahuense (1.19 Mg ha-1 año-1) en Norteamérica. La PPN estimada para las comunidades áridas del mundo oscila entre 0.03 Mg ha-1 año-1 y 8.16 Mg ha-1 año-1, correspondiendo el valor más bajo a una comunidad de dunas de Namibia en un año seco (Seeley y Louw, 1980, en Hadley y Szarek, 1981) y el valor más alto a una comunidad que recibió agua de escorrentía en un arroyo en la zona árida Chihuahuense en Norteamérica en un año húmedo (Ludwig and Smith, 1978, en Hadley y Szarek, 1981). Para las zonas áridas relativamente más mésicas del país, los valores de PPN están dentro del intervalo de valores de la PPNA del bosque tropical caducifolio de la región de Chamela, Jalisco (6.11 Mg ha-1 año-1 - 8.08 Mg ha-1 año-1; Martínez-Yrízar, Maass, Pérez-Jímenez y Sarukhán, 1996) y bosques tropicales secos del mundo (6 Mg ha-1 año-1 - 16 Mg ha-1 año-1; Murphy y Lugo, 1986).
Para estimar la productividad primaria neta subterránea o bajo el suelo (PPNB) se ha considerado la diferencia entre periodos en la biomasa radicular extraída directamente de monolitos de suelo o trampas para raíces, considerando de 0 cm a 30 cm de profundidad. Las trampas para raíces consisten en tubos de PVC perforados con suelo sin raíces que son enterrados por cierto periodo de, por ejemplo, dos meses. Así como en México, las estimaciones de la PPNB de los ecosistemas desérticos también son escasas a escala mundial. La PPNB promedio para dos matorrales xerófilos de la zona árida Hidalguense fue 3.3 Mg ha-1 año-1, e.e. = 0.51 Mg ha-1 año-1 (Tabla 1). Ese valor contrasta con la PPNB casi nueve veces menor estimada para la zona árida Poblana. Es posible que la diferencia en la PPNB entre los matorrales hidalguenses y poblanos se explique en parte por la técnica utilizada. En la zona árida Hidalguense la PPNB se estimó de la diferencia entre los valores máximo y mínimo de la biomasa radicular cosechada entre periodos, mientras que en la Poblana se estimó con la cosecha periódica de las raíces que penetraron cilindros perforados. Por lo tanto, las metodologías utilizadas en las estimaciones de biomasa en los ecosistemas es un tema que requiere mayor atención de estudio en México. Por otro lado, la PPNB de un pastizal halófilo de la zona árida Chihuahuense fue dos veces más alta que la de los matorrales hidalguenses. La PPNB de los matorrales de la zona árida Hidalguense están en el ámbito de valores de los matorrales desérticos fríos de Utah (1.86 Mg ha-1 año-1 - 4.43 Mg ha-1 año-1; Caldwell y Camp, 1974). El conocimiento de la PPNB es, en general, uno de los vacíos de información más importantes para el entendimiento de los flujos de carbono en los ecosistemas. Aunque existen evaluaciones globales de la biomasa de raíces a nivel ecosistémico (Jackson et al., 1997; Norby y Jackson, 2000), aún se carece de estimaciones mundiales de la PPNB. El uso de nuevos métodos como rizotrones, aproximaciones estructurales y la generación de bases de datos globales podrían generar avances significativos en las estimaciones de la PPNB (Jackson et al., 2001; McCormac et al., 2015; Iversen et al., 2017).
Producción de hojarasca y su descomposición
En los estudios revisados sobre producción de hojarasca en las zonas áridas mexicanas, la metodología consistió en utilizar trampas de hojarasca, siguiendo un protocolo estándar, para la colecta de hojas, ramas delgadas, flores, frutos, semillas e insectos muertos que caen de la vegetación al suelo. Los estudios se centraron en el componente fino (“fine litterfall”) que incluyó, además del componente foliar y reproductivo, fragmentos de ramas y ramitas con un diámetro menor a 1 cm, por lo que no se tiene conocimiento sobre la entrada al suelo de la biomasa muerta de ramas gruesas y troncos. La superficie de colecta de las trampas ha oscilado entre 0.0025 m2 y 1.0 m2, el número de trampas por sitio entre 7 y 100 y las muestras han sido colectadas de las trampas cada 30 o 15 días durante un lapso de 1 a 3 años. Una fuente de variación a tomar en cuenta en la estimación de la producción de hojarasca es la técnica de muestreo. Con trampas de 10 cm y 18 cm de diámetro posicionadas a nivel del suelo, en el área de captura de la hojarasca se obtuvo una producción anual de hojarasca de 3.34 Mg ha-1 año-1 y 3.61 Mg ha-1 año-1, respectivamente, mientras que con trampas de mayor diámetro (0.5 m) pero a una altura de 1 m se obtuvo un valor de 2.77 Mg ha-1 año-1 en la zona árida Sonorense (Búrquez et al., 1999).
La producción de hojarasca ha sido medida en 12 estudios y 16 sitios distribuidos en las zonas áridas Sonorense, Chihuahuense, Tamaulipeca y Poblana. La producción promedio de hojarasca en las zonas áridas de México fue 2.85 Mg ha-1 ano-1, e.e. = 0.640 Mg ha-1 ano-1 (excluyendo el sitio del matorral mediterráneo de la zona árida Sonorense debido a que la hojarasca se colecto directa mente del suelo en dos ocasiones y se promediaron los valores registrados en diferentes años para los mismos sitios del estudio del MET; Suplemento 3). Si la biomasa de las hojas y tallos de la hojarasca contiene 44.6% de carbono (Suplemento 2), la entrada anual de carbono por flujo de hojarasca a los ecosistemas desérticos mexicanos fue 1.27 Mg ha-1 año-1. Los valores más altos (6.52 Mg ha-1 año-1) de producción de hojarasca se registraron en la zona árida Tamaulipeca, mientras que los más bajos (0.20 Mg ha-1 año-1) en la zona más árida Sonorense. Los valores más bajos de producción anual de hojarasca en los desiertos han sido registrados para el Desierto de Mojave (0.194 Mg ha-1 año-1, en 1975; Strojan, Turner y Castetter, 1979) y los desiertos fríos de Artemisia tridentata (0.15 Mg ha-1 año-1) en los Estados Unidos. En contraste, para comunidades arbustivas perennifolias con clima mediterráneo y desiertos fríos de ese país, se encontró un valor más alto, de 7.83 Mg ha-1 año-1 (Ehleringer y Mooney, 1982). En los desiertos de México la producción anual promedio de hojarasca estuvo significativamente asociada con la precipitación promedio anual (Fig. 3a), pero no estuvo correlacionada con la temperatura promedio anual, ni con la latitud. La producción de hojas, como en la mayoría de los ecosistemas terrestres, fue el componente que más contribuyó a la producción anual de hojarasca de los desiertos mexicanos (Suplemento 3). Por lo anterior, no fue sorprendente encontrar que la producción de hojas en la hojarasca y la producción de hojarasca estuviesen significativamente relacionadas (Fig. 3b).
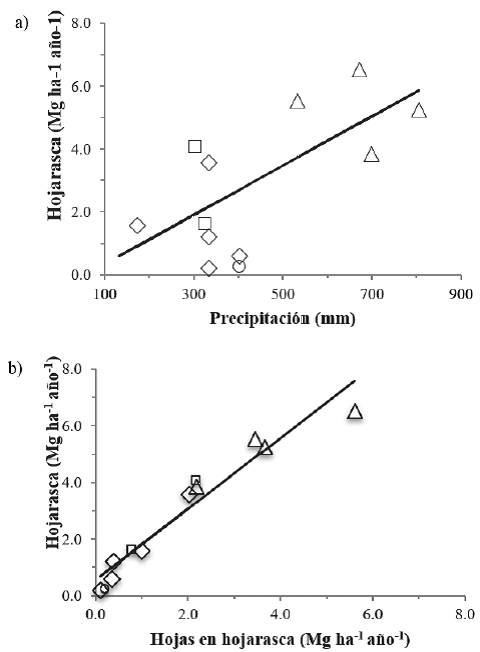
Los datos se ajustaron significativamente a los modelos de regresión lineal: producción de hojarasca (Mg ha-1) = -0.455467 + 0.0078571 × Precipitación (mm), r2 = 0.56, P < 0.0001, n = 12; producción de hojarasca (Mg ha-1) = 0.5615294 + 1.2519858 × producción de hojas en hojarasca (Mg ha-1), r2 = 0.93, P < 0.0001, n = 12.
Figura 3 Relación entre la producción de hojarasca con la precipitación media anual (a) y con la producción de hojas en la hojarasca en (b) en matorrales xerófilos de las zonas áridas Sonorense (rombo), Chihuahuense (cuadro), Tamaulipeca (triángulo) y Poblana (círculo).
Un modelo similar de regresión lineal entre la producción de hojarasca y la producción de hojas en la hojarasca fue registrado para los ecosistemas terrestres a escala global (producción de hojas en hojarasca (Mg ha-1 año-1) = 0.20006 + 1.38425 × producción de hojarasca (Mg ha-1 año-1); r2 = 0.86 (Meentemeyer, Box y Thompson, 1982). En las zonas áridas de México la producción de la hojarasca es marcadamente estacional y su magnitud depende principalmente de la cantidad de lluvia durante la época de crecimiento, normalmente concentrada en el verano, incluyendo el mozón del noroeste de México, que tiene una fuerte influencia en la dinámica de la vegetación y su productividad (Méndez-Barroso, Vivoni, Watts y Rodríguez, 2009). El estrés hídrico durante la sequía ocasiona la caída de las hojas, pero los eventos de lluvia en la época de crecimiento pueden disparar la producción de varias cohortes de hojas y ocasionar la abscisión de las hojas viejas. Sin embargo, la caída de hojarasca durante la época de crecimiento es mínima. Las temperaturas frías cercanas al punto de congelación ocasionaron el desprendimiento de las hojas en un matorral espinoso de la zona árida Tamaulipeca (González-Rodríguez et al., 2008). En una plantación con especies leñosas del MET se encontró que la relación entre la biomasa foliar y la hojarasca foliar dependió de la especie y de la estación (Ngangyo-Heya et al., 2017). Por otro lado, en un matorral con cactáceas columnares en la zona árida Poblana algunas especies suculentas producen y tiran sus flores regularmente en cierta época del año independientemente del patrón de lluvias (Pavón, Briones y Flores, 2005). Al depender de la productividad primaria, la producción de hojarasca varía espacialmente con la productividad de los sitios. En sitios planos y abiertos -y relativamente menos productivos en el desierto sonorense-, la producción de hojarasca fue solamente de 0.6 Mg ha-1 año-1, pero en un sitio cercano con mayor cobertura vegetal en los cauces de un arroyo de curso temporal la producción fue de 3.57 Mg ha-1 año-1 (Martínez-Yrízar, Nuñez, Miranda y Búrquez, 1999), muy cercana a la producción de hojarasca de los bosques tropicales caducifolios (Martínez-Yrízar et al., 2000).
A pesar de la extensión y enorme variedad de ecosistemas áridos y semiáridos de México y la relevancia del proceso de descomposición en el ciclo del C y la fertilidad del suelo, son contados los estudios que hayan examinado la degradación y el destino de la hojarasca una vez que ingresa al suelo. En general, ha predominado en la literatura científica el interés de analizar el patrón temporal de la descomposición y los factores que controlan el proceso en las condiciones altamente heterogéneas en estos ambientes. Se ha analizado la contribución relativa de la descomposición biótica (microflora y fauna del suelo) y la abiótica (fotodegradación), vía el efecto de la radiación UV que es particularmente intensa en los desiertos. A este respecto, un solo trabajo en México ha examinado la contribución relativa de estos dos agentes de descomposición en dos zonas climáticamente contrastantes, mostrando que factores como el intemperismo físico (oxidación fotoquímica) es responsable de la mayor pérdida de los residuos orgánicos en el ambiente árido (Montaña et al.,1988). La calidad de la hojarasca (por ejemplo, cocientes C:N, lignina:N), las condiciones particulares donde ocurre la descomposición en el desierto (p.ej. áreas expuestas vs. protegidas de la insolación) y el patrón de lluvia de corto plazo (p.ej. lluvias de verano) son los factores que mayormente explican los patrones de descomposición foliar observados en las zonas áridas Sonorense y Tamaulipeca (Arriaga y Maya 2007; Martínez-Yrízar et al., 2007; Marmolejo, Cantú y Gutiérrez, 2013). Sin embargo, se ha encontrado que, además de la fotodegradación, las termitas tienen una participación significativa en la descomposición en las áreas de suelo del desierto desprovistas de vegetación (Martínez-Yrízar et al., 2007). Estos estudios han utilizado bolsas de malla en las que se confina una cantidad conocida de hojarasca, se colocan sobre o bajo la capa de hojarasca y se van retirando a intervalos regulares para estimar la tasa de pérdida del material en función del tiempo. En general, se ha encontrado que la tasa descomposición anual de hojarasca es más lenta (intervalo 0.001 - 0.44; Montaño et al., 2016) que ecosistemas mésicos, pero en las fases iniciales, bajo condiciones de humedad durante el verano, hay una rápida pérdida de material que disminuye con el tiempo. Otros enfoques de estudio han sido analizar el potencial microbiano del suelo y la mineralización de carbono mediante experimentos de incubación de suelo (Núñez, Martínez-Yrízar, Búrquez y García-Oliva, 2001; Reyes-Reyes et al., 2003) para determinar el aporte de C de la hojarasca de distintas especies y distribuir en el suelo secciones de brazos de cactus para analizar la contribución de las larvas de insectos (Copestylum) en la inmovilización de nutrientes y en la velocidad de descomposición (Martínez-Falcón, Marcos-García, Moreno y Rotheray, 2012), o bien añadir hojas directamente bajo la copa de especies selectas mostrando que la mineralización de este material incrementa la materia orgánica y el contenido de N en el suelo (Herrera-Arreola, Herrera, Reyes-Reyes y Dendooven, 2007).
Respiración del suelo
El flujo de CO2 del suelo a la atmósfera se debe a la respiración heterótrofa de la microbiota y fauna del suelo y a la respiración autótrofa de las raíces (Weathers et al., 2013). Cueva-Rodríguez et al. (2016) mencionan que los factores controladores de la variación espacial y temporal de la respiración del suelo son la humedad del suelo, temperatura (cuando la humedad del suelo no es limitante), fotosíntesis y disponibilidad y calidad de la materia orgánica, además de la composición de la biota del suelo, las características físicas y nutrimentales del suelo y características heterogéneas intrínsecas de los procesos biogeoquímicos del suelo en el espacio y el tiempo. Cueva-Rodríguez, Yépez, Garatuza- Payan, Watts y Rodríguez (2012); Leon et al. (2014) y Robles-Zazueta, Yépez, Rodríguez, Garatuza-Payan y Watts (2014) estimaron el flujo de CO2 por respiración del suelo a la atmósfera con la técnica de medición in situ de CO2. Cueva-Rodríguez et al. (2012) hallaron valores mínimos y máximos de 0.52 g C m-2 d-1 y 9.43 g C m-2 d-1 de respiración del suelo para un matorral subtropical en el desierto Sonorense. Para este mismo sitio, Robles-Zazueta et al. (2014) encontraron valores mínimos y máximos de 0.01 g C m-2 d-1 y 3.31 g C m-2 d-1 de respiración edáfica y mostraron que la variación estuvo controlada por los pulsos de la precipitación durante la estación lluviosa. Asimismo, Leon et al. (2014) encontraron valores mínimos y máximos de 0.41 g C m-2 d-1 y 2.18 g C m-2 d-1 de respiración de suelo para un matorral mediterráneo en Baja California y observaron que la variabilidad espacial se relacionó con la humedad del suelo y la acumulación de mantillo, siendo el primer factor el principal controlador del flujo de CO2. Como fue señalado por Cueva-Rodríguez et al. (2016), las tres investigaciones anteriores muestran la importancia de considerar otros controladores de la respiración edáfica cuando la humedad del suelo no es limitante en los ecosistemas desérticos, tales como la variabilidad espacial y el efecto de la vegetación. La técnica más empleada en México para la medición del flujo de CO2 solamente ha incluido a la respiración heterótrofa de la microbiota del suelo bajo condiciones de laboratorio (Cueva-Rodríguez et al., 2016). El flujo microbiano de CO2 ha sido estimado como la tasa neta potencial de mineralización de carbono (TNPMC) con la técnica de trampas de NaOH (Coleman et al., 1978). En las zonas áridas mexicanas, la TNPMC promedio fue 28.4 μg C g-1 d-1, e.e. = 5.44 (11 sitios, Suplemento 4). Los valores más bajo se registraron en Cuatro Ciénegas, Coahuila y Mapimí, Durango, en la zona árida Chihuahuense, mientras el valor más alto se registró para suelo bajo costras biológicas en la zona árida Poblana (Montaño et al., 2016). En coincidencia con los resultados sobre la respiración del suelo in situ documentados por Cueva-Rodríguez et al. (2016), los estudios sobre la TNPMC en los suelos de las zonas áridas de México muestran que la disponibilidad de agua es un factor controlador muy importante de la respiración microbiana (Fig. 4a), además de la fertilidad del suelo (Fig. 4b, c). La TNPMC estuvo asociada positivamente con la cantidad de lluvia y la concentración de C y N en el suelo, pero no con la temperatura del aire, pH y concentración de P (Fig. 4a, b, c). La ausencia de correlación de la TNPMC con la temperatura del aire también ha sido evidenciada en estudios de respiración de suelo a escala mundial (ver Cueva-Rodríguez et al., 2016). La relación de la TNPMC con el C puede explicarse porque este último es el principal recurso energético para la actividad heterótrofa (Plante y Parton, 2007). Mientras que la relación de la TNPMC con el N podría deberse a que el proceso de mineralización de C conserva parte del N en el suelo en forma de amonio, que es desechado por la microbiota heterótrofa del suelo como consecuencia de la descomposición de la materia orgánica (Paul y Clark, 1996). Lo anterior sugiere la existencia de relaciones entre el flujo de CO2 del suelo a la atmósfera en condiciones de relativamente alta concentración de C y N. Sin embargo, la relación altamente significativa de la TNPMC con la precipitación respalda que la disponibilidad de agua es esencial para el proceso de mineralización de C y de respiración del suelo (Cueva-Rodríguez et al., 2016). Cabe mencionar que en el matorral semiárido Mediterráneo de Baja California, Leon et al. (2014) observaron con cámaras de suelo conectadas a un sistema de análisis de gases en infrarrojo que el flujo de CO2 de las raíces y microbios del suelo estuvo determinado principalmente por la precipitación. Leon et al. (2014) también observaron que el flujo de CO2 estuvo asociado con el contenido volumétrico de agua en el suelo durante la estación seca, pero estuvo relacionado con la distribución espacial de la biomasa radicular e índice de área foliar durante la estación húmeda. White II, Welty-Bernard, Rasmussen y Schwartz (2009), en un sitio en la zona árida Sonorense localizado fuera de los límites mexicanos, encontraron que el tipo de vegetación ejerció un fuerte control en la respiración microbiana del suelo. Con base en lo anterior, es recomendable que los estudios futuros de respiración del suelo y de mineralización de C incluyan las características de la vegetación.

Los datos se ajustaron significativamente a los modelos de regresión lineal: TNPMC (μ g C g-1 día-1) = -17.81214 + 0.1251066 × Precipitación (mm), r2 = 0.79, P = 0.006, n = 10. TNPMC (μ g C g-1 día-1) = 9.29614468 + 12.454481 × Nitrógeno (mg g-1), r2 = 0.51, P = 0.0021, n = 10; TNPMC (μ g C g-1 día-1) = 4.6135148 + 1.3254543 × Carbono (mg g-1), r2 = 0.45, P = 0.0335, n = 10.
Figura 4 Relación entre la tasa neta potencial de mineralización de carbono (TNPMC) con la precipitación (a), contenido de nitrógeno (b) y carbono (c) en matorrales xerofilos de las zonas áridas Sonorense (rombo), Chihuahuense (cuadro), Hidalguense (asterisco) y Poblana (circulo).
Conclusiones
A pesar de su extensión y diversidad, pocos han sido los estudios sobre la biomasa y productividad primaria aérea y subterránea de los ecosistemas de las zonas áridas mexicanas. Aun así, con la información disponible aquí presentada se pudieron identificar gruesamente los principales rasgos de la dinámica del C de las zonas Sonorense, Chihuahuense, Tamaulipeca, Hidalguense y Poblana. La magnitud de los valores de biomasa, productividad primaria y producción de hojarasca sitúan a los ecosistemas de las zonas áridas mexicanas en un lugar intermedio entre los desiertos del suroeste de los Estados Unidos y el bosque tropical caducifolio de México. Los factores ambientales que controlan la productividad primaria y la transferencia de carbono de la vegetación al suelo y atmósfera en las zonas áridas mexicanas son similares a los observados para ecosistemas similares limitados por agua en otras regiones del mundo. Es urgente un mayor número de estudios para mejorar nuestro entendimiento del proceso de asimilación de carbono, producción de biomasa y transferencia de materia y energía en las zonas áridas mexicanas, cuya sensibilidad/resiliencia al cambio de uso de suelo y otras presiones persistentes de cambio global es aún incierta.











 nueva página del texto (beta)
nueva página del texto (beta)


