Introducción
Los muérdagos son considerados los agentes biológicos de mayor destrucción entre los bosques templados de coníferas (Geils, Cibrián y Moody, 2002). El género Arceuthobium (muérdago enano) parasita coníferas de interés comercial, causando pérdidas económicas en la producción maderable en diversas regiones en Canadá y Norte América (Hawksworth y Wiens, 1996; Reid y Shamoun, 2009; DeBruyn, Paetkau, Ross, Godfrey y Friedman, 2015). Durante el parasitismo el sistema endofítico crece y se desarrolla internamente en las ramas del hospedero, una vez que la infección se establece (dos a cinco años) emergerán los primeros brotes jóvenes donde la infección secundaria se intensifica rápidamente (Hawksworth y Wiens, 1996; Worrall y Geils, 2006). La infección reduce las tasas de crecimiento, fecundidad y transpiración; limitando la capacidad fotosintética del hospedero (Press y Phoenix, 2005; Mathiasen, Nickrent, Shaw y Watson, 2008).
El proceso de infestación se conoce como ascendente en el dosel (Hawksworth y Wiens, 1996), por lo que la densidad forestal juega un papel importante; en bosques densos la producción de brotes es suprimida por la falta de luz (Muir, Robinson y Geils, 2004). En contraste, la baja densidad arbórea estimula el desarrollo de los brotes aéreos debido a una menor competencia por los nutrientes y agua disponibles en el suelo, así como por la energía luminosa (Bickford, Kolb y Geils, 2005). El desarrollo del muérdago enano puede verse comprometido por acciones antropogénicas (manejo forestal y perturbación), alteraciones naturales (factores ambientales e incendios forestales) y características propias del bosque (edad y talla de los árboles), limitando la captación de recursos obtenidos del hospedero (Watson, 2001).
Entre las investigaciones sobre el manejo de muérdago enano se encuentran la aplicación de controles químicos que causan abscisión de brotes y la muerte foliar en un periodo de 15 a 45 días (Coria, Vázquez, Muñoz y Villa, 2010) o el control biológico con hongos fitopatógenos que atacan la corteza y el sistema endofítico, logrando reducir la producción de brotes y semillas (Askew, Shamoun y van der Kamp, 2011; Martin, Friedman y Phillips, 2012). Por otra parte, la implementación de prácticas silvícolas como los incendios prescritos (Concklin y Geils, 2008), los clareos (Trummer, Hennon, Hansen y Muir, 1998) y la combinación de quemas y clareo (Hessburg, Povak y Brion, 2008) han logrado reducir hasta 20% de árboles infestados por muérdago enano. Sin embargo, los incendios pueden afectar el vigor de los árboles siendo más susceptibles al ataque de otras plagas y enfermedades (Hawksworth y Wiens, 1996). Se ha observado que las podas han reducido el porcentaje de árboles infestados por muérdago en abetos (Maffei et al., 2016); o bien disminuir la propagación e intensificación del muérdago enano (Shaw y Agne, 2017).
En México los muérdagos representan la segunda causa de daño forestal después de los incendios (Hawksworth, Wiens y Geils, 2002). De acuerdo con la Secretaría de Medio Ambiente y Recursos Naturales (Semarnat) en el periodo 1990-2011 el promedio anual de la superficie afectada por plagas y enfermedades forestales en el país fue de 38 640 ha, de las cuales 13 910 ha (36%) corresponden a los muérdagos. Las acciones realizadas por el Programa de Conservación y Restauración de Ecosistemas Forestales (Procoref) coordinado por la Comisión Nacional Forestal (Conafor), incluyen el diagnóstico fitosanitario y posterior tratamiento a través de las labores de sanidad forestal (Semarnat, 2013).
En el Estado de México la Protectora de Bosques del Estado de México (Probosque), a través del programa de detección y combate de plagas realizó saneamientos en 651.5 ha durante el periodo 2000-2003 (Collado y Serrato, 2009). Dichos saneamientos también se han llevado a cabo en Áreas Naturales Protegidas como es el Nevado de Toluca, donde se tiene registro de la presencia de las especies Arceuthobium vaginatum (Willd.) Presl. y A. globosum (Hawksw. y Wiens) en los bosques de Pinus spp. (Franco, Endara, Regil y Nava, 2009). Durante el periodo 2009-2013 Probosque realizó la poda de ramas verdes para el control de muérdago enano en 175 ha de bosques de Pinus hartwegii (Lindl.) (Probosque, 2014); más de 70% de la superficie tratada se ubican en la ladera norte del área natural protegida. Sin embargo, la eficiencia de los tratamientos no ha sido evaluada.
Objetivos
El objetivo fue determinar el efecto de las podas sobre las poblaciones de Arceuthobium spp. del área natural protegida Nevado de Toluca, México.
Materiales y métodos
Área de estudio
El estudio se llevó a cabo dentro del área natural protegida Nevado de Toluca (NT) localizada en los 18°51’31’’ y 19°19’03’’ latitud Norte y 99°38’54’’ y 100°09’58’’ longitud Oeste (Rojas, Valdez, Mireles, Reyes y Pastor, 2007), en los ejidos San José Contadero y Santa María del Monte (Fig. 1) ubicados en la ladera Norte (altitud promedio de 3700 m) dentro del municipio de Zinacantepec. Los bosques de pino (Pinus spp.) predominan arriba de los 2900 m de altitud, el clima es semifrío subhúmedo C (E) wig (2800 m - 3700 m snm) con una temperatura media anual entre -2 ºC y +7 ºC, lluvias en verano y una precipitación media anual de 1000 mm (González et al., 2007).
Diseño de muestreo
Se procedió a un muestreo estratificado dirigido considerando como estratos los rodales tratados y no tratados, la muestra para cada estrato fue proporcional en cada tipo de bosque considerado, por lo tanto, en bosque semidenso se seleccionaron seis parcelas con poda y cinco sin poda, mientras que en bosque denso la superficie tratada fue mayor, por lo que se seleccionaron nueve parcelas con poda y siete sin poda. El tamaño de la muestra se obtuvo siguiendo las fórmulas propuestas por Hernández, Fernández-Collado y Baptista (2006); las parcelas fueron circulares de 1000 m2 (Flores, Rodríguez, Meléndez y Rosas, 2008), separadas entre sí 100 m y ubicadas en sitios con baja perturbación.
Monitoreo de variables
Las evaluaciones se realizaron durante los meses de mayo a junio de 2013, 2014 y 2015. En cada una de las parcelas se registró el diámetro normal (DN) ≥ 2.5 cm de todos los árboles con una altura (A) ≥ 1.5 m; los individuos menores se registraron y solo se diferenciaron las plántulas (A < 0.3 m). Esta información se utilizó para determinar la densidad forestal, así como la distribución horizontal. Asimismo, se registró la presencia y ausencia de muérdago enano para determinar el porcentaje de árboles infestados y su distribución por grado de infección. La severidad de la infección se determinó de acuerdo con el método propuesto por Hawksworth (1977). Este sistema se basa en la estimación visual de la intensidad de la infección en la copa, la cual se divide en tres secciones verticales (alta, media y baja); para cada una se determina la intensidad: 0 = infección no visible, 1 = < 50% de ramas infectadas y 2 = >50% de ramas infectadas. La intensidad de infección para cada tercio se suma para determinar el grado de infección para el árbol: 0 = nulo, 1-2 = leve, 3-4 = moderado y 5-6 = severo.
Análisis estadístico
Para las variables DN, A, porcentaje de árboles infestados y grado de infección, se efectuó la prueba de normalidad y homogeneidad de varianza Kolmogorov Smirnov. Debido a la distribución de los datos se eligieron los análisis no paramétricos de Friedman para k muestras relacionadas, para determinar las diferencias entre los años de evaluación por tratamiento y entre tratamientos para ambos tipos de bosque (p < 0.05). Los análisis fueron realizados mediante el paquete estadístico SPSS® v. 20.0. (IBM, 2011) para Windows 7.
Resultados y discusión
Características de los bosques
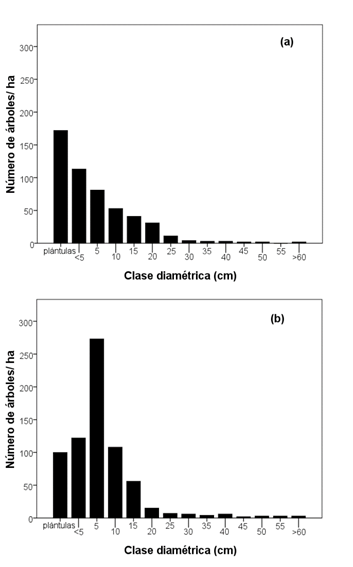
La población del bosque semidenso fue de 233 árboles/ha; la distribución de los valores de DN de los árboles muestra que las plántulas y los individuos de categoría < 5 comprenden 54% de la población (Fig. 2a). Galeana-Pizaña, Ordoñez-Díaz y Corona-Romero (2013) sugiere que este tipo de distribución diamétrica corresponde a un proceso de sucesión dirigida de individuos en etapas de regeneración avanzada, resultado de las campañas de reforestación como se ha observado en bosques de Abies religiosa (Kunth Schltdl. Et Cham.) y Pinus hartwegii (Lindl.). En el bosque denso la población arbórea fue de 486 árboles/ha, la distribución de diámetros indica que la media de los individuos se encuentra en la clase diamétrica de 5 cm (Fig. 2b), sugiriendo una sucesión secundaria correspondiente a un estado de regeneración activa de individuos del género Quercus spp y P. pseudostrobus Lindl. que han sobrevivido a incendios (Alanís-Rodríguez et al., 2011).
En bosques semidensos la media del diámetro normal y altura de la población de pinos podados fue 80% y 56%, respectivamente, mayor que el valor correspondiente a los individuos sin poda; mientras que en los bosques densos las podas solo promovieron 40% de incremento en el diámetro normal y 27% de incremento en altura (Tabla 1). Las diferencias estadísticas (p < 0.05) en la talla muestra que la reducción en la biomasa de la copa por efecto de la poda reactiva la capacidad fotosintética (Amateis y Burkhart, 2011), reduce la competencia de requerimientos nutrimentales entre la copa y el tallo, lo que favorece el crecimiento y desarrollo de los árboles.
Evaluación del efecto de las podas
En los bosques con podas se registró un promedio de 4.7% de árboles infestados para bosque denso y de 12.1% para bosque semidenso (Tablas 2 y 3), y en ambos casos los resultados no presentaron diferencias estadísticas (p < 0.05) durante los tres periodos de evaluación (Tablas 2 y 3); esto indica que el tratamiento tiene efecto positivo al menos durante el periodo evaluado. Los resultados demuestran que la poda es más efectiva que las quemas prescritas, los clareos y la combinación de quemas y clareos las cuales reducen el porcentaje de infestación por muérdago de 79.5% hasta 14.1% (Trummer et al., 1998; Concklin y Geils, 2008; Hessburg et al., 2008). Además, estos tratamientos han mostrado un efecto temporal de solo cinco años, a partir de los cuales se observa un incremento de 24% de infestación y hasta 76% en 14 años. En contraste, los resultados del presente estudio muestran que durante los tres años de evaluación solo hubo un incremento de hasta 2% de infestación (Tablas 2 y 3).
Tabla 2 Distribución del grado de infección en bosque semidenso.
| Evaluaciones por tratamiento |
Porcentaje de árboles por grado de infección* | |||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | ||
| Poda | ||||||||
| 1 | 81.9 | 4.2 | 4.2 | 1.4 | 6.9 | 0.0 | 1.4 | |
| 2 | 86.0 | 3.5 | 4.7 | 1.2 | 1.2 | 1.2 | 2.3 | |
| 3 | 95.7 | 4.3 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | |
| Sin Poda | ||||||||
| 1 | 43.7 | 23.0 | 21.8 | 4.6 | 0.0 | 0.0 | 6.9 | |
| 2 | 37.3 | 13.3 | 15.7 | 12.0 | 6.0 | 2.4 | 13.3 | |
| 3 | 27.6 | 13.8 | 13.8 | 3.4 | 17.2 | 0.0 | 24.1 | |
*0 = sano; 1 y 2 = leve; 3 y 4 = moderada; 5 y 6 = severa.
Tabla 3 Distribución del grado de infección en bosque denso.
| Evaluaciones por tratamiento |
Porcentaje de árboles por grado de infección* | |||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | ||
| Poda | ||||||||
| 1 | 86.7 | 5.7 | 3.0 | 1.8 | 0.6 | 0.3 | 1.8 | |
| 2 | 96.0 | 0.9 | 0.9 | 0.9 | 0.0 | 0.0 | 0.9 | |
| 3 | 96.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 4.0 | |
| Sin Poda | ||||||||
| 1 | 28.4 | 12.7 | 10.6 | 7.5 | 2.8 | 1.3 | 36.7 | |
| 2 | 43.8 | 13.5 | 20.2 | 10.1 | 4.5 | 0.0 | 7.9 | |
| 3 | 42.4 | 11.8 | 18.8 | 10.6 | 2.4 | 2.4 | 11.8 | |
*0 = sano; 1 y 2 = leve; 3 y 4 = moderada; 5 y 6 = severa.
Grado de infección en árboles no tratados
Los bosques no tratados presentaron diferencias estadísticas (p < 0.05) en los tres periodos de evaluación. Para el bosque semidenso el porcentaje de árboles infestados incrementó 16.1% (Tabla 2), debido a que la baja densidad arbórea estimula el desarrollo de los brotes aéreos y por ende la propagación del muérdago enano (Bickford et al., 2005). En contraste, el bosque denso registró una disminución en el porcentaje de árboles infestados (Tabla 3), debido a la inclusión de individuos en la categoría < 5 (32.2%) que no fueron considerados en la primera evaluación, ya que no cumplían con la talla (DN) y altura considerada para el presente estudio, sin embargo, en las subsecuentes evaluaciones se incorporaron.
El porcentaje de árboles infestados por muérdago enano es consistente con lo hallado en otros estudios realizados en bosques de Pinus hartwegii (Lindl.) del centro del país parasitados por A. globosum Hawksw. y Wiens y A. vaginatum (Willd.) Presl. (Hernández-Benítez, Cano-Santana, Castellanos-Vargas, 2005; Ramírez-Dávila y Porcayo-Camargo, 2010; Queijeiro-Bolaños y Cano-Santana, 2015). Por ejemplo, Ramírez-Dávila y Porcayo-Camargo (2010) señalaron como valor máximo 94.8% de árboles infestados por muérdago enano y como valor mínimo 69.6% en diez sitios de monitoreo en bosques de Pinus motezumae Lamb. en el Parque Nacional Nevado de Toluca, sin diferenciar sitios con o sin poda.
Los mayores porcentajes de árboles infestados en el bosque semidenso se presentan en los grados de infección 1, 2 (moderado) y 6 (severo) (Tablas 2 y 3), y este último representa un riesgo de infección latente debido a que se incrementa con la densidad, ya que se favorece la dispersión de las semillas a través del viento (Hawksworth y Wiens, 1996; Muir y Geils, 2002). Los menores porcentajes de árboles infestados tanto en bosques semidensos como en bosques densos se concentran en las categorías 3, 4 y 5, y corresponde a las fracciones I (alta) y II (media) de la copa del árbol. Lo anterior, se debe probablemente a que la radiación solar puede acelerar el desarrollo del muérdago y, por ende, su propagación, por lo que se ha sugerido que la densidad arbórea limita el desarrollo del muérdago y su propagación, ya sea por limitar la incorporación de luz o debido a la competencia por nutrientes dada por el mayor número de individuos. Lo anterior es consistente con el hecho de que el muérdago enano es una planta que necesita luz para su desarrollo. Muir, Robinson y Geils (2004) mencionan que en bosques densos el muérdago se distribuye hacia la parte alta de la copa, sin embargo, la producción de brotes en estos sitios es suprimido por la falta de luz y sus efectos en el hospedero son limitados.
Tanto en bosques semidensos como densos las clases diamétricas ≤ 20 cm fueron las más susceptibles a ser infestados por muérdago enano, ya que se presentaron todos los grados de infección (Fig. 3a y 3b). Esto refleja que las defensas en las coníferas dependen del estado ontogénico (Lorio, Stephen y Paine, 2004) y la fenología de la planta, siendo en las etapas juveniles la máxima competencia por los recursos para su desarrollo. Por ejemplo, Pinus pinaster Ait. es atacado por insectos durante las primeras etapas de vida (Chen, Kolb y Clancy, 2002); mientras que en etapas maduras los caracteres defensivos tienen gran trascendencia para garantizar su contribución en la siguiente generación (Sampedro, Moreira y Zas, 2011).
Conclusiones
Las podas son una estrategia que reduce la incidencia de muérdago enano y tiene un efecto permanente en el periodo evaluado tanto en el bosque semidenso como en el denso. Los árboles infestados de clase ≤ 20 son más susceptibles al ataque de muérdago enano y no tienen correlación con los grados de infección. La densidad arbórea limita el desarrollo del muérdago y su propagación porque limita la incorporación de luz y la competencia por nutrientes dada por el mayor número de individuos. Las categorías juveniles son más susceptibles a la infección que las categorías adultas debido al desarrollo de mecanismos de defensa especializados.











 text new page (beta)
text new page (beta)