Introducción
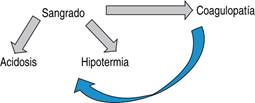
Por definición, la cirugía de control de daños se refiere a la culminación rápida de una cirugía después de controlar el sangrado que puede amenazar la vida y evitar la contaminación para después llegar a la corrección de las anormalidades fisiológicas y manejo definitivo, encaminado a evitar la tríada letal (Figura 1).1,2
El término “control de daños”, utilizado en la armada naval, tiene como significado “la capacidad de un barco militar de absorber un daño y continuar con la misión” de ahí deriva el término cirugía de control de daños, y el término resucitación de control de daños.3,4
Se ha demostrado que al combinarse ambos métodos de control de daños se obtiene una supervivencia aproximada de 60 a 90% en comparación con el uso de estos métodos por separado de 58%. Feliciano también demuestra una supervivencia de 90% en su serie de investigación.5,6
El dogma quirúrgico tradicional dicta que una operación debe ser completada definitivamente, independientemente de la condición fisiológica del paciente. En la guerra, víctimas del campo de batalla padecían lesiones exsanguinantes y eran sometidos a amputaciones por más de 100 años. Causando un tercio de las muertes, por trauma de los 6 millones que se reportan al año.7,8
Pringle describió la compresión del hilio hepático, para lesiones hepáticas severas, compresión digital de la tríada portal y empaquetamiento para frenar la hemorragia masiva en 1908. Halsted modificó esta técnica colocando hojas de caucho para empaquetar y proteger el parénquima hepático, se han reportado el uso de estos empaquetamientos perihepáticos desde los 70 y 80.9,10
Lucas y Ledgerwood en 1976 en el Hospital de Detroit, reportaron tres empaquetamientos en 637 lesiones de hígado. Feliciano reportó en los 80 supervivencia de 90% en 10 pacientes con lesiones hepáticas severas que se empaquetaron.3
Antecedentes históricos
El concepto moderno de laparotomía abreviada fue descrito por Stone en 1983 y el término de “control de daños” fue acuñado en 1993 por Schwab, en Filadelfia. Y hace referencia al control inicial rápido de la hemorragia y la contaminación, cierre abdominal temporal, reanimación en la Unidad de Cuidados Intensivos (UCI) y la relaparotomía subsecuente con reparación definitiva.3,7 Fue un término que popularizó Rotondo en 1990. Una revisión moderna de Shopiro identificó que en 1,000 pacientes con trauma abdominal se ha utilizado esta técnica.11
Durante los años 70 y 80 también se popularizó el uso de las UCI basado en la resucitación clínica manejando el síndrome de dificultad respiratoria aguda (SDRA), síndrome de respuesta inflamatoria sistémica (SIRS) y fallo orgánico múltiple (FOM) evitando la muerte temprana durante el postquirúrgico, alternativa que buscaban los cirujanos de trauma en los 80 identificando la tríada mortal y la definición definitiva de la cirugía de control de daños como se conoce en nuestros días. El manejo de los pacientes con un puntaje de gravedad de la lesión de al menos 30 puntos con la cirugía ortodoxa conllevaba una mortalidad superior a 70%. Fue con la cirugía de control de daños (CCD), en la década de 1990, que se alcanzó a reducir la mortalidad a 58-67%, a 33% en 2001, y hasta 10-27% para 2006.7,10
Baker en 1974 creó un método para describir al paciente con múltiples daños y evaluar la emergencia, llamado ISS (Injury Severity Score). La puntuación es la suma de las calificaciones más altas de las tres regiones corporales más afectadas, obteniendo un índice crítico. Tornetta resalta claramente la importancia del resultado del ISS como factor pronóstico de mortalidad; una calificación de 0 a 18 representa una mortalidad menor a 5%, de 19 a 30 la mortalidad es de 30%, y más de 30 puntos de 45%.1
Fisiopatología
La presencia de coagulopatía, hipotermia y acidosis metabólica, “tríada mortal”, fue descrita por primera vez por Burch en 1992.12 En un paciente gravemente lesionado conlleva un riesgo de mortalidad de hasta 90%.7 La hemorragia descontrolada y la terapia intravenosa iatrogenia resultan en el desarrollo de la traída letal, lo que conduce a un círculo vicioso que desencadena rápidamente la muerte.13
La presencia de coagulopatía se relaciona con una mortalidad de 28-46%.12 La resucitación intensa y rápida con fluidos intravenosos conllevan una dilución de los factores de coagulación, que afectan la cascada de coagulación y pueden causar un consumo de los mismos, desencadenando la coagulación intravascular diseminada. Aumenta la presión hidrostática intravascular, lo que lleva a desplazamiento de líquido, plaquetas y sangre, al espacio extravascular, lo que agrava la CID. Existe un desbalance entre el tromboxano y la prostaciclina que provoca una disfunción del sistema fibrinolítico y disfunción plaquetaria.14
La hipotermia se define como una temperatura corporal de 35 oC o menos durante más de cuatro horas15 y puede producir hipotensión, arritmias cardiacas, alteraciones hematológicas, respiratorias, renales y endocrinas. Es secundaria a la pérdida de fluidos por el trauma, por resucitación intensa con líquidos intravenosos, exposición del cuerpo por completo como lo define la revisión detallada del ATLS. También ocurre en casos de cirugías con incisiones extensas que provocan la evaporación de líquido intraperitoneal de las superficies expuestas.16,17
La hipotermia es un fenómeno que se observa en más de dos terceras partes de los pacientes con trauma y su efecto en la mortalidad se observó por primera vez en los casos con ruptura de aneurisma de la aorta abdominal, siendo de 91-100% en pacientes con temperatura menor de 32 oC y de 40-60% en aquéllos con temperatura de 32-35 oC.7 La mortalidad aumenta 10% si la temperatura cae por debajo de los 34 oC.18 Los principales efectos de la hipotermia son:
Disminución del gasto cardiaco.
Disminución de la frecuencia cardiaca.
Aumento de las resistencias vasculares periféricas.
Arritmias como bradicardia sinusal.
Disminución de la tasa de filtración glomerular.
Disminución de la absorción de Na+ en los túbulos renales.
Depresión del sistema nervioso central (SNC).
Disminución de la actividad fibrinolítica (coagulopatía).
La acidosis es un indicador de hipoxia tisular y es producida por isquemia y necrosis.14 La acidosis es de tipo metabólica y ocurre como resultado de la producción de lactato y el metabolismo anaerobio, si el defecto ácido-base no se corrige en por lo menos 48 horas la mortalidad llega a ser hasta de 86-100%.19 Al conducir el metabolismo anaerobio y a la síntesis de ácido láctico y otras sustancias citotóxicas, el aumento del lactato se correlaciona con la gravedad de la lesión e incluso el déficit de base puede utilizarse como un marcador de gravedad de la lesión y como predictor de los requerimientos de transfusión. La acidosis metabólica en el estado de choque puede exacerbarse a causa de un pinzamiento aórtico, uso de vasopresores, transfusiones masivas, trastornos del rendimiento miocárdico y reanimación con grandes volúmenes de cristaloides. De no corregirse la acidosis metabólica láctica por sí sola, tiene una mortalidad de 45-67%.20
Los efectos orgánicos se enlistan a continuación:
Disminución de la contractilidad del miocardio.
Disminución del inotropismo.
Disminución de la respuesta a catecolaminas.
Arritmias ventriculares.
Aumento de la presión intracraneal (PIC).
Prolongación del tiempo parcial de tromboplastina (TPT).
Disminución de la actividad del factor V de la coagulación.
Indicaciones para la cirugía de control de daños
A. Factores críticos fisiológicos: hipotermia demostrada, acidosis demostrada, con déficit de base > 8, coagulopatía demostrada por alargamiento del TP (tiempo de protrombina), trombocitopenia, requerimientos masivos de transfusiones (más de 10 unidades globulares), tiempo para reparación que exceda los 90 minutos, inestabilidad hemodinámica, con datos francos de hipoperfusión tisular.21
B. Lesiones asociadas complejas al trauma primario: trauma cerrado por alta energía con compromiso torácico, múltiples lesiones penetrantes en tórax, trauma abdominal severo, con trauma vascular mayor en el mismo paciente.22
C. Otras consideraciones: lesiones que pueden ser reparadas con mayor eficacia como con una embolización angiográfica, pacientes ancianos, o con otras comorbilidades.23-25
Estrategia del método de la cirugía de control de daños
El manejo inicial de los pacientes de trauma está basado en los principios del curso ATLS. Una evaluación sistemática del paciente enfocado en tratar las lesiones que amenazan la vida, para llevar a los pacientes que presentan lesiones que pueden ser corregidas por medio de cirugía, son llevados a la sala de operaciones inmediatamente.26 La selección de pacientes quienes se beneficiarían con la cirugía de control de daños, se basan en una gran constelación de lesiones, así como en el estado físico del paciente, los mejores candidatos son aquellos que presentan lesiones extensas que requieren largo tiempo quirúrgico, con inestabilidad hemodinámica, y lesiones exsanguinantes mayores.27,28
La estrategia del método para la cirugía del control de daños, se divide en varias etapas, se describen tres etapas principalmente, algunos autores describen 4 y hasta 5 etapas, tomando la convalecencia, y/o la reconstrucción definitiva de la pared abdominal.29 Como esta última etapa de la estrategia.
Etapa I
Esta etapa va desde el manejo pre hospitalario, también llamada etapa 0 hasta que el paciente es ingresado a quirófano y se toma de decisión de realizar cirugía de control de daños y ésta es concluida.30 Las lesiones abdominales que más frecuentemente requieren del manejo con cirugía de control de daños, son lesiones hepáticas severas hasta en 83% siendo más común lesión grado III31 y lesiones esplénicas y renales. Para lesiones que se pueden reparar está indicada la maniobra de Pringle hasta por 60 minutos, sin representar isquemia del parénquima que repercuta en la función hepática.32 El método primario para las lesiones abdominales hepáticas complejas es el empaquetamiento.33,34 Empaquetar el hígado se realiza usando una laparotomía y colocando compresas en el sitio del origen de la hemorragia, cuando la vena cava retrohepática se lesiona, el empaquetamiento se realiza anterior comprimiendo la vena cava por completo, otras lesiones del parénquima requieren empaquetamiento anterior y posterior, la meta es tamponar el sitio de sangrado, sin suprimir el flujo sanguíneo del parénquima hepático, se pueden colocar hojas plásticas sobre el parénquima para luego empaquetar con compresas, para evitar retirar los coágulos cuando se retire el empaquetamiento.35,36 El empaquetamiento es el método más usado en el manejo de las lesiones hepáticas mayores, las indicaciones para realizarlo son el tratamiento de la lesión hepática debido a la magnitud de otras lesiones intraabdominales, la presencia de coagulopatía relacionada con choque profundo o la naturaleza “irreparable” de la lesión hepática.26,37,38 El uso juicioso de los empaquetamientos en pacientes altamente seleccionados provee una supervivencia de 60-90%. Feliciano demostró una supervivencia de 90% en los años 80 en empaquetamientos hepáticos.39 La hemorragia hepática puede persistir en caso de mala aplicación de las compresas en torno al hígado o por la presencia de irregularidades en la herida (como ocurren en el trauma contuso). Además, el empaquetamiento se relaciona con algunas complicaciones, como son el desarrollo de fístulas biliares, biliomas y absceso hepático.16,20
Una vez controlada la hemorragia y la contaminación peritoneal, se debe realizar un cierre temporal del abdomen. Para ello, se pueden usar pinzas de campo, mallas, bolsas plásticas “bolsa de Bogotá”, cierre de la aponeurosis, hojas plásticas o de silicón y empaquetamiento al vacío, hojas pegadas con velcro, las cuales proporcionan una cubierta libre de tensión e impermeable del contenido abdominal para prevenir la pérdida de líquidos y la evisceración.16
Etapa II
La segunda etapa, también llamada de resucitación, va desde la conclusión del evento quirúrgico y el ingreso del paciente a la UCI para la estabilización fisiológica, hasta la decisión de la realizar la laparotomía definitiva. En la actualidad esta etapa también es conocida como resucitación de control de daños.20
La primera medida de corrección fisiológica, debe ser la recuperación de la temperatura corporal en un cuarto aislado con temperatura constante, soluciones tibias y cubiertas calientes o térmicas que mantienen el calor.40
Después se debe corregir la acidosis, lo cual se logra mejorando la demanda de oxígeno, y asegurando la perfusión tisular, los determinantes de la perfusión tisular son el gasto cardiaco, la hemoglobina y la saturación de oxígeno en la sangre arterial. Por lo tanto, la resucitación con hemoderivados es la ideal, evitando la acidosis hiperclorémica en este tipo de pacientes, la cual aumenta la mortalidad. La monitorización de la presión venosa central es el mejor parámetro para evaluar si la resucitación está siendo adecuada.39-41
La adecuada resucitación hasta este punto ayuda a la corrección de la coagulopatía, acompañado de la resucitación con plasmas frescos congelados, crioprecipitados y factores de coagulación como el factor VII, en el cual se ha encontrado mejora en la coagulopatía para casos sometidos a cirugía de control de daños.39,41
Etapa III
Esta etapa, también conocida como la cirugía definitiva, la cual se debe realizar cuando el paciente se encuentre fuera de la triada letal y sin riesgo de sufrirlo de nuevo, ya con las constantes vitales fisiológicas estables podrá entrar de nuevo a quirófano para la reparación definitiva de las lesiones y el cierre definitivo de la pared abdominal, preferentemente entre las 24 y 36 horas. Esta etapa no tiene un tiempo estándar para realizarse; sin embargo, se recomienda no exceder las 72 horas para su realización.39,41 Se ha reportado aumento de la mortalidad realizándola en las primeras horas después de la primera cirugía. Durante el procedimiento definitivo se completa la revisión en busca de las lesiones que pudieron pasar desapercibidas en la primera cirugía, se retira el empaquetamiento y se controlan sitios de sangrado y el cierre definitivo de la aponeurosis.42
Etapa IV
El concepto de cierre retardado de la pared abdominal se acredita a Stone y colaboradores, en el año de 1981, realizaron un estudio entre 167 pacientes, con una mortalidad aproximada de 85% en aquellos pacientes cuyo abdomen se cerró a tensión, comparado con 22% sólo en los que se decidió el cierre retardado.3 En algunas revisiones modernas ya se describe la etapa IV de resucitación después de la cirugía definitiva y describen la etapa V como de cierre definitivo, esto depende de las literaturas revisadas y del uso en cada centro hospitalario.43
Complicaciones
Las principales complicaciones dependen del sitio de lesión y del tipo de reparación realizada, o bien complicaciones sistémicas derivadas de la hemorragia, de la resucitación masiva o infecciones locales o intraabdominales, hasta el síndrome compartamental.44 Se ha descrito mayor número de complicaciones y peor pronóstico postoperatorio en pacientes con obesidad mórbida con índice de masa corporal (IMC) > 40.45
Una revisión de Rotondo identificó una mortalidad general de hasta 50% y morbilidad de 40% en 961 pacientes sometidos a cirugía de control de daños. Estos reportes señalan la mejoría en la supervivencia de los pacientes con cirugía abreviada que con un procedimiento convencional.46
Se identificó una mortalidad aumentada en casos de otras lesiones graves asociadas a trauma abdominal.47
Se ha comprobado que la adecuada resucitación en los primeros 15 minutos determina un factor de riesgo como predictor de supervivencia en casos que serán sometidos a cirugía de control de daños.10
La presencia de la tríada mortal se asoció a una mayor mortalidad con independencia del tipo de traumatismo.48
El síndrome compartamental abdominal descrito por Richardsson en 1976 resulta del incremento persistente en la presión intraabdominal (PIA), pudiendo ser de dos tipos: primario (causado por lesiones abdominales) y secundario (sin lesiones intraperitoneales). El trauma abdominal es la causa más frecuente de síndrome compartamental abdominal (SCA) primario, especialmente si se practica una laparotomía de control de daños. Los factores que predisponen a estos pacientes al aumento en la PIA son el empaquetamiento abdominal, sangrado por coagulopatía, edema intestinal por reanimación masiva con líquidos, aumento de volumen del intestino por lesiones vasculares mesentéricas, cierre de la aponeurosis y piel bajo tensión y contaminación extensa que resulta en íleo y distensión abdominales.49 La incidencia del SCA en trauma grave es de 14-33% de los pacientes con trauma que ingresan a la UCI.7,10
Una vez desarrollado el SCA, la mortalidad asociada oscila entre 63-72%.7
“El éxito de la cirugía de control de daños depende del método disciplinado, el cual incluye decisiones del cirujano, control rápido y determinación.”
Material y métodos
Estudio descriptivo, retrospectivo y observacional que comprendió el periodo de 01 de enero 2015 al 01 de junio 2018. El grupo de pacientes fueron todos los que ingresaron al Hospital General de Querétaro a la terapia intensiva para cirugía de control de daños, se analizaron los expedientes clínicos de los pacientes recabando la información en Tablas recolectoras de datos y se determinó el número de pacientes que cumplieron los criterios de inclusión siguientes: pacientes con expediente clínico y que hayan entrado a terapia intensiva para proseguir con la tercera etapa de cirugía de control de daños y hayan terminado la cirugía.
Después de determinar el número de pacientes que cumplieron los criterios de inclusión, se revisaron detenidamente los expedientes para determinar qué pacientes no cumplieron los criterios al 100% excluyendo a los siguientes:
Pacientes con registro incompleto.
Pacientes cuyos cambios estén alterados por alguna otra enfermedad eventual como diabetes e hipertensión arterial.
Pacientes menores de 16 y mayores de 60 años de edad.
Se identificaron y analizaron el total de variables: Ph, el cual es una medida de acidez o alcalinidad de una solución, siendo una variable cuantitativa numérica; transfusiones sanguíneas, la cual hace alusión al número de concentrados eritrocitarios administrados, siendo una variable cuantitativa numérica; tiempos de coagulación, que se refiere a el tiempo en el que se obtiene la coagulación en la sangre extraída de los pacientes, es una cuantitativa numérica; la temperatura es una medida de calor dentro de un cuerpo expresado en grados, es una variable cuantitativa numérica; estancia en unidad de cuidados intensivos, que refiere al periodo en el que permanece un paciente en dicha unidad, es una variable cuantitativa numérica; hemoglobina, cantidad de hemoproteína que se encuentra en el cuerpo expresada en g/dl, siendo una variable cuantitativa numérica.
Se recopiló la información en Tablas de recolección de datos, para posteriormente vaciar los resultados en una base de datos en hoja de MS Excel y se analizó mediante el programa estadístico IBM SSPS 20.0, para la obtención de las variables a consideración, representando los resultados de la investigación mediante gráficas y Tablas de correlación, además de su descripción en texto.
Se realizaron medidas descriptivas de tendencia central como son moda, media y mediana. Se realizó el análisis estadístico de los resultados en porcentajes y promedios, para determinar la frecuencia.
Se realizó estadística descriptiva con el objetivo final de facilitar el manejo de la información, la organización y el análisis de la misma.
Resultados
En la presente investigación se analizaron 30 pacientes, (datos recabados de los expedientes clínicos) durante el periodo comprendido entre el 01 de enero de 2015 al 01 de junio de 2018, los cuales se sometieron a cirugía de control de daños en el Hospital General de Querétaro. Se analizaron las siguientes variables: pH, número de trasfusiones, temperatura, estancia en unidad de cuidados intensivos, tiempo de coagulación y hemoglobina. Asimismo, se analizaron datos previos a su ingreso a la unidad de cuidados intensivos y previo al tiempo quirúrgico como: niveles de hemoglobina, temperatura, pH y tiempos de coagulación, que a lo largo de la investigación nos arrojó los siguientes resultados.
De los 30 pacientes que se analizaron, encontramos que la distribución de genero se encontró en una relación de 80% hombres y 20% mujeres.
Para la distribución de edades de los pacientes que fueron sometidos a cirugía de control de daños, se encontró que se tiene una media de 43.5 años, con una moda de 48 años, tal como lo muestra la Figura 2.
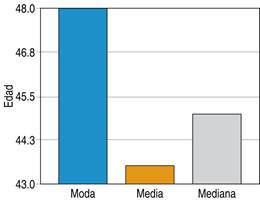
Figura 2: Distribución por edad de pacientes sometidos a cirugía de control de daños en el Hospital General de Querétaro.
Los resultados nos expresan el tiempo en horas que se encontraron los pacientes en la unidad de cuidados intensivos, reportando una media de 41 horas, moda de 48 horas y una mediana de 40 horas.
Para los niveles de hemoglobina en los pacientes sometidos a cirugía de control de daños se tomaron dos mediciones de los expedientes, uno previo al ingreso a la unidad de cuidados intensivos con una media de 9.1 mg/dl y moda de 10 mg/dl, y otra medición previa al segundo tiempo quirúrgico o ingreso a la tercera etapa de cirugía de control de daños, encontrando una moda de 11.8 mg/dl y una media de 12 mg/dl tal como se expresa en la Figura 3.
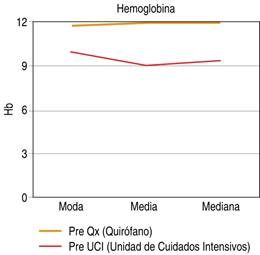
Figura 3: Niveles de hemoglobina en pacientes previo a su ingreso a unidad de cuidados intensivos y previo a segundo tiempo quirúrgico, sometidos a cirugía de control de daños en el Hospital General de Querétaro.
Dentro de la Figura 4 podemos observar los tiempos de coagulación con medición de acuerdo al INR (razón normalizada internacional) de la cual se tomaron dos mediciones, previo al ingreso a unidad de cuidados intensivos arrojando una media de 1.42 y una moda de 1.3 y previo a la tercera etapa de la cirugía de control de daños observando una media de 1.31 y una moda de 1.3.
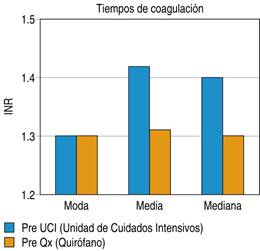
Figura 4: Tiempos de coagulación en pacientes previo a su ingreso a unidad de cuidados intensivos y previo a segundo tiempo quirúrgico, sometidos a cirugía de control de daños en el Hospital General de Querétaro.
Para la temperatura se tomaron dos mediciones previas al ingreso a la unidad de cuidados intensivos, la cual nos otorga una media de 35.8 grados centígrados y una moda de 36 grados centígrados, y otra medición previa al ingreso a la tercera etapa de la cirugía de control de daños con una moda de 36.8 grados centígrados, una media de 36.5 grados centígrados y una mediana de 36.6 grados centígrados, esto expresado en la Figura 5.
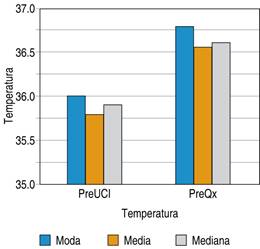
Figura 5: Temperatura en pacientes previo a su ingreso a unidad de cuidados intensivos y previo a segundo tiempo quirúrgico, sometidos a cirugía de control de daños en el Hospital General de Querétaro.
En la Figura 6 podemos encontrar el pH con el que llegaron los pacientes a la unidad de cuidados intensivos con una moda de 7.2 y una media de 7.1, y los valores que se obtuvieron previos al ingreso a la tercera etapa de la cirugía de control de daños con una moda de 7.3 y una media de 7.33.
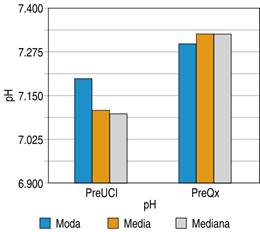
Figura 6: Niveles de pH en pacientes previo a su ingreso a unidad de cuidados intensivos y previo a segundo tiempo quirúrgico, sometidos a cirugía de control de daños en el Hospital General de Querétaro.
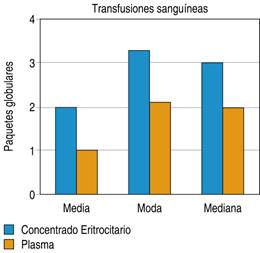
Para el número de transfusiones sanguíneas se observó una media de dos unidades de concentrado eritrocitario y una unidad de plasma con una moda de 3.3 unidades de concentrados eritrocitarios y 2.1 unidades de plasma, como son expresados en la Figura 7.
Discusión
La literatura internacional menciona una gran incidencia en sujetos menores de 30 años, del género masculino principalmente,7,50,51 datos que coinciden parcialmente con los resultados del estudio en el grupo de población estudiada, siendo la media de edad 43.5 años, una moda de edad se presentó en los 48 años. El grupo de edad más afectado se observó entre los 40 y 50 años. En cuanto al género, los pacientes masculinos fueron más afectados con 24 casos que representaron 80% y el género femenino con seis casos, lo que corresponde a 20%, siendo esta población altamente productiva, cabe destacar que se eliminaron de esta población los pacientes menores de 16 años debido a que no son pacientes que se ingresan de forma rutinaria en nuestra unidad y pacientes mayores de 60 años por la alta frecuencia de comorbilidades.
La etapa III de la cirugía de control de daños, también conocida como la cirugía definitiva, es decir donde se lleva a cabo el desempaquetamiento y la reparación final en caso de que sea necesario, la cual se debe realizar cuando el paciente se encuentre fuera de la triada letal y sin riesgo de sufrirlo de nuevo, así como para realizar el cierre definitivo de la pared abdominal, preferentemente entre las 24 y 36 horas50 esta etapa no tiene un tiempo estándar para realizarse más sin embargo se recomienda no exceder las 72 horas para su realización.52-54 Con respecto a esta variable es donde se obtiene una media de 41 horas para entrar a la tercera etapa de la cirugía de control de daños y una moda de 48 horas, entrando en rangos internacionales y recomendados como los autores antes mencionados, esto comparado con publicaciones de Latinoamérica se encuentra por debajo del tiempo promedio de 72 horas (medida que se estandariza para el ingreso a la tercera etapa de cirugía de control de daños)37 pero al momento de traspolar con publicaciones canadienses y europeas donde los tiempos de estancia en unidad de cuidados intensivos se reducen de 12-24 horas, se refleja una considerable brecha de horas para la recuperación del paciente de la tríada letal.
La presencia de coagulopatía se relaciona con una mortalidad del 28-46%,12 con respecto a este punto encontramos que los pacientes presentan una recuperación respecto al INR (razón internacional normalizada)con una media de 1.4 al ingreso a la unidad de cuidados intensivos y una recuperación a una media de 1.3, mismo evento que se observó con la temperatura la cual se tuvo una corrección, ya que al ingresar a la unidad de cuidados intensivos se contaba con una media de 35.8 grados centígrados y fue modificada al lograr una media de 36.5 grados centígrados. De forma favorable fue beneficiado la corrección del pH logrando una media de 7.33 respecto a un 7.1 que es el valor con el que ingresaron a la unidad de cuidados intensivos. Con esto se ve corrección de la triada letal objetivo primordial de la segunda etapa de la cirugía de control de daños, ya que con esto evitamos llegar a una mortalidad del 90% una vez establecida esta y sin posibilidad de recuperación de estos parámetros.7
Con respecto al número de transfusiones requeridas en la unidad de cuidados intensivos tenemos que se empleó una media de dos paquetes globulares y una moda de 3.3 paquetes globulares para la contribuir a la corrección de la triada letal, siendo estos no significantes debido a que no se contabilizó el número de unidades desde el ingreso a urgencias.
Conclusiones
El actuar en la cirugía de control de daños, específicamente en la segunda etapa, consiste en el manejo de la triada letal en la unidad de cuidados intensivos, donde las intervenciones van encaminadas a la preparación del paciente para una intervención definitiva pero segura para el paciente. Se concluye que se cumplen los requerimientos indispensables para la corrección de la acidosis, coagulopatía e hipotermia, mejorando de esta manera indudablemente la morbimortalidad de estos pacientes tanto a corto, mediano y largo plazo. Pero también cabe mencionar que la estancia en esta unidad es considerablemente menor, evitando así la posibilidad de infecciones tanto asociadas a la ventilación mecánica que estos pacientes requieren como intraabdominales, y las características de los tejidos al momento de la cirugía definitiva, siendo este estudio un indicador para alertar en las posibles mejoras en nuestro actuar en la cirugía de control de daños para mejores resultados a nuestros pacientes esto con la finalidad de optimizar los tiempos en la atención y las estrategias para la corrección de la triada letal en los pacientes con trauma.











 nova página do texto(beta)
nova página do texto(beta)