Introducción
Los tumores del estroma gastrointestinal fueron descritos bajo este término a partir de 1983 y reconocidos como una entidad tumoral gastrointestinal heterogénea; se empleó este término para hacer referencia a este grupo de neoplasias de origen mesenquimal.1 Este tipo de tumor representa 1% de las neoplasias de tracto gastrointestinal con una incidencia aproximada de 20 casos por millón de habitantes.2 Se presenta con mayor frecuencia entre los 50 y 60 años sin predomino de uno u otro sexo. Este tumor puede afectar cualquier porción del tubo digestivo y su distribución específica corresponde a 70% gástrico, 25% intestino delgado, 5% colon y recto y 2% esofágico.3 Mientras que la mayoría de los tumores del estroma gastrointestinal (GIST, por sus siglas en inglés) son esporádicos, hay reportes de asociación a síndromes familiares.4 Su comportamiento puede ser benigno o incluso metastásico al momento del diagnóstico. Para el diagnóstico existen múltiples opciones como tomografía computarizada o resonancia magnética; sin embargo el estándar de oro se considera la identificación de la proteína KIT (CD 117) en inmunohistoquímica, presente en este tipo de tumores hasta en 60-70%. El tratamiento estándar de un GIST sin metástasis es la resección quirúrgica completa. En caso de presentarse en etapas avanzadas de la enfermedad, el uso de terapia blanco con inhibidores de la proteína cinasa ha permitido mejorar la supervivencia y el manejo de este tipo de tumor así como disminuir su recurrencia.
Material y métodos
Se realizó estudio longitudinal, retrospectivo, observacional y clínico en pacientes con diagnóstico histopatológico de GIST atendidos entre enero de 2012 y diciembre de 2022 en la Unidad de Oncología del Hospital General de Puebla. La información se obtuvo con base en historias clínicas, notas de evolución, récords quirúrgicos, reporte histopatológico e inmunohistoquímica.
Variables analizadas: incidencia, edad promedio al momento del diagnóstico, síntomas más frecuentes, método diagnóstico utilizado, localización, índice mitótico, inmunohistoquímica, tipo de cirugía realizada, supervivencia y recurrencia.
Para el manejo de datos se realizó captación de medias entre grupos independientes y se aplicó una prueba estadística paramétrica. Las variables categóricas se reportan en frecuencia y porcentajes.
Resultados
Se revisaron 24 expedientes con diagnóstico de GIST confirmado por histopatología e inmunohistoquímica. En el periodo de estudio se atendieron 1,169 pacientes con diagnóstico de neoplasia de tubo digestivo. La incidencia institucional de GIST en este tiempo corresponde a 2%.
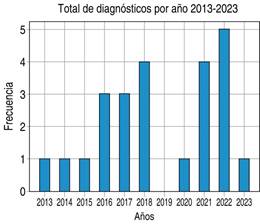
En el periodo de estudio se encontró mayor incidencia en el año 2022 con cinco casos, 20.8% en términos relativos, 16.6% de los casos se presentó en 2018 y 2021 para cada año y 12.5% en 2016 y 2017. No hubo registro de casos en 2019 y en los periodos restantes hubo un total de solamente un caso diagnosticado (Figura 1).
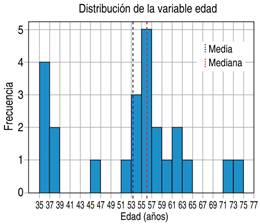
Al ser una variable numérica se realizó un análisis estadístico descriptivo. La edad media al momento del diagnóstico fue 53.2 años. Los límites de edad fueron de 35 años a 75 años en su límite superior. La edad más frecuente de presentación fue a los 56 años con cinco casos presentados, lo cual coincide con la mediana estadística, y además fue un dato cercano a la edad promedio. La desviación estándar fue 11.26 años. El segundo pico se presentó a los 36 años con cuatro casos (Figura 2).
Al tratar de encontrar un comportamiento de distribución normal en los datos como consecuencia de que n < 30, se analizó el valor de la asimetría y curtosis. Para el caso del coeficiente asimetría se obtuvo un valor -0.13, que si bien tiende a cero, al ser menor de cero indica un pequeño sesgo de los datos hacia la derecha; mientras que la curtosis resultó en -0.85, al ser negativa la distribución fue platicúrtica.
Se detectó mayor incidencia en el sexo masculino con 15 casos contra nueve del sexo femenino.
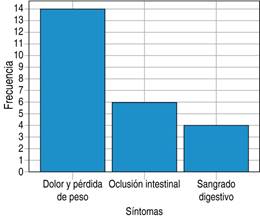
Se observó que 58% inició con síntomas compatibles con dolor abdominal y pérdida ponderal; 25% inició con episodio de oclusión intestinal en el servicio de urgencias. Únicamente 12.5% presentó datos de sangrado de tubo digestivo bajo como única referencia clínica (Figura 3).
Respecto al método diagnóstico, fue más frecuente el hallazgo histopatológico posterior a la resección quirúrgica en 45% de los casos. En segundo lugar, se realizó el diagnóstico por endoscopia en 33% de los pacientes. Sólo se identificó como hallazgo tomográfico en 20% de los casos.
Se observó que la localización tumoral en esta serie fue mayor en intestino delgado con 66%. El GIST gástrico se presentó en 29% de los casos y en colon sigmoides en 4%, sin manifestarse en ninguna otra región del tubo digestivo (Figura 4).
El índice mitótico más frecuente en esta serie de casos fue bajo (de uno a dos en 50 campos) con 58%, mientras que en 29% se encontró un índice mitótico alto (> 5 en 20 campos). A su vez se detectó que 8% no mostró mitosis en el estudio histopatológico.
La inmunohistoquímica reveló presencia de proteína KIT (CD 117) en 100% de los casos estudiados; se detectaron otros marcadores como CD34 en 54% de los pacientes, mientras que discovered on gastrointestinal stromal tumor 1 (DOG1) sólo se reportó en 4% (Tabla 1).
Tabla 1: Patrones de inmunohistoquímica.
| Pacientes | Patrón de inmunohistoquímica |
|---|---|
| 13 | CD 117 (+) CD34 (+), CK 20 (-) |
| 9 | CD 117 (+) CD34 (-), CK 20 (-) |
| 1 | CD 117 (+) DOG1 (+) CD34 (-) Citoqueratina (-) |
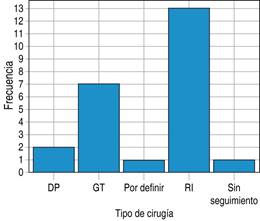
Los pacientes recibieron tratamiento quirúrgico en 96% de los casos; 58% se sometió a resección intestinal del segmento tumoral y entero-entero anastomosis término-terminal. Por su parte, para la localización gástrica se realizó gastrectomía total con esófago-yeyuno anastomosis. De los pacientes, 4% no acudió a recibir tratamiento posterior al diagnóstico (Figura 5).
La supervivencia a cinco años se presentó en 16% de los casos. De los pacientes, 41% se encuentran aún en seguimiento. Se observó supervivencia menor de cinco años en 41% de los pacientes.
Hubo recurrencia en 16% de los casos con actividad tumoral en hígado y pulmón.
Discusión
El tumor del estroma gastrointestinal (GIST, por sus siglas en inglés) hace referencia a tumores mesenquimales del tracto gastrointestinal originados en las células intersticiales de Cajal.
Las células de Cajal son una estirpe celular del estroma intestinal localizada entre las capas musculares longitudinal y circular y se relacionan con la coordinación y control de la motilidad intestinal.5 En GIST la literatura menciona una incidencia aproximada de 0.3-2% de los tumores gastrointestinales,6 lo cual corresponde a lo encontrado en la unidad de oncología. Aunque la literatura describe una relación mujer-hombre 1:1, algunos estudios sugieren una tendencia mayor en el sexo masculino.7 En lo que respecta a esta serie, se observó que la mayoría de los casos (66.6%) corresponde a hombres en comparación con 37.5% en el sexo femenino. En términos absolutos la diferencia no es muy significativa, pues apenas alcanzó un rango de diferencia por sexo de seis casos. Algunos estudios revelan una incidencia equiprobable; sin embargo, se ha reportado una tendencia mayor en el sexo masculino.8 Según la literatura, la edad de presentación oscila entre 60 y 69 años9 e incluso hay reportes de casos en niños; sin embargo, en esta revisión se encontró su pico más alto a los 56 años, que corresponde a la edad promedio (intervalo 35-75 años), pese a esto, el segundo pico a los 36 años (16%) está bajo estudio.
Los GIST pueden aparecer en cualquier parte del tracto gastrointestinal, desde el esófago hasta el recto e incluso hay reportes de localizaciones extraintestinales como mesenterio, omento o retroperitoneo. A pesar de su amplia distribución, 50-60% se presentan en estómago, 20-30% en intestino delgado, 5% en esófago y 5% en el resto de la cavidad abdominal. Algo que vale la pena mencionar en esta serie es que la mayor incidencia en su localización es intestinal con 66% en comparación con la localización gástrica que se encontró en 29% y su comparación con lo descrito en la literatura. Se considera que incluso a pesar del tamaño, el índice mitótico y la edad del paciente, la localización es un factor pronóstico importante, esto debido a que los tumores que se originan en intestino delgado, colon recto o mesenterio se asocian con un desenlace menos favorable que los originados en el estómago.10
Respecto a su presentación clínica, se reporta que un alto porcentaje permanece asintomático hasta observarse como hallazgo al momento de un estudio. En los pacientes sintomáticos las manifestaciones suelen ser inespecíficas y erráticas y corresponden a 70% de los pacientes con este tipo de tumor.11 Se reporta la presencia de sangrado de tubo digestivo como síntoma más frecuente seguido de dolor abdominal, pérdida de peso, masa palpable, entre otros. En esta serie el síntoma más frecuente fue el dolor abdominal inespecífico y la pérdida de peso (58%) seguido de episodios de oclusión intestinal (25%) y por último, datos de sangrado de tubo digestivo (12.5%).
Histológicamente se describe el GIST como un tejido formado por células con morfología descrita en una de tres categorías: células fusiformes, epitelioides y de tipo mixto.12 Para principios de 1990 existía confusión respecto a las líneas de diferenciación mostrada en este tipo de tumores; gracias a los estudios realizados en torno a las mutaciones en la proteína KIT y su expresión, se transformó este campo en relación con el diagnóstico del tumor.13 KIT es un receptor de tirosina cinasa tipo III, la cual presenta su activación con la unión del factor de células madre con posterior activación de vías de transducción de señales dando como resultado la proliferación, diferenciación, maduración y supervivencia celular, y que muestra su derivación de las células intersticiales de Cajal.14 Debido a esto, se determinó que una característica de los GIST es la expresión de CD 117 (KIT) en 90-95% de los casos seguida de CD34 en 60-70%. En esta serie se encontró positividad para CD 117 en 100% de los casos seguida de CD34 en 54% y sólo 4% para DOG1 (Tabla 1).
Debido a la inespecificidad del cuadro clínico, aproximadamente 50% de los pacientes tienen metástasis al momento del diagnóstico. Los métodos diagnósticos de imagen incluyen tomografía computarizada, resonancia magnética, PET scan (tomografía de emisión de positrones) y ultrasonido. De éstos, la tomografía parece tener mayor utilidad, además de tener la ventaja de evidenciar invasión y metástasis.15 En esta revisión se observó que 45% fue diagnóstico histopatológico posterior a la resección tumoral, mientras que 30% obtuvo diagnóstico histopatológico prequirúrgico por endoscopia y sólo 20% fue por hallazgo tomográfico.
EL GIST tiene un potencial maligno incierto. El índice mitótico en conjunto con el diámetro tumoral se ha utilizado para estratificar el riesgo de recurrencia en este tipo de tumores. Existen reportes que indican que un índice mitótico superior a cinco mitosis/50 campos (alto) tiene riesgo de recurrencia de 86%.9 A su vez se reportan índices menores de cinco mitosis/50 campos (bajo) con un riesgo de recurrencia de 11%. En este estudio se encontró un índice mitótico bajo en 58%, mientras que hubo un índice alto en 29% (Figura 6). Los sitios más comunes de recurrencia son hígado (65%), peritoneo (50%), ambos (20%) En este estudio se detectó recurrencia en 16% observando actividad tumoral en hígado y pulmón.16 De este grupo de pacientes, 75% presentó índice mitótico alto, mientras que 25% mostró un índice mitótico bajo.
El tratamiento es dependiente del tamaño, localización y diseminación. La cirugía se considera el tratamiento inicial, la cual con resección completa en etapas tempranas es el estándar de oro y tiene potencial curativo si se consiguen márgenes negativos.17 La disección ganglionar regional tiene poco valor por la ausencia de metástasis a este nivel. En caso de enfermedad irresecable, la cual se reporta en Estados Unidos entre 13 y 50%,18 o si hay alto riesgo de recurrencia se utiliza como tratamiento médico el uso de inhibidores de la tirosina cinasa (imatinib, sunitinib, regorafenib). Este tipo de fármaco se considera el tratamiento estándar en enfermedad metastásica.19 Tiene mala respuesta a la quimioterapia, mientras que la radioterapia únicamente se utiliza con fines analgésicos o en caso de hemorragia intraperitoneal.
Conclusiones
Los tumores del estroma gastrointestinal tienen un comportamiento impredecible. Debido a la baja frecuencia relativa de GIST, es importante considerarlo entre las alternativas diagnósticas de los tumores abdominales para un tratamiento lo más oportuno posible. Si bien la cirugía se considera el tratamiento curativo para este tipo de tumor, debido a lo insidioso de la presentación clínica el riesgo de detectarlo en estadios avanzados es alto. La aplicación de la proteína KIT (CD 117) como marcador diagnóstico, e incluso actualmente como blanco terapéutico con el uso de medicamentos inhibidores de tirosina cinasa, ha mejorado la supervivencia en este tipo de pacientes.20 El seguimiento estrecho a largo plazo es esencial por el alto riesgo de recurrencia. Se requieren estudios en series mayores de GIST que permitan aclarar factores etiológicos y de riesgo, como en este estudio en el que la mayor frecuencia se observó en el género masculino o la presentación del tumor se detectó en edades tempranas.











 nueva página del texto (beta)
nueva página del texto (beta)