Introducción
A nivel mundial, el cáncer colorrectal (CCR) representa la tercera neoplasia maligna más común y la cuarta causa principal de mortalidad relacionada con el cáncer y cuyos síndromes familiares reconocidos corresponden a alrededor de 5% de los casos.1,2 Existen dos amplias clases de cáncer colorrectal hereditario, según la ubicación predominante del cáncer: distal y proximal. La poliposis adenomatosa familiar (PAF) y la mayoría de los casos esporádicos pueden considerarse un paradigma para la clase distal, mientras que el cáncer colorrectal no polipósico hereditario (síndrome de Lynch) representa más claramente la clase proximal.3,4
La PAF es un síndrome autosómico dominante causado por una mutación germinal del gen de la poliposis adenomatosa coli.5 Afecta a 1:10,000 personas y representa aproximadamente 1% del cáncer colorrectal. Su característica principal es la aparición de más de 100 pólipos adenomatosos colorrectales, pudiendo llegar a ser miles, iniciando en edad joven, con riesgo de cáncer cercano a 100% si no recibe tratamiento oportuno. La mayoría de los casos comienzan como pólipos colónicos adenomatosos benignos.2,6,7
La complejidad de las posibles presentaciones clínicas de estos síndromes incluye, además de los trastornos colorrectales severos o atenuados, diversas manifestaciones extracolónicas como poliposis gástrica y duodenal y tumores desmoides, que pueden requerir tratamiento endoscópico o quirúrgico adicional que complica el proceso terapéutico e impone una vigilancia continua incluso cuando la enfermedad colorrectal es erradicada.8
Presentación de caso
Se trata de un hombre de 56 años de edad, bajo tratamiento médico por hipertensión arterial de larga evolución y cardiopatía isquémica tratada con colocación de stent coronario hace dos años, antecedente heredofamiliar de cáncer de colon en dos familiares de primer grado menores de 50 años. Acude a valoración externa por historia de tres meses de evolución con sangrado de tubo digestivo bajo (STDB) acompañado de síndrome anémico, se realiza colonoscopia observando poliposis múltiple (más de 200 pólipos), con lesiones de aspecto neoplásico en colon sigmoides y colon transverso (Figura 1). No se encontraron lesiones cutáneas u óseas anormales ni tampoco se identificó la presencia de hipertrofia del pigmento del epitelio retiniano.
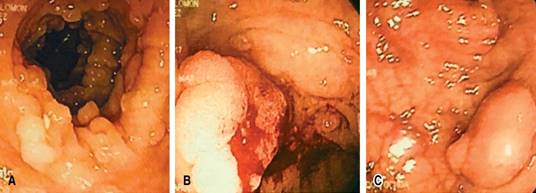
Figura 1: Colonoscopia donde se observa poliposis múltiple (A), con lesiones de aspecto neoplásico en colon transverso (B) y colon sigmoides (C).
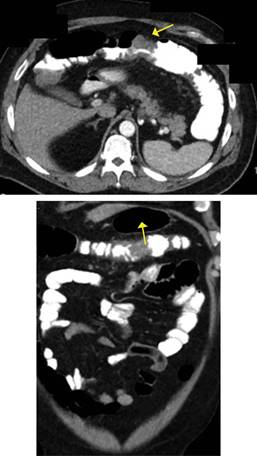
Se complementó su estudio con endoscopia de tubo digestivo alto observando superficie micronodular difusa en porción alta del cuerpo del estómago, sin pólipos duodenales (Figura 2), y tomografía computarizada toracoabdominal con contraste iv, que reveló tumoración de colon transverso con infiltración de grasa pericolónica, la cual condiciona obstrucción parcial, así como la presencia de adenopatías paraaórticas (Figura 3). En los estudios de laboratorios se observó una hemoglobina: 9.0 g/dl, proteínas totales: 5.8 g/dl, albumina 3.0 g/dl y antígeno carcinoembrionario: 131 ng/ml.
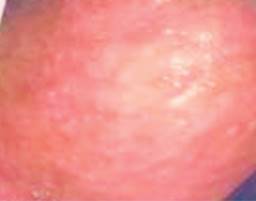
Figura 2: Endoscopia: superficie micronodular difusa en porción alta del cuerpo del estómago, sin pólipos duodenales.
Durante el segundo día de internamiento, el STDB continúa con disminución de la hemoglobina a 7.0 g/dl y agregándose cuadro de oclusión intestinal, por lo que se decide programar para cirugía.
Se realiza colectomía total con ileostomía terminal por laparoscopia de cuatro puertos manoasistida, encontrando múltiples implantes peritoneales y hepáticos, de los cuales se tomaron biopsias. En el postoperatorio, el paciente desarrolla íleo adinámico que se resuelve hasta transcurridos 18 días con nutrición parenteral, posteriormente toleró la vía oral, con ileostomía funcional, previa colocación de catéter Port-a-Cath a su egreso.
El departamento de patología reportó más de 200 pólipos adenomatosos tubulares con displasia de bajo grado, así como la presencia de adenocarcinoma tipo intestinal con componente mucinoso en colon transverso y sigmoides. La biopsia hepática reveló colangiocarcinoma (CCA) tipo I. Se realizó panel de inmunohistoquímica por inestabilidad microsatelital: MLHI, MSH2, MSH6 y PMS2 con expresión nuclear conservada, y pérdida de la expresión nuclear del gen APC, prueba molecular de identificación de mutación del gen KRAS negativa, con CK7 (+), CK9 (+) y CK20 (-) en biopsia hepática, sugiriendo PAF asociada con colangiocarcinoma primario (Figura 4).
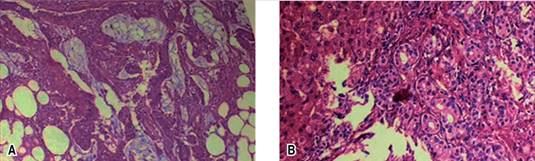
Figura 4: (A) Adenocarcinoma colónico mucosecretor con células en anillo de sello, (B) Adenocarcinoma en hígado bien diferenciado.
El paciente fue readmitido para recibir adyuvancia con quimioterapia a base de FOLFOX + bevacizumab en seis ciclos, con buena tolerancia, actualmente asintomático.
Discusión
La mayoría de los CCR se desarrollan a partir de lesiones preneoplásicas benignas: pólipos adenomatosos o adenomas. Vogelstein propuso un modelo multistep de carcinogénesis para el desarrollo del CCR que describe la progresión de un adenoma benigno a un carcinoma maligno a través de una serie de etapas histológicas bien definidas, lo que se conoce como el modelo de secuencia adenoma-carcinoma, de acuerdo con esto se entiende que la etiología del CCR es multifactorial y es probable que implique las acciones de genes en múltiples niveles, entre los que han sido implicados p53, APC, factor de crecimiento transformante (TGF)-β, SMAD, MLH1, MSH2, MSH6, PMS2, AXIN, STK11, PTEN, DCC y KRAS.9
En 1991 se descubrió el gen responsable de la PAF, llamado Adenomatous Polyposis Coli o gen APC.10 Se han descubierto más de 300 diferentes mutaciones en dicho gen que pueden causar este tipo de poliposis (Anexo 1), se demostró que el riesgo de desarrollar manifestaciones específicas de PAF, así como la gravedad de la enfermedad en el intestino grueso están relacionados con el tipo de mutación genética. Las más graves se observan con mayor frecuencia en las mutaciones entre los codones 1250 y 1464. Esto implica un comienzo temprano con síntomas (dolor abdominal, diarrea, sangre en las heces) incluso antes de los 20 años de edad, un alto número de pólipos en colon y recto y una progresión temprana a malignidad. Aunque clínicamente comprobado, la PAF no tiene una mutación genética reconocible, existe una gran cantidad de manifestaciones extracolónicas de la PAF, entre las que destacan osteomas, quistes epidermoides, tumores desmoides, afección gastroduodenal, hipertrofia congénita del epitelio pigmentado de la retina, entre otros.11
El manejo de este tipo de enfermedades o síndromes hereditarios debe iniciarse con un consejo genético para informar del tipo de patología, de la mejor terapéutica y del seguimiento necesario, disminuyendo así la morbimortalidad atribuible a estos síndromes. La prevención se verá favorecida por la identificación específica de la mutación causal de la línea germinal en la familia del paciente, lo que clasifica el riesgo y marca la pauta para el plan terapéutico y de vigilancia. Actualmente, la cirugía profiláctica es obligatoria; sin embargo, el tipo de técnica quirúrgica dependerá de la gravedad de las manifestaciones y del genotipo presentado.12,13
El CCA es un tumor maligno que surge del epitelio biliar en cualquier parte del sistema del conducto biliar, desde los conductos biliares hasta la ampolla de Vater. Se asocia a menudo con la inactivación de genes supresores de tumores, por ejemplo, p53, SMAD4, Bcl-2 y p16. También se han descrito mutaciones en oncogenes, incluyendo KRAS, p53, c-ErbB-2 y c-Neu. Aunque las mutaciones pueden conducir a cambios fenotípicos detectables, los perfiles moleculares en la citología biliar no tienen en la actualidad un papel establecido de diagnóstico o pronóstico.14
Distinguir el CCA intrahepático del adenocarcinoma metastásico y otros tumores hepáticos primarios puede ser difícil. La diferenciación requiere en particular de las metástasis del tubo digestivo que a menudo no se pueden realizar por histología. Otras modalidades especialmente de imagen son esenciales. Pueden ser útiles los paneles de inmunohistoquímica que incluyen CK7, CK19, CK20, CDX-2, TTF-1, receptores de estrógeno/progesterona y PSA, dependiendo del contexto clínico. Los CCA suelen ser CK7 positivos y CK20 negativos,15,16 como los que presentó nuestro paciente.
En la actualidad no existen marcadores séricos específicos para neoplasias de la vía biliar en pacientes sanos o portadores de polimorfismos genéticos. Existen estudios prometedores de marcadores como diferentes mucinas, interleucina-6, ácido siálico y metaloproteinasas de matriz utilizados en combinación, pero se necesitan más investigaciones.17
El estándar de oro ideal para la prevención de complicaciones o retrasar el desarrollo de cáncer colorrectal sería una técnica genética que permitiera la eliminación del gen enfermo y la implantación de un gen libre de enfermedad. En este momento, esto sigue siendo pura especulación. La mayor parte de la investigación trata sobre los sistemas para el cribado de las mutaciones de la línea germinal en el gen de la poliposis adenomatosa coli que predispone a la susceptibilidad y enfermedad en la poliposis adenomatosa familiar. Hoy en día existen sistemas técnicos que detectan las mutaciones en el gen APC, las cuales podrían ser útiles en el diagnóstico molecular de casos presintomáticos en familias con PAF;18 sin embargo, hay otras formas interesantes de abordar el problema de una evaluación de riesgo de portador presintomática en la poliposis adenomatosa familiar como el uso combinado de marcadores moleculares y biomarcadores, siendo necesaria la comprensión detallada del proceso de carcinogénesis.19
Conclusión
La poliposis adenomatosa familiar puede no ser considerada una sola entidad de enfermedad con guías estándar para el tratamiento quirúrgico. Sin embargo, la colectomía profiláctica después de la manifestación de pólipos, pero antes del desarrollo del cáncer colorrectal, sigue siendo la prevención más efectiva. En la actualidad, las técnicas de análisis genético de refinación y las nuevas terapias dirigidas con la posibilidad de identificar la mutación que lleva el paciente (ya sea que esté relacionada con un fenotipo grave o no) han asumido un papel fundamental en la indicación del tipo de tratamiento quirúrgico en términos de radicalidad. Algunas herramientas bioinformáticas pretenden predecir la sensibilidad del tumor a los fármacos en función de su característica molecular, así como en el seguimiento a corto y largo plazo tanto del paciente como de sus familiares de primer grado.20,21
Las opciones quirúrgicas son la proctocolectomía con ileostomía terminal, la colectomía subtotal con anastomosis ileorrectal y la proctocolectomía restauradora con reservorio ileoanal. La decisión debe basarse en la estimación del riesgo de padecer cáncer colorrectal, teniendo así que los pacientes con alto riesgo como aquéllos con más de 20 adenomas en el recto, más de 1,000 adenomas en colon, adenomas rectales mayores de 3 cm de diámetro o con displasia severa o en pacientes con diagnóstico confirmado de cáncer de colon o recto, la proctocolectomía restauradora con bolsa ileoanal podría ser el procedimiento de elección.22
La aplicación de diversos biomarcadores intermedios a los estudios de quimioprevención aumenta la capacidad de los investigadores para analizar los efectos de nuevos agentes quimiopreventivos en el colon y en otros órganos.











 nova página do texto(beta)
nova página do texto(beta)