Introducción
El linfoma gastrointestinal primario (LGIP) es una enfermedad poco común que se presenta en el tracto gastrointestinal, siendo éste el sitio extraganglionar más comúnmente afectado.1 Alrededor del 5-20% de los linfomas extranodales ocurren en el tracto gastrointestinal (GI); sin embargo, el LGIP sólo representa del 1-4% de todos los tumores GI.2 El LGIP puede ocurrir en cualquier parte del tracto GI, pero los sitios más frecuentes son: estómago, intestino delgado, región ileocecal y colorrectal.3,4 Su etiología aún se desconoce, pero diversos factores se han relacionado a su patogenia como la infección por Helicobacter pylori, virus de la inmunodeficiencia humana, enfermedad celiaca, Campylobacter jejuni, virus de Epstein-Barr, virus de la hepatitis B, enfermedad inflamatoria intestinal e inmunosupresión.5-8
La mayoría de los LGIP son linfomas no Hodgkin (LNH),4 siendo el linfoma de Hodgkin (LH) extremadamente raro en el tracto GI9. Desde el punto de vista histológico, los LGIP son principalmente del tipo difuso de células B gigantes (DLBCL) y linfoma de tejido linfoide asociado a mucosas.10,11 La distribución geográfica del LGIP es variable, siendo el de células B predominante en los países occidentales y el de células T con mayor incidencia en los países orientales.12,13 El pronóstico de esta entidad depende del género, subtipo histológico, estadio tumoral y el uso de cirugía radical.14-16
Presentación del caso
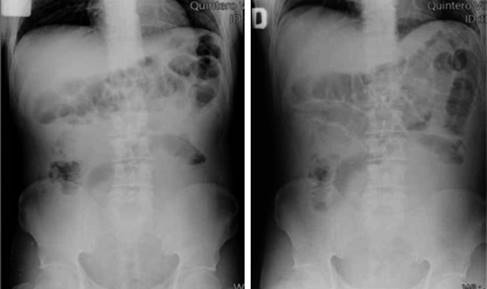
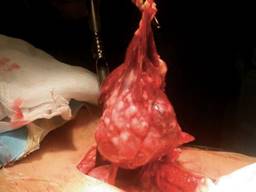
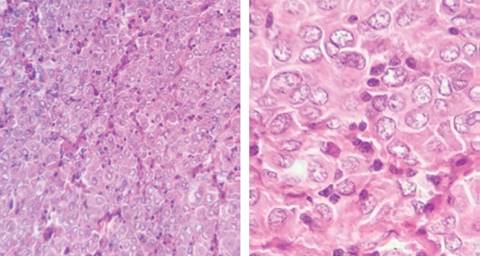
Se presenta el caso de un paciente de 57 años de edad, quien cuenta con los antecedentes de pérdida de peso de 10 kg en los últimos dos meses y cambios en el hábito intestinal consistentes en diarrea recurrente. Acude al servicio de urgencias de nuestro hospital con dolor abdominal intenso de 72 horas de evolución, tipo cólico localizado en mesogastrio, de inicio insidioso, sin factores atenuantes o exacerbantes, 36 horas posteriores se agrega náusea y vómito de contenido gastroalimentario en múltiples ocasiones, fiebre de hasta 39 oC e hiporexia, por lo que se automedicó con antibióticos no especificados y analgésicos sin lograr mejoría clínica, por lo que acude al servicio de urgencias de nuestra unidad hospitalaria. A su ingreso se toman muestras sanguíneas y radiografía abdominal de pie y decúbito como estudios de rutina iniciales. En la exploración física con los siguientes signos vitales: frecuencia cardiaca 105 × min, frecuencia respiratoria 22 × min, TA 90/60 mmHg, temperatura 36.9 oC. Presenta deshidratación mucotegumentaria, con aspecto caquéctico, abdomen plano, peristalsis ausente, con resistencia muscular involuntaria, doloroso a la palpación profunda en los cuatro cuadrantes, con datos francos de irritación peritoneal. Los exámenes de laboratorio muestran conteo leucocitario de 9.8 × 103/L, neutrofilia del 85%, hemoglobina de 13.1 g/dl, INR de 1.09. Las placas simples de abdomen únicamente mostraron asas fijas segmentarias (Figura 1). Tras integrarse cuadro de abdomen agudo quirúrgico, se realiza laparotomía exploradora sobre línea media infraumbilical (15 cm) con hallazgos transoperatorios de hemoperitoneo de 350 cm3 y múltiples tumoraciones encapsuladas dependientes de mesenterio e intestino delgado, de diferentes tamaños oscilando de 4 a 14 cm en mesenterio a 90, 130, 150, 160 cm de ligamento de Treitz, con múltiples implantes peritoneales menores de 1 cm. La tumoración de 14 cm de diámetro sufrió ruptura aparentemente espontánea, la cual ocasionó hemoperitoneo de aproximadamente 300 ml, por lo que fue resecada y se encontró en el borde antimesentérico de yeyuno a 130 cm de la válvula ileocecal, sin necesidad de resección intestinal. Las demás lesiones descritas no fueron resecadas debido a que en todo el borde intestinal se observaron lesiones múltiples de diferente tamaño, dicha ruptura ocasionó hemoperitoneo (Figuras 2 y 3). Igualmente, fueron resecadas tres lesiones de mayor tamaño y que fueron accesibles durante la laparotomía. Durante el posoperatorio, el paciente tiene adecuada evolución iniciando vía oral al tercer día de la cirugía y es trasladado al sexto día a un centro oncológico para continuar protocolo y manejo. El análisis histológico e inmunohistoquímico reveló el diagnóstico histopatológico de linfoma difuso de células B gigantes (Figura 4 y Tabla 1).
Discusión
En el escenario clínico resulta difícil diferenciar entre un LGIP extranodal y linfomas nodales primarios diseminados, por lo que se utilizan los criterios de Dawson para distinguir entre estas dos entidades17 (Tabla 2). La clasificación de Ann Arbor modificada por Musshoff se emplea para clasificar los linfomas gastrointestinales primarios17 (Tabla 3). Los tumores primarios de intestino delgado representan el 2% de los tumores GI malignos. El linfoma constituye del 15-20% de las neoplasias de intestino delgado y representa del 20-30% de los tumores GI primarios. El íleon es el sitio más afectado (60-65%), seguido del yeyuno (20-25%) y por último el duodeno (6.8%).18 La edad de presentación varía dependiendo del subtipo histológico, siendo más común su presentación entre la sexta y séptima décadas de vida.19 Microscópicamente, el linfoma difuso de células B gigantes muestra células hendidas, no hendidas e inmunoblásticas. Se demuestra su estirpe celular al ser positivo a antígenos en las pruebas de inmunohistoquímica tales como: CD 20, CD 22, CD 19, CD 70A, y BSAP/PAX5 y muy raramente positivo a marcadores de células germinales (BCL6 y CD 10).20 La sintomatología suele ser inespecífica y los pacientes suelen padecer dolor abdominal (65%), con evacuaciones sanguinolentas (27%), masa abdominal (20%), náusea, vómito, fatiga, pérdida de peso, síntomas de obstrucción intestinal, cambios en el hábito intestinal y en raras ocasiones perforación intestinal.21-24 Los hombres tienen mayor tendencia a la perforación intestinal en este tipo de tumores que las mujeres. Algunos reportes demuestran que la tasa de perforación es menor en linfomas de células B, comparada con linfomas de células T.25 Los hallazgos radiológicos son muy inespecíficos. La tomografía computarizada puede evidenciar masas intraabdominales, engrosamiento de la pared intestinal, desplazamiento de órganos adyacentes u obstrucción luminal. Las lesiones multifocales se presentan en 10-25% de los pacientes tal como ocurrió en nuestro paciente. La biopsia vía endoscópica o guiada por tomografía puede ayudar al diagnóstico definitivo. La introducción de la cápsula endoscópica y de la enteroscopia con doble balón ha evitado la realización de intervenciones quirúrgicas mayores.26
Tabla 2: Criterios de Dawson.17
| 1. Ausencia de linfadenopatías periféricas |
| 2. Ausencia de linfadenopatías mediastinales en radiografía de tórax |
| 3. Frotis de sangre periférica normal |
| 4. Durante la laparotomía, el compromiso es sólo esófago, estómago e intestino o sólo ganglios regionales |
| 5. Ausencia de compromiso hepático y esplénico, excepto por la diseminación directa de la enfermedad a partir de un foco contiguo |
Tabla 3: Sistema de clasificación de estadios de Ann Arbor modificada por Musshoff para linfomas gastrointestinales primarios.17
| EI: Afectación detectada en una o más localizaciones gastrointestinales a un lado del diafragma sin infiltración ganglionar |
| • EI1 Linfoma limitado a mucosa y submucosa o linfoma precoz |
| • EI2 Linfoma extendido a través de la submucosa |
| EII: Afectación de una o más localizaciones gastrointestinales en un lado del diafragma con infiltración ganglionar, independientemente del grado de infiltración en profundidad de la pared |
| • EII1 Infiltración de ganglios regionales |
| • EII2 Infiltración de ganglios linfoides alrededor del área regional |
| EIII: Afectación del tracto gastrointestinal y/o de los ganglios linfáticos a uno ambos lados del diafragma |
| EIV: Masa linfoide con o sin infiltraciones de ganglios y afectación difusa de órganos y tejidos no gastrointestinales |
El mejor método diagnóstico, en ocasiones terapéutico relacionado a complicaciones, es la videoendoscopia y/o el ultrasonido endoscópico.
¿Cuál es el papel de cada una de estas técnicas en el diagnóstico y en el tratamiento de algunas complicaciones como la hemorragia gastrointestinal?
Estas técnicas endoscópicas han contribuido al diagnóstico y tratamiento de las complicaciones como la hemorragia digestiva, que en el 5% de los casos suele estar presente en el intestino delgado y que en adultos mayores su origen suele estar relacionado a tumoraciones (tumoraciones del estroma gastrointestinal, tumores carcinoides, linfomas, adenocarcinomas, etcétera).27,28
En pacientes con anatomía modificada por cirugía previa, sobre todo en pacientes sometidos a cirugía bariátrica o derivaciones en Y de Roux, donde la cápsula endoscópica no tiene alcance, se prefiere el uso de la enteroscopia asistida por dispositivo con balón único o doble; sin embargo, su uso suele estar limitado ante hemorragias intermitentes o sangrados recurrentes.29 La enteroscopia transquirúrgica durante laparotomía o laparoscopia se usa típicamente como último recurso en pacientes con sangrados recurrentes, o sangrados no revelados durante las técnicas anteriores.30 ¿Cuál es el papel del ultrasonido endoscópico en la caracterización de la profundidad mural gastrointestinal y en la caracterización y adquisición tisular de ganglios linfáticos sospechosos para diagnóstico (citopatología e inmunohistoquímica) y clasificación (Ann Arbor modificada)? El uso de la endoscopia por sí sola no es capaz de detectar lesiones neoplásicas, ya que éstas pueden estar presentes entre capas profundas de las paredes gastrointestinales; sin embargo, cuando se combina con múltiples biopsias de diferentes sitios, sobre todo en lesiones sospechosas, mejora la exactitud en el diagnóstico.31 Consecuentemente, características endosonográficas que en un principio podrían ser invisibles o variar en grosor dentro de las paredes intestinales o presentarse de forma difusa dentro de ellas podrían ser cruciales para la detección temprana y diferenciación de diversas tumoraciones.32 Suekane et al. mostraron que un infiltrado superficial o lesiones difusas detectadas por ultrasonido endoscópico estaban asociadas con linfoma tipo MALT, mientras que las formaciones sólidas con linfoma de células B para la detección de linfomas gastrointestinales.33 Actualmente, el ultrasonido endoscópico EUS (por sus siglas en inglés, Endoscopic Ultrasound) es considerado el método de elección para el estadiaje de linfomas gástricos primarios, incluyendo la detección de ganglios linfáticos afectados, mostrando superioridad en comparación con la tomografía.34 Esta superioridad es debida a la detección de ganglios linfáticos y a la diferenciación de las capas gástricas involucradas en relación con la lesión. La diferenciación de ganglios afectados o no por el linfoma se basa en los criterios ultrasonográficos de malignidad (estructura hipoecoica, bordes irregulares y demarcados, contorno redondeado y tamaño mayor de 1 cm).35 Desde 1990, se ha determinado en la literatura una exactitud del EUS para la detección de linfoma gástrico primario para el estadiaje T y N del 90 y 80%, respectivamente.36,37 Sin embargo, en 2002, un estudio multicéntrico que incorporó datos de 34 centros (incluyendo 70 pacientes) mostró una exactitud general del EUS en determinar el estadio (acorde a la clasificación modificada de Ann Arbor) del 53%, aunque la mayoría de los centros evaluadores no eran centros experimentados en el uso del EUS en el estadiaje, como muestra el hecho de que sólo cinco de los 34 centros reclutaron más de dos pacientes. Aun cuando este estudio podría subestimar el rol del EUS en el estadiaje del linfoma gastrointestinal, es remarcable el problema de la experiencia del operador en este procedimiento.38
Con el surgimiento de la biopsia por aspiración con aguja fina guiada por ultrasonido endoscópico “EUS-FNA” (por sus siglas en inglés Endoscopic Ultrasound-Guided Fine Needle Aspiration), se encontró la posibilidad de toma de muestras de tejidos transmurales, lo cual permite la evaluación citológica de la muestra para el diagnóstico citológico, a diferencia de la biopsia endoscópica utilizada para el diagnóstico histológico;39 sin embargo, no ha mostrado utilidad para la estadificación de la enfermedad. Estudios actuales han demostrado una mejoría en cuanto a la exactitud diagnóstica con el uso de la EUS-FNA al ser combinada con la citometría de flujo y la inmunocitoquímica, pero la evidencia aún se limita a estudios retrospectivos y con pocos pacientes.40
¿El grado histológico juega un papel importante en el tratamiento?
Aproximadamente el 5% de los linfoma se presentan en el tracto gastrointestinal, siendo el estómago el más frecuente, seguido del intestino delgado y el colon. Los parámetros que determinan el tratamiento son: la histología y la extensión de la enfermedad. En cuanto al grado histológico, a diferencia del linfoma folicular, éste no tiene un papel importante en cuanto al tratamiento y pronóstico de la enfermedad. La mayoría de los linfomas primarios gastrointestinales son de histologías difusas y comúnmente agresivos, especialmente el linfoma difuso de células B grandes, linfoma de células del manto y linfoma intestinal de células T. Solamente una mayoría de pacientes con linfoma no Hodgkin de tipo agresivo tiene enfermedad localizada al momento del diagnóstico y son mínimos los beneficios terapéuticos entre los estadios III y IV (Ann Arbor), por esta razón tiene menos impacto la estadificación en el linfoma no Hodgkin que en el linfoma Hodgkin. El estadiaje en el linfoma no Hodgkin identifica, por tanto, una minoría de pacientes. quienes pueden ser tratados con terapia local o combinada y la identificación del tipo histológico nos permite determinar el pronóstico y evaluar el impacto que tendrá el tratamiento.41 A ello se debe la gran insistencia en establecer una clasificación histológica adecuada para el tipo histológico. En 2001, la clasificación de la Organización Mundial de la Salud (OMS) aplicó los principios de la clasificación de la Revised European-American Lymphoma (REAL) y representó el primer consenso en la clasificación hematológica de las neoplasias. La clasificación del linfoma no Hodgkin de la REAL/WHO incluye muchas entidades no reconocidas por la International Working Formulation (IWF), considera el origen celular, y subdivide los linfomas dentro de sus precursores linfocíticos. Además, la clasificación está basada en el inmunofenotipo, genética y características clínicas. Estas consideraciones ayudaron a definir un tratamiento específico para cada tipo de linfoma (Tabla 4).
Tabla 4: Clasificación REAL/WHO de las neoplasias linfoproliferativas (Revised European-American Lymphoma/World Health Organization). 43
| Neoplasias de células B | |
|---|---|
| I. | Neoplasia precursora de células B |
| Leucemia/linfoma linfoblástico B precursor | |
| II. | Neoplasia madura (periférica) de células B |
| Leucemia linfocítica crónica de células B/linfoma linfocítico pequeño | |
| Leucemia prolinfocítica de células B | |
| Linfoma linfoplasmacítico | |
| Linfoma de células B de la zona marginal esplénica (± linfocitos vellosos) | |
| Leucemia de célula melenuda | |
| Mieloma de células plasmáticas/plasmocitoma | |
| Linfoma de células B de la zona marginal extranodal de tipo de tejido linfoide asociado a la mucosa | |
| Linfoma de la zona marginal nodal (± células B monocitoides) | |
| Linfoma del centro folicular | |
| Linfoma de células del manto | |
| Linfoma difuso de células B de células grandes | |
| Linfoma mediastínico de células B grandes | |
| Linfoma de efusión primaria | |
| Linfoma de Burkitt/leucemia de células de Burkitt | |
| Neoplasias de células T y NK células | |
| I. | Neoplasia precursora de células T |
| Leucemia/linfoma precursora T-linfoblástico | |
| II. | Neoplasia madura (periférica) de células T |
| Leucemia prolinfocítico de células T | |
| Leucemia linfocítico-granular de células T | |
| Leucemia agresiva de células NK | |
| Leucemia/linfoma de células T adultas | |
| Linfoma extranodal de células NK/T, tipo nasal | |
| Linfoma tipo enteropático de células T | |
| Linfoma hepatoesplénico gama/delta de células T | |
| Linfoma subcutáneo similar a paniculitis de células T | |
| Síndrome de Sezary/micosis fungoide | |
| Linfoma anaplásico de células grandes, tipo cutáneo primario | |
| Linfoma periférico de células T, inespecífico | |
| Linfoma angioinmunoblástico de células T | |
| Linfoma anaplásico de células grandes, tipo sistémico primario | |
| Enfermedad/linfoma de Hodgkin | |
| I. | Predominantemente linfocítico |
| II. | Esclerosis nodular |
| III. | Células mezcladas |
| IV. | Depleción linfocítica |
| V. | Clásico rico en linfocitos |
Modificado de: Görgün AE, Borowitz MJ. A clinician’s guide to the updated REAL/WHO classification of non-Hodgkin’s lymphoma: part I (indolent lymphomas). Turkish Journal of Cancer. 2000; 30: 5-14.
El tratamiento del linfoma localizado (etapa IE y IIE) involucra la resección del segmento afectado y su mesenterio adyacente. Las etapas IIIE y IVE son tratadas con quimioterapia. El uso de quimioterapia adyuvante es controversial. La supervivencia a cinco años en pacientes con linfoma resecable se aproxima al 80%.42 La cirugía tiene una aplicación limitada en el caso de linfoma difuso. El uso de radioterapia se ha reportado beneficioso como tratamiento adyuvante o paliativo. Una complicación común de los linfomas gastrointestinales es la perforación intestinal y peritonitis. El porcentaje más alto ocurre en intestino delgado (59%), en comparación con el estómago (16%) y colon (22%).24
Conclusión
No se cuenta con información adecuada sobre esta entidad en población latinoamericana y, dada la relevancia de esta patología, es difícil sospechar el diagnóstico de manera oportuna, y mucho más al presentarse de manera complicada. El diagnóstico, tratamiento y pronóstico del paciente con linfoma gastrointestinal primario se ven seriamente modificados al presentarse como abdomen agudo secundario a ruptura de la tumoración, como sucedió en este paciente, siendo realizado el diagnóstico definitivo posteriormente tras estudios de inmunohistoquímica y patología.











 nueva página del texto (beta)
nueva página del texto (beta)