Introducción
Los estudios iniciales sobre las quemaduras se enfocaron en mejorar la tasa de supervivencia global. La comprensión de la fisiopatología de las quemaduras ha conducido a mejores técnicas de reanimación con una reducción drástica en el número de muertes. Recientemente, el interés de la investigación se enfocó más a minimizar la morbilidad y mejorar la calidad de vida del paciente.1
Los injertos cutáneos delgados mallados libres (ICDML) autólogos son los que más se utilizan para cubrir defectos, incluyen epidermis y una cantidad variable de dermis que va de 8/1,000 de pulgada (0.196 mm) a 12/1,000 de pulgada (0.294 mm). Los ICDML pueden expandirse con técnicas de mallado (con radios que van de 1:1.5 a 1:9 de expansión) cuando se requiere una cobertura adicional.2 La ventaja de utilizar ICDML consiste en la habilidad de cubrir grandes áreas con menor zona del sitio donador que puede utilizarse para nueva toma cuando haya sanado completamente, lo cual sucede en condiciones óptimas de 7 a 10 días.3,4
Existe una serie de factores locales y sistémicos que influyen en el resultado de los ICDML como vascularidad inadecuada, tendón o hueso desvascularizado, hemostasia inadecuada, hematoma o seroma por debajo del injerto, movilización excesiva, áreas en contacto con fricción como la espalda, área anorrectal y genitales, hipoxia local tisular causada por tabaquismo o radiación previa. Los factores sistémicos que podrían disminuir la sobrevivencia de los ICDML son: edad avanzada del paciente, desnutrición, comorbilidades como la diabetes o la inmunosupresión y el uso de esteroides.5,6
Estudios demuestran la utilidad del plasma rico en plaquetas activado (PRPA) en el uso de injertos de diferente índole, en su mayoría del sistema musculoesquelético,7 por lo cual el uso en la aplicación de ICDML contribuiría a la rápida adhesión y a un mayor porcentaje de éxito.8
El PRP es un concentrado de plaquetas autólogas en un pequeño volumen de plasma que se obtiene secuestrando y concentrando sangre recién extraída. Las plaquetas normalmente contienen factor de crecimiento derivado de plaquetas (PDGF-AA), factor de crecimiento transformante β (TGF-β), factor de crecimiento transformante β2 (TGF-β2), factor de crecimiento epidérmico o epitelial (EGF) y factor de crecimiento endotelial vascular (VEGF).9 Estos factores de crecimiento se encuentran en concentraciones aumentadas al activar el plasma rico en plaquetas, actuando en la proliferación y diferenciación celular, quimiotaxis, angiogénesis, síntesis de matriz extracelular, efectos mitogénicos y atrayentes de células madre mesenquimatosas que promueven la regeneración por mayor tiempo10 confiriendo propiedades benéficas en todo proceso cicatrizal y de regeneración tisular.
Existen varios procedimientos de preparación para obtener PRP con diferentes contenidos, por ejemplo, con o sin leucocitos o de estructura diferente: fluido, gel o fibrina-estructura.5 Además de los diferentes métodos de activación que pueden producirse a partir de sangre, ya sea autóloga o alogénica.9 El PRP tiene una amplia gama de aplicaciones de curación clínica, se han revelado informes beneficiosos sobre la curación de heridas en diferentes campos de la cirugía y en el tratamiento de heridas agudas, crónicas y diabéticas y se ha utilizado para acelerar la cicatrización.1 Desde 1954 hasta la fecha se han publicado más de 1,000 manuscritos relacionados con PRP y curación de heridas, pero sus resultados son contradictorios, principalmente debido a la falta de un diseño de estudio uniforme.11,12 Aunado a lo anterior, la literatura sobre el uso de PRP en quemaduras es particularmente escasa.13,14
De igual modo son escasos los estudios clínicos respecto a la efectividad del PRPA autólogo en ICDML que demuestran la efectividad de esta preparación respecto al tiempo necesario para la neovascularización, disminución del dolor y epitelización más rápida.15
El PRPAA puede ser una opción en el tratamiento del paciente con quemaduras consideradas de tercer grado, adicionarlo al ICDML parece ayudar a la curación de la herida y reducir el tiempo de recuperación, resultado de la concentración de factores de crecimiento en la herida.16 La preparación del PRPAA es relativamente sencilla, ya que puede elaborarse con equipo existente en cualquier unidad y con la capacitación en el manejo básico de hemoderivados.1 Estudios experimentales en animales confirman la seguridad del uso de PRPA heterólogo,17 ya que el PRP contiene una cantidad mínima de inmunoglobulinas es poco probable una reacción cruzada por incompatibilidad.8 Sin embargo, no existe ningún estudio sobre la aplicación de PRPAA en humanos. Por lo anterior, el presente estudio brinda otra alternativa en el tratamiento de quemaduras de tercer grado, lo que es relevante desde el punto de vista biológico y administrativo. El protocolo de estudio se ajusta de acuerdo a los códigos internacionales de ética de la investigación, código de Núremberg (1947), 18ª Asamblea Mundial Médica (AMM, 1964), Declaración de Helsinki I, 29ª AMM (Tokio, 1975), Helsinki II enmendada en la 35ª AMM (Venecia, 1983) y 41ª AMM (Hong-Kong, 1989). Según la Ley General de Salud en su apartado de investigación médica artículo 17 conlleva un riesgo mayor. El protocolo fue aprobado por el comité de ética de la UACH y del Hospital General del Estado de Chihuahua.
Material y métodos
De febrero a mayo de 2016 se estudiaron 10 pacientes de 18 a 45 años de edad que acudieron a la Unidad de Quemados del Hospital General del Estado de Chihuahua con quemaduras de tercer grado menores de 35% de superficie corporal total, que eran candidatos a tratamiento definitivo con ICDML autólogo.
Se determinaron aleatoriamente 10 pacientes, contando cada evento de colocación de injerto como un caso aislado, por lo cual un mismo paciente con quemaduras en diferentes áreas y fecha de colocación de injerto diferente se tomó como un nuevo caso en cada ocasión, cinco de ellos para tratamiento con PRPAA y cinco para placebo con solución fisiológica al 0.9%. Se prosiguió a solicitar un paquete de concentrado plaquetario al departamento de banco de sangre. Se explicó a cada paciente los pasos y objetivos del estudio, se solicitó con especial atención la autorización de publicar fotografías y se firmó consentimiento informado antes de su participación, advirtiendo los riesgos y beneficios de manera tanto verbal como escrita.
Al terminar la aplicación del ICDML, bajo técnica estéril, se toma el concentrado plaquetario a razón de 1 cc por 4 cm2 de superficie de injerto, se mezcla con trombina bovina 28 U/ml y gluconato de calcio 2.8 mg/ml (calcio real), hay que esperar cinco minutos a que las plaquetas se degranulen y con un instrumento romo se deshace el coágulo formado, se toma la mezcla resultante con una jeringa de 10 cc y aguja No. 23 y se infiltra en lecho quirúrgico en tejido celular subcutáneo 0.5 cc con una separación de 2 cm en sentido longitudinal y lateral, se procede a cubrir con tela organdí, gasas vaselinadas y vendas. En caso de pacientes seleccionados para tratamiento placebo se infiltra solución fisiológica 0.5 cc en el tejido celular subcutáneo cada 2 cm en sentido longitudinal y lateral, continuando con el mismo manejo.
Al quinto día se descubrió el injerto (Figura 1), se recolectó muestra para cultivo de la superficie, se midió el área de injerto clínicamente adherida calculando el porcentaje de injerto exitoso. Se tomó biopsia tangencial de la zona injertada de 0.5 x 0.5 cm que incluye dermis y epidermis, se colocaron en formol y se enviaron al departamento de patología.
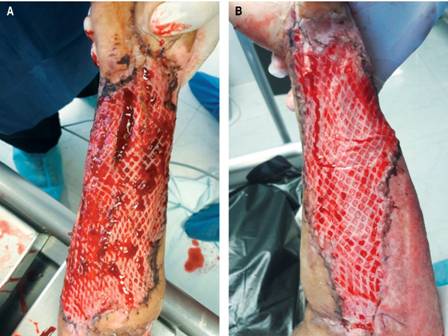
Figura 1: Fotografías tomadas al quinto día de la colocación del injerto, mismo paciente. (A) Brazo derecho control con aplicación de placebo. (B) Brazo izquierdo con aplicación de PRPAA. Se observa en la imagen del lado izquierdo sufrimiento en los bordes con pérdida posterior de esa zona y sangrado abundante al momento del retiro del material que recubre el sitio, por el contrario en el lado derecho existe un sangrado y formación de hematoma mínimo sin pérdida de injerto.
Análisis estadístico
Los datos fueron capturados en Excel y transformados en software STATA, al igual que las medidas de tendencia central y de dispersión; mientras que para las variables categóricas se calcularon frecuencias y proporciones. Las variables de resultado se compararon en los dos grupos de estudio utilizando la prueba t de Student cuando se midieron en la escala continua y con la prueba χ2 o con la prueba exacta de Fisher cuando las variables se midieron en la escala nominal u ordinal. Se determinó como diferencia significativa p menor de 0.05.
Resultados
Se estudiaron n = 10 pacientes con diagnóstico de quemaduras de tercer grado en la Unidad de Quemados del Hospital General de la ciudad de Chihuahua candidatos a toma y trasplante de ICDML. Las variables de los pacientes estudiados se muestran en la Tabla 1 sin encontrar diferencia significativa en los rangos de edades ni en el género de los pacientes estudiados. En la Tabla 2 se describen las características clínicas de los pacientes y de las zonas receptoras en las que se observa una mediana de 110 cm2 en los pacientes a quienes se aplicó PRPAA en comparación con 200 cm2 de quienes no se les aplicó, a su vez los niveles séricos de albúmina, que es un indicador del estado nutricional, no variaron en el grupo estudiado ni en el comparado. El tipo de quemadura fue similar en ambos grupos, sólo hubo un paciente del grupo control con quemadura eléctrica en relación con el resto, que en la totalidad fue por fuego directo.
Tabla 1: Características de los grupos estudiados.
| Variable | Pacientes tratados con PRP - X ± DE/n (%) |
Pacientes tratados con placebo - X ± DE/n (%) |
p |
|---|---|---|---|
| Edad (años) | 50 ± 9 | 49 ± 16 | 0.88 |
| Género | 0.52 | ||
| Masculino | 2 (40) | 4 (80) | |
| Femenino | 3 (60) | 1 (20) | |
| Escolaridad | 1.00 | ||
| Analfabeta | 3 (60) | 1 (20) | |
| Primaria | 2 (40) | 3 (60) | |
| Secundaria | 0 | 0 | |
| Preparatoria | 0 | 1 (20) | |
| Universidad | 0 | 0 | |
| Nivel socioeconómico | 1.00 | ||
| Bajo | 5 (100) | 4 (80) | |
| Medio | 0 | 1 (20) | |
| Alto | 0 | 0 | |
| Tabaquismo | 1.00 | ||
| Sí | 1 (20) | 1 (20) | |
| No | 4 (80) | 4 (80) |
Tabla 2: Características de los pacientes tratados con y sin PRP.
| Variable | Pacientes tratados con PRP - X ± DE/n (%) |
Pacientes tratados con placebo - X ± DE/n (%) |
p |
|---|---|---|---|
| Área receptora del injerto (cm2)* | 110 (100-200) | 200 (135-300) | 0.81 |
| Albúmina (g/dl) | 2.3 ± 0.52 | 2.54 ± 1.00 | 0.81 |
| Leucocitos (k/µl) | 7.8 ± 4.00 | 7.64 ± 4.00 | 0.64 |
| Tipo de quemadura | 0.94 | ||
| Fuego | 5 (100) | 4 (80) | |
| Química | 0 | 0 | |
| Eléctrica | 0 | 1 (20) | |
| Tiempo de exposición (min) | 3.2 ± 2.00 | 2.8 ± 2.00 | 0.75 |
1Expresada en mediana y RIC.
Se detectó una adhesión de 100% en los ICDML del grupo tratado con PRPAA a diferencia del grupo placebo, con una media de 92%. Se observó mayor incidencia de cultivos positivos para microorganismos patógenos en el grupo placebo (80%) en comparación con el grupo del PRP (20%). Respecto al dolor sólo hubo un paciente del grupo placebo referido en la escala 5/10 al quinto día de la intervención.
Histopatológicamente se apreciaron diferencias significativas en las muestras del grupo control con respecto a los grupos caso, entre ellas disminución de la fase aguda de la inflamación, aumento de la respuesta de inflamación crónica, incremento del grosor en el estrato córneo, aumento de vasos de neovascularización por campo y reacción granulomatosa en los grupos caso. La fibrosis fue muy similar en ambas muestras. Como se observa en las Tablas 3 y 4 las muestras de los pacientes con aplicación de PRPAA revelan datos de aceleración en el proceso de inflamación, de aguda a crónica con aumento de los vasos que nutren de la zona receptora al injerto, lo cual sugiere mayor adhesión y porcentaje de éxito en estos pacientes en comparación con los del grupo placebo (Tablas 3 y 4).
Tabla 3: Características morfológicas de las biopsias (caso).
| Paciente | Inflamación aguda/edema | Inflamación crónica | Reacción granulomatosa | Vasos de neoformación (tejido de granulación) |
Fibrosis |
|---|---|---|---|---|---|
| 1 | +++ | ++ | - | ++ | - |
| 2’ | + | +++ | ++ | +++ | + |
| 2 | + | +++ | ++ | +++ | ++ |
| 3 | - | ++ | - | ++ | - |
| 4 | + | ++ | + | ++ | + |
| 5 | + | +++ | - | +++ | +++ |
Discusión
Durante 2013 se reportaron en México 126,786 casos de quemaduras, de los cuales 56% de ellas ocurrieron en pacientes que se encuentran dentro de la edad productiva con un promedio de 20 a 50 años de edad. Un 85% del total de los accidentes se presentaron durante el horario laboral.18
En la Unidad de Quemados del Hospital General del Estado de Chihuahua se colocaron 86 ICDML durante 2013. La mayoría de los injertos se llevan a cabo en pacientes con múltiples morbilidades, propias del paciente o adquiridas durante el proceso de la quemadura o su recuperación, es decir, no se encuentran en las mejores condiciones clínicas ni nutricionales, aunado a ello la gran mayoría son de nivel socioeconómico y cultural bajo, las morbilidades propias de los diferentes grupos así como la reacción de compensación sistémica, lo que conduce a desnutrición y desbalance en el metabolismo normal o ideal,19 por lo cual la teórica cifra de 100% de adhesión del injerto no se lleva a cabo y por lo tanto da como resultado una inadecuada integración con la subsecuente pérdida del injerto. La falla de los ICDML ocasiona reintervenciones subsecuentes para retiro de tejido necrótico, aseos quirúrgicos múltiples, en caso de no existir zona donadora, la espera es de 10 a 12 días para retomar piel y nuevamente injertarla.20,21
La idea general detrás del éxito de PRPAA en la mejora de la curación está basada en el mayor nivel de factores de crecimiento administrados directamente a la herida así como en la reducción del tiempo de recuperación.16 La eficacia del PRP brinda la oportunidad de agregar una herramienta más al éxito de los injertos y puede ser una opción en el tratamiento del paciente con quemaduras consideradas de tercer grado. Neil Grant et al.1 confirman que la aplicación de PRPA autólogo a las quemaduras de segundo grado pueden acelerar el proceso de curación en ratas, pero no tiene efectos en las quemaduras de tercer grado. Una posible explicación del cierre más rápido de la herida en las quemaduras de segundo grado tratadas con PRP es: para que el PRPA autólogo sea efectivo puede necesitar algún sustrato como las células epiteliales restantes ubicadas en los folículos capilares y las glándulas sudoríparas que son características de las quemaduras de segundo grado, pero faltantes en las de tercer grado. Sin embargo, al igual que nuestro estudio a la microscopia el tejido de granulación se encontraba más desarrollado en las ratas tratadas con PRP que en el grupo control.
Destacamos que estos resultados contradictorios podrían ser debido a la variabilidad de los productos o procedimientos de PRP (es decir, no se obtuvo una concentración adecuada de PRP), al diseño deficiente de los estudios realizados o simplemente a la falta de efecto del PRP.
Hom et al.1 trataron biopsias experimentales con PPR en seres humanos y observaron un tiempo de cicatrización más rápido en comparación con el grupo control. Schade y Roukis16 observaron que la curación progresaba en pacientes con úlceras de pie diabético tratados con injerto cutáneo mallado, al igual que en nuestro estudio al aumentar el porcentaje de adhesión el tiempo de recuperación se acorta. Amable10 y Kaffashi17 encontraron resultados de recuperación clínica e histopatológicamente similares a los nuestros utilizando PRP alogénico (Figuras 2 y 3).
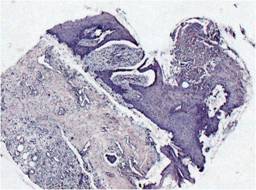
Figura 2: 4x, técnica HE, control. Se observa abundante inflamación aguda, infiltrado de neutrófilos intradérmicos y en dermis, edema, escasos vasos de neoformación.
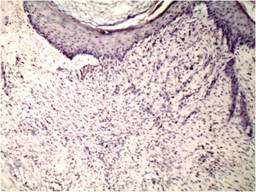
Figura 3: 4x, técnica HE, caso. Epidermis con datos de queratinización, en dermis se observan abundantes vasos de neoformación y datos de reacción inflamatoria crónica.
A diferencia de la literatura revisada nuestro estudio se enfocó en el uso de PRPAA en pacientes específicos, en quienes las variables no fueron significativas con respecto a los sesgos, además en la bibliografía estudiada sólo se encontraron reporte de casos, protocolos que no fue posible concluir o experimentación en animales. Nuestro estudio se llevó a cabo como ensayo clínico, además tuvo como innovación tratar el plasma alogénico. Se demostró que no hay efectos secundarios con mejoría en el curso clínico, ya que estos pacientes en su mayoría presentan desnutrición o niveles bajos de hemoglobina, lo que impide extraer sangre para hacer el preparado.
Nuestra principal limitante fue la cantidad de pacientes que cumplieron con los requisitos específicos en el cronograma acordado para este estudio, por lo cual se llevó a cabo como piloto.











 nueva página del texto (beta)
nueva página del texto (beta)


