Introducción
Los tumores del estroma gastrointestinal (conocidos como GIST por sus siglas en inglés) constituyen un grupo de tumores no epiteliales raros, cuya incidencia estimada es de 10 a 20 casos por cada millón de personas.1,2 Los GIST pueden aparecer a cualquier edad, pero predominan en personas de 40 a 70 años.3 Son los tumores mesenquimatosos más comunes del aparato digestivo (estómago, intestino delgado, mesenterio, hígado, retroperitoneo y epiplón) y se localizan con más frecuencia en el estómago (50-60%), seguido por el intestino delgado (30-40%).4
La gran mayoría de los GIST tienen mutaciones activadoras en el gen KIT de la tirosina cinasa y el gen del receptor alfa del factor plaquetario de crecimiento (PDGFRA), que codifican miembros de la familia de las tirosina cinasas receptoras transmembrana de tipo III. Con menor frecuencia, se han descrito GIST con mutaciones en otros genes, como BRAF, NF1, los genes del complejo enzimático SDH y el gen EGFR.5 Desde que se conocen las características moleculares, se introdujo el tratamiento dirigido con inhibidores de la tirosina cinasa (ITC), como el imatinib, para tumores avanzados y metastásicos de alto riesgo.
Los GIST gástricos son clínicamente asintomáticos hasta que alcanzan un tamaño considerable; en la mayoría de los casos, se diagnostican de manera fortuita. La resección quirúrgica ha sido la piedra angular del tratamiento de los GIST y hasta la fecha es el único tratamiento que puede ser curativo.3
Presentamos el reporte de un caso de GIST gigante con base en los criterios SCARE.6
Cuadro clínico
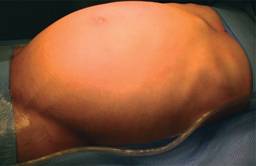
Un hombre de 39 años acudió a nuestro servicio por dolor abdominal acompañado de una masa palpable gigante e indolora. Había perdido entre 3 y 4 kg en un periodo de dos a tres meses. Presentaba distensión abdominal progresiva (Figura 1) y evacuaciones normales, sin sangre ni moco en las heces. Refería astenia, adinamia y malestar general. Sus signos vitales eran: presión arterial, 100/60 mmHg; frecuencia cardiaca, 76 lpm; frecuencia respiratoria, 16 rpm; temperatura, 36.0 oC. En la exploración física se le encontró pálido y caquéctico, con el abdomen distendido y asimétrico a la vista. La palpación reveló una masa sólida, junto con una masa gigante, bien definida y de bordes asimétricos, que ocupaba todos los cuadrantes.
Una tomografía computarizada (TAC) con contraste reveló un gran tumor de 38 × 24 × 32 cm (Figura 2), de probable origen mesentérico. La masa demostró una captación heterogénea del medio de contraste y componentes internos de baja densidad. Las estructuras vasculares en torno a la lesión estaban desplazadas hacia atrás y arriba del peritoneo. Se realizó una biopsia dirigida con ultrasonido que reveló un tumor del estroma gastrointestinal con células tumorales fusiformes, con un índice mitótico de dos por cada 50 campos de gran aumento; el índice de proliferación Ki-67 era de 4 a 6%.
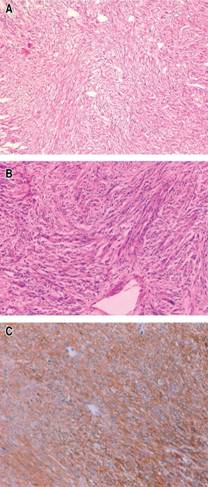
El tumor se extirpó por una incisión medial, de la apófisis xifoides hasta el pubis. Después de identificar y ligar los múltiples vasos que irrigaban la masa (Figura 3), se realizó una resección en cuña del estómago con una engrapadora lineal. No hubo rupturas ni fugas del tumor, ya que se envolvió en una gran bolsa de plástico para movilizarlo y extirparlo. La pieza quirúrgica fue una masa de bordes irregulares que pesó 13 kg y midió 49 × 45 × 15 cm. Desde el punto de vista histopatológico, se trató de un tumor del estroma gastrointestinal de células fusiformes bien diferenciado (de bajo grado),1 pT4 (de más de 10 cm), de riesgo intermedio (índice mitótico menor de cinco por cada 50 campos de gran aumento y mayor de 10 cm), que se resecó en su totalidad (Figuras 4 A-C).
No hubo complicaciones postoperatorias y el paciente a la fecha tiene 15 meses de operado, sano y sin indicios de recurrencia.
Discusión
Los tumores del estroma gastrointestinal constituyen un grupo de tumores raros cuya incidencia se calcula en 10 a 20 casos por cada millón de personas en Estados Unidos.1,2 Estos tumores representan las neoplasias mesenquimatosas más frecuentes del aparato digestivo.1 Mazur y Clark acuñaron el término “tumor estromal” en 1983.7 En la actualidad, se propone que los GIST se originan de las células intersticiales de Ramón y Cajal.3
Los GIST se caracterizan por mutaciones en los genes KIT y PDGFRA, que codifican tirosina cinasas receptoras. Las mutaciones de KIT están presentes en 60 a 85% de los GIST, mientras que las mutaciones de PDGFRA se hallan en 10 a 15% de los GIST. Sin embargo, entre 10 y 15% de los GIST no presentan mutaciones detectables en ninguno de estos receptores, aunque se han descrito en los genes BRAF, NF1, los genes del complejo enzimático SDH y el gen EGFR.5 Zeng y sus colaboradores8 explican que la vía de transducción de señales Wnt/β-catenina interviene en la progresión tumoral y la resistencia al imatinib. Por otra parte, Geddert y su grupo señalan que el biomarcador de células madre cancerígenas CD133, un bajo grado de metilación del ADN y una concentración alta de la proteína se asocian significativamente con tumores más grandes y una supervivencia más corta sin recurrencia.9 Estas observaciones parecen indicar la existencia de otras vías de señalización molecular en la patogénesis de estos tumores. Se recomienda de forma enfática incluir un análisis molecular sistemático entre los procedimientos diagnósticos de todos los GIST, dado el tipo de información predictiva y pronóstica que ofrece en casos de GIST sin expresión de CD117.5
El cuadro clínico es variable y depende del tamaño del tumor y su localización. Los síntomas suelen ser inespecíficos.3,4 Las manifestaciones más frecuentes son anemia, pérdida de peso, sangrado gastrointestinal y dolor abdominal.3 Por lo menos entre 10 y 30% se diagnostican por casualidad, mientras que el 70% de los pacientes presentan una amplia gama de manifestaciones clínicas. Entre 15 y 50% de los pacientes tienen metástasis.10 No hay un signo físico que indique específicamente la presencia de un GIST. Los estudios de imagenología de primera elección son la TAC y la resonancia magnética (RM). La TAC con contraste intravenoso permite identificar posibles hemorragias, calcificación intratumoral y lesiones hepáticas hipervasculares, mientras que la RM sirve para visualizar los tumores en el área pélvica y estudiar la extensión mesentérica y peritoneal. Aunque estas opciones de imagenología sirven para establecer un diagnóstico de presunción, ninguna es muy específica5 y el diagnóstico definitivo se obtiene mediante análisis histopatológico de una muestra de biopsia. Las características histológicas de los GIST permiten clasificarlos como de células fusiformes (70%), de células predominantemente epitelioides (20%) o de una mezcla de células fusiformes y epitelioides.11 El marcador inmunohistoquímico más utilizado para el diagnóstico es la CD117; en más del 95% de los casos se obtiene una tinción positiva, y en el 75% de ellos, una tinción intensa. Otros marcadores utilizados son CD34 (expresión positiva en 70-90% de los casos), actina (20-30%), S-100 (10%) y desmina (2-4%).5 A pesar de estos marcadores, los factores necesarios para clasificar el riesgo de recurrencia en cada paciente dependen del tamaño del tumor, el índice mitótico y la localización. Si el tumor mide menos de dos centímetros y el índice mitótico es menor de cinco por cada 50 campos de gran aumento, el riesgo es muy bajo. Además, los GIST gástricos tienen un mejor pronóstico.5
Los GIST suelen ser radiorresistentes e insensibles a la quimioterapia. Por esta razón, la cirugía sigue siendo el principal tratamiento para pacientes sin indicios de metástasis.12 La presencia de metástasis no es una contraindicación para el tratamiento quirúrgico, pero la infiltración del tronco celíaco, de la arteria mesentérica superior y de la confluencia portomesentérica sí lo es. La cirugía laparoscópica es aceptable en caso de tumores de menos de cinco centímetros de diámetro. No debe realizarse linfadenectomía, por la poca frecuencia de metástasis linfáticas de estos tumores.5
Antes del advenimiento de los tratamientos adyuvantes, la tasa general de supervivencia a cinco años de los pacientes sometidos a extirpación quirúrgica de tumores localizados era del 70%. Por otra parte, antes de la administración de inhibidores de la tirosina cinasa (ITC), la mediana de la supervivencia general de los pacientes con enfermedad avanzada era de 20 meses. La introducción de los ITC ha modificado considerablemente la historia natural de esta enfermedad, y la mediana de la supervivencia general en los pacientes con GIST metastásicos hoy en día es mayor de cinco años.12
Varios estudios clínicos han evaluado el papel del imatinib como tratamiento adyuvante. El tratamiento adyuvante no está indicado en los pacientes de bajo riesgo; en los pacientes de riesgo intermedio, no hay suficientes evidencias que lo justifiquen, mientras que los pacientes de alto riesgo deben recibir un tratamiento con 400 mg de imatinib al día durante tres años.5
Se han descrito tumores de 10 cm en adelante por Misawa (10 cm),13 Bara (12 cm),14 Sun (13 cm),15 Dal Corso y Vinagreiro (17 cm),16,17 Schneider (19 cm) y sus respectivos colaboradores.18 En varios casos se reportaron masas tumorales de hasta 20 a 30 cm. Zhou (21 cm),11 Fukuda (22 cm),19 Miyazaki (23 cm),2 Patil10 y sus grupos comunicaron cuatro casos y revisaron 21 más de GIST, mientras que Sorour y sus colegas3 registraron 90 casos; estos dos últimos autores describieron tumores de 30 cm. Navarrete y su equipo20 analizaron un tumor mayor de 30 cm (32 cm), lo mismo que hicieron Schmieder y sus colaboradores en una cohorte de 558 pacientes.21 Wang y y su grupo reportaron un tumor de 34 cm,1 y Cappellani y sus colegas, un tumor de 37 cm y 8.5 kg;22 este último es el tumor más grande que encontramos mencionado en la literatura médica. Aquí presentamos el caso de un GIST gigante que se manifestó con síntomas sistémicos y gastrointestinales inespecíficos. Un tumor de 49 cm y 13 kg podría representar, a nuestro entender, el GIST más grande reportado hasta la fecha. De hecho, esta es la primera mención de un GIST mayor de 40 cm.
Conclusiones
En conclusión, los GIST son tumores raros. La mayoría de los pacientes no muestran síntomas y el diagnóstico es fortuito. El tratamiento ha cambiado considerablemente en las últimas décadas. Presentamos un caso de un tumor de 49 cm y 13 kg; hasta donde sabemos, este tumor podría representar el GIST más grande descrito en la literatura médica.











 nueva página del texto (beta)
nueva página del texto (beta)