Introducción
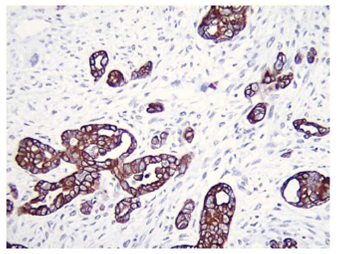
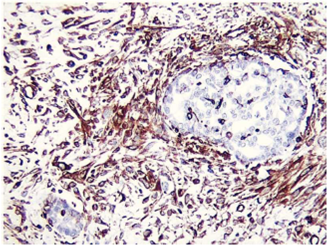
El carcinosarcoma (CS) o tumor mixto mulleriano maligno (TMMM) de ovario constituye el 1% de las neoplasias ováricas. Se han reportado cerca de 400 casos en la literatura mundial1. Histopatológicamente el CS está formado por un componente epitelial y otro mesenquimal, ambos malignos; el segundo puede tener elementos homólogos (tejido normalmente encontrado en el ovario) o heterólogos (elementos no encontrados normalmente en el ovario). También se lo ha denominado sarcoma mixto mesodérmico cuando el carcinoma tiene componentes mesenquimales heterólogos y CS cuando tiene componentes mesenquimales homólogos (figuras 1 y 2)2. Según la Organización Mundial de la Salud (OMS), está clasificado como un subtipo de los tumores epiteliales, generalmente de alto grado3.
El CS o TMMM es el más frecuente de los sarcomas primarios de ovario4. No se han descrito factores predisponentes para el desarrollo de este tipo de neoplasia en el ovario. Se ha utilizado para su caracterización parámetros clínicopatológicos e inmunohistoquímicos como p53 y Ki67, útiles para su identificación en algunas ocasiones5, queratina, vimetina y focalmente actina, los cuales son fuertemente positivos (figuras 1 y 2)6.
Se caracterizan por presentar un curso clínico agresivo y en la mayoría de los casos se presentan en etapas avanzadas7. Son indistinguibles de las neoplasias epiteliales malignas de ovario; algunos autores han referido como dato distintivo la presencia de ascitis hemorrágica en etapas avanzadas. Los marcadores tumorales utilizados en estos casos, como el CA125, son inespecíficos, al igual que la lactato deshidrogenasa (DHL). Se caracteriza por su mal pronóstico8,9. Como en las neoplasias epiteliales de ovario, en el CS la cirugía es la piedra angular de manejo, y la citorreducción óptima es un factor preponderante en el pronóstico10. Se han propuesto diferentes esquemas con quimioterapia, principalmente a base de cisplatino en combinación con otros citotóxicos, opción que ha dado buenos resultados en los tumores epiteliales; sin embargo, en el CS los resultados son muy variables entre los diferentes autores y son desalentadores, porque la dificultad de estudios radica en la rareza de la neoplasia11. El objetivo de este estudio es presentar la experiencia del Departamento de Ginecología del Instituto Nacional de Cancerología en el manejo de esta neoplasia.
Pacientes y métodos
En el periodo de 1 de enero de 2005 al 31 de diciembre de 2008, se recibió a 192 pacientes con el diagnóstico de neoplasias malignas primarias de ovario en el Departamento de Ginecología Oncológica del Instituto Nacional de Cancerología de México; se identificó un total 16 pacientes con sarcomas primarios de ovario y tumores metastásicos al ovario, de las que a 8 (4.16%) se las diagnosticó como CS o TMMM. De las 8 pacientes, se operó inicialmente en otra institución a 5. Todas las pacientes pasaron el protocolo de estu dio mediante análisis de laboratorio (biometría hemática, química sanguínea, pruebas de función hepática, tiempo parcial de tromboplastina y tiempo de trombina, CA125), radiografía de tele de tórax y tomografía computarizada (TC).
Se practicó a todas las pacientes laparotomía exploradora, citorreductora y etapificadora mediante un abordaje abdominal de línea media supraumbilical e infraumbilical, lavado peritoneal, histerectomía tipo I, salpingooforectomía bilateral, omentectomía infracólica, linfadenectomía pelviana bilateral y paraaórtica, y biopsias múltiples peritoneales (estas, en ausencia de enfermedad extraovárica), llevadas a cabo por cirujanos oncólogos y ginecólogos oncólogos adscritos al departamento de ginecología. En la cirugía, el residuo tumoral fue clasificado como óptimo (< 1 cm) y subóptimo (> 1 cm). En todos los casos se planteó manejo con quimioterapia postoperatoria a base de carboplatino (6AUC) y taxol (175 mg/m2). En todos los casos, dos patólogos oncólogos del Departamento de Patología expertos en la revisión de tumores ginecológicos realizaron la revisión histopatológica.
Resultados
La frecuencia de CS o TMMM en esta serie fue el 4.1% (8/192 casos) de todos los tumores malignos primarios de ovario. La media de edad de las 8 pacientes era 51.1 (mediana, 51; intervalo, 20-67) años. La presentación clínica inicial fue dolor y distensión abdominal en el 62.5% y masa palpable y sangrado transvaginal en el 25%, con una duración promedio de los síntomas de 4.68 (0.5-12) meses. La determinación de CA125 fue de 1.7-693 U/ml, el cual se determinó en 6 casos (promedio, 259.8 U/ml); en los dos casos restantes no se encontró registrado en el expediente.
El 62.5% de las pacientes (5/8) llegaron al instituto operadas de forma incompleta. A estas pacientes, tras pasar el protocolo de estudio, se las operó para completar la cirugía etapificadora y citorreductora, como manejo inicial en nuestra institución. Las etapas tras la cirugía fueron: etapa I, 2 pacientes; etapa II, 1 paciente; etapa III, 2 pacientes; etapa IV (por metastásis pulmonares), 2 pacientes; 1 paciente no fue etapificada. De las pacientes en EC III, una quedo con residuo óptimo y otra con residuo subóptimo. Dos pacientes en etapa IV y la paciente que no fue etapificada por malas condiciones generales no fueron llevadas a cirugía. Ninguna paciente sometida a cirugía presentó complicaciones quirúrgicas mayores que retrasaran su estancia hospitalaria ni el tratamiento con quimioterapia.
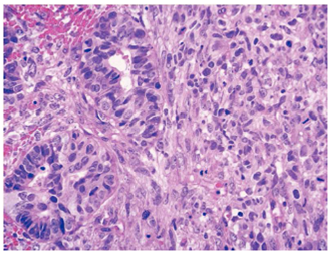
En el estudio histopatológico tanto de las piezas operatorias como de la revisión de laminillas, en todos los casos se estableció el diagnóstico de CS o TMMM primario de ovario; el componente epitelial maligno fue de tipo glandular, aunque puede ser de tipo no glandular; los más frecuentes son el carcinoma escamoso y el indiferenciado. El componente glandular usualmente es de tipo endometrioide, pero el carcinoma seroso papilar o de células claras también puede presentarse. El componente sarcomatoso puede ser homólogo o heterólogo. En los primeros el componente mesenquimatoso corresponde a un sarcoma indiferenciado, leiomiosarcoma o sarcomas del estroma endometrial. Cuando el componente mesenquimatoso es de tipo heterólogo, con más frecuencia corresponde a cartílago o músculo estriado maligno en forma de rabdomioblastos, aunque puede presentarse cualquier tipo de diferenciación (figuras 3 y 4).

Figura 3 Neoplasia bifásica constituida por áreas de condrosarcoma y adenocarcinoma poco diferenciado (×100).
Ambos componentes mesenquimatoso y epitelial son fácilmente identificados al estudio histológico y se encuentran bien demarcados, aunque en algunos casos puede observarse transición entre ambos componentes. Por estudios de inmunohistoquímica, los elementos epiteliales son positivos a citoqueratinas y los componentes mesenquimatosos, a vimetina. En las neoplasias heterólogas, otros marcadores de inmunohistoquímica pueden resultar positivos dependiendo del tipo de diferenciación. Por otro lado, la positividad de ambos componentes a TP53 apunta al origen monoclonal de ambos componentes (figuras 1 y 2). El componente homólogo estuvo presente en 5 pacientes y el heterólogo en 3.
En todos los casos se planteó la utilización de quimioterapia, pero solo aceptaron 4 (EC III, 2 pacientes; EC IV, 1; no clasificable, 1) a base de carboplatino/taxol; el número de ciclos fue seis; adyuvante en 2 casos y paliativa en 2 por enfermedad metastásica pulmonar y por enfermedad no clasificable. No se reportó el grado de toxicidad en ninguno de los casos. El intervalo del seguimiento fue de 1-42 (promedio, 24) meses; 4 pacientes estaban en seguimiento con supervivencia libre de enfermedad a los 42 meses del 37.5% (etapa I, 2; etapa II, 1; etapa III, 1), 3 pacientes con actividad tumoral (EC III, 2 pacientes), 2 pacientes habían fallecido (la no etapificada y la de etapa IV).
Discusión
El CS de ovario es una neoplasia rara que se presenta en el 1% de los tumores malignos del ovario, en nuestra serie la frecuencia fue del 4.1% y la edad de las pacientes (promedio, 51.1 años), casi 15 años menor que lo reportado en la literatura (> 65 años)11.
Entre los factores pronósticos más importantes, está el residuo tumoral como resultado de la cirugía inicial, y el principal objetivo del procedimiento quirúrgico es retirar implantes visibles. Silasi et al reportaron 22 pacientes con diagnóstico de CS en etapas avanzadas, cuando se logró citorreducción óptima (residuo tumoral < 1 cm); la supervivencia fue de 46 meses, mientras que cuando la citorreducción fue subóptima (residuo tumoral > 1 cm) fue de 26 meses12. De nuestra serie, se llevó a cirugía al 62.5%, 3 pacientes en etapas tempranas (EC I, 2; EC II, 1) y 3 pacientes en etapas avanzadas (EC III); de estas, en 2 se logró citorreducción óptima (75%) y en 1, subóptima (25%).
Sood et al estudiaron 47 casos de CS, y en el análisis multivariable la citorreducción fue el factor más significativo (p < 0.001) seguido por el subtipo histológico (p < 0.02), con una diferencia en la supervivencia de 25 frente a 8 meses entre la citorreducción óptima y la subóptima3. Para otros autores, la citorreducción óptima se ha asociado a aumento del periodo libre de recaídas (p = 0.001), pero no a la supervivencia13. A pesar del tamaño de nuestra serie, sí se halló correlación entre el residuo y la supervivencia.
La supervivencia en etapas tempranas (I y II) fue estadísticamente mayor que para las pacientes con etapas avanzadas (III y IV). La misma tendencia se observó en nuestra serie, pero el número de casos es pequeño para obtener conclusiones. La etapa temprana es el factor pronóstico más significativo en el CS de ovario; las series publicadas son pequeñas por la rareza de la neoplasia, y dicha aseveración se ha tomado de las neoplasias epiteliales del ovario14. Nuestras pacientes con etapas tempranas tuvieron mejor supervivencia.
En la serie de Harris et al, la más grande de una sola institución (40 pacientes), la supervivencia fue de 32.9 meses debido a que fueron frecuentes las etapas tempranas15. Diferentes reportes han propuesto que la existencia de componentes homólogos o heterólogos modifica el pronóstico de las pacientes; Cicin et al reportaron que en relación con los componentes homólogos y heterólogos existe diferencia significativa en supervivencia media (50 frente a 9.7 meses; p = 0.042) y el intervalo libre de progresión (25 frente a 7.7 meses; p = 0.05)14.
En nuestros casos, independientemente de los componentes homólogos o heterólogos, obtuvimos una supervivencia del 37.5% a los 42 meses; sin embargo, es una serie pequeña cuyos resultados se deberá analizar cuidadosamente. Zorzou et al estudiaron una serie de 9 pacientes, y el 53% de ellas sobrexpresaba p53, y se vio que mejoraba la supervivencia pero no de manera estadísticamente significativa (p = 0.6). Por inmunohistoquímica, se ha utilizado EMA, S100, vimetina, Ki67 y CD45RO, pero no son indicadores pronósticos significativos16. En el 50% de los casos se utilizó inmunohis-toquímica para identificar la neoplasia. En otros estudios, el análisis multivariable considera factores pronósticos el componente estromal (p = 0.02), la citorreducción subóptima (p = 0.01), la edad (p = 0.01) y el componente epitelial seroso (p = 0.05)17.
Se han publicado casos de CS de ovario asociados a mutación del gen BRCA2 y se ha apuntado con base en ello que ambos elementos del tumor (epitelial y mesenquimal) pueden tener un origen común18. La utilización de la quimioterapia en porcentaje de efectividad es en este tipo de neoplasia mucho menos efectiva que en los tumores epiteliales. Se han probado diferentes citotóxicos. La utilización de adriamicina en monoterapia no ha sido efectiva; en varios estudios los esquemas que han utilizado platino tienen una respuesta global de un 64-85%. Cicin et al, en su revisión de 26 casos, observaron que los esquemas a base de platino (platino/taxol y platino/ifosfamida) mejoraron estadísticamente la supervivencia (36 frente a 9.7 meses; p = 0.04)14. El esquema ideal de quimioterapia aún permanece desconocido19.
El platino tiene una actividad definida en las pacientes con CS de ovario; en 3 de 4 pacientes de nuestra serie se vio respuesta completa a la quimioterapia a base de platino. Estudios futuros con nuevos citotóxicos son difíciles de llevar a cabo por lo poco frecuente de la neoplasia20. El uso de platino e ifosfamida da un nuevo horizonte a los taxanos, pero se deberá esperar a nuevos ensayos21. Sood et al reportaron en 1998 un 80% de respuesta con regímenes a base de platino, y sin platino solo un 20% de respuesta3. Sin embargo, en la serie de Brown et al, se obtuvo respuesta al platino en el 25% de 70 casos, menos que lo reportado en la literatura22.
Se ha intentado otras alternativas, como el uso de quimioterapia intraperitoneal. Xanthoulis et al reportaron 2 casos de enfermas que lograron citorredución óptima utilizando doxorubicina intraperitoneal y se mantuvieron libres de enfermedad 2 y 3 años23. Intrasorn et al encontraron que las pacientes menores de 65 años tenían mejor supervivencia que las mayores de 65 años (p = 0.02)24. En nuestra serie solo 1 paciente era mayor de 65 años.
En conclusión, el CS o TMMM primario de ovario es una neoplasia rara, biológicamente agresiva. La cirugía es la piedra angular de su tratamiento y la citorreducción óptima es el factor pronóstico más importante, similar al cáncer epitelial de ovario, y la quimioterapia deberá considerarse como manejo adicional en todas las etapas clínicas, debido a la histología de mal pronóstico.











 text new page (beta)
text new page (beta)