Introducción
Una fístula aortoentérica (FAE) es una comunicación anormal entre la aorta y el tubo digestivo1. Fue descrita por primera vez por sir Astley Cooper en el siglo XIX2-4. La incidencia de las fístulas aortoentéricas primaras (FAEp) varía del 0.04 al 0.07%, mientras que las secundarias (FAEs) van del 0.4 al 2.4%3,5. Puede afectar a cualquier porción del tubo digestivo, pero el duodeno es el más involucrado (hasta el 83% de los casos)3,4. Las FAE son una de las afecciones más complejas de diagnosticar y tratar. El antecedente de cirugía aórtica, la presencia de una cicatriz abdominal y sangrado gastrointestinal reciente deben hacernos sospecharla6.
Del 11 al 28% de los pacientes se presentará con la tríada clásica de sangrado gastrointestinal, dolor abdominal y masa pulsátil en el abdomen2,3.
La patogenia sigue sin comprenderse del todo; se han propuesto varias teorías: en una de ellas, la fístula se facilita por la falta de tejido retroperitoneal interpuesto entre el material protésico y el intestino adyacente, lo que lleva a erosión; también se cree que una infección indolente del injerto puede promover adherencias inflamatorias, destrucción y fistulización del tracto digestivo4,6. La tomografía computarizada (TC) abdominal se ha convertido en la modalidad diagnóstica. Su sensibilidad es de un 40-90% y la especificidad, de un 33-100%7. La pérdida de la pared del aneurisma, aire en retroperitoneo, la extravasación del medio de contraste y la destrucción del plano graso entre el aneurisma y el duodeno orientan al diagnóstico de FAE4. También se puede emplear la esofagogastroduodenoscopia, aunque el reporte endoscópico negativo no excluye la posibilidad de FAE4,5. El tratamiento convencional consiste en cirugía abierta con bypass extraanatómico y ligadura de la aorta, cierre del tracto fistuloso y escisión completa de los materiales protésicos8. La mortalidad es elevada, superior al 75%5.
Caso clínico 1
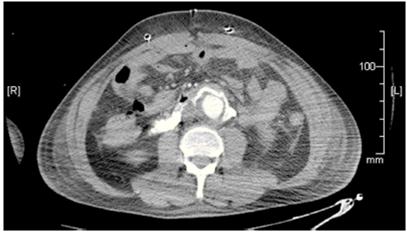
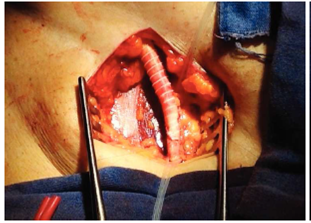
A un varón de 58 años de edad, con tabaquismo y alcoholismo desde su juventud, claudicación de extremidades inferiores, 5 días antes de su ingreso se le inició dolor abdominal en mesogastrio y flanco derecho; 72 h después presentó evacuaciones melénicas, diaforesis y debilidad. Se le realizó endoscopia, que informó de gastritis crónica, restos hemáticos en cámara gástrica y úlcera duodenal Forrest IIB en bulbo duodenal. El control endoscópico ulterior mostró obstrucción del campo visual por sangrado activo, a lo que se agregan datos de choque hipovolémico. Se realizó laparotomía exploradora con ligadura de la arteria gastroduodenal, duodenotomía con cierre de úlcera duodenal y duodenorrafia, además de enteroscopia transoperatoria, sin evidencia de sangrado. En la evolución posquirúrgica, se encontró una masa pulsátil en el abdomen y disminución gradual de hemoglobina. Se le realizó TC abdominal contrastada y arteriografía, donde se corroboró un aneurisma de la aorta abdominal infrarrenal con comunicación a duodeno (figuras 1 y 2). Se lo programó para nueva laparotomía en conjunto con los servicios de angiología y cirugía vascular, y se encontró aneurisma de 7 × 7 cm con comunicación a la cuarta porción duodenal de 4 mm (figura 3). Se practicó cierre primario del defecto duodenal y bypass axilofemoral con injertos sintéticos. El paciente presentó después datos de isquemia de extremidad inferior derecha, y se lo sometió a amputación supracondílea.
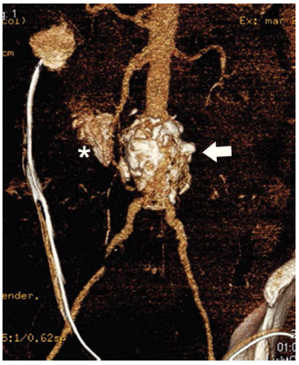
Figura 2 Reconstrucción 3D, muestra la presencia de aneurisma de la aorta abdominal infrarrenal (fl echa blanca) con fístula aortoentérica (asterisco).
Caso clínico 2
Varón de 72 años de edad, sin toxicomanías, con antecedente de hipertensión arterial sistémica de 35 años de evolución, dislipemia, liposarcoma con desarticulación de extremidad inferior izquierda y aneurisma de la aorta abdominal infrarrenal, diagnosticado 17 años antes, de 8 × 8 cm, con trombo mural, se sometió a derivación aortoiliaca derecha con injerto de dacrón 3 meses antes de su ingreso. Había iniciado su padecimiento 12 días antes, con pérdida del estado de alerta, hematemesis en una ocasión y hematoquecia en múltiples ocasiones. Se lo sometió a endoscopia superior, que informó de úlcera gástrica Forrest III, y se complementó con colonoscopia con la que no se visualizaba sitio de sangrado por abundante contenido hemático. Se acompañaba además de fiebre de 38.5 °C. Lo refirieron a nuestra institución con hemoglobina de control de 6 g/dl y hematocrito del 18.4% tras la transfusión de 6 paquetes globulares. Se realizó nueva endoscopia, que no pudo evidenciar el sitio de sangrado por el estado de inestabilidad hemodinámica. Se lo sometió a laparotomía urgente, en manejo conjunto por los servicios de cirugía general y angiologíacirugía vascular. Se encontró FAE secundaria con comunicación a la cuarta porción duodenal (figuras 4 y 5). Se retiró el injerto previo, se realizó cierre del muñón aórtico y bypass axilobifemoral (figura 6) y se desbridó el tejido intestinal necrótico (duodeno con afección de más del 50% de su diámetro). Se realizó exclusión duodenal con colocación de sonda de gastrostomía y yeyunostomía. El paciente recibió apoyo de la unidad de cuidados intensivos, pero falleció 10 h después del procedimiento.
Discusión
Una FAE es una comunicación anómala entre la aorta y algún segmento del tubo digestivo, que frecuentemente es el duodeno1,5.
El primero en acuñar el término fue sir Astley Cooper en el siglo XIX2-4,9; el primer reporte de caso fue descrito por Salman4. La división en FAEp y FAEs, así como la primera clasificación de las fístulas, la realizaron De Weese y Fry en 19621.
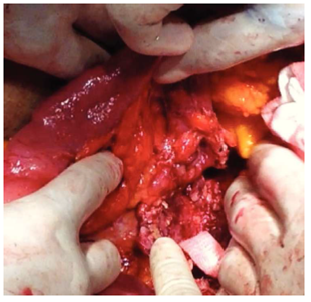
Figura 4 Fístula aortoduodenal. Diagnóstico confirmado por LAPE, abundante tejido desvitalizado intestinal y periaórtico.
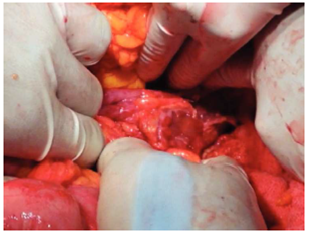
Figura 5 Orificio duodenal que afecta a más del 50% de la circunferencia y se encuentra en la cuarta porción duodenal.
Las FAEp son poco comunes. Estudios de autopsias han revelado que alrededor del 3.5% de las hemorragias intestinales altas masivas son por esta afección10. Se estima que su incidencia es de un 0.04-0.07%4,9. Las FAEs son 10 veces más frecuentes, su incidencia es de un 0.5-2.3%3,9,10. Se asocian a las cirugías vasculares. En décadas pasadas se reportaba una incidencia tan alta como del 5-10%, pero ha disminuido debido a las mejoras en las técnicas quirúrgicas, los materiales de reemplazo más adecuados, las suturas sintéticas más durables y la aposición de tejidos entre el intestino y el injerto11. Aumenta su incidencia cuando la cirugía primaria se realiza por un aneurisma de la aorta abdominal sintomá tico (0.66-1.7%) comparado con cirugía electiva por afecciones oclusivas (0.2-0.5%) o aneurismáticas (0.17%)12. Pueden ser una posible presentación de infección del injerto aórtico en un 20-25%6.
El sitio anatómico más involucrado es el duodeno (50-83%), la tercera porción se afecta en un 51-60%, la cuarta porción en un 5-8%, la segunda en el 3% y la primera en el 1%3,4,9. La afección duodenal ocurre por su posición cercana a la pared anterior de la aorta y la localización de la tercera porción entre la aorta y la arteria mesentérica superior11. También se puede encontrar FAE en esófago, yeyuno, íleon o colon4. La tasa de afección de yeyuno e íleon suele ser < 4% de los casos10. La localización menos frecuente es la colónica9.
Existe una presentación típica que consiste en la tría-da sangrado gastrointestinal (64%), dolor abdominal (32%) y masa pulsátil (25%), pero solo se presenta en un 11-28% de los pacientes4,7,9. La hemorragia digestiva alta puede ser oculta, intermitente o masiva9, en patrón típico de sangra-do centinela o “heraldo”, seguido de hemorragia masiva. En el 70% el intervalo es > 6 h; en el 50%, > 24 h, y en un 29-40%, > 1 semana. En 1914 se describió una segunda tríada, llamada de Chiari, relacionada con la FAE esofágica, y consiste en dolor centrotorácico o disfagia, hemorragia centinela y sangrado masivo tras un intervalo libre de síntomas9. Otros síntomas menos frecuentes son: dolor de espalda intermitente, fiebre, melenas y síncope4. Las FAEs se caracterizan por un sangrado intermitente de varios meses de evolución, que no siempre es masivo y se manifiesta con melenas, proctorragia o enterorragia10. Se clasifican en dos tipos: primarias y secundarias9. Las FAEp en un 66-85% son por aneurismas de la aorta abdominal (AAA), y otras causas son sífilis, tuberculosis, infecciones bacterianas, fúngicas, mixtas, adenocarcinoma de páncreas, cuerpos extraños, li-tiasis biliar, antecedente de radioterapia, úlcera péptica y divertículos complicados4,9.
Las FAEs ocurren meses a años después de la cirugía original. Bastounis et al reportan que el intervalo promedio desde la cirugía inicial a la aparición de sangrado gastroin-testinal es de 32 meses; 20 años de experiencia del hospital Johns Hopkins muestran que el promedio es de 2.8 años. El periodo más largo reportado es de 27 años y el más corto, 2 días13. Se describen dos tipos de FAEs: a) aortoentérica verdadera o injertoentérica con o sin seudoaneurisma, surge entre la línea de sutura aórtica proximal y el intestino, y es la más común, y b) paraprotésicaentérica, que no desarrolla comunicación entre el injerto y el intestino y supone el 15-20% de todas las secundarias; el sangrado ocurre en los bordes del intestino por pulsaciones mecánicas del injerto.
No está claro el mecanismo fisiopatológico de las FAE6,9,10,13. La mayoría de los casos de las fístulas primarias son por rotura de un AAA al lumen del intestino, ocasionada por la adhesión directa seguida de erosión progresiva por presión pulsátil2,3,7.
Las FAEs se producen por decúbito de un asa sobre la prótesis en su cuerpo o sus ramas (fístula paraprotésica) o sobre la línea de sutura aórtica12. La erosión se facilita por la falta de tejido retroperitoneal interpuesto o por las pulsaciones excesivas de los injertos redundantes. También se cree que una infección indolente del injerto puede promover adherencias inflamatorias y ulterior erosión6.
Es importante prevenir la elongación protésica y asegurar la cobertura de toda la prótesis con tejido retroperitoneal o con epiplón para evitar el contacto directo de la prótesis con el intestino12. También se han descrito FAEs a tratamiento endovascular, relacionadas con la anulación de la endoprótesis, migración o rotura12.
La endoscopia y la TC abdominal son las técnicas complementarias más utilizadas, aunque en la mayoría de los casos se realiza en el acto quirúrgico9,13. En la literatura ninguna prueba ha demostrado absoluta eficacia para establecer el diagnóstico de esta complicación. La combinación de endoscopia con TC abdominal podría ser la mejor opción12.
La endoscopia tiene una especificidad del 25-50% y es frecuente que se encuentren otras causas de sangrado (gastritis, duodenitis o úlcera péptica), lo que puede retardar el diagnóstico3. En ocasiones es difícil determinar el sitio exacto de hemorragia debido al gran volumen de contenido hemático en el tubo digestivo y porque el endoscopio no alcanza zonas más distales10. El diagnóstico endoscópico se realiza al encontrar una masa pulsátil extraluminal, ulceración de la pared y hemorragia activa. El hallazgo endoscópico de otras enfermedades gastrointestinales o la ausencia de hallazgos patológicos no excluye la presencia de la FAE4,12.
La angiografía convencional es de poca utilidad10,12, ya que en la mayoría de los casos el estado hemodinámico del paciente no permite realizarla1. Objetivar la comunicación requiere una hemorragia activa con pérdidas > 0.5 ml/min, que tiene una sensibilidad del 26% y especificidad del 13%9.
La TC abdominal con contraste intravenoso es el método más empleado (sensibilidad, 40-90%; especificidad, 33-100%6,8) y permite evaluar el espacio retroperitoneal, el engrosamiento del tejido intestinal adyacente, la integridad de la prótesis, la erosión de la luz intestinal y la existencia periprotésica de líquido o gas. La extravasación de contraste de la aorta a la luz intestinal es el único signo definitivo de FAE4,12. Dentro del diagnóstico diferencial tomográfico se encuentran: fibrosis retroperitoneal, aneurisma aórtico infectado, aortitis infecciosa e infección del injerto sin fistulización8.
En algunas series se propone el uso de la resonancia magnética (RM), aunque su utilidad todavía no está definida12.
La técnica quirúrgica más empleada es la resección del aneurisma o injerto protésico, cierre del muñón aórtico, reparación intestinal y bypass extraanatómico con derivación axilobifemoral5,9,12,13. Otros autores realizan la sustitución in situ de la prótesis (puede estar impregnada con rifampicina) como una alternativa menos agresiva, pero solo para casos seleccionados; está contraindicada en casos de sepsis, supuración y necrosis periaórtica y en caso de infección por bacterias Gramnegativas5,6,12. Se debe preferir la reconstrucción vascular extraanatómica cuando haya contaminación retroperitoneal difusa. Si no hay contaminación, colocar un injerto aortoaórtico es buena opción. La sobrevida del injerto a 5 años es mejor para los bypass aortoaórticos (95-100%) que para los extraanatómicos (50-80%), pero debe ponerse en balanza frente a la tasa de infecciones, que puede ser de un 10-20% de los aortoaórticos frente a un 3-13% de la reconstrucción axilobifemoral2.
No se recomiendan la reconstrucciones de un nuevo sistema aortoiliaco a partir de las venas profundas de las piernas, pues conlleva riesgo de infección por bacterias Gramnegativas y tiene gran riesgo de rotura6.
La terapia endovascular se ha demostrado viable como opción de tratamiento, asociada a menor trauma y tiempos quirúrgicos cortos, menor necesidad de transfusión y menor morbimortalidad. Puede ser exitoso a corto plazo, pero puede tener complicaciones como sangrado recurrente e infecciones5,8. En un metanálisis de Kakkos et al, se trató a 59 pacientes con terapia endovascular; el 93% tuvo éxito, la mortalidad a 30 días fue del 8.5%, el 19% de los pacientes tuvieron sangrado recurrente y el 32% sufrió sepsis. La mortalidad a 12 y 24 meses fue del 15 y el 19%5.
El tipo de reparación intestinal depende de cada caso, cuando el defecto intestinal es < 3 cm, se puede realizar cierre primario; si es mayor, se debe realizar resección duodenal9,12. Se ha señalado que, si se va a realizar anastomosis entérica, que sea lo más lejana del injerto2. En el postoperatorio es indispensable la cobertura antibiótica de amplio espectro durante 1 semana si los cultivos son negativos y 4-6 semanas si son positivos9; los gérmenes más encontrados son Salmonella y Klebsiella4. Cuando el paciente se somete a bypass extraanatómico, la tasa de amputación de extremidades inferiores es del 9%; la de infección protésica, del 22%, y de trombosis, del 20%9. Las complicaciones por ligadura del muñón aórtico ocurren en hasta el 89%; el riesgo de una nueva fístula es de un 9-22%12. La supervivencia después del tratamiento quirúrgico es de un 18-93%4.
La morbimortalidad es elevada, de un 30-85% a 30 días1,9,12. Se relacionan con mortalidad precoz la inestabilidad hemodinámica, la necesidad de cirugía urgente, la transfusión sanguínea preoperatoria por anemia y la necesidad de uti-lizar pinzas aórticas por encima de las arterias renales6,12.
Conclusiones
Las FAE son una afección de baja incidencia que, para sus oportunos diagnóstico y tratamiento, requieren un alto índice de sospecha basada en los antecedentes del paciente. La mortalidad aun con tratamiento exitoso es alta en los primeros 30 días, debido sobre todo al retraso en el abordaje secundario al vasto diagnóstico diferencial del sangrado gastrointestinal. Para establecer el diagnóstico, el procedimiento de elección es la TC abdominal, aunque en muchas ocasiones la cirugía termina de establecer la presencia de FAE. Los procedimientos quirúrgicos deben individualizarse según las condiciones de cada paciente; los más aceptados actualmente son: bypass extraanatómico axilobifemoral o sustitución in situ del injerto. Se han reportado casos en que el tratamiento es endovascular, pero todavía faltan más estudios a largo plazo para determinar su éxito en este tipo de enfermedades.











 nueva página del texto (beta)
nueva página del texto (beta)