Introducción
Las cicatrices queloides han representado siempre lesiones difíciles de tratar. Hasta el momento no hay tratamiento que haya presentado resultados satisfactorios al 100%. Los pacientes con una lesión tienen repercusión biopsicosocial, funcionalmente limita la movilidad, elasticidad y otras funciones cutáneas, estéticamente representa una lesión nada deseable. Las descripciones de la fisiología cicatrizal más clásicas hablan de tres fases: inflamación, proliferación y maduración. Las etapas de cicatrización de la herida son secuenciales y simultáneas1,2. Con exposición del colágeno, el endotelio y las proteínas intra y extravasculares comienza con la hemostasia. La vasoconstricción y la formación del coágulo hacen que se detenga la hemorragia. El endotelio de los vasos dañados produce su propio vasoconstrictor, la endotelina. Los demás mediadores de la vasoconstricción derivan de las catecolaminas circulantes, el sistema nervioso simpático y las prostaglandinas liberadas por las células dañadas3. La cascada de la coagulación se compone de dos vías convergentes: extrínseca e intrínseca. La vía extrínseca de la coagulación es una vía esencial para la formación normal del trombo y comienza por la exposición del factor tisular sobre la superficie subendotelial4. Pese a que cada vía posee un desencadenante diferente, las dos activan el factor X y la producción de trombina.
La trombina cumple dos funciones esenciales en la formación del coágulo: cataliza la conversión del fibrinógeno en fibrina e inicia la activación plaquetaria5. Las plaquetas activadas contribuyen a la hemostasia a través de su adherencia, agregación y desgranulación, la agregación plaquetaria en el entorno de la matriz de fibrina forma un coágulo6. Con la hemostasia se inicia de inmediato la inflamación. La extravasación de los líquidos y la migración de las células explican el edema de la herida. Los neutrófilos son el primer subgrupo de leucocitos que penetra en la herida. Los neutrófilos liberan diversos tipos de enzimas proteolíticas, descomponen las bacterias y la matriz extracelular del foco de lesión7. Los macrófagos, procedentes de los monocitos extravasados, son esenciales para la cicatrización y cumplen diversas tareas en las fases inflamatoria y proliferativa. Fuente mayoritaria de citocinas y factores de crecimiento, los macrófagos resultan necesarios para el reclutamiento y la activación celulares, la síntesis de la matriz, la angiogenia y la remodelación8. La proliferación tiene lugar entre el 4.1 y el 12.1 días después de la lesión. En este período, los fibroblastos, las células musculares lisas y las células endoteliales infiltran la herida, mientras que las células epiteliales empiezan a cubrir la zona dañada. Los fibroblastos son una de las últimas poblaciones celulares en llegar a la herida. Las primeras señales para el reclutamiento de los fibroblastos provienen de productos derivados de las plaquetas: factor de crecimiento derivado de las plaquetas (PDGF), factor de crecimiento insulina dependiente (IGF-1) y TGF-b, los fibroblastos proliferan y empiezan a sintetizar colágeno9,10. A medida que se crea la matriz, el TGF-b también actúa proporcionando una estabilidad estructural a través del descenso en la actividad de la proteasa, el aumento de los inhibidores tisulares de la metaloproteinasa y una mayor producción de proteínas de adhesión celular11. El colágeno de tipo I predomina en la matriz extracelular de la piel intacta. El colágeno de tipo III, presente en menores cantidades en la piel no dañada, es el más importante para la reparación de la herida12. Además del colágeno, los fibroblastos producen y secretan glucosaminoglicanos que se acoplan a la proteína para convertirse en cadenas de polisacáridos sulfatadas, conocidas como proteoglicanos. Se cree que los proteoglicanos son el componente principal de la «sustancia fundamental» del tejido de granulación13.
El incremento del lactato, junto con el descenso del pH y de la tensión de oxígeno contribuye a inhibir de la angiogenia14. La etapa siguiente en la cicatrización corresponde a la epitelización. En el lugar de la lesión se crea una nueva monocapa de epitelio. Las células de esta capa se diferencian adoptando un aspecto menos elongado y más cuboidal que las células basales. La proliferación celular posterior restablece la epidermis multiestratificada15. Por último, con la cicatriz conformada se inicia la etapa de “Maduración y Remodelación” de la cicatriz empieza una semana después de la lesión y continúa entre 12 y 18 meses. Al cabo de 1 semana, la fuerza de la matriz corresponde a un 3% de la del tejido no dañado. Las colagenasas y las proteasas aumentan y descomponen estas primeras fibrillas de colágeno. A las 3 semanas la fuerza del tejido aumenta hasta un 30%, y a los 3 meses alcanza un máximo del 80% de la fuerza original16,17. La cicatriz queloide se define como cicatrización patológica caracterizada por depósito anormal de colágena, que únicamente ocurre en humanos18. Las queloides fueron descritas hace siglos en el Papiro de Smith, el cual describe técnicas quirúrgicas usadas en Egipto alrededor de 1700 a.C. La primera descripción clara de un queloide fue dada por Alibert en 1806. El término deriva de la palabra griega chele, que significa “tenaza de cangrejo”19. La mayoría de las cicatrices queloides ocurren dentro de 1 año después de un daño local tal como acné vulgar, vacunación por BCG, o trauma local, pero el retraso puede ser de hasta 24 años. Las personas de piel oscura, forman queloides con una frecuencia de 2 a 19 veces mayor a los caucásicos.
Existe una tendencia familiar a desarrollar cicatrices queloides. Afecta ambos sexos igualmente dentro del mismo grupo de edad. Aunque en algunos estudios se ha reportado una mayor incidencia en mujeres. La edad de inicio más comúnmente observada es entre los 10 y 30 años de edad, siendo rara en los extremos de la vida18,19. Genéticamente asociado con HLA-B14,-B21, HLABW16, -BW35, HLA-DR5, -DQW3, grupo sanguíneo A. La transmisión reportada es autosómica dominante con penetrancia clínica incompleta y expresión variable. La formación de queloides es causada por un incremento en la actividad anabólica en ausencia de un mayor catabolismo en la síntesis de colágeno y glucosaminoglicanos (GAG). El colágeno formado es de composición normal, con sólo un ligero aumento en la proporción usual entre tipo I y tipo III. El número de fibroblastos no aumenta y parece histológicamente normal20. Se sabe que las alfa globulinas séricas son inhibidores de la colagenasa. Los estrógenos elevan el nivel de alfa globulinas séricas, lo cual puede ayudar a explicar la mayor incidencia de queloides en las mujeres. Las cicatrices queloides se caracterizan por una cicatriz en relieve, dolorosa o pruriginosa y fuera de los límites de la herida original. Es común que involucre lóbulos auriculares, hombros, tercio proximal de brazos, tórax anterior, especialmente área preesternal y parte superior de tórax posterior. La tasa de recurrencia en queloides después de escisión quirúrgica varía del 50 al 80%21. La prevención es el tratamiento ideal. El cierre temprano de la herida al disminuir el tiempo de la fase inflamatoria decrece la cantidad de fibrosis. Siempre que se pueda, las incisiones deben planearse paralelas a las líneas de menor tensión de la piel, y suturar sin tensión22. Los corticoesteroides se consideran el estándar de oro, dentro de los cuales se administra en 2 formas, intralesional como el acetato de Triamcinolona, el fosfato de dexametasona solo o combinado con hialuronidasa, y con aplicación tópica se administra la hidrocortisona. La Triamcinolona es la más popular. La tasa de éxito es de cerca de 70%. Los corticosteroides tienen un efecto inhibitorio sobre el crecimiento de fibroblastos y alfa2 macroglobulina, el cual resulta en degradación del colágeno23.
La radiación después de la resección quirúrgica puede prevenir la recurrencia en aproximadamente el 75% de los casos24. El uso de compresión en la prevención de cicatrices queloides con prendas elásticas que proporcionen una presión de 24 mmHg para que exceda la presión capilar normal. El efecto buscado es causar hipoxia, disminuye los niveles de la alfa2 macroglobulina que inhibe la colagenasa25. Unos autores sugieren el efecto benéfico del incremento en la humedad de la piel con uso de laminas de silicon26. La escisión quirúrgica de la cicatriz queloide sin una terapia adyuvante tiene un alto porcentaje de recurrencia que varía entre el 50 y el 80% y a menudo aparece una cicatriz de mayor tamaño27,28. La Toxina Botulina es producida por la bacilo Clostridium botulium. La historia de este bacilo se inicia oficialmente en 1820, con las investigaciones realizadas por Justinus Kerner (1786-1862), en el reino de Würtenburg, sobre los envenenamientos producidos por salsas con carne, fue hasta 1870 cuando Muller lo describió como síndrome “Botulus” (del latín botulus que significa salchicha). En 1895 Van Ermengem fue el primero en aislar el germen Clostridium botulium en la comida consumida por pacientes intoxicados. En 1928 Snique y Sommer, de la Universidad de California, fueron los primeros en purificar la toxina Botulínica A. Descubrieron que el 90% de la toxina es producida en cultivo, y no fue hasta 1979 cuando la FDA (Federal Drug Administration) aprobó su uso para la utilización en estudios en pacientes humanos voluntarios29,30. La neurotóxica se expresa inicialmente como un polipéptido único de casi 1,300 residuos de aminoácidos (MW ∼150 kDa). Los extractos crudos de toxina (MW varía de ∼300 a 900 kDa) contienen varias proteínas tóxicas auxiliares que forman un complejo con la neurotóxica31. La toxina botulínica tiene alta afinidad por la unión neuromuscular. Los serotipos A, E y C1 tienen afinidad por la proteína SNAP-25 de membrana, los tipos B, D, F y G por la proteína VAMP y el serotipo C1 también por la sintaxina32,33,34. La toxina botulínica actúa inhibiendo la liberación de acetilcolina en la zona presináptica de la unión neuromuscular, el proceso involucra tres etapas: unión, inter nalización y el bloqueo neuromuscular35-40.
La toxina libre puede ser fácilmente eliminada si la temperatura se eleva por encima de los 80 °C durante más de 10 min41. La toxina tiene interacción en potencialización con los aminoglucosidos, ciclosporina, Dpenicilamina, estreptomicina y por otros fármacos que interactúen en la transmisión neuromuscular, como los relajantes musculares. La cloroquina disminuye el efecto de la toxina. Los eventos adversos reportados por la aplicación de la toxina botulínica se describen con cuadros pseudogripales, y en forma local debilidad muscular, dolor, edema, equimosis, cefalea, boca seca y alteraciones en la mímica perioral o periocular. No se conoce la dosis letal de la Toxina botulínica en aplicación exógena, aunque algunos autores estimaron más de 3500 U en varones de más de 100 kg42,43. En la actualidad, la toxina ha sido aprobado por la FDA para estrabismo, blefaroespasmo, disfonía cervical, espasticidad de las extremidades superiores, la hiperhidrosis maxilar, migraña crónica, y la incontinencia urinaria44. Actualmente hay un aumento en la aplicación cosmética de la toxina en arrugas moderadas a severas en adultos45,46. En este trabajo determinamos el efecto de la toxina botulínica en la cicatrización queloide.
Material y métodos
Realizamos un Ensayo clínico abierto. Se captaron los pacientes con cicatrices queloides en consulta externa del Centro Medico ISSEMyM Ecatepec. Previa autorización del paciente voluntario con firma de consentimiento informado se realizó medición de la cicatriz queloide, anotando tamaño, área corporal, tipo de piel, sexo, edad. Se aplicó Toxina Botulínica tipo A, sin complejo proteico en plano intralesional a dosis 2 unidades por cada centímetro de cicatriz queloide. Se tomó fotografía de la cicatriz queloide antes de la aplicación de la toxina botulínica. Se realizó revisión clínica y fotográfica de la cicatriz queloide al mes de la aplicación. Se aplicó cuestionario de evolución clínica a los pacientes voluntarios en el estudio para determinar grado de mejoría, aparición de eventos indeseables o adversos, cambios de sensibilidad y cambios en coloración. La selección de la muestra es no probabilística de oportunidad o voluntario, secuencial. Los criterios de inclusión fueron la presencia de cicatriz queloide en alguna parte del cuerpo, cualquier edad, ambos sexos, cualquier tipo de piel de acuerdo a la Clasificación de Fitzpatrick. Los criterios de no inclusión fueron pacientes embarazadas, el uso de medicamentos, padecer enfermedades neuromusculares, alergias conocidas a la toxina botulínica o al huevo y presentar infección en el área de la cicatriz queloide. Los criterios de eliminación fueron recibir otro tratamiento para cicatriz queloide durante el estudio, abandono voluntario al tratamiento establecido en el estudio. Se realizó un análisis descriptivo para identificar frecuencias, se organizaron los datos de carácter nominal en tablas de contingencia, identificando las proporciones porcentajes o tasas; a través de análisis de Media, Desviación típica y Prueba de Kolmogorov-Smirnov. Este estudio fue sometido para su aprobación por el comité local de investigación y ética y se siguieron los lineamientos éticos de Helsinki, las Buenas Prácticas Clínicas y lo establecido en el reglamento de la Ley General de Salud en materia de Investigación para La Salud en su título segundo, sobre aspectos éticos de la investigación. Todos los pacientes participantes firmaron Consentimiento Informado para su participación voluntaria en el estudio.
Resultados
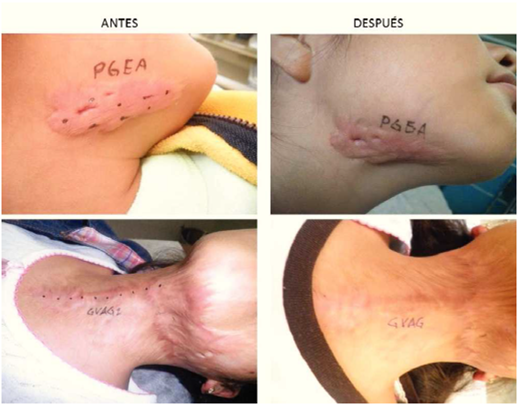
En el estudio se incluyeron a 68 pacientes voluntarios, 4 fueron eliminados de los resultados finales 3 por no acudir a su cita de evaluación clínica y uno por aplicación de esteroide intralesional en la cicatriz que estaba siendo evaluada. 64 pacientes se incluyeron en los resultados finales, pacientes femeninos (70%), y del género masculino 19 pacientes (30%). La Media en la edad fue de 35 años, teniendo una edad mínima de 4 años y una máxima de 62 años, desviación típica de 17.46. La localización de cicatrices fue en abdomen con 21 pacientes (33%) en tórax con 14 pacientes (22%), extremidades torácicas o superiores con 10 pacientes (16%) y en cara con 8 pacientes (13%), cuello con 6 pacientes (9%) y extremidades pélvicas o inferiores con 5 pacientes (8%) . La etiología fue predominante por procedimientos quirúrgicos con 30 pacientes (47%) y por accidentes con 19 pacientes (30%), espontanea con 13 pacientes (20%) y perforación en 2 pacientes (3%). El tipo de piel evaluada de acuerdo a la clasificación dermatología de Fitzpatrick de tipos de piel, se encontró predominio de tipo de piel IV en 34 pacientes (53%) seguida de tipo de piel III con 21 pacientes (33%) y por último el tipo de piel II con 9 pacientes (14%). No hubo ningún paciente con tipo de piel I, V y VI. La mejoría clínica y fotográfica con una sola aplicación un mes después se obtuvieron resultados con mayor frecuencia de reportes entre 60% en 19 pacientes (30%), del 70% en 18 pacientes (28%) y del 80% en 11 pacientes (17%), los reportes restantes de 50% con 8 pacientes (13%), 30% en 5 pacientes (8%), 40% en 3 pacientes (5%) y los porcentajes de mejora del 10, 20, 90 y 100% no registraron en ningún paciente. El valor mínimo de mejoría registrado es de 30 y máximo de 80%. Se obtuvo una Media de 61.72, Desviación típica de 14.09 y p= 0.11. En 46 pacientes (72%) se reportó aclaramiento en la coloración de la piel. En 42 pacientes (66%) reportó disminución en la sensibilidad (hipostesia) y desaparición del prurito en la cicatriz. No se reportó ningún evento (figs. 1 y 2).
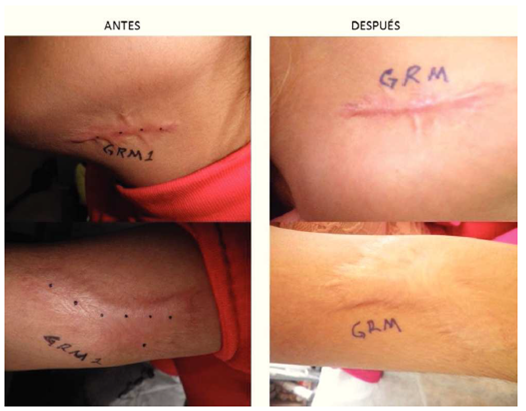
Figura 1 Cicatriz queloide en cuello y brazo antes y 1 mes después de aplicación de toxina botulínica.
Discusión
La cicatrización queloide ha representado un reto para la ciencia médica, hasta el momento no existe un método terapéutico que garantice al 100% la eliminación de las cicatrices queloides, siendo el manejo preventivo el mejor método para el manejo de esta forma de cicatrización22. La presencia de una cicatriz queloide representa para el paciente una afección que repercute tanto física como psicosocialmente, variando dependiendo de su localización. En este estudio se pretende conocer si la aplicación de la toxina botulínica en las cicatrices queloides puede producir una mejoría en la funcionalidad y la estética de la zona afectada por la cicatriz queloide, se corroboro datos epidemiológicos que ya habían sido descritos, como la localización de la cicatrices queloides en las llamadas zonas queloidogenicas18,19,47, sin embargo también fue una porción importante la que se tuvo a nivel abdominal, siendo todas producto de procedimientos quirúrgicos.
El reporte es muy variable con respecto a la presencia de algunos factores que influyen en la capacidad cicatrizal del organismo como la edad en la cual se tiene predominio en personas jóvenes, encontrando en este estudio una mayor proporción de pacientes adultos, no se encontró relación entre la edad, las enfermedades concomitantes y el consumo de tabaco, alcohol u otros medicamentos (analgésicos, antimicrobianos) con la efectividad o la mejoría de la cicatriz queloide posterior a la aplicación de la toxina botulínica, ya que en todos estos pacientes las cifras de mejoría fueron iguales a la de los pacientes sin estos factores. No se encontró ninguna relación en estos pacientes con antecedentes heredofamiliares conocidos por los pacientes, aunque ya está demostrada la predisposición genética para el desarrollo de cicatriz queloide48. Se confirma también el predominio de aparición de cicatrización queloide respecto al tipo de piel, sabiéndose que tiene más predominio de aparición en raza negra y asiática, en este estudio existió más frecuencia en pacientes con tono de piel más oscuro, aunque los reportes de mejoría no fueron significativamente diferentes de los pacientes con tipo de piel más blanca. El tamaño de la cicatriz fue muy variable y no se observó ninguna relación o diferencia entre los diferentes tamaños de cicatrices con los porcentajes de mejoría. Se obtuvo una mejoría clínica de la cicatriz queloide que se reporta en nuestro estudio hasta en un 80 % con una sola aplicación, en el primer mes, resultado que es comparable con los reportes hechos con el tratamiento estándar o ideal hasta el momento que es el uso de Triamcinolona23,49,50,51. Sin embargo los resultados son aun preliminares ya que sería conveniente llevar un seguimiento a los 6, 12 y 24 meses para determinar la resultante cicatrizal final el índice de recurrencia que pueda existir. Hasta el momento con los resultados obtenidos en un primer mes, con una sola dosis, se pueden considerar alentadores para la mejoría cicatrizal, siendo entonces una opción válida la implementación de mayor dosis en periodos mensuales para favorecer mejores resultados.
Los hallazgos en cuanto a la disminución en la sensibilidad en la cicatriz queloide y desaparición del dolor y prurito, además del aclaramiento de la cicatriz, teniéndose mejores resultados en aquellas cicatrices localizadas en la cara, representan un beneficio adicional a la terapia, ya que esto mejora la funcionalidad y la estética en la cicatriz, la fun cionalidad respecto a que disminuyen las molestias en la fricción o movilidad de la cicatriz y la estética al tener un aclaramiento que puede dar semejanza dérmica con la piel circundante sana. En este estudio no se tuvo ningún efecto adverso por la aplicación de la toxina y únicamente se reporta como evento indeseable y conocido es la presencia de dolor durante la aplicación intralesional de la toxina botulínica, evento que se presenta con cualquier forma terapéutica que se aplica mediante punción en la lesión, sin embargo el dolor desaparece rápidamente y no se registran ninguna otra molestia con la dosis y forma de aplicación implementados en este estudio. Dentro del análisis estadístico se obtuvo una p=0.011 lo cual presenta significancia estadística. Se Obtuvieron resultados comparables con los expuestos recientemente con el imiquimod52, colchicina53, luz intensa pulsada54 y Bleomicina55, terapéuticas comparadas en efectividad con la Triancinolona.
Conclusiones
En este estudio se evaluó el uso de la Toxina Botulínica en cicatriz queloide proporcionada beneficio o mejoría en la cicatriz queloide, teniéndose resultados positivos ya que se demuestra que el uso de la toxina botulínica si proporciona mejoría estética y funcional en la cicatriz queloide, comparable con las terapéuticas ideales hasta el momento implementadas, por lo tanto la aplicación de toxina botulínica para el manejo de la cicatriz queloide es un método terapéutico eficaz y debe ser considerado como una opción importante en el manejo de las cicatrizaciones queloides.











 nueva página del texto (beta)
nueva página del texto (beta)