Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Cirujano general
versão impressa ISSN 1405-0099
Cir. gen vol.35 no.1 Ciudad de México Jan./Mar. 2013
ARTÍCULO DE INVESTIGACIÓN
El estado nutricio no influye en el desarrollo de dehiscencia de anastomosis en una población mexicana
The nutritional state does not influence development of anastomotic dehiscence in a Mexican population
Juan Carlos Silva Godínez, Sergio Vásquez Ciriaco, Arturo Jarquín Arremilla, Paola Vela Maqueda
Hospital Regional de Alta Especialidad de Oaxaca
Correspondencia:
Dr. Juan Carlos Silva Godínez
Servicio de Cirugía General, Hospital General de México
Dr. Balmis Núm. 148, Col. Doctores, 06726 México, D.F
Tel: 55 45 03 06 12,
E-mail: jcgodinez@hotmail.com
Recibido para publicación: 14 febrero 2013
Aceptado para publicación: 22 marzo 2013
Resumen
Objetivo: Describir los factores de riesgo asociados al desarrollo de dehiscencia anastomótica en pacientes sometidos a cirugía intestinal en una población mexicana, con énfasis en el estado nutricional del paciente.
Sede: Servicio de Cirugía, Hospital Regional de Alta Especialidad de Oaxaca, Secretaría de Salud.
Diseño: Estudio clínico, ambispectivo, ambilectivo de casos y controles.
Análisis estadístico: Análisis univariado con χ2, regresión logística binomial simple y regresión logística multivariada.
Pacientes y métodos: Se analizaron 144 pacientes sometidos a 214 resecciones y/o derivaciones intestinales con anastomosis. Se consideraron distintos factores clínicos, demográficos y de laboratorio asociados a dehiscencia de anastomosis. Los principales factores de riesgo considerados fueron: número de anastomosis, tipo de anastomosis, IMC, antecedente de cáncer, creatinina, tabaquismo, tipo de cirugía, nivel de hemoglobina, cuenta de leucocitos y linfocitos, tiempos de coagulación, biometría hemática, género, hipotensión intraoperatoria, diabetes mellitus, enfermedad cardiovascular, puntuación de ASA, hiperbilirrubinemia, BUN y sangrado quirúrgico. Se valoró la asociación de estas variables a la dehiscencia anastomótica y a la mortalidad de la población.
Resultados: Se analizaron 144 pacientes sometidos a 214 anastomosis. En el análisis univariado, las variables que mostraron significancia estadística para dehiscencia fueron edad (p < 0.001), sangrado (p = 0.01) y la necesidad de transfusiones (p = 0.03). La presencia de hipoalbuminemia o un IMC < 15 no fueron significativos tanto en el análisis univariado como en el multivariado. El sangrado quirúrgico y la necesidad de transfusiones mostraron ser los predictores más significativos de desarrollo de dehiscencia anastomótica en el análisis multivariado (p < 0.01).
Conclusiones: La presencia de hipoalbuminemia y un bajo índice de masa corporal no aumenta el riesgo de dehiscencia anastomótica en la población de estudio. Los principales factores de riesgo asociados a la fuga anastomótica son el sangrado transoperatorio y la administración de hemoderivados en el perioperatorio.
Palabras clave: Desnutrición, dehiscencia de anastomosis.
Abstract
Objective: To describe the risk factors associated to the development of an anastomotic dehiscence in patients subjected to intestinal surgery in a Mexican population, emphasizing the nutritional state of the patient.
Setting: Surgery Service, Regional High Specialty Hospital of Oaxaca, Mexico. Ministry of Health (Third Level Health Care Center).
Design: Clinical, ambispective, ambilective study of cases and controls.
Statistical analysis: Univariate analysis with χ2, simple binomial logistic regression, and multivariate logistic regression.
Patients and methods: We analyzed 144 patients subjected to 214 resections and/or intestinal shunts with anastomoses. We considered different clinical, demographic, and laboratory factors associated to dehiscence of anastomoses. The main risk factors considered were: number of anastomoses, type of anastomoses, IMC, antecedents of cancer, creatinine, smoking, type of surgery, hemoglobin level, leukocytes and lymphocyte counts, clotting time, blood biometrics, gender, intraoperative hypotension, diabetes mellitus, cardiovascular disease, ASA score, hyperbilirubinemia, BUN, surgical bleeding. We assessed the association of these variables with anastomotic dehiscence and mortality in the studied population.
Results: We analyzed 144 patients subjected to 214 anastomoses. The univariate analysis revealed that the variables with statistical significance for dehiscence were age (p < 0.001), bleeding (p = 0.01), and need of transfusions (p = 0.03). The presence of hypoalbuminemia or a BMI < 15 was not significant in either the univariate and multivariate analyses. Surgical bleeding and the need of transfusions were the most significant predictors for the development of anastomotic dehiscence in the multivariate analysis (p < 0.01).
Conclusions: The presence of hypoalbuminemia and a low BMI does not increase the risk of anastomotic dehiscence in the studied population. The main risk factors associated to anastomotic leakage are transoperative bleeding and administration of hemoderivates during the perioperative time.
Key words: Malnutrition, dehiscence of anastomosis.
Introducción
La fuga de una anastomosis con derrame del contenido intestinal hacia la cavidad abdominal es una de las complicaciones quirúrgicas más importantes en la actualidad.1 Las tasas de fuga reportadas varían del 1 al 24%, dependiendo en qué tipo de anastomosis fue realizada y si la operación se efectuó de manera electiva o de urgencia.2-5 Diversos estudios han establecido que existe una correlación entre los niveles bajos de albúmina así como del estado nutricio y un incremento en la incidencia de dehiscencia de anastomosis.5,6 Se ha reportado que los pacientes clasificados con desnutrición proteico-calórica tienen una respuesta subóptima para la cicatrización, medida por la concentración de hidroxiprolina en la herida. La albúmina, proteína principal sintetizada por el hígado, así como el índice de masa corporal constituyen las mejores y más sencillas pruebas nutricionales para evaluar la evolución de un paciente.7,8
Sin embargo, existen estudios clínicos en donde la presencia de hipoalbuminemia y un pobre estado nutricio preoperatorio incrementa la frecuencia de complicaciones, como las infecciosas; sin embargo, no la frecuencia de dehiscencia.4,9,10 En este sentido, estudios experimentales han mostrado que es la alimentación perioperatoria, y no el estado nutricional el factor determinante de la dehiscencia anastomótica.11 A pesar de que se han descrito una serie de factores relacionados con las dehiscencias de las anastomosis y uno de ellos es el estado nutricio, en los principales centros asistenciales quirúrgicos de nuestro país mensualmente se realizan un porcentaje importante de anastomosis intestinales, y algunas veces ocurren dehiscencia de las mismas, muchas realizadas en pacientes con un estado nutricio no idóneo; sin embargo, no existen registros que comprueben la relación entre estas dos variables en nuestro medio. De igual manera, la observación empírica en nuestra población de una alta incidencia de desnutrición, sin observar un incremento en la incidencia de anastomosis, motiva a volver a examinar la incidencia y las consecuencias de la dehiscencia anastomótica. Específicamente, buscamos identificar los factores de riesgo que contribuyen al desarrollo de dehiscencia en una población mexicana con un énfasis especial en el estado nutricional del paciente.
Pacientes y métodos
Se identificaron a todos los pacientes que fueron sometidos a cirugía intestinal que involucrara resección y anastomosis intestinal, utilizando el archivo electrónico del Hospital Regional de Alta Especialidad de Oaxaca (CIED®) durante el periodo comprendido entre el 1 de enero de 2009 al 1 de junio de 2013 y se realizó una revisión de expedientes clínicos de manera ambispectiva. Se descartaron aquellos pacientes que fueron sometidos a reparación primaria de perforación intestinal, anastomosis ureteroentéricas y coloanales. Aquellos pacientes que murieron dentro de los primeros siete días posteriores a la cirugía sin recibir alimentación por vía oral fueron excluidos del análisis. Para fines del análisis, se consideró a las anastomosis al recto como por debajo de la reflexión peritoneal. Las cirugías fueron realizadas por siete cirujanos de base y aproximadamente 15 residentes durante el periodo de estudio. En los casos electivos que involucraron cirugía colónica, se realizó preparación mecánica mediante enemas con fosfato de sodio o con polietilenglicol. En todos los casos se brindó antibiótico profiláctico. La técnica de dos capas abierta fue la predominante; sin embargo, también se utilizaron otras técnicas. La fuga anastomótica fue diagnosticada mediante el uso de estudios radiográficos contrastados, confirmada durante un tiempo quirúrgico subsecuente o por la presencia de fístulas fecales o intestinales. Además, si no existía sitio de infección alternativo evidente, se consideró la presencia de signos de sepsis, incluyendo fiebre, leucocitosis, dolor abdominal y la visualización de un absceso adyacente a la anastomosis, en una tomografía computada, como evidencia de fuga. Se consideraron las variables demográficas así como los siguientes factores de riesgo asociados a dehiscencia de anastomosis: número de anastomosis, tipo de anastomosis, técnica con que se construyó la anastomosis, IMC, antecedente de cáncer, creatinina, tabaquismo, cirugía de urgencia o programada, nivel de hemoglobina, cuenta de leucocitos y linfocitos, tiempos de coagulación, biometría hemática, química sanguínea género, hipotensión intraoperatoria, diabetes mellitus, enfermedad cardiovascular, puntuación de ASA, hiperbilirrubinemia, BUN y sangrado quirúrgico. Se consideraron además los ingresos y egresos operatorios, la necesidad de transfusión, así como la cantidad y tipo de hemoderivados administrados. Además, se contrastó cada uno de las variables de laboratorio obtenidas de manera rutinaria en la atención de estos pacientes. Se analizó la relación existente entre estas variables y el desarrollo de dehiscencia de anastomosis y la mortalidad en la población de estudio.
Los datos se analizaron con medidas de tendencia central y de dispersión para cada variable, por cada uno de los grupos analizados. Para las variables categóricas utilizadas se construyeron tablas de contingencia y se realizó, en donde fuera aplicable, la prueba de χ2 con el objeto de identificar dependencia entre variables. La significancia estadística se determinó como un valor de p menor a 0.05. Cuando se contrastaron variables cuantitativas con variables categóricas se utilizó regresión logística binaria simple para determinar si existe una asociación estadística. Todas las variables que mostraron una tendencia a la significancia estadística (p ≤ 0.20) en el análisis univariado fueron incluidas en el análisis multivariado. Con el objetivo de discernir la relación entre las variables significativas en el análisis univariado, las variables escogidas se incluyeron en un análisis multivariado realizado mediante regresión logística binaria multivariada con el método condicional. Las variables que resultaron significativas en el análisis multivariado fueron expresadas como razón de riesgos con intervalos de confianza. La captura de los datos fue realizada en el programa informático Microsoft Excel® versión 2011 (Microsoft Corporation, Redmond, WA, EUA). El análisis de los datos se realizó con el programa informático SPSS versión 20 (IBM Corporation, Nueva York, NY, EUA).
Resultados
Se analizaron 144 pacientes que fueron sometidos a 214 resecciones o derivaciones intestinales con anastomosis. La información demográfica se muestra en el cuadro I. La edad promedio de los pacientes fue de 51 años, con un rango de 15 a 88 años. El 7.3% de las cirugías fue realizada de manera urgente. El tiempo promedio de cirugía fue de 174 minutos (rango 35-360 minutos). El diagnóstico más común fue carcinoma (Cuadro II).

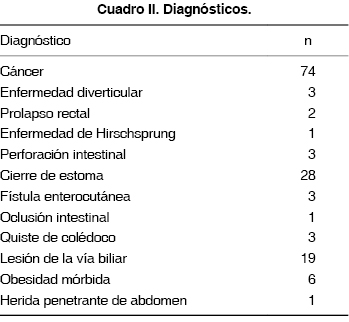
Las anastomosis más comunes fueron la yeyunoyeyunal (25.7%), mientras que 7% fueron de intestino delgado a colon y 5.6% fueron colorrectales (Cuadro III). Se utilizaron diversas técnicas anastomóticas, aunque predominó la técnica manual en doble capa.
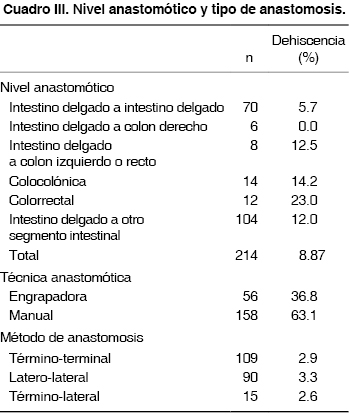
Existió dehiscencia de la anastomosis en 19 pacientes, para una tasa global de fuga anastomótica del 8.8%. La dehiscencia fue clínicamente evidente en un promedio de 7.1 días (rango 1 a 24 días) posteriores a la cirugía. La dehiscencia fue detectada en un segundo tiempo quirúrgico en 12 pacientes y por estudios radiográficos en siete pacientes. No existió diferencia entre la presencia de dehiscencia y el tipo de anastomosis (p = 0.51) o entre los niveles de anastomosis (por ejemplo, por arriba o debajo de la reflexión peritoneal) (p = 0.20). Con el tamaño de muestra estudiado, es posible detectar una diferencia en la tasa de dehiscencia del 4.5% con un poder de 0.86 entre intestino delgado y colon. No existió diferencia entre la fuga anastomótica entre las técnicas manuales y con engrapadora. Se construyeron anastomosis sincrónicas en 55 pacientes para un total de 123 anastomosis. Ocurrieron siete dehiscencias en 43 pacientes en los cuales se realizaron dos anastomosis y una dehiscencia en 12 pacientes con tres anastomosis. Cuando se analizó si el número de anastomosis aumentaba el riesgo de dehiscencia, no hubo un resultado significativo por medio de la prueba de χ2 (p = 0.719).
Los resultados del análisis univariado se muestran en el cuadro IV. Las variables que alcanzaron significancia estadística para el desarrollo de dehiscencia fueron la edad, la puntuación de ASA, el sangrado, y la administración de transfusiones. Cabe destacar que no se analizaron puntos de corte para la cantidad de sangrado que aumentaran el riesgo de dehiscencia. En cuanto a los factores considerados, existió dehiscencia anastomótica en dos pacientes que se considera se encontraban en un estado nutricional pobre, en comparación con 17 pacientes considerados con un estado nutricional adecuado, considerado como aquéllos que tuvieron niveles de albúmina mayores o iguales a 30 g/l. Esta diferencia no alcanzó significancia estadística (p > 0.06). La contrastación del índice de masa corporal como indicador de desnutrición mostró un resultado similar.

La anemia por sí misma no mostró un efecto deletéreo; sin embargo, la transfusión intraoperatoria mostró una fuerte influencia hacia mayores tasas de dehiscencia anastomótica, tanto en pacientes con anemia como en pacientes con hematocritos preoperatorios normales.
Cabe destacar la interacción entre la duración de la cirugía y el número de transfusiones. Si sólo se transfundía un paquete globular, la prolongación de la cirugía no influenciaba de manera adversa la tasa de dehiscencia; sin embargo, si se transfundían dos o más paquetes, la dehiscencia era más frecuente por cada periodo de tiempo que se incrementara la duración de la cirugía (p < 0.01).
Las anastomosis colocolónicas o colorrectales realizadas en cirugía de urgencia tuvieron resultados más pobres que aquéllas realizadas de manera electiva; sin embargo, la tasa de dehiscencia entre éstas no fue significativamente diferente (Cuadro IV). La alta tasa de dehiscencia en cirugía de emergencia en el colon, sin duda, refleja varios factores, incluyendo un colon no preparado, la presencia de infecciones y sepsis y la naturaleza del padecimiento que requiere la intervención de urgencia.
La tasa de mortalidad global fue del 13.8% y, en 35% de los decesos, la causa directa fue sepsis abdominal ocasionada por la dehiscencia de la anastomosis. La mortalidad en pacientes con dehiscencia anastomótica fue del 36.8% en comparación con 9.6% de los pacientes con anastomosis intactas (p = 0.005). Un análisis de regresión logística que considera la mortalidad como variable dependiente, muestra que la dehiscencia constituye un predictor independiente de la muerte intrahospitalaria (razón de momios = 4.508, p = 0.02). Otros factores que también fueron predictores independientes de muerte fueron la cirugía de urgencia y el sangrado. Cuando se realizó el análisis multivariado con dehiscencia como variable dependiente, sólo el sangrado y el nivel de la anastomosis resultan determinantes para el desarrollo de dehiscencia (p < 0.01), aún cuando se controla para los niveles de albúmina.
Discusión
La dehiscencia anastomótica es una de las complicaciones más temidas en la cirugía gastrointestinal, ya que se ha documentado en múltiples ocasiones que aumenta la morbilidad y la mortalidad de manera significativa.6,15,17,18 Aun cuando se considera que la ocurrencia de dehiscencia es inevitable, muchos investigadores han tratado de identificar varios factores de riesgo perioperatorios para ésta.6,13,19,20
Existen diversos estudios que han analizado distintos tipos de anastomosis y han reportado diferentes factores de riesgo que contribuyen a la dehiscencia anastomótica21. Sin embargo, existen estudios que han provisto de evidencia de la relevancia o falta de ésta para la mayoría de los factores de riesgo que se han reportado.9,16 Entre las variables clínicas que se han analizado, se encuentran aquellas específicas del paciente, intraoperatorias, y específicas del tipo de anastomosis. Los factores específicos del paciente incluyen el estado nutricional, la administración de esteroides, el antecedente de tabaquismo, la presencia de leucocitosis, comorbilidades cardiovasculares, el uso de alcohol, el riesgo operatorio y la presencia de sepsis abdominal. Los factores intraoperatorios incluyen el estado hemodinámico, el tiempo quirúrgico mayor a dos horas, la necesidad de transfusión y la presencia de sepsis abdominal. Se han descrito incluso factores de riesgo específicos para el tipo de anastomosis, por ejemplo, la colorrectal.9,22,23
Aun cuando, de manera general, se reconoce que el estado nutricio influye de manera negativa la cicatrización, los mecanismos no se encuentran completamente dilucidados. No se requiere argumentar que todas las sustancias necesarias para una reparación tisular normal deben encontrarse en cantidades suficientes, ya que la cicatrización es un proceso complejo y altamente anabólico. Dado que no existe una definición clara y mesurable para la desnutrición, la comparación de los diversos estudios resulta complicada. La albúmina, que se utiliza como un marcador subrogado de síntesis proteica, en general, es utilizada frecuentemente como una medida de desnutrición. Se ha reportado una relación inversa entre la tasa de complicaciones postoperatorias y la concentración de albúmina, en especial cuando ésta se encuentra por debajo de 30 g/l.24 Este hallazgo ha sido confirmado de manera experimental en ratas.25,26 Müllen reportó que la administración de nutrición parenteral preoperatoria durante 10 días, en pacientes bien nutridos, mejoraba los resultados de la cirugía intestinal al disminuir todas las complicaciones infecciosas y la dehiscencia anastomótica de un 32 a un 17% y la mortalidad de un 19 a 5%.24 Sin embargo, aun cuando de manera experimental la nutrición preoperatoria mejora el contenido de colágena y la fuerza tensil anastomótica cuando se compara con el ayuno y una dieta baja en residuos, de manera respectiva,27,28 los mayores efectos se obtienen cuando se brinda una dieta posoperatoria temprana, definida como aquélla brindada 12 horas posteriores a la cirugía, con una dieta enriquecida en fibra.29 Estos hallazgos sugieren que es la alimentación perioperatoria, y no el estado nutricional, el factor determinante de la dehiscencia anastomótica, situación que ha sido documentada en diversos estudios clínicos.30-32
En nuestro estudio, ni la presencia de hipoalbuminemia ni un IMC bajo se asociaron de manera estadísticamente significativa al desarrollo de dehiscencia en el análisis univariado ni en el multivariado. De acuerdo con cifras proporcionadas por la Organización de las Naciones Unidas para la Alimentación y la Agricultura, entre el 10 al 12% de la población en nuestro país sufre desnutrición.12 Estas cifras volverían esperable una incidencia mayor de complicaciones postoperatorias. Sin embargo, la tasa de dehiscencia en nuestro estudio fue del 8.8%, cifra que se encuentra dentro de lo reportado en la literatura internacional.14,15 Esta tasa de dehiscencia puede explicarse porque se incluyeron diversas patologías intestinales, en contra de la mayoría de los reportes, los cuales se enfocan en un segmento intestinal o patología. En concordancia con nuestras observaciones, la maximización de la nutrición preoperatoria es una medida importante para reducir el riesgo de dehiscencia; sin embargo, múltiples estudios han mostrado que para la mayoría de los pacientes no existe beneficio en brindar nutrición parenteral preoperatoria en la cirugía intestinal.10,33
Otras variables que se intentaron analizar reflejan situaciones complejas, las cuales se encuentran relacionadas con el estado hemodinámico del paciente. La presencia de hipotensión intraoperatoria y de transfusiones fueron significativas de manera individual o en combinación, las anastomosis presentaron dehiscencia en 23% de los pacientes que recibieron transfusiones. Aun cuando las transfusiones perioperatorias son relativamente comunes en cirugía intestinal, deben tratar de ser evitadas tanto como sea posible. Se ha documentado que además del detrimento en la supervivencia, después de la cirugía colorrectal,34 la administración de transfusiones afecta la cicatrización de anastomosis intestinales, demostrado de manera tanto clínica35 como experimental.36 La transfusión sanguínea influye en las funciones de los linfocitos T y los macrófagos.37-39 Esto podría afectar la respuesta a la cicatrización de las anastomosis en los pacientes.
Existen modelos experimentales clásicos en los que la cicatrización cutánea se retrasa por la presencia de hipoxia e hipovolemia u otras consecuencias de la hemorragia masiva, como son las transfusiones múltiples35 y los resultados del presente estudio sugieren una afección similar en la cicatrización intestinal.34
La validez de los hallazgos en el presente estudio se encuentra basada en el supuesto de que los cirujanos mantienen estándares de excelencia y que una larga serie de casos se encuentra controlada de manera interna, cuando todas las cirugías son realizadas por pocos cirujanos y por residentes supervisados por los mismos. Las variables que muestran correlación estadística con una mayor tasa de dehiscencia anastomótica se encuentran relacionadas con una inadecuada cicatrización intestinal. Las limitaciones del presente estudio se encuentran enmarcadas en cuatro aspectos. En primer lugar, la naturaleza observacional del estudio no permite valorar los factores de riesgo que no son considerados de manera rutinaria en la atención médica de los pacientes. En relación a la muestra, el incluir todas las patologías atendidas durante el periodo de estudio podría oscurecer factores de riesgo específicos para poblaciones determinadas. Metodológicamente, se ha realizado un estudio de correlaciones entre variables y con los resultados obtenidos no se puede brindar una explicación sobre el porqué de las complicaciones presentadas. Así mismo, la limitación muestra, como ya se ha señalado, impide la comparación entre subgrupos específicos de pacientes y la realización de análisis factoriales, que podría constituir el paso siguiente para delimitar con mayor corrección las variables clínicas y los factores de riesgo que faciliten identificar qué pacientes se encuentran bajo un mayor riesgo de dehiscencia anastomótica.
La cicatrización de las anastomosis intestinales se encuentra determinada por la suma de diversos factores. En un estudio clásico, Morgenstern40 propuso una tabla en la cual se ponderan diversos factores y si el paciente excede una puntuación, se recomienda no realizar una anastomosis. Aun cuando, frecuentemente, la situación en el quirófano es extremadamente compleja como para ser reducida a una simple ecuación, el principio es ciertamente válido.
Las consecuencias de una dehiscencia anastomótica son graves. Aun cuando resulta imposible evitar todas las dehiscencias de las anastomosis, su incidencia puede reducirse ejerciendo especial cuidado, se delinean y prevén los factores de riesgo. Las anastomosis deben realizarse con una técnica quirúrgica adecuada y cuidadosa y deben extremarse las precauciones cuando se trata a un paciente de alto riesgo.
Por tanto, podemos concluir que un pobre estado nutricio, valorado mediante la presencia de hipoalbuminemia o un índice de masa corporal menor a 15, no constituye un factor de riesgo para el desarrollo de dehiscencia de anastomosis en pacientes sometidos a cirugía intestinal. En la población de estudio, los factores de riesgo que fueron más significativos para el desarrollo de dehiscencia de anastomosis fueron el sangrado transoperatorio y la administración de transfusiones.
REFERENCIAS
1. Goulder F. Bowel anastomoses: The theory, the practice and the evidence base. World J Gastrointest Surg . 2012; 4: 208-213. [ Links ]
2. Eberl T, Jagoditsch M, Klingler A, Tschmelitsch J. Risk factors for anastomotic leakage after resection for rectal cancer. Am J Surg . 2008; 196: 592-598. [ Links ]
3. Matthiessen P, Hallböök O, Rutegárd J, Simert G, Sjödahl R. Defunctioning stoma reduces symptomatic anastomotic leakage after low anterior resection of the rectum for cancer: a randomized multicenter trial. Ann Surg . 2007; 246: 207-214. [ Links ]
4. Hyman NH. Managing anastomotic leaks from intestinal anastomoses. Surgeon . 2009; 7: 31-35. [ Links ]
5. Golub R, Golub RW, Cantu R Jr, Stein HD. A multivariate analysis of factors contributing to leakage of intestinal anastomoses. J Am Coll Surg . 1997; 184: 364-372. [ Links ]
6. Davis B, Rivadeneira DE. Complications of colorectal anastomoses: leaks, strictures, and bleeding. Surg Clin North Am . 2013; 93: 61-87. [ Links ]
7. Sánchez-Fernández P, Mier DJ, Castillo-González A, Blanco-Benavides R, Zárate-Castillo J. Factores de riesgo para dehiscencia de herida quirúrgica. Cir Cir . 2000; 68: 198-203. [ Links ]
8. Domínguez-Jimenez GL, Athié-Athié A, Mijares-García JM, Cárdenas-Lailson E, Perez-Reyez E. Efecto de la desnutrición en la anastomosis colónica de la rata. Cir Cir . 2001; 23: 81-86. [ Links ]
9. Hyman NH, Osler T, Cataldo P, Burns EH, Shackford SR. Anastomotic leaks after bowel resection: what does peer review teach us about the relationship to postoperative mortality? J Am Coll Surg . 2009; 208: 48-52. [ Links ]
10. Burden S, Todd C, Hill J, Lal S. Pre-operative nutrition support in patients undergoing gastrointestinal surgery. Cochrane Database Syst Rev . 2012; 11: CD008879. [ Links ]
11. Naskar TK, Chakraborty S, Mukhopadhyay S, Agnes C, Majumdar P. Did you choose the right suture material for skin closure in elective caesarean section? J Indian Med Assoc . 2012; 110: 644-648. [ Links ]
12. Food and Agriculture Organization of the United Nations. The double burden of malnutrition. Case studies from six developing countries. FAO Food Nutr Pap . 2006; 84: 1-334. [ Links ]
13. Docherty JG, McGregor JR, Akyol AM, Murray GD, Galloway DJ. Comparison of manually constructed and stapled anastomoses in colorectal surgery. West of Scotland and Highland Anastomosis Study Group. Ann Surg . 1995; 221: 176-184. [ Links ]
14. Fingerhut A, Elhadad A, Hay JM, Lacaine F, Flamant Y. Infraperitoneal colorectal anastomosis: hand-sewn versus circular staples. A controlled clinical trial. French Associations for Surgical Research. Surgery . 1994; 116: 484-490. [ Links ]
15. Hyman N, Manchester TL, Osler T, Burns B, Cataldo PA. Anastomotic leaks after intestinal anastomosis: it's later than you think. Ann Surg . 2007; 245: 254-258. [ Links ]
16. Kingham TP, Pachter HL. Colonic anastomotic leak: risk factors, diagnosis, and treatment. J Am Coll Surg . 2009; 208: 269-278. [ Links ]
17. Morales MP, Miedema BW, Scott JS, de la Torre RA. Management of postsurgical leaks in the bariatric patient. Gastrointest Endosc Clin N Am . 2011; 21: 295-304. [ Links ]
18. Morks AN, Ploeg RJ, Sijbrand Hofker H, Wiggers T, Havenga K. Late anastomotic leakage in colorectal surgery: a significant problem. Colorectal Dis . 2013; 15: e271-275. [ Links ]
19. Brisinda G, Vanella S, Cadeddu F, Mazzeo P. Colonic anastomotic leak: risk factors, diagnosis, and treatment. J Am Coll Surg . 2009; 208: 1152-1154. [ Links ]
20. Kang CY, Halabi WJ, Chaudhry OO, Nguyen V, Pigazzi A, Carmichael JC, et al. Risk factors for anastomotic leakage after anterior resection for rectal cancer. JAMA Surg . 2013; 148: 65-71. [ Links ]
21. Schrock TR, Deveney CW, Dunphy JE. Factor contributing to leakage of colonic anastomoses. Ann Surg . 1973; 177: 513-518. [ Links ]
22. Iancu C, Mocan LC, Todea-Iancu D, Mocan T, Acalovschi I, Ionescu D, et al. Host-related predictive factors for anastomotic leakage following large bowel resections for colorectal cancer. J Gastrointestin Liver Dis . 2008; 17: 299-303. [ Links ]
23. Karanjia ND, Corder AP, Bearn P, Heald RJ. Leakage from stapled low anastomosis after total mesorectal excision for carcinoma of the rectum. Br J Surg . 1994; 81: 1224-1226. [ Links ]
24. Mullen JL, Gertner MH, Buzby GP, Goodhart GL, Rosato EF. Implications of malnutrition in the surgical patient. Arch Surg . 1979; 114: 121-125. [ Links ]
25. Law NW, Ellis H. The effect of parenteral nutrition on the healing of abdominal wall wounds and colonic anastomoses in protein-malnourished rats. Surgery . 1990; 107: 449-454. [ Links ]
26. Ward MW, Danzi M, Lewin MR, Rennie MJ, Clark CG. The effects of subclinical malnutrition and refeeding on the healing of experimental colonic anastomoses. Br J Surg . 1982; 69: 308-310. [ Links ]
27. Delany HM, Demetriou AA, Teh E, Levenson SM. Effect of early postoperative nutritional support on skin wound and colon anastomosis healing. JPEN J Parenter Enteral Nutr . 1990; 14: 357-361. [ Links ]
28. Martinez-Mas E, Vazquez-Prado A, Larrocha-Grau M, Artigues-Sanchez E, Lloris-Carsi JM, Trullenque-Peris R. The impact of low-residue enteral feeding on the healing of colonic anastomoses. Hepatogastroenterology . 1993; 40: 481-484. [ Links ]
29. Demetriades H, Botsios D, Kazantzidou D, Sakkas L, Tsalis K, Manos K, et al. Effect of early postoperative enteral feeding on the healing of colonic anastomoses in rats. Comparison of three different enteral diets. Eur Surg Res . 1999; 31: 57-63. [ Links ]
30. Wheble GA, Knight WR, Khan OA. Enteral versus total parenteral nutrition following major upper gastrointestinal surgery. Int J Surg . 2012; 10: 194-197. [ Links ]
31. Pacelli F, Bossola M, Papa V, Malerba M, Modesti C, Sgadari A, et al. Enteral versus parenteral nutrition after major abdominal surgery: an even match. Arch Surg. 2001; 136: 933-936. [ Links ]
32. Braga M, Gianotti L, Vignali A, Cestari A, Bisagni P, Di Carlo V. Artificial nutrition after major abdominal surgery: impact of route of administration and composition of the diet. Crit Care Med . 1998; 26: 24-30. [ Links ]
33. de Aguilar-Nascimento JE, Bicudo-Salomao A, Portari-Filho PE. Optimal timing for the initiation of enteral and parenteral nutrition in critical medical and surgical conditions. Nutrition . 2012; 28: 840-843. [ Links ]
34. Wobbes T, Joosen KH, Kuypers HH, Beerthuizen GI, Theeuwes GM. The effect of packed cells and whole blood transfusions on survival after curative resection for colorectal carcinoma. Dis Colon Rectum . 1989; 32: 743-748. [ Links ]
35. Wobbes T, Bemelmans BL, Kuypers JH, Beerthuizen GI, Theeuwes AG. Risk of postoperative septic complications after abdominal surgical treatment in relation to perioperative blood transfusion. Surg Gynecol Obstet . 1990; 171: 59-62. [ Links ]
36. Tadros T, Wobbes T, Hendriks T. Blood transfusion impairs the healing of experimental intestinal anastomoses. Ann Surg . 1992; 215: 276-281. [ Links ]
37. Waymack JP, Balakrishnan K, McNeal N, Gonce S, Miskell P, Warden GD, et al. Effect of blood transfusions on macrophage-lymphocyte interaction in an animal model. Ann Surg . 1986; 204: 681-685. [ Links ]
38. Waymack JP, Robb E, Alexander JW. Effect of transfusion on immune function in a traumatized animal model. II. Effect on mortality rate following septic challenge. Arch Surg . 1987; 122: 935-939. [ Links ]
39. Waymack JP, Rapien J, Garnett D, Tweddell JS, Alexander JW. Effect of transfusion on immune function in a traumatized animal model. Arch Surg . 1986; 121: 50-55. [ Links ]
40. Morgenstern L, Yamakawa T, Ben-Shoshan M, Lippman H. Anastomotic leakage after low colonic anastomosis. Clinical and experimental aspects. Am J Surg . 1972; 123: 104-109. [ Links ]
Nota
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/cirujanogeneral














