Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Cirujano general
versão impressa ISSN 1405-0099
Cir. gen vol.34 no.1 Ciudad de México Jan./Mar. 2012
Research articles
Comparación entre la técnica de malla cupular elíptica (MCE) con la técnica de Lichtenstein para disminuir el dolor postquirúrgico en plastía inguinal abierta. Resultados preliminares
Comparison of a dome-shaped elyptical mesh (DSEM) technique with the Lichtenstein technique to diminish post-surgical pain in open hernioplasty. Preliminary results
Rafal Ludwik Smolinski Kurek, Juan Carlos Mayagoitia González, Martha Alicia Hernández González, Sergio Solorio Meza
Unidad Médica de Atención Ambulatoria 55 (UMAA 55), Hospital General de Zona No. 21 y Unidad Médica de Alta Especialidad T1 del Instituto Mexicano del Seguro Social (IMSS), León, Gto.
Correspondencia: Dr. Rafal Ludwik Smolinski Kurek.
Condado de Burgos Núm. 125. El Condado plus. 37218.
León, Gto. Tel. 477 7768584. E-mail:
ludwiksrk@hotmail.com
Recibido para publicación: 20 diciembre 2011 Aceptado para publicación: 15 enero 2012
Resumen Objetivo: Comparar la técnica de Lichtenstein con la técnica de la malla cupular elíptica (MCE) en cuanto a dolor postoperatorio.
Sede: Unidad Médica de Atención Ambulatoria número 55 del Instituto Mexicano del Seguro Social. León, Gto.
Diseño: Ensayo clínico controlado, aleatorizado, doble ciego.
Análisis estadístico: Chi cuadrada, prueba Logrank-KaplanMeier, análisis de varianza de medidas repetidas con factor agrupante, análisis de riesgo de Cox.
Material y métodos: Aleatorizamos 90 pacientes con hernia inguinal en dos grupos: MCE y Lichtenstein. Seguimiento a la semana, uno, tres y seis meses. Variables estudiadas: intensidad del dolor por escala visual análoga, frecuencia de dolor, consumo de analgésicos, tipo de disestesias, complicaciones y recidiva a seis meses.
Resultados: Grupos comparables en características generales. Encontramos proporción menor de pacientes con dolor en grupo MCE (χ2 = 7.28, p = 0.007). MCE mostró menor intensidad del dolor con (F = 22.37, p = 0.000003). No hubo diferencias en tiempo quirúrgico, consumo de analgésicos o frecuencia de disestesias a excepción de la primera semana. La técnica quirúrgica demostró ser determinante para dolor en análisis de riesgo (p = 0.009). Se presentó una recidiva en grupo MCE.
Conclusiones: MCE es una técnica quirúrgica, igual de efectiva y segura que la técnica Lichtenstein y produce menor dolor postoperatorio.
Palabras clave: Hernia, hernia inguinal, hernioplastía inguinal, inguinodinia, neuropatía inguinal.
Introducción La cirugía de la hernia inguinal es una de las cirugías más frecuentes en México y en el mundo.1,2 Se ha observado que la recidiva de las hernias inguinales en México se presenta en un 11 a 20% utilizando técnicas con tensión y en un 0.5 a 1% utilizando técnicas libres de tensión o con material protésico.2- En la literatura mundial, algunos porcentajes de recurrencia son alrededor del 2% en reparaciones con técnica de Lichtenstein, siendo realizadas por cirujanos generales no dedicados a la cirugía herniaria exclusivamente, 3.6% en reparaciones sin tensión diferentes de la técnica Lichtenstein y 3.3% en reparaciones laparoscópicas.2,5
La técnica de Lichtenstein se ha convertido en el estándar de oro y continúa siendo el procedimiento de reparación más popular y el más utilizado para la reparación de la hernia inguinal;6 sin embargo, el dolor postquirúrgico sigue siendo una realidad y llega a ser una complicación importante y, en algunos de los casos, puede llegar a ser invalidante. Los factores participantes en la génesis de la inguinodinia con esta técnica quirúrgica son la inadecuada identificación de los nervios inguinales con su consiguiente lesión y/o atrapamiento por el material de sutura, el estado de inflamación continua y fibrosis que genera la malla, además de su tendencia natural a encogerse7 y que al estar en contacto directo con las estructuras nerviosas pueda dar lugar a atrapamiento y tracción nerviosa, generando dolor.
El dolor postoperatorio crónico o inguinodinia, posterior a una plastía inguinal, tiene una incidencia en la literatura mundial en las plastías abiertas con malla que varía entre 5 y 15% entre etiologías somáticas y neuropáticas,4,8 aunque hay series que reportan hasta un 63%.6 En otras revisiones se han reportado frecuencias de inguinodinia posterior a plastía inguinal con técnica de Lichtenstein de hasta 28.5%,9 más de la mitad de estos pacientes presentan dolor entre moderado y severo, llegando en ocasiones a ser incapacitante.9 En el presente estudio proponemos una nueva técnica quirúrgica a la cual denominamos ''técnica de malla cupular elíptica (MCE)'', la cual pretende abatir el dolor postquirúrgico evitando los inconvenientes mencionados en el párrafo anterior, mediante la aplicación de los siguientes principios:
1. Colocación de la malla en el espacio preperitoneal, evitando todo contacto de la malla con estructuras nerviosas.
2. Configurar la forma de la malla mediante la forma de una cúpula elíptica, lo cual además de adaptarse mejor a la forma natural del canal inguinal, evitará la formación de meshomas.
3. Disminuir la cantidad de sutura empleada para fijar la malla, utilizando sólo cuatro puntos simples colocados en sitios estratégicos, valiéndonos de la posición preperitoneal de la malla y de su forma de cúpula.
Material y métodos Se realizó un ensayo clínico prospectivo, doble ciego y controlado en pacientes adultos con diagnóstico de hernia inguinal primaria no complicada, en la Unidad Médica de Atención Ambulatoria 55 (UMAA 55) del Instituto Mexicano del Seguro Social (IMSS) desde agosto 2010 hasta diciembre 2011.
Se calculó un tamaño muestral de 168 pacientes con base en alfa 0.05, beta 0.2, poder 0.8, diferencia esperada de 10% en frecuencia de dolor entre las dos técnicas. De estos pacientes, hasta la fecha, 90 completaron el seguimiento requerido, siendo el presente análisis con base en estos 90 pacientes y las diferencias encontradas en la prueba logrank con un poder de 58%. Se realizó muestreo por conveniencia en pacientes mayores de 18 años que acudieron a la consulta de cirugía general con diagnóstico de hernia inguinal no complicada no recidivante. Previa firma de consentimiento informado, se asignó a cada paciente, mediante una tabla de números aleatorios a dos grupos de tratamiento: Grupo A: 45 pacientes operados con la técnica de malla cupular elíptica y Grupo B: 45 pacientes operados con la técnica de Lichtenstein.
Los criterios de inclusión fueron: pacientes mayores de 18 años con diagnóstico de hernia inguinal no complicada no recidivante que acudieron a la consulta externa, reuniendo los criterios de cirugía mayor ambulatoria: puntuación de la Sociedad Americana de Anestesiología (ASA) de 2 o menor, índice de masa corporal menor de 35, ausencia de complicaciones, sin alteraciones cognoscitivas o psiquiátricas y no estar incluidos en otro protocolo de estudio. Los criterios de no inclusión consistieron en pacientes con patología de base que pudiera repercutir en el grado de sensibilidad o percepción del dolor o que presentaran inguinodinia previa a la cirugía. Los criterios de exclusión se establecieron para pacientes cuyo diagnóstico transquirúrgico resultara ser diferente del de hernia inguinal o cuyo seguimiento postquirúrgico se volviera imposible por cambio de domicilio o de adscripción. Se consideró para cada grupo de tratamiento las siguientes variables descriptivas: edad en años, género, tipo de hernia de acuerdo a la clasificación de Gillbert modificada por Rutkow,4 tiempo quirúrgico medido en minutos a partir de la incisión de la piel hasta la finalización del cierre de la misma, complicaciones transquirúrgicas como cualquier incidente o evento adverso ocurrido durante el procedimiento quirúrgico, complicaciones postquirúrgicas como cualquier evento adverso ocurrido posterior a la cirugía, detectado durante el seguimiento del paciente. Modalidad ambulatoria exitosa cuando el paciente se encontraba en las condiciones adecuadas para permitir su egreso a domicilio el mismo día, sin tener que acudir a la unidad de urgencias por eventos adversos relacionados con la misma. Finalmente, recidiva de la hernia o aparición de una nueva hernia en la ingle operada. Dentro de las variables dependientes principales estudiadas tenemos la escala visual análoga del dolor (EVA) clasificada como cuantitativa numérica con una puntuación desde 0 como ausencia de dolor, hasta 10 como máximo dolor posible. Presencia o ausencia de dolor, lo cual quedó determinado al dividir la escala visual análoga en dos; 0 a 2 puntos como ausencia de dolor y 3 a 10 puntos como presencia de dolor. Se consideró este punto de corte con base en lo descrito en la literatura,10 que considera cualquier dolor superior a 2 en la escala visual análoga como motivo de interferencia en la realización de las actividades cotidianas y laborales. Miligramos de paracetamol y diclofenaco ingeridos por cada paciente posterior a la cirugía en respuesta al dolor, clasificada como variable cuantitativa numérica continua. Como variable independiente secundaria se realizó mapeo inguinal por dermatomas, según la técnica descrita por Álvarez Quintero,11 determinando la presencia o ausencia de disestesias inguinales. Se consideró como presencia de disestesia la aparición de hipoestesia, anestesia o hiperestesia en la ingle operada. Se clasificó la variable como cualitativa dicotómica. Se mencionaron también los nervios inguinales afectados con fines descriptivos: ilioinguinal, iliohipogástrico y rama genital del genitocrural.
Se le informó ampliamente a cada paciente sobre los pormenores de cada técnica quirúrgica, sus riesgos y ventajas esperadas y se solicitó su consentimiento por escrito. Para la asignación aleatoria a los grupos de tratamiento de los pacientes se utilizó una tabla de números aleatorios, quedando desde ese momento registrados en la hoja de captación de datos. Todos los pacientes contaban con estudios de laboratorio dentro de parámetros normales. A los pacientes de más de 40 años o con algún estado comórbido se les solicitó una radiografía de tórax y un electrocardiograma y se les envió a una valoración preoperatoria con el médico internista. Independientemente del grupo asignado, todas las cirugías se realizaron en modalidad ambulatoria por dos cirujanos certificados, quienes tuvieron la misma oportunidad de operar pacientes aplicando ambas técnicas, y con anestesia locorregional según la técnica de Ponka,12 aplicada por el mismo cirujano. Se contó con un anestesiólogo, quien aplicó anestesia endovenosa con la finalidad de sedar al paciente. En ninguno de los pacientes se utilizó profilaxis antibiótica. A todos los pacientes, independientemente del grupo, se les colocó malla de polipropileno pesado, por disponibilidad. Posterior a la cirugía, cada paciente pasó a la sala de recuperación donde se le aplicaron analgésicos endovenosos del tipo AINE y posteriormente fue vigilado hasta cumplir con los criterios establecidos para ser egresado a su domicilio: Estabilidad hemodinámica, nivel de alerta adecuado, nivel de dolor tolerable, ausencia de sangrado, capacidad para deambular, tolerancia a la vía oral. Al ser egresado, cada paciente llevaba una nota de alta donde se especificó los cuidados postquirúrgicos y los datos de alarma que pudieran implicar complicaciones, siendo instruido de acudir al Servicio de Urgencias en caso necesario. Se indicó a cada paciente la toma de analgésicos durante 4 días posteriores a la cirugía con la siguiente posología; paracetamol 500 mg cada seis horas y diclofenaco 100 mg cada 12 horas. A partir del quinto día, la indicación fue la toma de analgésicos en caso de dolor, conservando la misma posología. En el día de cada consulta se contabilizó la ingesta de analgésicos mediante el recuento de las cajas vacías.
Los pacientes operados se citaron a consulta externa en un lapso de siete días, al mes, a los tres meses, y por último a los seis meses, para ser valorados por un residente de cirugía de tercer año, quien no tenía acceso al expediente clínico y, por lo tanto, desconocía el grupo de tratamiento al que pertenecía cada paciente. La valoración consistió en: evaluar la escala visual análoga EVA, revisar la cantidad de miligramos de analgésico requeridos por el paciente desde la cirugía o desde la última evaluación, evaluar la herida buscando complicaciones y recidivas, y realizar el mapeo por dermatoma.
El análisis estadístico consistió en aplicar la chi cuadrada para comparar la proporción de pacientes con dolor por grupo en cada tiempo de evaluación por separado, así como la proporción de pacientes con disestesia en cada grupo. La prueba logrank -KaplanMeier para comparar las curvas de sobrevivencia (proporción de pacientes con dolor a lo largo del tiempo) en cada grupo. El análisis de varianza de medidas repetidas (tiempo) con factor agrupante (técnica) para comparar la intensidad del dolor en medias de puntuación EVA entre ambos grupos a lo largo del tiempo y el análisis de riesgo de Cox para evaluar qué tanto influye cada variable en la persistencia del dolor postquirúrgico, se realizaron con el programa estadístico NCSS 2007.
La técnica de Lichtenstein fue efectuada estrictamente con base en la última descripción de Parviz Amid.6,13 La técnica de malla cupular elíptica se efectuó de acuerdo a la siguiente descripción:
Técnica de la malla cupular elíptica (MCE)
1. Posición decúbito, antisepsia convencional, sedación endovenosa por anestesiólogo y técnica de Ponka de anestesia infiltrativa locorregional con solución preparada de xilocaína al 2% (25%), ropivacaína (25%) y solución fisiológica (50%).
2. Incisión 3 a 4 cm sobre anillo inguinal profundo, disección hasta aponeurosis del oblicuo mayor, la cual se infiltra con solución anestésica inundando el canal inguinal y se abre en sentido longitudinal, cuidando estructuras nerviosas.
3. Se infiltra el cordón espermático y se diseca aislándolo mediante una cintilla umbilical o drenaje Penrose.
4. Se identifica el saco herniario indirecto, se diseca gentilmente y se reduce manualmente sin abrirlo. Si se trata de un saco directo, se invagina con puntos de sutura si es muy grande, o se deja sin ningún tratamiento.
5. Se recorta un segmento de malla de polipropileno acorde a las dimensiones del canal inguinal en forma elíptica (Figura 1).
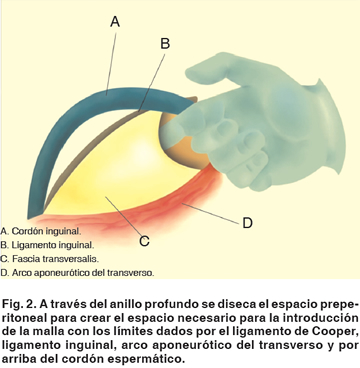
6. A través del orificio inguinal profundo, se diseca de forma roma el espacio preperitoneal, hasta lograr un espacio libre considerable para el tamaño de la malla, lateralmente por debajo del ligamento inguinal, inferiormente hasta el ligamento de Cooper, medialmente por debajo de la masa musculotendinosa del arco aponeurótico del transverso, y superiormente, rodeando y dejando libremente disecado el cordón inguinal. El espacio preperitoneal y sus estructuras se pueden abordar de forma segura bajo visión directa, respetando los vasos epigástricos mediales, al introducir la rama lateral de un separador Farabeuf (Figura 2).
7. El primer punto con sutura monofilamento absorbible (polidioxanona o poliglecaprone) se coloca bajo visión directa con ayuda del separador Farabeuf y se coloca con la malla aun fuera del espacio preperitoneal. El punto atraviesa desde afuera hacia adentro las siguientes estructuras: ligamento inguinal, ligamento de Cooper, malla. Posteriormente, el mismo punto atraviesa las mismas estructuras en sentido inverso (Figura 3).
8. Se pasa una de las colas de la malla por debajo del cordón inguinal, el cual ahora se rechaza hacia el ligamento inguinal, quedando expuesto el arco aponeurótico del transverso. De esta manera y siempre bajo visión directa a través del orificio inguinal profundo, se coloca el segundo punto de sutura que atraviesa desde fuera hacia adentro: masa muscular del arco aponeurótico del transverso, malla y posteriormente regresa en sentido inverso (Figura 4).
9. Posteriormente se inserta la malla en el espacio preperitoneal a través del orificio inguinal profundo y se despliega por el espacio preperitoneal mediante la tracción de los dos primeros puntos. Después, las colas de la malla se entrecruzan alrededor del cordón inguinal pero ya en el espacio preperitoneal, lo que le confiere la forma cupular a la malla con el vértice hacia abajo. Finalmente se ponen otros dos puntos de sutura, atravesando desde afuera la masa muscular del arco aponeurótico del transverso, asegurando el entrecruzamiento de las colas alrededor del cordón inguinal y verificando que las colas distalmente queden dentro del espacio preperitoneal para que cubran el triángulo lateral de la ingle (Figura 5).
10. Finalmente, la malla queda escondida a la vista, debajo de la fascia transversalis, en el espacio preperitoneal, donde al cruzarse las colas adopta la forma de una cúpula elíptica (Figuras 6 y 7).
11. Se efectúa cierre por planos, igual que en la técnica de Lichtenstein.





Resultados Hasta el momento de la elaboración del presente reporte, se cuenta con los siguientes resultados: 90 pacientes completaron el seguimiento a los seis meses: 45 del grupo A y 45 del grupo B. Podemos observar en el cuadro I las características generales de ambos grupos. Al final del cuadro observamos las medias del tiempo quirúrgico en cada grupo, medido en minutos. En ninguna de las variables observadas se pudo encontrar diferencias significativas, por lo que consideramos que nuestros grupos de estudio son estadísticamente comparables. Ninguno de los pacientes operados en el estudio presentó complicaciones ni eventos adversos durante el procedimiento quirúrgico. El 100% de los pacientes cursaron con cirugía ambulatoria exitosa en ambos grupos de tratamiento. Se realizó análisis de varianza de medidas repetidas con un factor agrupante para comparar las medias de la puntuación de EVA (intensidad del dolor) entre los dos grupos de tratamiento a lo largo del tiempo postoperatorio. Al comparar los dos grupos de tratamiento en cuanto a las medias de la puntuación de EVA (Figura 1), a lo largo del tiempo, se obtuvo, mediante el análisis de varianza de medidas repetidas, diferencia en la intensidad del dolor (F = 22.37, p = 0.000003), siendo menor con la técnica MCE. En el cuadro II se observa la proporción de pacientes que persisten con dolor en ambos grupos de tratamiento a la semana, al mes, a los tres meses y a los seis meses del seguimiento postquirúrgico. Con base en las proporciones del cuadro II, se graficaron dos curvas de análisis de sobrevivencia (una para cada grupo), considerando que las proporciones de pacientes con dolor disminuyen con el tiempo y en donde se puede ver la disminución de la probabilidad de presentar dolor a medida que avanza el tiempo y las diferencias en esas probabilidades entre las dos técnicas quirúrgicas. Así se pudo calcular la probabilidad de persistir con dolor en cualquier momento determinado del tiempo postquirúrgico para cada grupo de tratamiento. Estas probabilidades se observan en el cuadro III, donde se puede ver que la probabilidad de tener dolor a los 162 días es de 0.37 para la técnica MCE y 0.48 en la técnica de Lichtenstein. Esta diferencia resultó significativa con la prueba de logrank -KaplanMeier (χ2 = 7.28, p = 007). En el cuadro IV se observan las proporciones de pacientes con disestesia inguinal (anestesia, hipoestesia o hiperestesia, cuadro V) en los dos grupos de tratamiento. La proporción fue menor en el grupo MCE, pero la diferencia sólo fue significativa en la primera semana del seguimiento.




Se realizó el análisis multivariado de riesgo proporcional de Cox para determinar el peso de otras variables en la presencia de dolor postquirúrgico. Dentro de las variables predictoras del modelo se incluyeron como numéricas: la edad. Dentro de las variables predictoras categóricas se incluyeron en el modelo: técnica quirúrgica (grupo de tratamiento), presencia de disestesias, género, clasificación de Gilbert y presencia de complicaciones. La técnica quirúrgica fue el único factor estadísticamente relevante, lo cual significa que la elección de una u otra técnica es un factor determinante en la presencia de dolor postoperatorio.
En el cuadro VI se observan la cantidad y tipos de complicaciones en las cuales de los seromas presentados ninguno requirió punción: todos drenaron de forma espontánea. Los hematomas presentados eran menores e involucionaron de forma espontánea sin necesidad de punción ni drenaje. Se presentaron tres casos de edema agudo de cordón inguinal de leve a moderado (entre 2 y 3 cm), los cuales involucionaron a dimensiones normales en un lapso de uno a dos meses. En nuestro estudio no se presentaron infecciones de la herida quirúrgica: sólo una recidiva de hernia inguinal en un paciente operado con la técnica de la malla cupular elíptica (MCE) que corresponde al 2% del grupo hasta ahora operado. La recidiva ocurrió a los tres meses de la primera cirugía y el paciente fue reoperado, esta vez con la técnica de Lichtenstein, dado el difícil acceso al espacio preperitoneal por la fibrosis ocasionada por la malla previa. Su evolución postoperatoria ha sido satisfactoria hasta el momento actual.

Discusión Con base en los resultados del análisis preliminar de los primeros 90 pacientes que concluyeron el seguimiento, encontramos diferencias en cuanto a la presencia del dolor entre las dos técnicas, a la semana y al mes. A los tres y a los seis meses existe una tendencia a favor de la técnica MCE, aunque no alcanza la significancia estadística. De igual manera se demostró una diferencia en cuanto a la presencia de dolor postoperatorio a lo largo de seis meses, a favor de la técnica de la malla cupular elíptica. Al comparar las medias de las puntuaciones EVA entre los dos grupos a lo largo del tiempo se encontraron diferencias en cuanto a la intensidad del dolor. Sin embargo, al momento de evaluar el consumo de analgésicos postoperatorios (paracetamol y diclofenaco) no se presentaron diferencias. En el presente estudio encontramos que la proporción de disestesias es menor en la técnica MCE que en la de Lichtenstein; no obstante, esa diferencia sólo alcanzó significancia estadística en la primera semana del seguimiento. Al realizar el análisis de riesgo, se observó que el grupo de tratamiento es el único factor contribuyente a la persistencia del dolor a lo largo del tiempo con significancia estadística. La presencia de disestesias no resultó ser un factor predictor significativo en estos pacientes. No hubo diferencias significativas en cuanto a la presencia y al tipo de complicaciones entre las técnicas. No está claro si la elección de una determinada técnica quirúrgica pueda influir en el dolor postoperatorio, pero está demostrado en grandes revisiones retrospectivas14 y en metaanálisis15 que las técnicas laparoscópicas y la utilización de mallas ligeras producen menos dolor postoperatorio, lo cual probablemente tenga que ver con la posición de la malla, el contacto entre la malla y los nervios inguinales y el grado de fibrosis que genera la malla en los tejidos.16 El sustento teórico para respaldar el porqué la técnica MCE produce menos dolor postquirúrgico reside en la posición preperitoneal de la malla, en donde se disminuye el contacto de la misma con los nervios inguinales: el ilioinguinal, el iliohipogástrico y la rama genital del genitocrural. Está demostrado de forma experimental que el contacto de tejido nervioso con mallas de polipropileno da lugar a degeneración de la mielina, edema neural y fibrosis, lo que produce neuropatías periféricas y neuralgias.16 Existen otras técnicas que colocan dispositivos de malla en el espacio preperitoneal inguinal, al igual que en nuestra técnica: técnica de Trabucco, técnica de Ugahary, Stoppa, parche de Kugel, Prolene Hernia system , las técnicas laparoscópicas TAPP (transabdominal) y TEPP (extraperitoneal). Sin embargo, en las primeras cinco mencionadas se utilizan dispositivos de malla previamente preformados o prefabricados que, en la gran mayoría de los casos, no están disponibles en nuestros hospitales, por lo que su realización es casi anecdótica. Las técnicas laparoscópicas se realizan con mayor frecuencia, pero requieren equipo laparoscópico y entrenamiento especializado. De igual manera, son muy escasos los ensayos clínicos que comparen alguna de estas técnicas con otras en cuanto al dolor. La técnica que proponemos es nueva en cuanto a su diseño quirúrgico y, por lo tanto, no existen reportes al respecto en la literatura. Ofrece las ventajas de su sencillez, mínimos recursos requeridos (malla plana simple de polipropileno), reproductibilidad, utilidad para reparar todo tipo de hernias de la ingle (directas, indirectas, femorales) y la posición preperitoneal de la malla y, por lo tanto, menor contacto con estructuras nerviosas, como fundamento de que puede producir menos dolor postoperatorio. Nutley y cols., en 2006, realizaron una técnica parecida a la que proponemos (aunque con diferencias en cuanto a la forma de la malla y proceso de fijación) en donde colocaron un segmento de malla simple de polipropileno en el espacio preperitoneal. Aplicaron la técnica en 52 pacientes con un seguimiento a tres años, reportando dolor leve en la escala visual análoga (0.58 hasta 1.39). Sin embargo, no tuvieron grupo control y además afirman que su técnica sólo es aplicable para la reparación de hernias inguinales directas.17
Existen otros ensayos clínicos en los cuales compararon una técnica quirúrgica con malla en el espacio preperitoneal con la técnica de Lichtenstein (que es nuestro mismo parámetro de comparación) para evaluar la evolución del dolor. En el 2010, Langeveld y cols. dividieron en forma aleatoria a 660 pacientes en dos grupos de tratamiento, siendo el control operado con técnica de Lichtenstein y el grupo experimental operado con la técnica laparoscópica TEP (plastía total extraperitoneal), en la cual, a semejanza de nuestro estudio, la malla es colocada en el espacio preperitoneal.18 En un seguimiento a largo plazo de hasta cinco años, encontraron diferencias significativas con menos dolor postoperatorio en la técnica TEP (preperitoneal) en las primeras seis semanas postoperatorias, pero sin encontrar diferencias en el dolor crónico (más de seis semanas) entre las dos técnicas, lo cual es comparable a nuestros resultados. Los autores también encontraron menos disestesias con la técnica TEP preperitoneal,18 lo cual también se asemeja a nuestros resultados, aunque sólo encontramos diferencias en este aspecto en la primera semana.
Awad y cols., en 2007, compararon en un seguimiento a tres años la técnica de Lichtenstein con la técnica Prolene Hernia System , una técnica abierta (no laparoscópica) en la cual se coloca un dispositivo prefabricado de malla donde una de sus hojas permanece en el espacio preperitoneal.19 Encontraron una diferencia significativa en cuanto a menos dolor neuropático a largo plazo con la técnica del dispositivo preperitoneal.19 Sin embargo, en un metaanálisis que comparaba el dolor entre la técnica de Lichtenstein y el Prolene Hernia System no se encontraron diferencias significativas en cuanto al dolor postoperatorio.15
En un estudio prospectivo de 418 pacientes, Hompes y cols. evaluaron el dolor postoperatorio a 3 años de pacientes operados con la técnica de Kugel, en la cual se emplea un parche de malla expandible, que es colocado por abordaje abierto en el espacio preperitoneal.20 En el estudio se encontró que ninguno de los pacientes tuvo dolor importante posterior al año de seguimiento. En este estudio se encontró el género femenino y la edad avanzada como factores asociados al dolor postoperatorio,21 algo que no se demostró en nuestro estudio.
Nuestro estudio no logró demostrar una diferencia en cuanto al consumo de analgésicos, lo cual es comparable con otros estudios,18 y puede deberse a la variabilidad subjetiva en la percepción del dolor.
La presencia de disestesias en nuestro estudio no demostró ser un factor predictor importante en la persistencia del dolor, mediante el análisis de riesgo proporcional de Cox. Las causas de las disestesias pueden tener una etiología multifactorial. Según se ha demostrado22 no siempre existe una correlación entre el dolor inguinal postoperatorio y la presencia de alteraciones de la sensibilidad inguinal, lo cual significa que puede haber pacientes que presentan disestesias, pero sin presentar dolor y viceversa. Según describen Aasvang y cols.22,23 puede haber pacientes en un inicio asintomáticos sólo con hipoestesia o anestesia inguinal que con el tiempo desarrollan hiperestesia y dolor, lo cual probablemente obedece al proceso de cicatrización de un nervio dañado con el consiguiente desarrollo de un neuroma.
Los mismos autores23 señalan que los pacientes postoperados de hernioplastía inguinal que desarrollan hiperestesias inguinales no necesariamente refieren presentar dolor, ya que la hiperestesia se puede desarrollar bajo diversas modalidades de estímulo que puede ser táctil, a la presión o a la temperatura y que no son las mismas para todos los pacientes. Mencionan los autores que en los pacientes con hiperestesias que sí refieren dolor, la hiperestesia se presenta incluso en la ingle sana o no operada, lo cual implica un fenómeno paradójico de sensibilización donde participa el sistema nervioso central.23 Las complicaciones menores que presentaron los pacientes operados con la técnica MCE en nuestro estudio son comparables en frecuencia con nuestro grupo control y también con la frecuencia de complicaciones reportadas en la literatura en la mayoría de las reparaciones inguinales que utilizan material protésico.24
El caso de recidiva herniaria que se presentó en los pacientes operados con la técnica MCE corresponde al 2% de los pacientes analizados en ese grupo y es comparable con las frecuencias de recidiva que reporta la Asociación Mexicana de Hernias, para plastías con material protésico.4
Una de las limitantes de nuestro estudio y de este análisis parcial es el tamaño de la muestra, pues con base en la diferencia encontrada en la prueba logrank con los 90 pacientes analizados se calculó un poder de 58%. Por tanto, podemos concluir que:
1. La técnica de la malla cupular elíptica (MCE) es una nueva técnica quirúrgica para la reparación abierta de la hernia inguinal, comparable en efectividad y complicaciones a la técnica de Lichtenstein y ofrece menos dolor postoperatorio.
2. La presencia de disestesias inguinales como indicador de daño neural no fue un factor determinante del dolor postquirúrgico en ninguno de los grupos de tratamiento, por lo que el dolor que refieren los pacientes operados obedece a otras causas además de las neuropáticas.
3. Se requiere un seguimiento a largo plazo de los pacientes operados para evaluar el comportamiento del dolor crónico y la presencia de recidivas.
Agradecimientos
Se agradece a María José Hernández la realización de los dibujos-esquemas de la técnica de la malla cupular elíptica.
REFERENCIAS
1. Melchor-González JM, Pérez-García R, Argumedo-Villa M, Domínguez-Garciadiego F. Reparación de la hernia inguinal sin tensión. Cir Ciruj 2000; 68: 68-69. [ Links ]
2. Zaga-Minian I. Actualidades en hernia inguinal. Estado del arte. Cir Gen 2005; 27: 164-167. [ Links ]
3. Ramírez-Barba EJ, Lozano R, Lara-Lona E. Epidemiología de las hernias de la pared abdominal. En: Mayagoitia-González JC. Hernias de la pared abdominal. México, DF, Editorial Alfil. 2009: 9-19. [ Links ]
4. Mayagoitia-González JC, Martínez-Múnive A, Cisneros-Muñoz HA, Álvarez-Quintero R, Ramírez-Mancillas LR, Gil-Galindo G, et al. Guías de práctica clínica para hernias de la pared abdominal. Asociación Mexicana de Hernias. 2009. Disponible en: http://www.amhernia.org/guias.pdf. [ Links ]
5. Porrero-Carro JL, Sánchez-Cabezudo Díaz-Guerra C. Evidencias científicas en el tratamiento de la hernia inguinal. Cir Esp 2002; 72: 157-159. [ Links ]
6. Amid P. Técnica de hernioplastía libre de tensión Lichtenstein. En: Mayagoitia GJC. Hernias de la pared abdominal. Tratamiento actual. 2nda Ed. México, DF, Editorial Alfil. 2009: 133-139. [ Links ]
7. García-Ureña MA, Vega-Ruiz V, Díaz-Godoy A, Báez-Perrera JM, Marín-Gómez LM, Carnero-Hernández FJ, et al. Differences in polypropylene shrinkage depending on mesh position in an experimental study. Am J Surg 2007; 193: 538-542. [ Links ]
8. Bay-Nielsen M, Perkins F, Kehlet H; Danish Hernia Database. Pain and functional impairment one year after inguinal herniorrhaphy: a nation wide questionnaire study. Ann Surg 2001; 233: 1-7. [ Links ]
9. Nienhuijs S, Staal E, Strobbe Luc, Rosman C, Groenewoud H, Bleichrodt R. Chronic pain after mesh repair of inguinal hernia: a systematic review. Am J Surg 2007; 194: 394-400. [ Links ]
10. Srikandarajah S, Gilron I. Systematic review of movement evoked pain versus pain at rest in postsurgical clinical trials and meta-analyses: a fundamental distinction requiring standardized measurement. Pain 2001; 152: 1734-1738. [ Links ]
11. Álvarez-Quintero R, Anaya-Prado R, Malé-Velázquez E. Inguinodinia: mapeo por dermatomas como método diagnóstico. Cir Gen 2004; 26: 265-69. [ Links ]
12. Hernández-Ibar RS, Vega-Cervantes L, López-Flores A, Govantes-Ávila E, Ávila-Rivera JL. Anestesia local para el tratamiento de la hernia inguinal primaria. Cir Gen 2007; 29: 188-191. [ Links ]
13. Amid PK, Shulman AG, Lichtenstein IL. Open ''tension-free repair'' of inguinal hernias: the Lichtenstein technique. Eur J Surg 1996; 162: 447-453. [ Links ]
14. Bright E, Reddy VM, Wallace D,, Garcea G, Dennison AR. The incidence and success of treatment for severe chronic groin pain after open, transabdominal preperitoneal and totally extraperitoneal hernia repair. World J Surg 2010; 34: 692-696. [ Links ]
15. Zhao G, Gao P, Ma B, Tian J, Yang K. Open mesh techniques for inguinal hernia repair: a meta-analysis of randomized controlled trials. Ann Surg 2009; 250: 35-42. [ Links ]
16. Ferzli GS, Edwards E, Al-Khoury G, Hardin R. Postherniorraphy groin pain and how to avoid it. Surg Clin North Am 2008; 88: 203-216. [ Links ]
17. Nutley MT, Mulloy RH, Hagen N. Minimal postoperative pain using preperitoneal nontension sutured repair of direct inguinal hernias. Am J Surg 2006; 191: 479-482. [ Links ]
18. Langeveld HR, Riet M, Weidema WF, Stassen LP, Steyerberg EW, Lange J, et al. Total extraperitoneal inguinal hernia repair compared with Lichtenstein (the LEVEL-trial): a randomized controlled trial. Ann Surg 2010; 251: 819-824. [ Links ]
19. Awad SS, Yallalampalli S, Srour AM, Bellows CF, Albo D, Berger DH. Improved outcomes with the Prolene Hernia System mesh compared with the time-honored Lichtenstein onlay mesh repair for inguinal hernia repair. Am J Surg 2007; 193: 697-701. [ Links ]
20. Hompes R, Vansteenkiste F, Pottel H, Devriendt E, Van Rooy F. Chronic pain after Kugel inguinal hernia repair. Hernia 2008; 12: 127-132. [ Links ]
21. Dasari B, Grant L, Irwin T. Immediate and long-term outcomes of Lichtenstein and Kugel patch operations for inguinal hernia repair. Ulster Med J 2009; 78: 115-118. [ Links ]
22. Aasvang EK, Kehlet H. The effect of mesh removal and selective neurectomy on persistent postherniotomy pain. Ann Surg 2009; 249: 327-34. [ Links ]
23. Aasvang EK, Brandsborg B, Jensen TS T, Kehlet H. Heterogeneous sensory processing in persistent postherniotomy pain. Pain 2010; 150: 237-242. [ Links ]
24. Aasvang EK, Brandsborg D, Christensen B, Jensen TS, Kehlet H. Neurophysiological characterization of postherniotomy pain. Pain 2008; 137: 173-181. [ Links ]














