Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.29 no.3 Chapingo sep./dic. 2023 Epub 26-Ene-2024
https://doi.org/10.5154/r.rchsh.2023.01.001
Artículo de revisión
Solanum demissum Lindl. en el mejoramiento genético de la papa
1 Universidad Autónoma Chapingo. Carretera México-Texcoco km 38.5, Chapingo, Estado de México, C. P. 56230, MÉXICO.
2 Centro de Desarrollo e Innovación Tecnológica. Ruta 6, km 38, Hohenau, Itapúa, C. P. 06290, PARAGUAY.
Solanum demissum Lindl. es una de las especies más valoradas y utilizadas para el mejoramiento genético de la papa (Solanum tuberosum L.) debido a su riqueza en genes de resistencia a diversos factores bióticos y abióticos. A lo largo de los años, ha sido una planta de interés, principalmente por ser resistente al tizón tardío de la papa (causado por Phytophthora infestans [Mont. ] de Bary.), lo cual ha desencadenado cruzas entre S. demissum y S. tuberosum para la obtención de cultivares resistentes. Asimismo, ha sido utilizada para la identificación de razas fisiológicas de P. infestans y, recientemente, se ha asociado a glicoalcaloides y compuestos antioxidantes, cuyos posibles usos son de interés para diversas industrias. Dado que existe un gran potencial en la especie S. demissum, no solo como fuente de genes de resistencia sino también como fuente de importantes compuestos bioactivos, esta revisión resume los aportes de la investigación de la especie Solanum demissum en el mejoramiento genético de la papa cultivada, así como sus usos potenciales en otras áreas. Además, se evidencian las áreas de oportunidad y limitaciones para el mejoramiento genético para la resistencia al tizón tardío, de tal manera que sirva como punto de partida para el desarrollo de nuevas investigaciones o líneas.
Palabras clave: papa silvestre; recursos fitogenéticos; tizón tardío; resistencia; compuestos bioactivos
Solanum demissum Lindl. is one of the most valued and used species for potato (Solanum tuberosum L.) breeding due to its richness in genes for resistance to various biotic and abiotic factors. Over the years, it has been a plant of interest, mainly for its resistance to potato late blight (caused by Phytophthora infestans [Mont.] de Bary.), which has led to crosses between S. demissum and S. tuberosum to obtain resistant cultivars. It has also been used for identifying physiological races of P. infestans and, recently, it has been associated with glycoalkaloids and antioxidant compounds, whose potential uses are of interest to various industries. Since there is great potential in the species S. demissum, not only as a source of resistance genes but also as a source of important bioactive compounds, this review summarizes the research conducted on the use of Solanum demissum in the breeding of cultivated potato, as well as its potential uses in other areas. In addition, areas of opportunity and limitations for breeding for resistance to late blight are highlighted to serve as a starting point for the development of new research or lines.
Keywords: wild potato; plant genetic resources; late blight; resistance; bioactive compounds
Contenido sobresaliente
For more than 100 years S. demissum has been used in potato breeding.
14 genes for vertical resistance to late blight have been identified.
Resistance to insects, nematodes, bacteria, viruses and frost damage is documented for this species.
The presence of bioactive compounds of interest to the industry has been also reported.
Introducción
Los parientes silvestres de los cultivos son especies de plantas que están estrechamente relacionadas con las plantas cultivadas, y constituyen un enorme reservorio de diversidad genética que se puede utilizar para producir nuevas variedades de cultivos resistentes a enfermedades, plagas y estrés abiótico, con el potencial de contribuir a la seguridad alimentaria frente al cambio climático y el crecimiento demográfico (Fonseka, Fonseka, & Abhyapala, 2020). En el caso específico de la papa cultivada (Solanum tubersoum L.), sus parientes silvestres (Solanum spp.) son especies de gran interés, ya que portan genes útiles para el mejoramiento genético de este cultivo (Tiwari et al., 2013). Hasta la fecha, se conocen 151 especies de papas silvestres distribuidas en 16 países de América (Spooner et al., 2019; https://cipotato.org/potato/wild-potato-species).
Dentro de los parientes silvestres de la papa, Solanum demissum Lindl. ha sido, por más de 100 años, una de las especies más valoradas y utilizadas para el mejoramiento genético de la papa debido a su riqueza en genes de resistencia al tizón tardío (Phytophthora infestans [Mont. ] de Bary.). Se han identificado 14 genes de resistencia vertical, algunos introducidos en variedades comerciales, por lo cual se considera que alrededor del 50 % de las variedades comerciales en el mundo cuentan con genes de esta especie (Enciso-Maldonado, Lozoya-Saldaña, Díaz-García, & López-Salazar, 2021; Lozoya-Saldaña, 2011; Paluchowska, Śliwka, & Yin, 2022; Rodríguez, 2015).
Durante los siglos XIX y XX se realizaron distintas colectas alrededor del mundo, y a partir del siglo XX los científicos se enfocaron en realizar cruzas entre S. demissum y S. tuberosum para la obtención de cultivares resistentes (Turner, 2005); posteriormente, se utilizó para identificar razas fisiológicas de P. infestans (Black, Mastenbroek, Mills, & Peterson, 1953; Malcolmson & Black, 1966) y se demostró resistencia a insectos, virus, bacterias y nematodos (Bachmann-Pfabe, Hammann, Kruse, & Dehmer, 2019; del Rio & Bamberg, 2020; Eraso-Grisales, Mejía-España, & Hurtado-Benavides, 2019; Fürstenberg-Hägg, Zagrobelny, & Bak, 2013; Hidalgo-Gómez, Carrillo-Salazar, Rojas-Martínez, Rivera-Peña, & Ayala-Garay, 2022; Lambers, Chapin, & Pons, 2008; Tingey, 1984; Vega & Bamberg, 1995; Zoteyeva, Chrzanowska, Flis, & Zimnoch-Guzowska, 2012). Además, se ha detectado una alta actividad antioxidante (Friedman, 2006; Hale, Reddivari, Nzaramba, Bamberg, & Miller, 2008) y de glicoalcaliodes, compuestos encontrados en Solanum spp., principalmente, y que han resultado ser útiles en la defensa de las plantas y ante enfermedades humanas (Friedman, 2006; Kuc, 1992; Manrique-Carpintero, Tokuhisa, Ginzberg, Holliday, & Veilleux, 2013).
Los objetivos de esta revisión fueron resumir los aportes de las investigaciones de la especie S. demissum en el mejoramiento genético de la papa cultivada, así como sus usos potenciales en otras áreas, y evidenciar las áreas de oportunidad y limitaciones del mejoramiento genético para resistencia al tizón tardío, de tal manera que la revisión sirva como punto de partida para el desarrollo de nuevas investigaciones o líneas.
Metodología
Se realizó una búsqueda bibliográfica en bases de datos especializadas, tanto científicas como técnicas, incluyendo el Centro de Información Científica del CONACYT (https://cicco.conacyt.gov.py/), Google (https://www.google.com/webhp?hl=es-419&sa=X&ved=0ahUKEwjU04Os9YfxAhVJJrkGHUopCQcQPAgI), Google Académico (https://scholar.google.es/schhp?hl=es), Web of Science (https://mjl.clarivate.com/search-results), páginas web de instituciones estatales, páginas web de entidades internacionales relacionadas con los recursos fitogenéticos de papas, entre otras.
Primero, se combinaron las palabras clave y conectores para la búsqueda en todos los campos: “Solanum demissum”, “tizón tardío”, “Phytophthora infestans”, “estrés abiótico”, “resistencia a insectos”, “resistencia a heladas”, “papas silvestres”, “genes de resistencia”, donde se obtuvieron resultados de 1848 a 2022. Se utilizaron los criterios de inclusión, como el año (periodo 1845-2022) e idioma (inglés, español). Posteriormente, se seleccionaron todos los materiales técnicos y científicos disponibles en estas bases de datos referentes al origen, distribución, caracterización, resistencia a factores bióticos y abióticos, y análisis químicos relacionados con S. demissum.
Origen y distribución de Solanum demissum
Solanum demissum, papa silvestre perteneciente a la familia de las solanáceas (sección Petota del género Solanum) (Spooner & Hijmans, 2001), es una planta de porte alto con 60 cm de altura, flores de color violeta a morado, tubérculos blancos a bronceado, redondos a comprimidos, y de 5 cm de diámetro (Figura 1) (Hidalgo-Gómez et al., 2022). Se puede multiplicar sexualmente a través de las semillas contenidas en los frutos, lo que da como resultado una descendencia heterogénea, ya que es una especie hexaploide autoincompatible (2n = 6x = 72, con número de balance del endospermo [EBN, por sus siglas en inglés] de cuatro) (Spooner & Hijmans, 2001), lo cual da lugar a una compleja y amplia variabilidad genotípica. Esta fue descrita por primera vez por John Lindley (1848) en el artículo Notes on the Wild Potato, publicado en The Journal of the Horticultural Society of London. En dicho artículo, el autor describe accesiones de S. demissum, colectadas en el Valle de Toluca y Michoacán (México), como plantas que producen muchos estolones y pocos tubérculos, y da énfasis en que la especie no presenta síntomas de “la enfermedad”.

Figura 1 Solanum demissum cultivada en el Valle de Toluca: A) flores, B) plantas, C) planta, D) flores, E) frutos y F) semillas.
El principal centro de distribución de papas silvestres se encuentra en Sudamérica, en la región Andina entre Perú, Bolivia y Chile (Spooner et al., 2019), mientras que México es considerado el segundo mayor centro de biodiversidad de estas especies (Lozoya-Saldaña, 2005). S. demissum se encuentra distribuida en México y Guatemala (Figura 2). La mayor abundancia y diversidad se encuentra en territorio mexicano, en el Eje Volcánico y la Sierra Madre del Sur, entre las latitudes 19 y 21°, donde el clima es templado, sub-húmedo, con lluvias en verano de 800 a 900 mm anuales, alta humedad relativa y oscilación térmica de 12 a 20 °C (Hijmans, Spooner, Salas, Guarino, & de la Cruz, 2002; Lozoya-Saldaña, 2005; Luna-Cavazos, Romero-Manzanares, & García-Moya, 2012; USDA Germoplasm Resources Information Network [GRIN, https://www.ars-grin.gov/]). Spooner, Martinez, Hoekstra, y van den Berg (1997) indican que S. demissum es una especie que, usualmente, crece sólo en lugares sombreados bajo árboles maduros, entre musgo u hojarasca de pino.

Figura 2 Distribución geográfica de Solanum demissum. Mapa generado a partir de los datos de Hijmans et al. (2002) y USDA-GRIN (https://www.ars-grin.gov/).
Resistencia al tizón tardío
El interés en colectar y estudiar las papas silvestres nació a partir de la hambruna irlandesa de la papa, también conocida como la Gran Hambruna, ocurrida en la década de 1840. En esta, los monocultivos de papa en Irlanda fueron devastados por “la enfermedad”, actualmente conocida como tizón tardío, causada por el oomiceto P. infestans, la cual provocó una gran crisis alimentaria que derivó en una grave escasez de alimento, y en la pérdida de vidas humanas debido al hambre y la desnutrición (Fry et al., 2015; Majeed, Siyar, & Sami, 2022; O'Neill, 2009; Schoina & Govers, 2014). Después de este acontecimiento, a través de varias expediciones europeas, se colectaron genotipos de parientes silvestres de papa para cruzarlos con la especie comestible con la finalidad de obtener variedades resistentes (Hawkes, 1941). Las variedades de papa comestibles, de ese entonces, se obtuvieron a través de cruzas intraespecíficas de un limitado número de genotipos de S. tuberosum, lo cual generó una base genética estrecha, que fue superada fácilmente por el oomiceto (Turner, 2005).
El oomiceto P. infestans es uno de los patógenos más estudiados dentro de la fitopatología; sin embargo, sigue siendo tema de investigación debido a que continúa causando epidemias importantes en cultivos de papa y tomate en todo el mundo (Fry et al., 2015). Al principio, y hasta mediados del siglo XX, los fitomejoradores consideraban que la cruza entre variedades europeas de S. tuberosum con sus parientes silvestres mexicanos daría una descendencia de papas resistentes al tizón tardío; no obstante, el Dr. Salaman, en Cambridge, demostraría la naturaleza hereditaria de la resistencia de una especie silvestre (S. endinense), e inició las primeras cruzas entre S. tuberosum y S. demissum (Black, 1954; Turner, 2005). Donald Reddick, de la Universidad de Cornell, realizó una expedición de exploración de plantas a las montañas de México (Reddick-Retires, 1951), donde la variabilidad y los indicios de resistencia al tizón tardío detonaron un particular interés en estudiar las papas silvestres mexicanas (S. bulbocastanum, S. pinnatisectum, S. hjertingii, S. papita, S stoloniferum, S. polyadenium, S. verrucosum y S. demissum, entre otras) (Enciso-Maldonado et al., 2022; Zoteyeva et al., 2012; Song et al., 2003).
Actualmente, se considera que el centro de diversidad más importante de P. infestans se encuentra en el Valle de Toluca, y se extiende hasta Michoacán y Tlaxcala, donde existe una metapoblación del patógeno que podría contribuir al resurgimiento repetido de P. infestans en Estados Unidos y en otros lugares (Wang et al., 2017). En este sentido, se cree que las especies mexicanas han co-evolucionado con el patógeno durante millones de años y han adquirido una resistencia natural al mismo (Alfaro, 1995), siendo S. demissum una de las especies más estudiadas en los últimos 100 años (Figura 3) debido a que cuenta con genes de resistencia vertical (Enciso-Maldonado et al., 2021; Lozoya-Saldaña, 2011; Paluchowska et al., 2022).
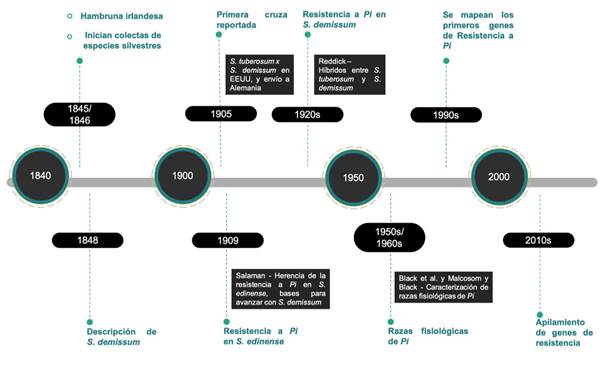
Figura 3 Cronología del uso de Solanum demissum en el mejoramiento de la papa para su resistencia al tizón tardío (Phytophthora infestans). Fuente: Elaboración propia.
Una de las contribuciones más importantes que se ha realizado con S. demissum es la identificación de razas fisiológicas de P. infestans, ya que este oomiceto puede presentar diferentes niveles de virulencia, con lo cual puede superar la resistencia del huésped y causar la enfermedad; además, como se mencionó anteriormente, S. demissum porta genes de resistencia. La resistencia genética, en el caso de la interacción P. infestans-especie silvestre de papa, se puede explicar mediante el modelo de gen a gen, donde por cada gen de resistencia del huésped existe un gen específico que determina la patogenicidad o virulencia del patógeno (Flor, 1959). Por lo tanto, el gen de resistencia de la planta solo es efectivo si hay un gen de avirulencia correspondiente en el patógeno (Alvarez-Morezuelas, Alor, Barandalla, Ritter, & de Galarreta, 2021; Serrano & Cádenas, 2008).
Black et al. (1953) y Malcolmson y Black (1966) inocularon diferentes razas del patógeno en diferenciales de plantas hospederas, con lo cual compararon los genes de inmunidad presentes en la serie de hospederos y, a partir de ello, formularon un sistema de nomenclatura adecuado para la aplicación internacional. De esta manera, evaluaron el espectro de virulencia, que es el rango de genes Avr expresados por el aislado cuando es inoculado en la serie diferencial de genotipos con genes de resistencia R. Cuando se observaron aislados con el mismo espectro de virulencia, se denominaron razas fisiológicas, y mientras más amplio fue el espectro de virulencia se consideró más compleja la raza del patógeno (Alvarez-Morezuelas et al., 2021). En este sentido, Black et al. (1953) describen que la raza 1, 2 es capaz de causar enfermedad en genotipos que carguen los genes de resistencia R1, R2 o R1-R2, pero no prospera en presencia de los genes R3 o R4. Por lo tanto, la susceptibilidad solo es posible cuando la raza tiene en su designación todos los numerales presentes en el genotipo de la planta. En consecuencia, el genotipo R1-R2, que es el huésped natural de las razas 1, 2, es susceptible a las razas 1, 2; 1, 2, 3; 1, 2, 4 y 1, 2, 3, 4, y solo es inmune al resto.
Los diferenciales de Black se utilizan hasta el día de hoy para caracterizar los aislados de P. infestans en patotipos o razas fisiológicas con base en su virulencia en plantas con genes R de un grupo diferencial de genotipos (Alvarez-Morezuelas et al., 2021). Gracias a los estudios de Black et al. (1953) y Malcolmson y Black (1966), se iniciaron investigaciones para introducir los genes de resistencia al tizón tardío contenidos en S. demissum en cultivares de papa, los cuales fueron utilizados por agricultores durante años.
A partir de la década de los 2000, se comenzó a emplear y relacionar el término efector con el término avirulencia (Hogenhout, Van der Hoorn, Terauchi, & Kamoun, 2009). Los efectores se definen como “todas la proteínas patógenas y moléculas pequeñas que alteran la estructura y función de la célula hospedante”, y cuyas alteraciones facilitan la infección y desencadenan la respuesta de defensa de la planta (Hogenhout et al., 2009; Kamoun, 2007). Los efectores presentes en P. infestans han sido estudiados ampliamente y se clasifican, de forma general, en efectores apoplásticos y efectores citoplásmicos, aunque en estudios recientes se pueden encontrar más clasificaciones. Los primeros son proteínas pequeñas ricas en cisteína (SCR), como las proteínas PcF (antes llamadas fitotoxinas), una familia de proteínas inductoras de necrosis y etileno (NLP), e inhibidores de enzimas y proteasas extracelulares que degradan las estructuras del huésped. Mientras que los efectores citoplásmicos son una familia de proteínas RXLR y proteínas CRN (Fabro, 2022; Kamoun, 2006; Saraiva et al., 2022).
Genes efectores del tipo RXLR han sido extraídos de la secuencia de P. infestans y usados en ensayos de expresión de genes en especies silvestres de papa, esto con el objetivo de encontrar actividad de avirulencia y acelerar la clonación de los genes R (Lokossou, et al., 2009; Saunders et al., 2012; Schornack et al., 2009; Vleeshouwers et al., 2008). Varios genes NLR (asociados con la inmunidad desencadenada por efectores (ETI, por sus siglas en inglés), donde la mayoría pertenecen a la familia CC-NLR, han sido identificados, siendo R3a de S. demissum y Rpi-blb2 de S. bulbocastanum (que reconocen los efectores RXLR AVR3a y AVRblb2, respectivamente) de gran interés, ya que acentúan la importancia y utilidad del estudio de efectores en la búsqueda y clonación de genes de resistencia (Majeed et al., 2022; Saraiva et al., 2022).
Hasta la fecha, se han encontrado 14 genes de resistencia al tizón tardío funcionales en S. demissum: R1, R2, Rpi-demf1, R3a, R3b, R4 al , R4 MA , R5, R6, R7, R8, R9a, R10 y R11. De estos, los genes R1, R2, R3a, R3b, R8 y R9 han sido clonados y clasificados dentro de la familia de genes que codifican el sitio de unión de nucleótidos y las proteínas que contienen dominios repetidos ricos en leucina (Paluchowska et al., 2022). La clonación molecular de los genes ha facilitado la realización de estudios a nivel molecular para el manejo de la resistencia al tizón tardío de la papa, ya que estos se pueden utilizar en ingeniería genética para desarrollar cultivares resistentes (Rogozina, Beketova, Muratova, Kuznetsova, & Khavkin, 2021). Sin embargo, estos genes aún no se han introducido ampliamente en los cultivares de papa, en parte, debido a las dificultades de cruzamiento por la diferencia en ploidías (Bethke, Halterman, & Jansky, 2017).
La coevolución continua de los efectores de patógenos y los genes R de las plantas representa la llamada carrera armamentista entre plantas y patógenos (Khavkin, 2015; Saraiva et al., 2022).
Resistencia a insectos
Solanum demissum ha demostrado ser resistente a plagas, como el escarabajo de la papa de Colorado (Leptinotarsa decemlineata) y la cigarrita de la papa (Empoasca fabae) (Fürstenberg-Hägg et al., 2013). La resistencia al escarabajo de la papa de Colorado está asociada positivamente con el alto contenido de los glicoalcaloides chaconina, demissina y leptinas (Kuc, 1992), metabolitos secundarios conocidos por actuar como defensa química ante ciertos patógenos, aunque son potencialmente dañinos en humanos (Eraso-Grisales et al., 2019; Lambers et al., 2008; Tingey, 1984). Una limitante en la obtención de genotipos de S. tuberosum resistentes a insectos se basa en que la descendencia de híbridos resistentes entre S. tuberosum y S. demissum producen tubérculos con alto contenido glicoalcaloides.
Resistencia a nematodos
Los nematodos del quiste de la papa, Globodera pallida y G. rostochiensis, conforman un grupo económicamente importante para el cultivo de papa. Sus quistes pueden sobrevivir más de 10 años en el suelo, y persistir incluso en condiciones ambientales desfavorables y a la aplicación de nematicidas (Dandurand et al., 2019). Bachmann-Pfabe et al. (2019) identificaron genotipos resistentes a la infección por nematodos en 15 de 67 accesiones de S. demissum evaluadas, y 45 de 67 con resistencia parcial. Además, indican que la resistencia de las accesiones originarias de México se podría deber a la presencia de G. mexicana en el territorio mexicano, que está estrechamente relacionada genéticamente con G. pallida.
Resistencia a otros agentes infecciosos
En el programa de papa del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), en Metepec, Estado de México, se encontró que S. demissum presenta cierta resistencia a la bacteria Candidatus Liberibacter solanacearum, por lo cual se podría incluir en programas de mejoramiento genético para mitigar los efectos de este microorganismo (Hidalgo-Gómez et al., 2022).
Por otra parte, un cribado de especies silvestres realizado por Zoteyeva et al. (2012) demostró que S. demissum presenta resistencia a los virus X de la papa (PVX) y virus Y de la papa (PVY), lo cual forma parte del programa de mejoramiento de papa de Bulgaria (Masheva, 2014). Sin embargo, aunque Tiwari, Jeevalatha, Tuteja, y Khurana (2022) acentúan que el gen Ny dms de S. demissum confiera una respuesta hipersensibe (HR) contra el PVY y el virus A de la papa (PVA), el mejoramiento tradicional no ha resultado del todo efectivo debido a la rápida evolución de las cepas virulentas (mismo caso que el tizón tardío), por lo que resulta importante el uso de nuevas tecnologías como CRISPR-Cas (Doudna & Charpentier, 2014) para la generación de resistencia por medio de interrupción de factores del hospedero o la interferencia en el genoma viral.
Resistencia a heladas
A diferencia del manejo de plagas y enfermedades, las heladas no se manejan fácilmente con prácticas de cultivo o tratamientos químicos; por ello, se recomienda el uso de variedades resistentes para reducir las pérdidas por heladas (Vega & Bamberg, 1995). S. demissum se clasifica, dentro del grupo de parientes silvestres de la papa, como una de las especies más resistentes a heladas, al soportar hasta -2 °C (Vega & Bamberg, 1995). Desde inicios del siglo XX, esto ha desencadenado la obtención de híbridos a partir de cruzas entre S. demissum y S. tuberosum resistentes a heladas (del Rio & Bamberg, 2020).
Otras propiedades
Los glicoalcaloides, metabolitos secundarios estudiados ampliamente, se encuentran comúnmente en la papa y sus parientes silvestres, y han sido catalogados como compuestos tóxicos, por lo que resultan útiles en la defensa ante el ataque de patógenos y ante ciertas enfermedades humanas (Friedman, 2006; Friedman, McDonald, & Filadelfi-Keszi, 1997; Kuc, 1992; Manrique-Carpintero et al., 2013). En S. demissum se han encontrado altas concentraciones de (-tomatina, demissina, demissidina, tomatidina, chaconina y tomatidinol (Distl & Wink, 2009; Friedman et al., 1997); este último ha sido introgresado en S. tuberosum (McCue, 2009). Dichos compuestos han mostrado un efecto en el tratamiento de diferentes enfermedades, ya que se han asociado a propiedades antiinflamatorias, antihiperglucémicas, antibióticas, anticolesterolemiantes y anticancerígenas (Friedman, 2006; Milner et al., 2011). La tomatidina inhibe el crecimiento in vitro de células cancerosas de colon e hígado (Wölfling, 2007). La (-chaconina y la (-tomatina tienen efecto positivo en la inactivación del virus del herpes tipo 1 (Thorne, Clarke, & Skuce, 1985), mientras que (-tomatina inhibe el crecimiento e induce la apoptosis en células de leucemia mieloide (Huang et al., 2015).
En especies silvestres de papa, incluida S. demissum, se ha reportado alta actividad antioxidante, y se han encontrado compuestos fenólicos como acido p-cumárico, ácido clorogénico y ácido cafeico. Estos últimos tienen propiedades antioxidantes, antibacterianas, antivirales, antifúngicas y antiinflamatorias (Butiuk, Martos, Adachi, & Hours, 2016; Eroglu & Dogan, 2023; Friedman, 2006; Hale et al., 2008).
Discusión
Solanum demissum es un recurso fitogenético importante, valorado por su resistencia a plagas y enfermedades, posicionándose en el mapa como uno de los parientes silvestres de la papa más aprovechados en los programas de mejoramiento genético. Sin embargo, a pesar de que los genes de resistencia al tizón y otros factores de estrés han sido uno de los aspectos más estudiados en los últimos 100 años (al lograr la obtención de innumerables cultivares resistentes al tizón tardío), los resultados obtenidos a partir del mejoramiento genético tradicional no han sido del todo exitosos. P. infestans, y otros patógenos, han logrado evadir la resistencia genética de los cultivares obtenidos a través de cruzas con S. demissum, lo cual ha dado lugar al desarrollo de nuevas epidemias a nivel mundial, como en Estados Unidos, Canadá, India, México, Perú, la gran mayoría de los países europeos, África y Asia (Fry et al., 2013; Hwang et al., 2014; Dey et al., 2018; Romero-Montes, Lozoya-Saldaña, Mora-Aguilera, Fernández-Pavia, & Grünwald, 2012; Zoteyeva & Patrikeeva, 2010; Forbes, 2015).
Derivado de lo anterior, resulta indispensable continuar investigando, descubriendo y proponiendo mejoras mediante el uso de nuevas tecnologías para eficientizar los programas de mejoramiento. Actualmente, se visualizan dos vertientes en la aplicación de estas herramientas: la búsqueda e identificación de genes candidatos en S. demissum, y la introgresión de los genes descubiertos a S. tuberosum.
Para la búsqueda e identificación de genes, conocer la diversidad, estructura y relaciones del germoplasma, el genotipado por secuenciación (GBS), los estudios de asociación de genoma completo (GWAS) y los QTL’s, por mencionar algunos ejemplos, son herramientas útiles que pueden facilitar y acelerar la localización y selección de los genes de interés, que después se buscará introducir o silenciar en la papa cultivada. Diversos estudios documentan la factibilidad del uso de estas herramientas (Bastien, Boudhrioua, Fortin, & Belzile, 2018; Boudhrioua et al., 2017; Bradshaw, Hackett, Pande, Waugh, & Bryan, 2008; Hackett, McLean, & Bryan, 2013; Okada et al., 2019; Prodhomme et al., 2020; Rosyara, de Jong, Douches, & Endelman, 2016; Saidi & Hajibarat, 2020; Uitdewilligen et al., 2013; Zhang, Qu, Gu, Xu, & Xue, 2022). Algunos ejemplos de genes que pueden ser interesantes son los de resistencia a tizón tardío (ya mencionados anteriormente), el gen GBBSI (asociado con la amilosa), los genes Asn1, Asn2 y Vlnv (asociados con la acumulación de acrilamida), el gen de la polifenoloxidasa (responsable del pardeamiento) y el gen de la β-actina del escarabajo.
Referente a la introgresión de genes a S. tuberosum, la transformación genética fue la primera estrategia utilizada, donde los métodos principales son la biobalística, la fusión de protoplastos y la transformación mediada por Agrobacterium (Díaz-Granados & Chaparro-Giraldo, 2012). La biobalística consiste en el bombardeo de microproyectiles cubiertos del ADN que se desea transferir, lo cual lleva, al interior de la célula, los genes de interés que después serán integrados al genoma de la planta. La fusión por protoplastos es una transferencia mediada por compuestos químicos que utiliza, más comúnmente, polietilenglicol para inducir permeabilidad en las membranas y así permitir el paso del ADN a la célula. El sistema Agrobacterium funciona gracias a la capacidad del género para infectar a organismos vegetales y transferir ADN, y consiste en utilizar al organismo como vector de transferencia del gen a la planta. Esta transformación puede ser trans-génesis o cis-génesis. Esta última es utilizada en el caso de S. demissum y S. tuberosum, ya que son especies estrechamente relacionadas (del Mar Martínez-Prada, Curtin, & Gutiérrez-González, 2021; Díaz-Granados & Chaparro-Giraldo, 2012; Nadakuduti, Buell, Voytas, Starker, & Douches, 2018; Nicolia, Fält, Hofvander, & Andersson, 2021; Toinga-Villafuerte, Vales, Awika, & Rathore, 2022; Van Eck, 2018; Zhang, Zhang, & Chen, 2020).
La segunda estrategia utilizada para la introgresión es la edición genética. Las nucleasas de dedos de zinc (ZFN), las nucleasas TALEN y el complejo CRISPR-Cas9 son métodos útiles y otra alternativa para el uso e introducción de genes de interés procedentes de S. demissum (Van Eck, 2018). En algunas revisiones y ensayos se han demostrado casos de éxito con el uso de TALEN y CRISPR-Cas9 en S. tuberosum, como la reducción de glicoalcaloides en tubérculos, resistencia a herbicidas, calidad de almidón en tubérculo, autoincompatibilidad y actividad de polifenoloxidasa en tubérculo (PPO) para reducir el pardeamiento enzimático.
La generación de variedades modificadas genéticamente, producidas y comercializadas desde 1995 (NewLeafTM, NewLeafTM Plus, NewLeafTM Y, Innate® 1.0 Innate® 2.0, AmfloraTM, Starch potato, Elizaveta Plus, Lugovskoi Plus, SpuntaG2, Desiree, Ranger Russet, Taedong Valley, King Edward, Chicago, Atlantic, Kuras, Sayaka y Mayqueen), incluyen enfoques de transformación genética cis-génesis, CRISPR-Cas9 y TALEN, en donde las características adquiridas abarcan la incorporación de resistencia al escarabajo de la papa de colorado, al PVY y al tizón tardío, la reducción de acrilamida, glicoalcaloides, black spot y amilosa, y el incremento de TAG, carotenoides y vitaminas (Abdallah, Hamwieh, Radwan, Fouad, & Prakash, 2021; del Mar Martínez-Prada et al., 2021; Hameed, Zaidi, Shakir, & Mansoor, 2018; Nadakuduti et al., 2018; Tiwari et al., 2022; Tussipkan & Manabayeva, 2021; Yasumoto et al., 2020; Wang et al., 2015).
Técnicas como el silenciamiento de genes (ARNi) (utilizado para conferir resistencia a virus como el PVY, PVX, PVS, PLRV y el tizón tardío) (Del Mar Martínez-Prada et al., 2021; Hameed et al., 2018; Sun et al., 2016) o el bloqueo de genes (gene knockout, sugerido como una estrategia efectiva para reducir el contenido de acrilamida) (Del Mar Martínez-Prada et al., 2021), utilizadas en conjunto con CRISPR-Cas9, resultan ser exitosas y proveen una base interesante para otros estudios sobre la funcionalidad de los genes (Clasen et al., 2016; Kieu, Lenman, Wang, Petersen, & Andreasson, 2021; Toinga-Villafuerte et al., 2022; Wang et al., 2015).
A partir de las amplias posibilidades de aplicación de las herramientas de transformación y edición genética, se han logrado visualizar dos retos importantes. Por un lado, se tiene la complejidad que representa la variabilidad de ploidías entre especies y, por el otro, las regulaciones gubernamentales impuestas y en proceso para los organismos genéticamente modificados (Van Eck, 2018).
Por otro lado, las propiedades antioxidantes y la presencia de glicoalcaloides en S. demissum fijan un punto de partida en la investigación agrícola y farmacéutica para aprovechar al máximo estos recursos. Se ha trabajado en la extracción de glicoalcaloides en papa cultivada (principalmente (-chaconina y (-solanina), y se han propuesto diferentes métodos de extracción, como la acuosa, la obtención de extractos etanólicos acidificados, la obtención de extractos con hidróxido de amonio y la extracción con líquidos presurizados (Eraso-Grisales et al., 2019; Sánchez-Maldonado, Mudge, Gänzle, & Schieber, 2014; Silva-Beltrán et al., 2015). Además, se ha evaluado la efectividad de extractos de estos compuestos ante cepas bacterianas como E. coli, Salmonella typhimurium, Listeria ivanovii y Staphylococcus aureus, así como el efecto biocida ante caracoles y el escarabajo de la papa de Colorado (Kuc, 1992; Silva-Beltrán et al., 2015).
Respecto a la actividad antioxidante, particularmente para la extracción de ácido p-cumárico, ácido clorogénico y ácido cafeico (presentes en S. demissum y cuyas propiedades se han descrito anteriormente), puede ser factible el uso de metodologías probadas en otros cultivos, como la alcachofa o el café, en las que se utilizan extractos alcohólicos, hidroalcohólico y la hidrólisis ácida con ácido clorhídrico (Eroglu & Dogan, 2023). Asimismo, se pueden considerar metodologías para determinar el solvente más adecuado para la extracción de los compuestos (Aristizábal, Vargas, & Alvarado, 2019; Gani et al., 2006; Ky, Noirot, & Hamon, 1997).
Finalmente, resulta valioso enfatizar la importancia que S. demissum ha tenido a lo largo de los años, al ser un parteaguas en el mejoramiento genético de la papa, y contribuir al entendimiento de las resistencias y a la identificación de razas fisiológicas. S. demissum ha sido protagonista en un gran número de investigaciones, y hoy en día cuenta con las propiedades y elementos para continuar contribuyendo en la mejora de cultivos y en la producción de compuestos útiles para el ser humano.
Conclusiones
Solanum demissum es una de las especies con gran potencial en diferentes áreas y para el mejoramiento genético de la papa. El mejoramiento tradicional presenta limitantes que podrían ser solventadas con el uso de nuevas tecnologías moleculares, ya que, al utilizarla de forma integral, resultarían en un importante avance en el campo de la mejora y aprovechamiento de especies vegetales.
Agradecimientos
El primer autor agradece al Consejo Nacional de Ciencia y Tecnología (CONACYT) por la beca otorgada para realizar los estudios de Doctorado en Ciencias en Horticultura.
REFERENCIAS
Abdallah, N. A., Hamwieh, A., Radwan, K., Fouad, N., & Prakash, C. (2021). Genome editing techniques in plants: a comprehensive review and future prospects toward zero hunger. GM Crops & Food, 12(2), 601-615. doi: 10.1080/21645698.2021.2021724 [ Links ]
Alfaro, R. C. (1995). Por los caminos evolutivos de la papa silvestre y cultivada. Ciencia y Desarrollo, 1, 86-91. doi: 10.33326/26176033.1995.1.25 [ Links ]
Alvarez-Morezuelas, A., Alor, N., Barandalla, L., Ritter, E., & de Galarreta, J. I. (2021). Virulence of Phytophthora infestans isolates from potato in Spain. Plant Protection Science, 57(4), 279-288. doi: 10.17221/39/2021-PPS [ Links ]
Aristizábal, C. E., Vargas, A. F., & Alvarado, P. N. (2019). Numerical determination of the correct solvents to extract a phytochemical from coffee pulp using Hansen solubility parameters, risk assessment, sustainability evaluation, and economic analysis. Dyna, 86(211), 138-147. doi: 10.15446/dyna.v86n211.78530 [ Links ]
Bachmann-Pfabe, S., Hammann, T., Kruse, J., & Dehmer, K. J. (2019). Screening of wild potato genetic resources for combined resistance to late blight on tubers and pale potato cyst nematodes. Euphytica, 215(3),1-15. doi: 10.1007/s10681-019-2364-y [ Links ]
Bastien, M., Boudhrioua, C., Fortin, G., & Belzile, F. (2018). Exploring the potential and limitations of genotyping-by-sequencing for SNP discovery and genotyping in tetraploid potato. Genome, 61(6), 449-456. doi: 10.1139/gen-2017-0236 [ Links ]
Bethke, P. C., Halterman, D. A., & Jansky, S. (2017). Are we getting better at using wild potato species in light of new tools?. Crop Science, 57(3), 1241-1258. doi: 10.2135/cropsci2016.10.0889 [ Links ]
Black, W. (1954). Late blight resistance work in Scotland. American Potato Journal, 31, 93-100. doi: 10.1007/BF02859981 [ Links ]
Black, W., Mastenbroek, C., Mills, W. R., & Peterson, L. C. (1953). A proposal for an international nomenclature of races of Phytophthora infestans and of genes controlling immunity in Solanum demissum derivatives. Euphytica, 2(3), 173-179. doi: 10.1007/BF00053724 [ Links ]
Boudhrioua, C., Bastien, M., Légaré, G., Pomerleau, S., St-Cyr, J., Boyle, B., & Belzile, F. (2017). Genotyping-by-sequencing in potato. In: Chakrabarti, S. K., Xie, C., & Tiwari, J. K. (Eds), The Potato Genome (pp. 283-296). Springer, Cham. doi: 10.1007/978-3-319-66135-3_15 [ Links ]
Bradshaw, J. E., Hackett, C. A., Pande, B., Waugh, R., & Bryan, G. J. (2008). QTL mapping of yield, agronomic and quality traits in tetraploid potato (Solanum tuberosum subsp. tuberosum). Theoretical and Applied Genetics, 116(2), 193-211. doi: 10.1007/s00122-007-0659-1 [ Links ]
Butiuk, A. P., Martos, M. A., Adachi, O., & Hours, R. A. (2016). Study of the chlorogenic acid content in yerba mate (Ilex paraguariensis St. Hil.): Effect of plant fraction, processing step and harvesting season. Journal of Applied Research on Medicinal and Aromatic Plants, 3(1), 27-33. doi: 10.1016/j.jarmap.2015.12.003 [ Links ]
Clasen, B. M., Stoddard, T. J., Luo, S., Demorest, Z. L., Li, J., Cedrone, F., Tibedu, R., Davison, S., Ray, E. E., Daulhac, A., Coffman, A., Yabandith, A., Retterath, A., Haun, W., Baltes, N. J., Mathis, L., Voytas, D. F., & Zhang, F. (2016). Improving cold storage and processing traits in potato through targeted gene knockout. Plant Biotechnology Journal, 14(1), 169-176. doi: 10.1111/pbi.12370 [ Links ]
Dandurand, L. M., Zasada, I. A., Wang, X., Mimee, B., de Jong, W., Novy, R., Whitworth, J., & Kuhl, J. C. (2019). Current status of potato cyst nematodes in North America. Annual Review of Phytopathology, 57, 117-133. doi: 10.1146/annurev-phyto-082718-100254 [ Links ]
del Rio, A., & Bamberg, J. (2020). A core subset of the ex situ collection of S. demissum at the US Potato Genebank. American Journal of Potato Research, 97(5), 505-512. doi: 10.1007/s12230-020-09799-9 [ Links ]
del Mar Martínez-Prada, M., Curtin, S. J., & Gutiérrez-González, J. J. (2021). Potato improvement through genetic engineering. GM Crops & Food, 12(1), 479-496. doi: 10.1080/21645698.2021.1993688 [ Links ]
Dey, T., Saville, A., Myers, K., Tewari, S., Cooke, D. E., Tripathy, S.,... & Guha Roy, S. (2018). Large sub-clonal variation in Phytophthora infestans from recent severe late blight epidemics in India. Scientific reports, 8(1), 1-12. doi: 10.1038/s41598-018-22192-1 [ Links ]
Díaz-Granados, C., & Chaparro-Giraldo, A. (2012). Métodos de transformación genética de plantas. Revista U.D.C.A Actualidad & Divulgación Científica, 15(1), 49-61. doi: 10.31910/rudca.v15.n1.2012.802 [ Links ]
Distl, M., & Wink, M. (2009). Identification and quantification of steroidal alkaloids from wild tuber-bearing Solanum species by HPLC and LC-ESI-MS. Potato Research, 52(1), 79-104. doi: 10.1007/s11540-008-9123-0 [ Links ]
Doudna, J. A., & Charpentier, E. (2014). The new frontier of genome engineering with CRISPR-Cas9. Science, 346(6213), 1258096-1258096. doi: 10.1126/science.1258096 [ Links ]
Enciso-Maldonado, G. A., Lozoya-Saldaña, H., Colinas-Leon, M. T., Cuevas-Sanchez, J. A., Sanabria-Velázquez, A. D., Bamberg, J., & Raman, K. V. (2022). Assessment of Wild Solanum Species for Resistance to Phytophthora infestans (Mont.) de Bary in the Toluca Valley, Mexico. American Journal of Potato Research, 99(1), 25-39. doi: 10.1007/s12230-021-09856-x [ Links ]
Enciso-Maldonado, G. A., Lozoya-Saldaña, H., Díaz-García, G., & López-Salazar, A. (2021). La búsqueda de resistencia al tizón tardío en papas silvestres. Investigaciones y Estudios-UNA, 12(2), 36-47. doi: 10.4713 3/I EUNA2124b [ Links ]
Eraso-Grisales, S., Mejía-España, D., & Hurtado-Benavides, A. (2019). Extracción de glicoalcaloides de papa nativa (Solanum phureja) variedad ratona morada con líquidos presurizados. Revista Colombiana de Ciencias Químico-Farmacéuticas, 48(1), 181-197. doi: 10.15446/rcciquifa.v48n1.80074 [ Links ]
Eroglu, A., & Dogan, A. (2023). Investigation of the phytochemical composition and remedial effects of southern grape hyacinth (Muscari neglectum Guss. ex Ten.) plant extract against carbon tetrachloride-induced oxidative stress in rats. Drug and Chemical Toxicology, 46(3), 491-502. doi: 10.1080/01480545.2022.2058011 [ Links ]
Fabro, G. (2022). Oomycete intracellular effectors: specialised weapons targeting strategic plant processes. New Phytologist, 233(3), 1074-1082. doi: 10.1111/nph.17828 [ Links ]
Flor, H. H. (1959). Genetic controls and host parasite interactions in rust diseases. In: Holton, C. S. (Ed.), Plant Pathology, Problems and Progress: 1908-1958 (pp. 137-144). Madison, Wisconsin, USA: University of Wisconsin Press. [ Links ]
Fonseka, R. M., Fonseka, H. H., & Abhyapala, K. M. (2020). Crop wild relatives: An underutilized genetic resource for improving agricultural productivity and food security. In: de Silva, R. P., Pushpakumara, G., Prasada, P., & Weerahewa, J. (Eds.), Agricultural research for sustainable food systems in Sri Lanka (pp. 11-38). Singapore: Springer. doi: 10.1007/978-981-15-3673-1_2 [ Links ]
Forbes, G. (2015). Recent developments concerning the population biology and control strategies of Phytophthora infestans in Asia and Africa. Fifteenth Euroblight Workshop, 17, 51-56. Retrieved from https://cgspace.cgiar.org/bitstream/handle/10568/72512/79273.pdf?sequence=2 [ Links ]
Friedman, M. (2006). Potato glycoalkaloids and metabolites: roles in the plant and in the diet. Journal of Agricultural and Food Chemistry, 54(23), 8655-8681. doi: 10.1021/jf061471t [ Links ]
Friedman, M., McDonald, G. M., & Filadelfi-Keszi, M. (1997). Potato glycoalkaloids: chemistry, analysis, safety, and plant physiology. Critical Reviews in Plant Sciences, 16(1), 55-132. doi: 10.1080/07352689709701946 [ Links ]
Fry, W. E., Birch, P. R., Judelson, H. S., Grünwald, N. J., Danies, G., Everts, K. L., Gevens, B. K., Gugino, D. A., Johnson, S. B., Johnson, M. T., McGrath, K. L., Myers, J. B., Ristaino, P. D., Roberts, G., & Smart, C. D. (2015). Five reasons to consider Phytophthora infestans a reemerging pathogen. Phytopathology, 105(7), 966-981. doi: 10.1094/PHYTO-01-15-0005-FI [ Links ]
Fry, W. E., McGrath, M. T., Seaman, A., Zitter, T. A., McLeod, A., Danies, G., ... & Smart, C. D. (2013). The 2009 late blight pandemic in the eastern United States-causes and results. Plant Disease, 97(3), 296-306. doi: 10.1094/PDIS-08-12-0791-FE [ Links ]
Fürstenberg-Hägg, J., Zagrobelny, M., & Bak, S. (2013). Plant defense against insect herbivores. International Journal of Molecular Sciences, 14(5), 10242-10297. doi: 10.3390/ijms140510242 [ Links ]
Gani, R., Jimenez-Gonzalez, C., ten Kate, A., Crafts, P. A., Jones, M., Powell, L., Atherton, J. H., & Cordiner, J. L. (2006). A modern approach to solvent selection: although chemists' and engineers' intuition is still important, powerful tools are becoming available to reduce the effort needed to select the right solvent. Chemical Engineering, 113(3), 30-44. Retrieved from https://go.gale.com/ps/i.do?id=GALE%7CA143580928&sid=googleScholar&v=2.1&it=r&linkaccess=abs&issn=00092460&p=AONE&sw=w&userGroupName=anon%7E66aa3095 [ Links ]
Hackett, C. A., McLean, K., & Bryan, G. J. (2013). Linkage analysis and QTL mapping using SNP dosage data in a tetraploid potato mapping population. PloS one, 8(5), e63939. doi: 10.1371/journal.pone.0063939 [ Links ]
Hale, A. L., Reddivari, L., Nzaramba, M. N., Bamberg, J. B., & Miller, J. C. (2008). Interspecific variability for antioxidant activity and phenolic content among Solanum species. American Journal of Potato Research, 85(5), 332-341. doi: 10.1007/s12230-008-9035-1 [ Links ]
Hameed, A., Zaidi, S. S., Shakir, S., & Mansoor, S. (2018). Applications of new breeding technologies for potato improvement. Frontiers in Plant Science, 9, 925. doi: 10.3389/fpls.2018.00925 [ Links ]
Hawkes, J. G. (1941). Potato collecting expeditions in Mexico and South America. Cambridge, UK: Imperial Bureau of Plant Breeding and Genetics. [ Links ]
Hidalgo-Gómez, Y., Carrillo-Salazar, J. A., Rojas-Martínez, R. I., Rivera-Peña, A., & Ayala-Garay, O. J. (2022). Síntomas foliares, biomasa y calidad de tubérculo de genotipos de papa inoculados con Candidatus Liberibacter solanacearum. Revista Fitotecnia Mexicana, 45(3), 323-323. doi: 10.35196/rfm.2022.3.323 [ Links ]
Hijmans, R. J., Spooner, D. M., Salas, A. R., Guarino, L., & de la Cruz, J. (2002). Atlas of wild potatoes. Systematic and ecogeographic studies on crop genepools 10. USA: International Plant Genetic Resources Institute (IPGRI). Retrieved from https://www.bioversityinternational.org/fileadmin/_migrated/uploads/tx_news/Atlas_of_wild_potatoes_826.pdf [ Links ]
Hogenhout, S. A., Van der Hoorn, R. A., Terauchi, R., & Kamoun, S. (2009). Emerging concepts in effector biology of plant-associated organisms. Molecular plant-microbe interactions, 22(2), 115-122. doi: 10.1094/MPMI-22-2-0115 [ Links ]
Huang, H., Chen, S., Van Doren, J., Li, D., Farichon, C., He, Y., Zhang, Q., Zhang, K., Conney, A. H., Goodin, S., Du, Z., & Zheng, X. (2015). α-tomatine inhibits growth and induces apoptosis in HL-60 human myeloid leukemia cells. Molecular Medicine Reports, 11(6), 4573-4578. doi: 10.3892/mmr.2015.3238 [ Links ]
Hwang, Y. T., Wijekoon, C., Kalischuk, M., Johnson, D., Howard, R., Prüfer, D., & Kawchuk, L. (2014). Evolution and management of the Irish potato famine pathogen Phytophthora infestans in Canada and the United States. American Journal of Potato Research, 91, 579-593. doi: 10.1007/s12230-0149401-0 [ Links ]
Kamoun, S. (2006). A catalogue of the effector secretome of plant pathogenic oomycetes. Annual Review of Phytopathology, 44(1), 41-60. doi: 10.1146/annurev.phyto.44.070505.143436 [ Links ]
Kamoun, S. (2007). Groovy times: filamentous pathogen effectors revealed. Current opinion in plant biology, 10(4), 358-365. doi: 10.1016/j.pbi.2007.04.017 [ Links ]
Khavkin, E. E. (2015). Potato late blight as a model of pathogen-host plant coevolution. Russian Journal of Plant Physiology, 62(3), 408-419. doi: 10.1134/S1021443715030103 [ Links ]
Kieu, N. P., Lenman, M., Wang, E. S., Petersen, B. L., & Andreasson, E. (2021). Mutations introduced in susceptibility genes through CRISPR/Cas9 genome editing confer increased late blight resistance in potatoes. Scientific Reports, 11(1), 1-12. doi: 10.1038/s41598-021-83972-w [ Links ]
Kuc, J. (1992). Antifungal compounds from plants. In: Nigg, H. N., & Seigler, D. (Eds), Phytochemical resources for medicine and agriculture (pp. 159-184). New York, USA: Springer. doi: 10.1007/978-1-4899-2584-8 [ Links ]
Ky, C. L., Noirot, M., & Hamon, S. (1997). Comparison of five purification methods for chlorogenic acids in green coffee beans (Coffea sp.). Journal of Agricultural and Food Chemistry, 45(3), 786-790. doi: 10.1021/jf9605254 [ Links ]
Lambers, H., Chapin, F. S., & Pons, T. L. (2008). Ecological biochemistry: allelopathy and defense against herbivores. In: Lambers, H., Chapin, F. S., & Pons, T. L. (Eds), Plant physiological ecology (pp. 445-477). New York, USA: Springer. doi: 10.1007/978-0-387-78341-3_13 [ Links ]
Lindley, J. (1848). Notes on the wild potatoes. The Journal of the Horticultural Society of London, 3, 65-72. [ Links ]
Lokossou, A. A., Park, T. H., van Arkel, G., Arens, M., Ruyter-Spira, C., Morales, J., ... & van der Vossen, E. A. (2009). Exploiting knowledge of R/Avr genes to rapidly clone a new LZ-NBS-LRR family of late blight resistance genes from potato linkage group IV. Molecular Plant-Microbe Interactions, 22(6), 630-641. doi: 10.1094/MPMI-22-6-0630 [ Links ]
Lozoya-Saldaña, H. (2005). Importancia Internacional del Valle de Toluca, México, en estudios sobre el tizón tardío de la papa (Solanum tuberosum L.), causado por Phytophthora infestans (Mont.) de Bary. Revista Mexicana de Fitopatología, 23(3), 312-319. Retrieved from https://eds.p.ebscohost.com/eds/pdfviewer/pdfviewer?vid=0&sid=8cf4001b-a890-42b0-b6f5-8f72c120c830%40redis [ Links ]
Lozoya-Saldaña, H. (2011). Evolution of vertical and horizontal resistance and its application in breeding resistance to potato late blight. Potato Journal, 38(1), 1-8. Retrieved from https://www.cabdirect.org/cabdirect/abstract/20113286059 [ Links ]
Luna-Cavazos, M., Romero-Manzanares, A., & García-Moya, E. (2012). Distribución geográfica de Solanum tuberosos silvestres de México y su relación con factores del medio. Interciencia, 37(5), 355-362. Retrieved from https://www.redalyc.org/pdf/339/33922756006.pdf [ Links ]
Majeed, A., Siyar, S., & Sami, S. (2022). Late blight of potato: From the great Irish potato famine to the genomic era - An overview. Hellenic Plant Protection Journal, 15, 1-9. doi: 10.2478/hppj-2022-0001 [ Links ]
Malcolmson, J. F., & Black, W. (1966). New R genes in Solanum demissum Lindl. and their complementary races of Phytophthora infestans (Mont.) de Bary. Euphytica, 15(2), 199-203. doi: 10.1007/BF00022324 [ Links ]
Manrique-Carpintero, N. C., Tokuhisa, J. G., Ginzberg, I., Holliday, J. A., & Veilleux, R. E. (2013). Sequence diversity in coding regions of candidate genes in the glycoalkaloid biosynthetic pathway of wild potato species. G3: Genes, Genomes, Genetics, 3(9), 1467-1479. doi: 10.1534/g3.113.007146 [ Links ]
Masheva, S. (2014). Recent trends of the breeding programs in main vegetables and potatoes in Bulgaria. Journal of Horticulture, 1(2), 1-3. doi: 10.4172/2376-0354.1000e102 [ Links ]
McCue, K. F. (2009). Potato glycoalkaloids, past present and future. Fruit, Vegetable and Cereal Science and Biotechnology, 3(1), 65-71. [ Links ]
Milner, S. E., Brunton, N. P., Jones, P. W., O’Brien, N. M., Collins, S. G., & Maguire, A. R. (2011). Bioactivities of glycoalkaloids and their aglycones from Solanum species. Journal of Agricultural and Food Chemistry, 59(8), 3454-3484. doi: 10.1021/jf200439q [ Links ]
Nadakuduti, S. S., Buell, C. R., Voytas, D. F., Starker, C. G., & Douches, D. S. (2018) Genome editing for crop improvement - applications in clonally propagated polyploids with a focus on potato (Solanum tuberosum L.). Frontiers in Plant Science, 9, 1607. doi: 10.3389/fpls.2018.01607 [ Links ]
Nicolia, A., Fält, A. S., Hofvander, P., & Andersson, M. (2021). Protoplast-based method for genome editing in tetraploid potato. In: Tripodi, P. (Eds), Crop Breeding. Methods in Molecular Biology. New York, USA: Springer . doi: 10.1007/978-1-0716-1201-9_12 [ Links ]
Okada, Y., Monden, Y., Nokihara, K., Shirasawa, K., Isobe, S., & Tahara, M. (2019). Genome-wide association studies (GWAS) for yield and weevil resistance in sweet potato (Ipomoea batatas (L.) Lam). Plant Cell Reports, 38(11), 1383-1392. doi: 10.1007/s00299-019-02445-7 [ Links ]
O'Neill, J. R. (2009). Irish potato famine. Abdo Group. [ Links ]
Paluchowska, P., Śliwka, J., & Yin, Z. (2022). Late blight resistance genes in potato breeding. Planta, 255(6), 1-20. doi: 10.1007/s00425-022-03910-6 [ Links ]
Prodhomme, C., Vos, P. G., Paulo, M. J., Tammes, J. E., Visser, R. G., Vossen, J. H., & van Eck, H. J. (2020). Distribution of P1 (D1) wart disease resistance in potato germplasm and GWAS identification of haplotype-specific SNP markers. Theoretical and Applied Genetics, 133(6), 1859-1871. doi: 10.1007/s00122-020-03559-3 [ Links ]
Reddick-Retires, D. (1951). Donald Reddick Retires American Potato Journal, 28, 491-492. doi: 10.1007/BF02854983 [ Links ]
Rodríguez, A. (2015). Riqueza de papas silvestres (Solanum sección Petota) y patrones de distribución geográfica en México. Agro Productividad, 8(1), 3-8. Retrieved from https://revista-agroproductividad.org/index.php/agroproductividad/article/view/631 [ Links ]
Rogozina, E. V., Beketova, M. P., Muratova, O. A., Kuznetsova, M. A., & Khavkin, E. E. (2021). Stacking resistance genes in multiparental interspecific potato hybrids to anticipate late blight outbreaks. Agronomy, 11(1), 115. doi: 10.3390/agronomy11010115 [ Links ]
Romero-Montes, G., Lozoya-Saldaña, H., Mora-Aguilera, G., Fernández-Pavia, S., & Grünwald, N. J. (2012). Rendimiento de papa en función de epidemia por tizón tardío (Phytophthora infestans Mont. de Bary). Revista Fitotecnia Mexicana, 35(1), 69-78. https://www.scielo.org.mx/pdf/rfm/v35n1/v35n1a10.pdf [ Links ]
Rosyara, U. R., de Jong, W. S., Douches, D. S., & Endelman, J. B. (2016). Software for genome‐wide association studies in autopolyploids and its application to potato. The Plant Genome, 9(2), 1-10. doi: 10.3835/plantgenome2015.08.0073 [ Links ]
Saidi, A., & Hajibarat, Z. (2020). Application of Next Generation Sequencing, GWAS, RNA seq, WGRS, for genetic improvement of potato (Solanum tuberosum L.) under drought stress. Biocatalysis and Agricultural Biotechnology, 29, 101801. doi: 10.1016/j.bcab.2020.101801 [ Links ]
Sánchez-Maldonado, A. F., Mudge, E., Gänzle, M. G., & Schieber, A. (2014). Extraction and fractionation of phenolic acids and glycoalkaloids from potato peels using acidified water/ethanol-based solvents. Food Research International, 65, 27-34. doi: 10.1016/j.foodres.2014.06.018 [ Links ]
Saraiva, M., Ściślak, M. E., Ascurra, Y. T., Ferrando, T. M., Zic, N., Henard, C.,... & Vleeshouwers, V. G. (2022). The molecular dialog between oomycete effectors and their plant and animal hosts. Fungal Biology Reviews, 43, 100289. doi: 10.1016/j.fbr.2022.10.002 [ Links ]
Saunders, D. G., Breen, S., Win, J., Schornack, S., Hein, I., Bozkurt, T. O., ... & Kamoun, S. (2012). Host protein BSL1 associates with Phytophthora infestans RXLR effector AVR2 and the Solanum demissum immune receptor R2 to mediate disease resistance. The Plant Cell, 24(8), 3420-3434. doi: 10.1105/tpc.112.099861 [ Links ]
Schoina, C., & Govers, F. (2014). The oomycete Phytophthora infestans, the Irish potato famine pathogen. In: Lugtenberg, B. (Ed), Principles of Plant-Microbe Interactions: Microbes for Sustainable Agriculture (pp. 371-378). Switzerland: Springer International Publishing. [ Links ]
Schornack, S., Huitema, E., Cano, L. M., Bozkurt, T. O., Oliva, R., Van Damme, M., ... & Kamoun, S. (2009). Ten things to know about oomycete effectors. Molecular plant pathology, 10(6), 795-803. doi: 10.1111/j.1364-3703.2009.00593.x [ Links ]
Serrano, F. R., & Cadenas, A. G. (2008). Fisiología de las plantas y el estrés. In: Azcón-Bieto, J., & Talón, M. (Eds), Fundamentos de fisiología vegetal (pp. 577-597). Spain: McGraw-Hill. Retrieved from https://dialnet.unirioja.es/servlet/articulo?codig o=6380409 [ Links ]
Silva-Beltrán, N. P., Ruiz-Cruz, S., Ríos, E. M., Ornelas-Paz, J., Cira-Chavez, L. A., & Gassos-Ortega, L. E. (2015). Efecto de solventes de extracción en la actividad biológica de extractos de subproductos de la papa (Solanum tuberosum). Biotecnia, 17(2), 20-25. Retrieved from https://www.redalyc.org/pdf/6729/672971116004.pdf [ Links ]
Song, J., Bradeen, J. M., Naess, S. K., Raasch, J. A., Wielgus, S. M., Haberlach, G. T., Liu, J., Kuang, H., Austin-Phillips, S., Buell, C. R., Helgeson, J. P. & Jiang, J. (2003). Gene RB cloned from Solanum bulbocastanum confers broad spectrum resistance to potato late blight. Proceedings of the National Academy of Sciences, 100(16), 9128-9133. doi: 10.1073/pnas.1533501100 [ Links ]
Spooner, D. M., & Hijmans, R. J. (2001). Potato systematics and germplasm collecting, 1989-2000. American Journal of Potato Research, 78(4), 237-268. doi: 10.1007/BF02875691 [ Links ]
Spooner, D. M., Martinez, V., Hoekstra, R., & van den Berg, R. G. (1997). Recolección de especies silvestres de papa en Guatemala. Agronomía Mesoamericana, 8(2), 59-66. Retrieved from http://www.mag.go.cr/rev_meso/v08n02_059.pdf [ Links ]
Spooner, D. M., Jansky, S., Rodríguez, F., Simon, R., Ames, M., Fajardo, D., & Castillo, R. O. (2019). Taxonomy of wild potatoes in northern South America (Solanum section Petota). USA: American Society of Plant Taxonomists [ Links ]
Sun, K., Wolters, A. M. A., Vossen, J. H., Rouwet, M. E., Loonen, A. E., Jacobsen, E., ... & Bai, Y. (2016). Silencing of six susceptibility genes results in potato late blight resistance. Transgenic research, 25(5), 731-742. doi: 10.1007/s11248-016-9964-2 [ Links ]
Thorne, H. V., Clarke, G. F., & Skuce, R. (1985). The inactivation of herpes simplex virus by some Solanaceae glycoalkaloids. Antiviral Research, 5(6), 335-343. doi: 10.1016/0166-3542(85)90003-8 [ Links ]
Tingey, W. M. (1984). Glycoalkaloids as pest resistance factors. American Potato Journal, 61(3), 157-167. doi: 10.1007/BF02854036 [ Links ]
Tiwari, J. K., Siddappa, S., Singh, B. P., Kaushik, S. K., Chakrabarti, S. K., Bhardwaj, V., & Chandel, P. (2013). Molecular markers for late blight resistance breeding of potato: an update. Plant Breeding, 132(3), 237-245. doi: 10.1111/pbr.12053 [ Links ]
Tiwari, J. K., Jeevalatha, A., Tuteja, N., & Khurana, S. M. (2022). Genome editing (CRISPR-Cas)-mediated virus resistance in potato (Solanum tuberosum L.). Molecular Biology Reports, 49, 12109-12119. doi: 10.1007/s11033-022-07704-7 [ Links ]
Toinga-Villafuerte, S., Vales, M. I., Awika, J. M., & Rathore, K. S. (2022). CRISPR/Cas9-mediated mutagenesis of the granule-bound starch synthase gene in the potato variety Yukon Gold to obtain amylose-free starch in tubers. International Journal of Molecular Sciences, 23(9), 4640. doi: 10.3390/ijms23094640 [ Links ]
Turner, R. S. (2005). After the famine: Plant pathology, Phytophthora infestans, and the late blight of potatoes, 1845-1960. Historical Studies in the Physical and Biological Sciences, 35(2), 341-370. doi: 10.1525/hsps.2005.35.2.341 [ Links ]
Tussipkan, D., & Manabayeva, S. A. (2021). Employing CRISPR/Cas Technology for the improvement of potato and other tuber crops. Frontiers in Plant Science, 12, 1-16. doi: 10.3389/fpls.2021.747476 [ Links ]
Uitdewilligen, J. G., Wolters, A. M., D’hoop, B. B., Borm, T. J., Visser, R. G., & Van Eck, H. J. (2013). A next-generation sequencing method for genotyping-by-sequencing of highly heterozygous autotetraploid potato. PloS one, 8(5), e62355. doi: 10.1371/journal.pone.0062355 [ Links ]
Van Eck, J. (2018). Genome editing and plant transformation of solanaceous food crops. Current Opinion in Biotechnology, 49, 35-41. doi: 10.1016/j.copbio.2017.07.012 [ Links ]
Vega, S. E., & Bamberg, J. B. (1995). Screening the US potato collection for frost hardiness. American Potato Journal, 72(1), 13-21. doi: 10.1007/BF02874375 [ Links ]
Vleeshouwers, V. G., Rietman, H., Krenek, P., Champouret, N., Young, C., Oh, S. K.,... & Van der Vossen, E. A. (2008). Effector genomics accelerates discovery and functional profiling of potato disease resistance and Phytophthora infestans avirulence genes. PLoS one, 3(8), e2875. doi: 10.1371/journal.pone.0002875 [ Links ]
Wang, J., Fernández‐Pavía, S. P., Larsen, M. M., Garay‐Serrano, E., Gregorio‐Cipriano, R., Rodríguez‐Alvarado, G., Grünwald, N. J., & Goss, E. M. (2017). High levels of diversity and population structure in the potato late blight pathogen at the Mexico centre of origin. Molecular Ecology, 26(4), 1091-1107. doi: 10.1111/mec.14000 [ Links ]
Wang, S., Zhang, S., Wang, W., Xiong, X., Meng, F., & Cui, X. (2015). Efficient targeted mutagenesis in potato by the CRISPR/Cas9 system. Plant Cell Reports, 34(9), 1473-1476. doi: 10.1007/s00299-015-1816-7 [ Links ]
Wölfling, J. (2007). Recent developments in the isolation and synthesis of D-homosteroids and related compounds. Arkivoc, 5, 210-230. Retrieved from http://www.arkat-usa.org/get-file/19924/ [ Links ]
Yasumoto, S., Sawai, S., Lee, H. J., Mizutani, M., Saito, K., Umemoto, N., & Muranaka, T. (2020). Targeted genome editing in tetraploid potato through transient TALEN expression by Agrobacterium infection. Plant Biotechnology (Tokyo, Japan), 37(2), 205-211. doi: 10.5511/plantbiotechnology.20.0525a [ Links ]
Zhang, F., Qu, L., Gu, Y., Xu, Z. H., & Xue, H. W. (2022). Resequencing and genome-wide association studies of autotetraploid potato. Molecular Horticulture, 2(1), 1-18. doi: 10.1186/s43897-022-00027-y [ Links ]
Zhang, Y., Zhang, Q., & Chen, Q. J. (2020). Agrobacterium-mediated delivery of CRISPR/Cas reagents for genome editing in plants enters an era of ternary vector systems. Science China Life Sciences, 63(10), 1491-1498. doi: 10.1007/s11427-020-1685-9 [ Links ]
Zoteyeva, N. M., & Patrikeeva, M. V. (2010). Phenotypic characteristics of North-West Russian populations of Phytophthora infestans (2003-2008). PRO-Special report, 14, 213-216. Retrieved from chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://web04.agro.au.dk/project2/euroblight/Workshop/2010Arras/Proceedings/Page213_216_Zoteyeva_web.pdf [ Links ]
Zoteyeva, N., Chrzanowska, M., Flis, B., & Zimnoch-Guzowska, E. (2012). Resistance to pathogens of the potato accessions from the collection of NI Vavilov Institute of Plant Industry (VIR). American Journal of Potato Research, 89(4), 277-293. doi: 10.1007/s12230-012-9252-5 [ Links ]
Recibido: 19 de Diciembre de 2022; Aprobado: 16 de Agosto de 2023











 texto en
texto en 



