Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo. Serie horticultura
versão On-line ISSN 2007-4034versão impressa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.29 no.1 Chapingo Jan./Abr. 2023 Epub 04-Dez-2023
https://doi.org/10.5154/r.rchsh.2022.05.009
Artículos científicos
Impacto de dos tratamientos hidrotérmicos aplicados secuencialmente sobre el metabolismo oxidativo relacionado con la tolerancia al daño por frío en frutos de mango
1 Universidad Autónoma de Sinaloa. Av. de las Américas y Josefa Ortiz s/n, Culiacán, Sinaloa, C. P. 80010, MÉXICO.
2 Cátedras CONACYT - Instituto Politécnico Nacional, Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional (CIIDIR). Boulevard Juan de Dios Bátiz Paredes, núm. 250, col. San Joachin, Guasave, Sinaloa, C. P. 81049, MÉXICO.
El mango es susceptible a daño por frío (DF), aunque su exposición a tratamientos térmicos de corto plazo puede inducir tolerancia a esta alteración; sin embargo, un periodo corto no es suficiente para controlar la mosca de la fruta. En este sentido, la aplicación de tratamientos térmicos secuenciales cuando se emplea el tratamiento cuarentenario puede implicar grandes beneficios para la comercialización del mango. El objetivo de esta investigación fue evaluar el efecto de dos tratamientos hidrotérmicos (THT) aplicados secuencialmente sobre la tolerancia al DF y los cambios en el metabolismo oxidativo del mango. Los frutos se dividieron en cuatro grupos: testigo, THT1 (inmersión en agua a 46.1 °C durante 75 min), THT2 (inmersión en agua a 55 °C durante 5 min) y THT1 + THT2. Los frutos se almacenaron a 5 °C por 30 días para inducir el DF, y después a 21 °C durante 8 días. Se utilizaron tres muestras con cinco repeticiones para evaluar el índice de DF, la pérdida de electrolitos (PE), el malondialdehído (MDA), la pérdida de peso (PP), el color, la firmeza y la actividad enzimática antioxidante. El THT1 redujo el DF durante el almacenamiento a temperatura baja, mientras que el THT2 y el THT1 + THT2 presentaron menores síntomas de DF durante la maduración. El uso de THT1 mostró un porcentaje similar de PE y mayor contenido de MDA (7.07 x 104 nmol·L-1) que el testigo (6.68 x 104 nmol·L-1). La combinación THT1 + THT2 presentó la menor PP (2.98 %) y la mayor actividad enzimática antioxidante durante el almacenamiento frío durante los primeros días a 21 °C; en tanto que el THT2 mostró la retención más alta de color y firmeza. Los THT aplicados de manera secuencial se pueden considerar una alternativa efectiva para inducir la tolerancia al DF y para mantener la calidad del mango.
Palabras clave: Mangifera indica L.; tratamiento cuarentenario; calentamiento de corto plazo; estrés por frío; enzimas antioxidantes.
Mango is susceptible to chilling injury (CI). Its short-term exposure to heat treatments can induce tolerance to this disorder; however, a short time is not enough to control the fruit fly. In this sense, the application of sequential heat treatments where the quarantine treatment is included can bring great benefits for mango marketing. The aim of this research was to evaluate the effect of two different sequentially-applied hot water treatments (HWT) on CI tolerance and changes in oxidative metabolism in mango. Mangoes were divided into four groups: control, HWT1 (dipping in water at 46.1 °C for 75 min), HWT2 (dipping in water at 55 °C for 5 min), and HWT1 + HWT2. Fruits were stored at 5 °C/30 days to induce CI and thereafter at 21 °C for 8 days. Three replicates with five repetitions were used to evaluate CI index, electrolyte leakage (EL), malondialdehyde (MDA), weight loss (WL), color, firmness and enzymatic antioxidant activity. The use of HWT1 reduced CI during low temperature storage, while HWT2 and the HWT1 + HWT2 showed lower CI symptoms during ripening. The use of HWT1 showed a similar EL % and higher MDA content (7.07 x 104 nmol·L-1) than the control (6.68 x 104 nmol·L-1). HWT1 + HWT2 showed the lowest WL (2.98 %) and the highest enzymatic antioxidant activity during cold storage and during the first days at 21 °C, while HWT2 showed the highest color and firmness retention. HWT applied sequentially can be considered an effective alternative to induce CI tolerance and to maintain the quality of mango.
Keywords: Mangifera indica L.; quarantine treatment; short-term heating; cold stress; antioxidant enzymes
Ideas destacadas:
El tratamiento hidrotérmico indujo tolerancia al daño por frío en mangos “Tommy Atkins”.
El tratamiento hidrotérmico secuencial mejoró la estabilidad de la membrana celular.
El tratamiento hidrotérmico secuencial influyó notablemente sobre la actividad de las enzimas SOD, CAT y APX durante el daño por frío.
Introducción
El mango (Mangifera indica L.) es un fruto tropical, muy aceptado por los consumidores debido a su sabor único, su aroma y su aspecto atractivo. Este fruto se produce y comercializa en todo el mundo, donde México es el sexto productor mundial y el principal exportador, especialmente hacia Canadá, Estados Unidos de América y Japón (Food and Agriculture Organization [FAO], 2021). Para su comercialización, el mango se almacena a temperaturas críticas (10 a 13 °C), ya que en su etapa preclimatérica es altamente susceptible al daño por frío (DF) (Chongchatuporn, Ketsa, & van Doorn, 2013; Zhang et al., 2017), un trastorno fisiológico que se observa cuando la fruta se almacena por debajo de la temperatura crítica.
La susceptibilidad al DF está relacionada con el tiempo de almacenamiento y la calidad fisicoquímica del fruto (López-López et al., 2018; de Mello-Vasconcelos et al., 2019). Los cambios en los componentes de la membrana y su permeabilidad son las primeras respuestas al DF a nivel celular, mientras que el estrés oxidativo es la segunda respuesta (Zhang, Shen, Li, Meng, & Sheng, 2013; Shadmani, Ahmad, Saari, Ding, & Tajidin, 2015). La combinación de estas respuestas en el mango “Tommy Atkins” genera síntomas como lesiones de picado o hundimiento, oscurecimiento de la cáscara, maduración irregular, decoloración interna, humedecimiento del tejido y deterioro por hongos (Wang et al., 2008; Kim, Lounds-Singleton, & Talcott, 2009). Además, los síntomas pueden ser más intensos cuando la fruta se almacena a temperaturas más altas (Zhang et al., 2012).
Estudios previos han reportado que el uso de ácido oxálico (“Zill”; Li, Zheng, Liu, & Zhu, 2014), óxido nítrico (“Kensington Pride”, Zaharah & Singh, 2011; Barman, Asrey, Pal, Jha, & Bhatia, 2014), goma arábiga, cloruro de calcio (“Choke Anan”; Khaliq, Muda-Mohamed, Ghazali, Ding, & Ali, 2016), y el tratamiento hidrotérmico (cuarentenario) solo (“Tommy Atkins”, Kim et al., 2009) o en combinación con cloruro de calcio (“Keitt”, López-López et al., 2018; Díaz-Corona et al., 2020) reduce la susceptibilidad del mango a las temperaturas bajas.
El uso de estrés moderado (temperatura alta o baja) antes del almacenamiento a baja temperatura es una tecnología que ayuda al fruto a reducir el estrés oxidativo, al activar el sistema antioxidante que incluye enzimas como superóxido dismutasa (SOD, EC 1.15.1.1), catalasa (CAT, EC 1.11.1.6), ascorbato peroxidasa (APX, EC 1.11.1.11), glutatión reductasa (GR, EC 1.8.1.7) y peroxidasa (POD, EC 1.11.1.7). Asimismo, aumenta las proteínas de choque térmico y los compuestos antioxidantes como los polifenoles, los carotenoides y el ácido ascórbico (López-López et al., 2018; Zhang et al., 2019). Este sistema permite preparar el mecanismo de defensa para un estrés potenciado como el almacenamiento en frío, y tiene efectos positivos en la calidad de la fruta al reducir la tasa de respiración y prolongar la vida de anaquel (Dea, Brecht, Nunes, & Baldwin, 2010; Nasef, 2018).
El protocolo de exportación demanda que los frutos sean sometidos a un tratamiento cuarentenario para eliminar plagas invasivas (USDA-APHIS, 2014). El uso de agua caliente como tratamiento curentenario (46.1 °C durante 75 a 110 min; USDA-APHIS, 2014) permite la desinfección de moscas de la fruta y reduce tanto el oscurecimiento lenticelar como la antracnosis. Adicionalmente, los tratamientos cuarentenarios incrementan la actividad de las enzimas antioxidantes (CAT, APX y POD) y reducen la susceptibilidad al DF en mango (López-López et al., 2018; Díaz-Corona et al., 2020). No obstante, el tratamiento cuarentenario también puede acelerar la maduración y potenciar el ablandamiento, la pérdida de agua, el hundimiento de la pulpa en el área del pedúnculo y el desarrollo deficiente del color, lo cual compromete la calidad del mango (Dessalegn, Ayalew, & Woldetsadik, 2013; Nasef, 2018).
Por otro lado, el uso de tratamientos hidrotérmicos (THT) de corto plazo permite retrasar la maduración y el ablandamiento del fruto, lo cual mantiene la calidad poscosecha. Algunos de estos efectos benéficos han sido reportados en frutos, como el limón “Lisboa” (Citrus limon [L.] Brum) (Safizadeh, Rahemi, & Aminlari, 2007), la mandarina “Satsuma” (Citrus unshiu Marc) (Ghasemnezhad, Marsh, Shilton, Babalar, & Woolf, 2008), el broccoli “Italica" (Brassica oleracea) (Zhang, Nakano, & Maezawa, 2009), el durazno “Baifeng” (Prunus persica Batsch) (Jin, Zheng, Tang, Rui, & Wang, 2009) y el níspero (Eriobotrya japonica) (Shao & Tu, 2012). En mango (“Tainong 1” y “Tommy Atkins”), el tratamiento térmico de corto plazo (55 °C por 10 min más 55 °C por 5 min) también incrementa la tolerancia al DF y reduce la pérdida de la calidad, pero no controla la mosca de la fruta (Zhang et al., 2012; Almeida-Miguel, Durigan, Marques, Ascari Morgado, & Ferraudo, 2016).
Algunos autores reportan que los tratamientos térmicos secuenciales en mangos “Tommy Atkins” (agua caliente a 36.5 °C durante 75 min + 46.5 °C durante 61 min) y “Tuu Shien” (agua caliente a 55 °C durante 3 min + calor de vapor a 46.5 °C durante 40 min) aplicados previo al almacenamiento a temperaturas bajas incrementan la tolerancia al DF, y reducen el daño a la membrana y la pérdida de agua, en comparación con los mismos tratamientos aplicados de manera individual (Nyanjage, Wainwright, & Bishop, 1999; Le, Shiesh, & Lin, 2010), aunque estas combinaciones no controlan la mosca de la fruta. En este sentido, los tratamientos térmicos secuenciales, donde se incluye el tratamiento cuarentenario, pueden tener grandes beneficios, al aprovechar el hecho de que el tratamiento cuarentenario con agua caliente asegura el control de plagas y que es un tratamiento obligatorio para los mangos exportados a los Estados Unidos. El objetivo de este estudio fue determinar el efecto de tratamientos térmicos secuenciales sobre la incidencia del DF, la actividad de las enzimas antioxidantes en mango “Tommy Atkins” y la maduración durante el almacenamiento a 5 °C (85 a 90 % de humedad relativa).
Materiales y métodos
Material vegetativo, tratamientos y diseño experimental
Los mangos “Tommy Atkins” se obtuvieron de una huerta ubicada en Culiacán, Sinaloa, México (24° 46’ 23’’ LN y 107° 32’ 56’’ LO, a 26 m s. n. m.). Los frutos se cosecharon de árboles de entre 15 y 20 años plantados en suelos arenosos y limosos, en clima cálido (30-34 °C). Las plantas se mantuvieron con riego por goteo antes de la temporada de lluvia. Los frutos se seleccionaron en el estadio 2 (8-11 °Brix) (Crisosto et al., 2009) con ausencia de daño físico y peso de 350 a 420 g; posteriormente, se transfirieron al laboratorio de Fisiología y Tecnología Poscosecha en la Universidad Autónoma de Sinaloa.
Los frutos se limpiaron por inmersión en una solución de 300 (L·L-1 de hipoclorito de sodio durante 3 min, se secaron con aire y se dividieron aleatoriamente en cuatro grupos. Cada grupo recibió uno de los siguientes tratamientos: testigo (sumergidos en agua a temperatura ambiente durante 15 y 30 días), THT1 (inmersión en agua a 46.1 °C durante 75 min [USDA-APHIS, 2014]), THT2 (inmersión en agua a 55 °C durante 5 min [Ghasemnezhad et al., 2008]) y THT1 +THT2 (tratamiento secuencial bajo las condiciones antes mencionadas, aplicado uno después del otro).
Los THT se realizaron usando un baño (1266-02, Cole-Parmer®, Thermo Scientific, EUA) con recirculación continua de agua caliente. Los frutos de cada tratamiento se almacenaron a 5 °C (85 a 90 % de humedad relativa) durante 15 y 30 días. Después del almacenamiento de 30 días a 5 °C, los frutos se dejaron madurar durante 4 y 8 días a 21 °C ± 1 °C.
Parámetros evaluados
Índice de daño por frío
El índice de daño por frio (IDF) se calculó de acuerdo con lo reportado por López-López et al. (2018). Las evaluaciones se hicieron una vez que las frutas se retiraron de cada almacenamiento. Los síntomas de DF se evaluaron visualmente e incluyeron oscurecimiento de la lenticela (L), picado (P), desarrollo irregular del color (U) y descomposición (D). La severidad de los síntomas por DF se evaluó mediante una escala visual de cinco puntos (0 = sin tejido dañado, 1 = 1 a 25 % de tejido dañado, 2 = 26 a 50 % de tejido dañado, 3 = 51 a 75 % de tejido dañado y 4 = más de 76 % de tejido dañado). Se utilizaron cinco frutos por tratamiento al día. El IDF se calculó mediante la siguiente fórmula:
donde SL es la severidad del oscurecimiento de la lenticela, SP es la severidad del picado, SU es la severidad del desarrollo irregular del color y SD es la severidad de la descomposición.
Pérdida de electrolitos
Para la pérdida de electrolitos (PE), se obtuvieron diez discos (7 mm de diámetro por 5 mm de altura) del mesocarpo de cada fruto con un barreno de corteza (Malacrida, Valle, & Boggio, 2006). Los discos se enjuagaron tres veces con agua deionizada, se colocaron en 25 mL de solución de 0.4 manatiol e incubaron por 2 h a 25 °C con agitación constante (150 rpm). Las lecturas de conductividad eléctrica (S·m-1) de la solución se tomaron con un medidor de conductividad (HI98311, Hanna Instruments®, Sudáfrica) después de la incubación (conductividad eléctrica inicial); posteriormente, los discos se colocaron en autoclave a 121 °C durante 20 min y se enfriaron a 25 °C (conductividad eléctrica total). Se utilizaron cinco frutos por día y por tratamiento. El porcentaje de PE se calculó con la siguiente fórmula:
Determinación del malondialdehído
El producto final de la peroxidación lipídica es el malondialdehído (MDA) y se determinó mediante la técnica del ácido tiobarbitúrico (TBA) conforme a Hodges, de Long, Forney, y Prange (1999). En resumen, se homogenizó 1 g de tejido fresco en 30 mL de etanol:agua (80:20 v/v) y se centrifugó a 3,000 g (4 °C por 10 min). Se prepararon dos soluciones: 1 mL de sobrenadante más 1 mL de solución A (-TBA) y 1 mL de sobrenadante más solución B (+TBA). Ambas soluciones contenían 20 % de ácido tricloroacético (TCA) + 0.01 % de hidroxitolueno butilado (BHT). La solución B también contenía 0.65 % de TBA. Todas las muestras se agitaron, se calentaron a 95 °C durante 25 min, se enfriaron y se centrifugaron (3,000 g) a 25 °C durante 10 min. Se tomaron lecturas de absorbancia a 440, 532 y 600 nm utilizando un espectrofotómetro UV-Vis (SQ2800, Unico, EUA). La concentración de equivalentes de MDA se calculó mediante la siguiente fórmula:
Pérdida de peso
La pérdida de peso (PP) se determinó individualmente en nueve frutos (Concellón, Zaro, Chaves, & Vicente, 2012). El peso se registró el día inicial y, posteriormente, cada tres días durante el almacenamiento a 5 °C. El porcentaje de PP se calculó como se indica a continuación:
donde Pi representa el peso inicial y Pf es el peso final.
Color
Este parámetro se midió con un colorímetro (CR200, Minolta, Japón) basado en el sistema de color CIELAB y calibrado con una placa blanca. Las mediciones se hicieron en tres puntos equidistantes en el eje ecuatorial de la cáscara de cada fruto, y se registraron los valores de luminosidad (L*) y ángulo Hue (°Hue).
Firmeza
La firmeza se evaluó con un penetrómetro digital (Chatillon DFE 100, AMETEK®, EUA) ajustado con una sonda cilíndrica de acero inoxidable de 11 mm de diámetro. La piel de la fruta se removió y el mesocarpo se penetró (5 mm de profundidad) en seis puntos distintos con una velocidad constante de 50 mm·min-1. Los resultados se expresaron en Newtons (N).
Metabolismo oxidativo (actividad enzimática)
Superóxido dismutasa (SOD, EC 1.15.1.1). La actividad enzimática de la SOD se determinó conforme a lo reportado por López-López et al. (2018). Una muestra de tejido liofilizado de 0.5 g se homogenizó con 5 mL de amortiguador de fosfato de potasio 0.05 M (pH 7.5) + 1 mM de ácido etilendiaminotetraacético (EDTA) + 5 % de polivinilpirrolidona (PVP). La mezcla se centrifugó durante 15 min (17,200 g a 4 °C) y el sobrenadante se recuperó como extracto enzimático. La mezcla de reacción incluyó 1 (L de extracto enzimático más 199 (L de amortiguador de fosfato de potasio 0.1 M (pH 7.8) que contenía 0.025 % de Triton X-100, 0.01 M de metionina, 0.11 M de EDTA y 57 (M de cloruro de nitro-azul de tetrazolio (NBT), más 50 (L de 20 (M de riboflavina (volumen final 250 (L). La absorbancia a 550 nm se registró antes y después de la exposición a la luz (25 W) durante 10 min, utilizando un lector de microplacas (The Synergy™ HT Multi-Detection, Bio-Tek®, EUA).
La actividad de la SOD se expresó en unidades de actividad enzimática por miligramo de proteína (U·mg-1 proteína). Una unidad de actividad SOD se definió como la cantidad de enzima que inhibiera el 50 % de la fotorreducción del NBT. Las proteínas se cuantificaron mediante el ensayo de Bradford (1976).
Catalasa (CAT, EC 1.11.1.6). Para analizar la actividad de la CAT se homogenizaron 0.5 g de tejido liofilizado con 5 mL de amortiguador de extracción (0.045 M de fosfato de potasio [pH 7.0] + 5 mM de ditiotreitol + 5 mM de EDTA + 0.125 g de polivinilpolipirrolidona). La mezcla se centrifugó a 17,200 g y 4 °C durante 30 min. El sobrenadante se recuperó como extracto enzimático. La actividad de la CAT se determinó midiendo la desaparición del peróxido de hidrógeno (H2O2) (López-López et al., 2018). La mezcla de reacción contenía 1 mL de amortiguador de fosfato de potasio 0.04 M (pH 7.0), más 0.04 M de H2O2 y 25 (L de extracto enzimático. Los cambios en la concentración del H2O2 durante 5 min se calcularon a partir de su coeficiente de extinción (43 M-1·cm-1) a 240 nm. Los resultados se expresaron en U·mg-1 proteína.
Ascorbato peroxidasa (APX, EC 1.11.1.11). La actividad de la APX se determinó utilizando el mismo extracto enzimático obtenido para la CAT. La mezcla de reacción contenía 969 (L de amortiguador de fosfato de potasio 40 mM (pH 7.0), 5 (L de ácido ascórbico 0.1 M, 1 (L de H2O2 0.1 M y 25 (L de extracto enzimático (López-López et al., 2018). La actividad se expresó en U·mg-1 proteína. Los cambios en la concentración de ácido ascórbico se calcularon a partir de su coeficiente de extinción (2.8 mM-1·cm-1) a 290 nm.
Análisis estadístico
Los datos se sometieron a un análisis de varianza de dos vías utilizando el programa Stat-graphics Plus 5.1 (Statistical Graphics, Rockville, MD). El efecto de los tratamientos (testigo, THT1, THT2 y THT1+THT2) y los días de almacenamiento (0, 15, 30, 30+4 y 30+8 días) fueron los factores analizados. Las diferencias significativas (P < 0.05) entre las medias se establecieron usando la prueba de diferencias mínimas significativas (DMS) de Fisher. A menos que otro número se indique, se utilizaron tres muestras con cinco repeticiones para el análisis.
Resultados y discusión
Índice de daño por frío
La aplicación de THT y el tiempo de almacenamiento tuvieron un efecto significativo en la presencia de síntomas de DF como picado, desarrollo irregular de color y descomposición en mangos “Tommy Atkins” (Figura 1). La aplicación de THT1, THT2 o THT1 + THT2 redujo significativamente la susceptibilidad al DF en comparación con el testigo después de 30 días a 5 °C (Figura 1a). Cuando los frutos se llevaron a maduración, la presencia de síntomas aumentó a medida que avanzó el periodo de almacenamiento (30+8 días) (Figura 1b). Los mangos tratados con THT2 y THT1 + THT2 presentaron un menor IDF (1.72). Al realizar un análisis de regresión lineal, el THT2 mostró el menor índice en la aparición de síntomas durante el almacenamiento a 5 °C (coeficiente de término lineal de 0.053 y coeficiente de determinación de R2 de 0.999), mientras que el THT1 + THT2 presentó este comportamiento durante el almacenamiento a 21 °C (coeficiente de término lineal de 0.080 y coeficiente de determinación de R2 de 0.955). Este resultado está relacionado con el tratamiento hidrotérmico poscosecha, ya que genera cambios fisiológicos y bioquímicos en el fruto. Estos cambios están relacionados con factores como el tipo de tratamiento térmico, el tiempo de exposición y el genotipo del fruto (Ummarat, Matsumoto, Wall, & Seraypheap, 2011).
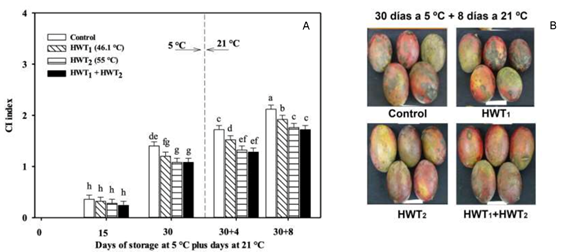
Figura 1 a) Índice de daño por frío (IDF) de mango “Tommy Atkins” durante almacenamiento a 5 °C más 4 y 8 días a 21 °C y b) imágenes representativas de mangos de cada tratamiento después de 30 días a 5 °C más 8 días a 21 °C. THT = tratamientos hidrotérmicos. Los datos son la media de cinco muestras con la diferencia mínima significativa (DMS = 0.17) como barras verticales. Barras con letras iguales entre los tratamientos no difieren estadísticamente (Fisher, P < 0.05).
El aumento de la tolerancia al DF, favorecido por un tratamiento térmico individual corto o largo, se ha reportado previamente en mango “Tuu Shien” y “Keitt” (Le et al., 2010; Díaz-Corona et al., 2020), plátano “Hom Thong” (Ummarat et al., 2011) y kiwi “Hongyang” (Ma et al., 2014). También se observó esta tolerancia cuando se aplicó un tratamiento térmico secuencial en papaya “Frangi” (Shadmani et al., 2015). La capacidad del THT2 y del tratamiento secuencial para reducir el IDF se puede atribuir al mantenimiento de la integridad de la membrana celular (menor contenido de MDA) y a una reducción de la permeabilidad de la membrana (menor PE; Figura 2a), así como a un aumento del sistema enzimático antioxidante que protege a las células del estrés oxidativo en los frutos sometidos a THT1 + THT2.
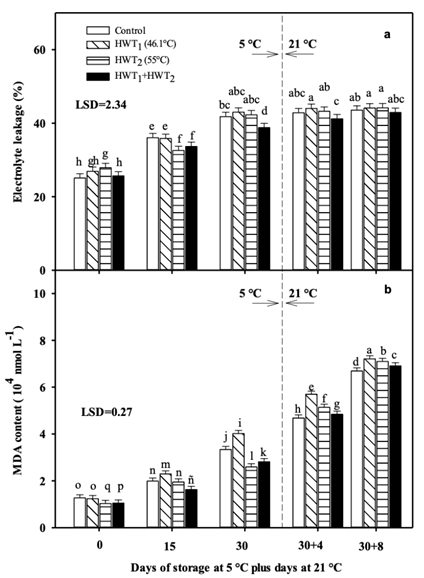
Figura 2 a) Pérdida de electrolitos y b) contenido de malodialdehido (MDA) en mango “Tommy Atkins” durante almacenamiento a 5 °C más 4 y 8 días de maduración a 21 °C. THT = tratamientos hidrotérmicos. Los datos son la media de cinco muestras con la diferencia mínima significativa (DMS = 0.17) como barras verticales. Barras con letras iguales entre los tratamientos no difieren estadísticamente (Fisher, P < 0.05).
La reducción de la susceptibilidad al DF en los frutos del THT1 respecto al testigo se relacionó con una mayor actividad enzimática, pero no con una reducción del daño en la membrana celular, ya que el THT1 presentó valores de MDA y PE más elevados que el testigo. Así, el uso de estrés térmico secuencial permite una mayor activación del sistema antioxidante en el fruto, preparándolo para un estrés mayor como el causado por frío a largo plazo (30 días a 5 °C).
Pérdida de electrolitos y malondialdehído
La PE aumentó en diferentes proporciones durante el almacenamiento a 5 °C y a temperatura ambiente en todos los tratamientos. En el día 15, el mango tratado con el THT2 y THT1 + THT2 presentó menor PE que el THT1 y el testigo, mientras que después de 30 días de almacenamiento en frío sólo el THT1 + THT2 mantuvo la menor PE. Sin embargo, durante el almacenamiento a 21 °C, todos los tratamientos presentaron una PE similar (Figura 2a). En el análisis de regresión a 5 °C, el THT1 + THT2 mostró la menor tasa de liberación de electrolitos, con un coeficiente de término lineal de 0.437 (coeficiente de determinación de 0.983). Por el contrario, en el análisis de varianza a 21 °C, el THT1 presentó la menor tasa en la PE (coeficiente de término lineal de 0.141 y coeficiente de determinación R2 de 0.826).
El contenido de MDA aumentó con el tiempo de almacenamiento en ambas temperaturas de almacenaje (Figura 2b). La fruta tratada con el THT2 mostró el menor contenido de MDA al final del almacenamiento a 5 °C, seguida por la fruta del tratamiento secuencial, mientras que la aplicación del THT1 promovió un mayor contenido de MDA, incluso por encima del testigo. Durante la maduración, los frutos tratados con los distintos THT presentaron un mayor contenido de MDA que el testigo, pero el uso del THT1 + THT2 permitió una menor peroxidación lipídica. Un comportamiento similar fue observado en el análisis de regresión lineal, ya que el THT2 presentó la menor tasa de producción de MDA con un coeficiente de regresión de 0.052 y un coeficiente de determinación R2 de 0.989 a 5 °C. Por otro lado, a 21 °C, este análisis mostró que el THT1 presentó la tasa de producción de MDA más baja, con un coeficiente de regresión de 0.398 y un coeficiente de determinación R2 de 0.999, lo cual difiere del análisis de varianza. Lo anterior debido, posiblemente, a la variabilidad en la producción de MDA.
El estrés abiótico producido por las bajas temperaturas promueve el daño oxidativo en el fruto y la senescencia rápida. Por lo tanto, la acumulación de especies reactivas de oxígeno (ERO) en las células debida al estrés puede provocar el deterioro de la membrana y un aumento de la PE y del contenido de MDA (Nasef, 2018). El uso de THT2 y THT1 + THT2 protegió a la membrana celular, con lo cual se redujeron los niveles de PE y MDA durante el almacenamiento en frío. Sin embargo, después de retirar de los 5 °C, la fruta del THT presentó incrementos significativos en dichos parámetros. Resultados similares fueron reportados con anterioridad en diferentes frutas (granada, mandarina, plátano y pepino) tratadas con THT durante un tiempo corto (40 a 55 °C, de 4 a 10 min), donde el tratamiento térmico redujo el daño de la membrana (Mirdehghan et al., 2007; Ghasemnezhad et al., 2008; Ummarat et al., 2011; Nasef, 2018).
Nasef (2018) señala que el tratamiento térmico (55 °C durante 5 min) disminuye el DF en pepinos debido a una reducción de la PE y a la conservación de la integridad de la membrana. Asimismo, el comportamiento del tratamiento secuencial del presente estudio fue similar al de la combinación de dos THT (36.5 °C durante 75 min más 46.5 °C durante 61 min) en mango “Tommy Atkins” almacenado a 4 y 9 °C (Nyanjage et al., 1999). Lo anterior debido a que el tratamiento térmico secuencial puede retrasar la maduración y el ablandamiento y, por tanto, reducir la PE. La aplicación individual de THT presentó una PE similar al testigo. Este incremento en la permeabilidad de la membrana celular se atribuye a los efectos del estrés térmico, ya que induce la activación de las proteínas de choque térmico, la vía de la arginina y el metabolismo de la glucosa. Además, aumenta las enzimas y los compuestos antioxidantes, como el ácido ascórbico y el glutatión, los cuales inhiben el daño peroxidativo (Zhang et al., 2019).
Pérdida de peso
Todos los tratamientos presentaron un incremento en la PP durante el almacenamiento a 5 °C, alcanzando valores de 2.98 % (THT1 + THT2) a 3.92 % (THT1) al final del almacenamiento (Figura 3). El mango tratado con un tratamiento secuencial presentó la menor PP (2.98 %), mostrando diferencias significativas (P < 0.05) con la fruta de los otros tratamientos después de 36 días a 5 °C. La fruta del THT1 y el testigo tuvieron valores similares y produjeron los porcentajes más altos de PP. Asimismo, este estudio reveló que el THT1 + THT2 fue más eficaz en la reducción de la PP que la aplicación individual de cada tratamiento térmico, lo cual sugiere que el tratamiento térmico secuencial podría reducir las alteraciones en la piel del fruto, la transpiración y la respiración durante el almacenamiento en frío, sin inhibir la maduración cuando se transfiere a temperatura ambiente (Shadmani et al., 2015).

Figura 3 Pérdida de peso de mango “Tommy Atkins” durante el almacenamiento a 5 °C. Los datos son la media de nueve muestras. Las barras verticales representan la diferencia mínima significativa (DMS) de Fisher = 0.33.
La aplicación del tratamiento térmico secuencial en mango podría aumentar las propiedades protectoras de la cutícula y la cera epicuticular, manteniendo la integridad del tejido (Shadmani et al., 2015). Contrario a estos resultados, el mango “Kensington” sometido a tratamiento secuencial por largo tiempo (calor de vapor a 40 °C por 8 h más THT a 47 °C por 15 min) y almacenado a temperatura de maduración presentó un incremento de PP (2.29 %), mayor tasa de respiración, maduración acelerada (11.43 N en firmeza, 13.92 °Brix y 0.96 acidez titulable) e incremento en transpiración y deshidratación, comparado con fruta testigo (Jacobi, Macrae, & Hetherington, 2000). Por otro lado, Nasef (2018) señala que la PP en pepinos se ve afectada por la temperatura del tratamiento (45 o 55 °C durante 5 min), el periodo de almacenamiento (7, 14 y 21 días a 5 °C, más 2 y 4 días a 20 °C) y su interacción. El uso de 55 °C durante 5 min podría potenciar las funciones de protección de la membrana y la pared celular, incluso durante la maduración. El uso de un tratamiento cuarentenario más un tratamiento térmico de corta duración no se había reportado anteriormente.
Color
Los parámetros de color (L* y ángulo Hue) se presentan en el Cuadro 1. La fruta mostró una coloración inicial rojo y verde brillante, con valores promedio de 41.18 y 18.23 para L* y °Hue, respectivamente. El tiempo de almacenamiento tuvo un efecto significativo sobre la pérdida de luminosidad (-9.67 % en promedio), sin distinción del tratamiento, la cual se mantuvo cuando los frutos se llevaron a maduración a 21 °C en THT1 + THT2 y el testigo. El THT2 presentó la reducción más baja en los valores de L* después de 30 días de almacenamiento frío, así como después de 8 días de maduración con respecto a otros tratamientos. Los tratamientos THT1 y THT1 + THT2 presentaron las pérdidas más altas en los valores de L* durante el almacenamiento frío (-13.91 %) y la maduración (-16.51 %), respectivamente.
Cuadro 1 Efecto de la aplicación individual y secuencial de dos condiciones de tratamiento térmico sobre la luminosidad, el ángulo Hue y la firmeza durante el almacenamiento de mango “Tommy Atkins”.
| Tratamientos | Días de almacenamiento a 5 °C + días a 21 °C | ||
|---|---|---|---|
| 0 | 30+0 | 30+8 | |
| Luminosidad | |||
| Testigo | 41.18 ± 0.46 aB | 36.84 ± 1.24 bB | 34.74 ± 0.97 cC |
| THT1 | 42.41 ± 1.02 aA | 36.51 ± 0.09 bB | 36.95 ± 0.86 bB |
| THT2 | 40.62 ± 0.54 aB | 39.22 ± 1.04 bA | 38.66 ± 1.01 bA |
| THT1 + THT2 | 43.06 ± 1.00 aA | 38.40 ± 0.35 bA | 35.95 ± 0.26 cBC |
| Ángulo Hue | |||
| Testigo | 18.23 ± 1.70 aB | 17.28 ± 0.82 aB | 14.96 ± 1.04 bC |
| THT1 | 18.81 ± 1.45 aAB | 17.33 ± 0.23 bB | 17.01 ± 0.80 bB |
| THT2 | 19.85 ± 0.71 aA | 18.98 ± 1.07 aA | 19.18 ± 0.96 aA |
| THT1 + THT2 | 18.90 ± 0.89 aAB | 18.28 ± 1.01 aAB | 17.36 ± 1.69 aB |
| Firmeza (N) | |||
| Testigo | 135.68 ± 3.75 aAB | 112.95 ± 3.24 bA | 29.70 ± 3.99 cC |
| THT1 | 137.08 ± 4.18 aA | 104.07 ± 4.66 bB | 29.33 ± 0.87 cC |
| THT2 | 133.60 ± 6.98 aB | 101.80 ± 4.78 bB | 47.52 ± 2.70 cA |
| THT1 + THT2 | 123.53 ± 4.72 aC | 97.67 ± 3.17 bC | 37.27 ± 1.96 cB |
Para cada parámetro, las medias con letras iguales (a, b, c) en la misma fila (días de almacenamiento para cada tratamiento), así como las iguales en la misma columna (A, B, C) (tratamientos en el mismo día), no difieren estadísticamente según la prueba de diferencia mínima significativa (DMS) de Fisher (P < 0.05). Los valores son la media ( desviación estándar. THT1 = tratamiento hidrotérmico (46.1 °C por 75 min), THT2 = tratamiento hidrotérmico (55 °C por 5 min), THT1 + THT2 (mismas condiciones aplicadas secuencialmente). 30+0 = 30 días de almacenamiento a 5 °C + 0 días a 21 °C, 30+8= 30 días de almacenamiento a 5 °C + 8 días a 21 °C.
Por otro lado, se observó una reducción significativa (P < 0.05) en los valores del °Hue durante el almacenamiento en frío en la fruta del THT1, mientras que los valores en los otros tratamientos permanecieron prácticamente constantes. Después de 8 días adicionales a 21 °C, sólo el testigo presentó una reducción significativa del °Hue (-13.42 %). El THT2 y el THT1 + THT2 preservaron la calidad del mango, y mantuvieron buena apariencia y color (luminosidad y °Hue). Este comportamiento se puede asociar a una reducción de los síntomas del IDF y de la PP, a la estabilización de la membrana celular y a un retraso en la maduración, lo cual redujo los cambios en el color de la piel (López-López et al., 2018).
Se observaron resultados similares en pepino “Dahshan”, ya que el uso de THT durante 5 min mantuvo buen color y buena apariencia, lo cual se atribuye a un retraso en la degradación de la clorofila por la reducción de las actividades de la clorofila oxidasa y peroxidasa, inducción de la proteína de choque térmico, estabilización de la membrana celular y reducción de la PP (Nasef, 2018). Asimismo, el índice de color de la cáscara no cambió significativamente en mango sumergido en tratamientos con calor durante un tiempo prolongado (75 min y 20 min) (Dea et al., 2010; Alvindia & Acda, 2015) o tratamiento con calor secuencial (3 min más 40 min) (Le et al., 2010), pero sí lo hacen cuando los frutos son expuestos a irradiación (Cruz, Soares, Fabbri, Cordenunsi, & Sabato, 2012).
Firmeza
Respecto a la firmeza, todos los tratamientos presentaron una reducción significativa durante el almacenamiento a 5 y 21 °C (Cuadro 1). Los valores iniciales de firmeza variaron de 123 a 137 N, y después de 30 días de almacenamiento en frío variaron de 112.95 a 97.67 N. La fruta testigo mostró la menor disminución de firmeza (-16.75 %). La aplicación del THT1 promovió la mayor pérdida de firmeza (-24.08 %), seguido del THT2 (-23.80 %) y el tratamiento secuencial (-20.93 %). Sin embargo, cuando los frutos se transfirieron a maduración, los del THT2 mostraron la menor pérdida de firmeza, seguidos por los de THT1 + THT2, mientras que los frutos testigo y del THT1 mostraron mayor pérdida de firmeza sin diferencias significativas (P > 0.05) entre ellos.
El uso del THT1 + THT2 originó una reducción significativa de la firmeza en comparación con los tratamientos por separado al inicio del estudio, lo cual se podría deber a un aumento de la tasa de respiración y de la síntesis de etileno que provocan la degradación del almidón en azúcares, o a una activación de las enzimas degradativas que afectan a la pared celular (Hossain, Rana, Kimura, & Roslan, 2014). Aunque el THT1 + THT2 presentó los valores de firmeza más bajos al final del periodo de almacenamiento a 5 °C, también presentó el menor cambio con respecto al día inicial. Por lo tanto, cuando se combina el tratamiento térmico secuencial con el almacenamiento a temperaturas frías, la degradación de la pared celular se reduce. De acuerdo con Mirdehghan et al. (2007), un doble estrés podría causar una menor despolimerización y solubilización de las sustancias pécticas (poliurónido), lo cual llevaría a una reducción de la pectina soluble y de la maduración, así como a una disminución de la fuerza de compresión y de la actividad enzimática, lo que mantendría la integridad celular, y reducir la pérdida de firmeza y la descomposición celular (Le et al., 2010; Mahto & Das, 2013).
Durante la maduración, la inmersión de la fruta en el THT2 redujo el ablandamiento al día 30 a 5 °C más 8 días a 21 °C, lo cual se podría deber a que el corto tiempo de inmersión no tuvo efecto sobre la actividad de las enzimas poligalacturonasa y (-galactosidasa (Chávez-Sánchez, Carrillo-López, Vega-García, & Yahia, 2013). Resultados similares con tratamientos secuenciales fueron reportados por Jacobi et al. (2000) en mango “Tuu Shein” tratado con aire caliente por 8 h más THT por 15 min, y Le et al. (2010) en mango tratado con THT más vapor de calor por 40 min, donde observaron un ablandamiento reducido debido a una menor degradación de la pared celular y cambios en el contenido de pectina soluble.
Metabolismo oxidativo (actividad enzimática)
La actividad de la SOD aumentó en todos los tratamientos durante el almacenamiento a 5 °C. En el día 30, el tratamiento secuencial mostró la actividad más alta, seguido del THT1, mientras que el THT2 y el testigo mostraron una menor actividad de la SOD sin diferencias significativas (P > 0.05) entre ellos (Figura 4a). En el día 30+8, todos los tratamientos presentaron una reducción significativa de la SOD; sin embargo, el THT1 + THT2 mantuvo la actividad más alta con diferencias significativas respecto a los otros tratamientos. La enzima SOD contribuye en la etapa inicial de la eliminación de las ERO y cataliza la transformación del ion superóxido (O2 -) en H2O2 (Alscher, Erturk, & Heat, 2002; Soleimani-Aghdam, Jannatizadeh, Sheikh-Assadi, & Malekzadeh, 2016). En este estudio, la aplicación de THT durante un tiempo prolongado (THT1 y THT1 + THT2) mejoró la actividad de la SOD; no obstante, el tratamiento secuencial presentó una mayor actividad en ambas temperaturas de almacenamiento (5 y 21 °C).
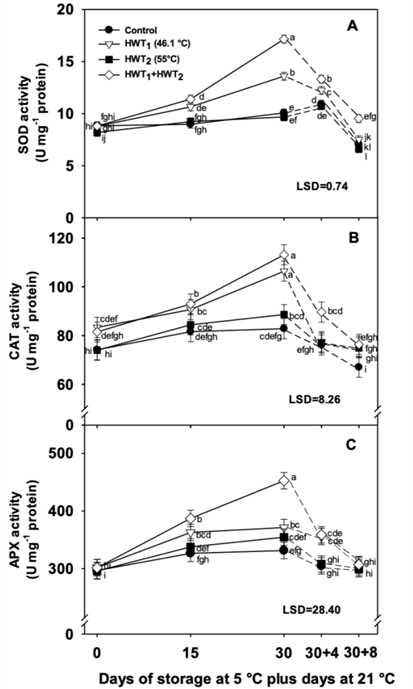
Figura 4 Actividad enzimática antioxidante en mango “Tommy Atkins” durante almacenamiento a 5 °C (líneas continuas) más 4 y 8 días a 21 °C (líneas punteadas): a) superóxido dismutasa (SOD), b) catalasa (CAT) y c) ascorbato peroxidasa (APX). Los datos son la media de cinco muestras con la diferencia mínima significativa (DMS) como barras verticales.
El THT2 no mostró ningún efecto sobre la actividad de la SOD debido al bajo daño de la membrana y a la reducción del contenido de ERO. Estos resultados sugieren que el efecto del THT1 + THT2 sobre la reducción del DF puede estar asociado a un incremento de la SOD, el cual impidió la acumulación de O2 - y, por tanto, el daño oxidativo, disminuyendo la PE y el contenido de MDA durante el almacenamiento en frío. No se observaron diferencias significativas en la actividad de la SOD entre la fruta del THT2 y el testigo. Por el contrario, Fogelman, Kaplan, Tanami, y Ginzberg (2011) y Wang et al. (2016) señalan que el aumento de la actividad de la SOD en melón “Hami” se debió al efecto del THT a 59 °C durante 30 s más 55 °C durante 3 min; sin embargo, la actividad de la SOD no tuvo efecto sobre la reducción del IDF, ya que aumentó el contenido de O2 - y H2O2, lo cual provocó peroxidación lipídica y daños en las membranas.
Los resultados obtenidos en este estudio fueron similares a los reportados por López-López et al. (2018) en mango “Keitt” sumergido en tratamiento cuarentenario y almacenado a 5 °C, ya que un incremento en la actividad de la SOD se relacionó con la tolerancia al DF y a la reducción del daño de la membrana. Además, el uso de THT secuencial (42 °C durante 30 min más 49 °C durante 20 min) en papaya “Frangi” no aumentó significativamente la actividad de la SOD durante el almacenamiento a 6 °C; por lo tanto, no se correlacionó con la tolerancia al DF (Shadmani et al., 2015). Esto es contrario a nuestros resultados con el tratamiento secuencial, y puede estar asociado con las diferencias en el tiempo de exposición a ambas temperaturas.
Los tratamientos THT1 + THT2 y THT1 presentaron una mayor actividad de la CAT durante el almacenamiento en frío al mostrar incrementos de 38.80 y 27.67 %, respectivamente, en el día 30 (Figura 4b), mientras que el THT2 y el testigo mostraron una menor actividad (19.80 y 11.68 %, respectivamente). Cuando los frutos se transfirieron a 21 °C, los tratados con THT1 presentaron la máxima reducción de la actividad de la CAT en el día 30+4, mientras que los tratados con THT1 + THT2 mantuvieron la actividad más alta con diferencias significativas respecto a los otros tratamientos. Al final del almacenamiento de maduración, la actividad de la CAT se redujo en todos los tratamientos, y no se observaron diferencias significativas entre ellos. La CAT reduce el H2O2 a agua y oxígeno, con lo cual protega a la membrana celular del daño oxidativo (Nasef, 2018).
La actividad de la CAT mostró un comportamiento similar a la actividad SOD. El THT1 y THT1 + THT2 presentaron un aumento significativo de la actividad de la CAT al final del almacenamiento a 5 °C. El tratamiento cuarentenario puede inducir estrés oxidativo, pero también induce defensas frente al estrés oxidativo (López-López et al., 2018). El THT2 indujo una actividad CAT mínima, similar al testigo, pero con la diferencia de que el THT2 reduce el daño de la membrana y la producción de ERO. Durante la maduración, el aumento de los síntomas de DF se asoció con la reducción de la CAT y la acumulación de H2O2, una molécula que permea fácilmente la membrana celular y reacciona con los iones metálicos intracelulares, lo cual produce radicales de hidroxilo que causan daños en la estructura de las proteínas y el ADN, así como pérdida de la integridad de la membrana (Sala & Lafuente, 2000).
El THT1 + THT2 mantuvo la actividad enzimática más alta durante los primeros cuatro días de maduración, tal y como se observó para la actividad de la SOD. La CAT y la SOD ayudan a reducir la producción de H2O2 y O2 - al limitar el radical hidroxilo intracelular y los síntomas de DF. En concordancia con lo anterior, diversos autores indican que el tratamiento térmico incrementa la actividad de la CAT y reduce la acumulación de H2O2 protegiendo a la célula de daños y síntomas de DF. La CAT presentó un mayor efecto antioxidante que la APX, enzima que compite por H2O2 durante el almacenamiento en frío (Fogelman et al., 2011; Nasef, 2018). Shadmani et al. (2015) informan que el THT secuencial en papaya promovió menos actividad CAT que el testigo a 6 °C, especialmente después de dos semanas. Además, observaron que la acumulación de H2O2 en la fruta testigo estaba correlacionada con una actividad CAT más alta y, por lo tanto, no se observó que una mayor actividad CAT se correlacionara con la tolerancia al DF en la fruta de THT (Shadmani et al., 2015).
En cuanto a la actividad de la APX, ésta aumentó durante el almacenamiento en frío en los frutos con diferentes THT, mientras que los frutos testigo no mostraron cambios significativos (Figura 4c). Después de 30 días a 5 °C, el tratamiento secuencial presentó mayor actividad APX, con diferencias significativas respecto al THT2 y el testigo. Después de 4 días a 21 °C, la actividad de la APX se redujo en todos los THT, pero el THT1 + THT2 mantuvo los valores más altos con respecto a los otros tratamientos. Después de 8 días a 21 °C, no se observaron diferencias significativas en la actividad de dicha enzima entre el testigo y todos los THT. En este trabajo, el uso de diferentes THT incrementó la actividad de la APX, especialmente al final del almacenamiento a 5 °C. Durante la maduración, todos los tratamientos redujeron la actividad de la APX de forma similar a las otras enzimas (SOD y CAT), al presentar la mayor actividad con el tratamiento secuencial.
Chongchatuporn et al. (2013) indican que una reducción de la susceptibilidad al DF está relacionada con una reducción de ERO y un incremento de las actividades de la CAT y la APX durante el almacenamiento en frío. Se han observaron resultados similares en fresa (Vicente, Martínez, Chaves, & Civello, 2006), brócoli (Zhang et al., 2009), plátano (Ummarat et al., 2011) y mango (López-López et al., 2018), donde hubo una mayor transcripción y actividad de la APX respecto al testigo, reducción de la acumulación de ERO y el daño celular, así como aumento de la tolerancia al DF. Un aumento sincronizado de las actividades de enzimas antioxidantes como SOD, CAT y APX, promovido por el tratamiento secuencial, es muy importante para la eliminación de ERO con el fin de proteger la membrana celular, inducir la tolerancia al DF y mantener la calidad durante el almacenamiento en frío.
Por lo tanto, el uso de tratamientos térmicos para el equilibrio entre las enzimas antioxidantes es crítico para la supervivencia celular durante el estrés por frío (Zhang et al., 2013; López-López et al., 2018). Es importante destacar que el efecto observado en el tratamiento secuencial (cuarentena más corto plazo) no ha sido reportado previamente para las actividades de la SOD, la CAT, la APX y la tolerancia al DF en mango.
Conclusiones
La aplicación de tratamientos térmicos, previo al almacenamiento en frío, redujo la susceptibilidad al daño por frío en mango “Tommy Atkins”, especialmente en aquellos tratados con THT2 (55 °C por 5 min) y en aquellos con THT1 + THT2 (46.1 °C por 75 min más 55 °C por 5 min). El THT1 + THT2 redujo la PE, el MDA y la PP a 5 °C y activó el sistema antioxidante al aumentar la actividad de la SOD, la CAT y la APX. El THT2 fue el que mejor mantuvo el color y la firmeza, seguido del tratamiento secuencial. La combinación de un tratamiento cuarentenario y un tratamiento térmico de corta duración puede ser una alternativa útil para mantener la calidad poscosecha durante el almacenamiento y la distribución de mango “Tommy Atkins”, ya que atiende a la normativa de control de plagas establecida por el USDA-APHIS y proporciona tolerancia al DF, lo cual facilitaría su comercialización en lugares lejanos. Asimismo, sería interesante probar dicho tratamiento en otros cultivares susceptibles a temperaturas bajas y comprobar su eficacia.
References
Alscher, R. G., Erturk, N., & Heath, L. S. (2002). Role of superoxide dismutases (SODs) in controlling oxidative stress in plants. Journal of Experimental Botany, 53(372), 1331-1341. doi: 10.1093/jexbot/53.372.1331 [ Links ]
Almeida-Miguel, A. C., Durigan, J. F., Magalhaes-Marques, K., Ascari-Morgado, C. M., & Ferraudo, A. S. (2016). Prevention of chilling injury in ‘Tommy Atkins’ mangoes previously stored at 5 °C, using heat treatment and radiation UV (UV-C). Revista Brasileira de Fruticultura. 38, 053-063. doi: 10.1590/0100-2945-123/14 [ Links ]
Alvindia, D. G., & Acda, M. A. (2015). Revisiting the efficacy of hot water treatment in managing anthracnose and stem-end rot diseases of mango cv. ‘Carabao’. Crop Protection. 67, 96-101. doi: 10.1016/j.cropro.2014.09.016 [ Links ]
Barman, K., Asrey, R., Pal, R. K., Jha, S. K., & Bhatia, K. (2014). Post-harvest nitric oxide treatment reduces chilling injury and enhances the shelf-life of mango (Mangifera indica L.) fruit during low-temperature storage. Journal of Horticultural Science & Biotechnology, 89(3), 253-260. doi: 10.1080/14620316.2014.11513076 [ Links ]
Bradford, M. M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemitry. 72, 248-254. doi: 10.1016/0003-2697(76)90527-3 [ Links ]
Chávez-Sánchez, I., Carrillo-López, A., Vega-García, M., & Yahia, E. M. (2013). The effect of antifungal hot-water treatments on papaya postharvest quality and activity of pectinmethylesterase and po- lygalacturonase. Journal Food Science and Technology, 50, 101-107. doi: 10.1007/s13197-011-0228-0 [ Links ]
Chongchatuporn, U., Ketsa, S., & van Doorn, W. G. (2013). Chilling injury in mango (Mangifera indica) fruit peel: Relationship with ascorbic acid concentrations and antioxidant enzyme activities. Postharvest Biology and Technology, 86, 409-417. doi: 10.1016/j.postharvbio.2013.07.023 [ Links ]
Concellón, A., Zaro, M. J., Chaves, A. R., & Vicente, A. R. (2012). Changes in quality and phenolic antioxidants in dark purple American eggplant (Solanum melongena L. cv. Lucía) as affected by storage at 0 °C and 10 °C. Postharvest Biology and Technology, 66, 35-41. doi: 10.1016/j.postharvbio.2011.12.003 [ Links ]
Crisosto, C. H., Crisosto, G. M., Brecht, J., Sargent, S., Kader, A., Mitcham, E., Maul, F., Brecht, P., Osuna, J., Kihlstadius, D., Menocal, O, González-Moscoso, S., Huag, M., Makani, O., & Resende-Nassur, R. (2009). Mango handling and ripening protocol. USA: National Mango Board. Retrieved from https://www.mango.org/wp-content/uploads/2017/10/Mango_Handling_and_Ripening_Protocol_Eng.pdf [ Links ]
Cruz, J. N., Soares, C. A., Fabbri, A. D., Cordenunsi, B. R., & Sabato, S. F. (2012). Effect of quarantine treatments on the carbohydrate and organic acid content of mangoes (cv. Tommy Atkins). Radiation Physics and Chemistry, 81, 1059-1063. doi: 10.1016/j.radphyschem.2012.02.026 [ Links ]
de Mello-Vasconcelos, O. C., Duarte, D., de Castro-Silva, J., Oliveros-Mesa, N. F., Teruel-Mederos, B. J., & Tonetyo-de Freiras, S. (2019). Modeling ‘Tommy Atkins’ mango cooling time based on fruit physicochemical quality. Scientia Horticulturae, 244, 413-420. doi: 10.1016/j.scienta.2018.09.068 [ Links ]
Dea, S., Brecht, J. K., Nunes, M. C., & Baldwin, E. A. (2010). Quality of fresh-cut “Kent” mango slices prepared from hot water or non-hot water-treated fruit. Postharvest Biology and Technology, 56(2), 171-180. doi: 10.1016/j.postharvbio.2010.01.007 [ Links ]
Dessalegn, Y., Ayalew, A., & Woldetsadik, K. (2013). Integrating plant defense inducing chemical, inorganic salt and hot water treatments for the management of postharvest mango anthracnose. Postharvest Biology and Technology, 85, 83-88. doi: 10.1016/j.postharvbio.2013.05.003 [ Links ]
Díaz-Corona, D. A., López-López, M. E., Ayón-Reyna, L. E., López-Velázquez, J. G., López-Zazueta, B. A., & Vega-García, M. O. (2020). Impact of hot water-calcium on the activity of the cell wall degrading and antioxidant system enzymes in mango stored at chilling temperature. Journal of Food Biochemistry, 44(8), 13286. doi: 10.1111/jfbc.13286 [ Links ]
Food and Agriculture Organization (FAO). (2021). Agricultural data FAOSTAT. USA: FAO. Retrieved January, 2021 from http://www.faostat.org [ Links ]
Fogelman, E., Kaplan, A., Tanami, Z., & Ginzberg, I. (2011). Antioxidative activity associated with chilling injury tolerance of muskmelon (Cucumis melo L.) rind. Scientia Horticulturae, 128(3), 267-273. doi: 10.1016/j.scienta.2011.01.034 [ Links ]
Ghasemnezhad, M., Marsh, K., Shilton, R., Babalar, M., & Woolf, A. (2008). Effect of hot water treatments on chilling injury and heat damage in ‘Satsuma’ mandarins: Antioxidant enzymes and vacuolar ATPase, and pyrophosphatase. Postharvest Biology and Technology, 48, 364-371. doi: 10.1016/j.postharvbio.2007.09.014 [ Links ]
Hodges, D. M., de Long, J. M., Forney, C. F., & Prange, R. K. (1999). Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds. Planta, 207, 604-611. doi: 10.1007/s004250050524 [ Links ]
Hossain, A., Rana, M., Kimura, Y., & Roslan, H. A. (2014). Changes in biochemical characteristics and activities of ripening associated enzymes in mango fruit during the storage at different temperatures. BioMed Research International, 2014, 1-11. doi: 10.1155/2014/232969 [ Links ]
Jacobi, K. K., Macrae, E. A., & Hetherington, S. E. (2000). Effects of hot air conditioning of “Kensington” mango fruit on the response to hot water treatment. Postharvest Biology and Technology, 21, 39-49. doi: 10.1016/S0925-5214(00)00163-0 [ Links ]
Jin, P., Zheng, Y., Tang, S., Rui, H., & Wang, C. Y. (2009). A combination of hot air and methyl jasmonate vapor treatment alleviates chilling injury of peach fruit. Postharvest Biology and Technology, 52, 24-29. doi: 10.1016/j.postharvbio.2008.09.011 [ Links ]
Khaliq, G., Muda-Mohamed, M. T., Ghazali, H. M., Ding, P., & Ali, A. (2016). Influence of gum arabic coating enriched with calcium chloride on physiological, biochemical and quality responses of mango (Mangifera indica L.) fruit stored under low temperature stress. Postharvest Biology and Technology, 111, 362-369. doi: 10.1016/j.postharvbio.2015.09.029 [ Links ]
Kim, Y., Lounds-Singleton, A. J., & Talcott, S. T. (2009). Antioxidant phytochemical and quality changes associated with hot water immersion treatment of mangoes (Mangifera indica L.). Food Chemistry. 115, 989-993. doi: 10.1016/j.foodchem.2009.01.019 [ Links ]
Le, T. N., Shiesh, C. C., & Lin, H. L. (2010). Effect of vapor heat and hot water treatments on disease incidence and quality of Taiwan native strain mango fruits. International Journal Agriculture and Biology, 12(5), 673-678. doi: 10-198/DAK/2010/12-5-673-678 [ Links ]
Li, P., Zheng, X., Liu, Y., & Zhu, Y. (2014). Pre-storage application of oxalic acid alleviates chilling injury in mango fruit by modulating proline metabolism and energy status under chilling stress. Food Chemistry, 142, 72-78. doi: 10.1016/j.foodchem.2013.06.132 [ Links ]
López-López, M. E., López-Valenzuela, J. A., Delgado-Vargas, F., López-Angulo, G., Carrillo-López, A., Ayón-Reyna, L. E., & Vega-García, M. O. (2018). A treatment combining hot water with calcium lactate improves the chilling injury tolerance of mango fruit. Horticultural Science, 53(2), 217-223. doi: 10.21273/HORTSCI12575-17 [ Links ]
Ma, Q., Suo, J., Huber, D. J., Dong, X., Han, Y., Zhang, Z., & Rao, J. (2014). Effect of hot water treatments on chilling injury and expression of a new C-repeat binding factor (CBF) in 'Hongyang' kiwifruit during low temperature storage. Postharvest Biology and Technology, 97, 102-110. doi: 10.1016/j.postharvbio.2014.05.018 [ Links ]
Mahto, R., & Das, M. (2013). Effect of gamma irradiation on the physico-chemical and visual properties of mango (Mangifera indica L.), cv. ‘Dushehri’ and ‘Fazli’ stored at 20 °C. Postharvest Biology and Technology, 86, 447-455. doi: 10.1016/j.postharvbio.2013.07.018 [ Links ]
Malacrida, C., Valle, E. M., & Boggio, S. B. (2006). Postharvest chilling induces oxidative stress response in the dwarf tomato cultivar Micro-Tom. Physiology Plant, 127, 10-18. doi: 10.1111/j.1399-3054.2005.00636.x [ Links ]
Mirdehghan, S. H., Rahemi, M., Martínez-Romero, D., Guillén, F., Valverde, J. M., Zapata, P. J., & Valero, D. (2007). Reduction of pomegranate chilling injury during storage after heat treatment: Role of polyamines. Postharvest Biology and Technology, 44, 19-25. doi: 10.1016/j.postharvbio.2006.11.001 [ Links ]
Nasef, I. N. (2018). Short hot water as safe treatment induces chilling tolerance and antioxidant enzymes, prevents decay and maintains quality of cold-stored cucumbers. Postharvest Biology and Technology, 138, 1-10. doi: 10.1016/j.postharvbio.2017.12.005 [ Links ]
Nyanjage, M. O., Wainwright, H., & Bishop, C. F. (1999). Effects of hot-water treatment and storage temperature on electrolyte leakage of mangoes (Mangifera indica Linn.). Journal of Horticultural Science and Biotechnology, 74(5), 566-572. doi: 10.1080/14620316.1999.11511154 [ Links ]
Safizadeh, M. R., Rahemi, M., & Aminlari, M. (2007). Effect of postharvest calcium and hot-water dip treatments on catalase, peroxidase, and superoxide dismutase in chilled lisbon lemon fruit. International Journal of Agricultural Research, 2(5), 440-449. doi: 10.3923/ijar.2007.440.449 [ Links ]
Sala, J. M., & Lafuente, T. (2000). Catalase enzyme activity is related to tolerance of mandarin fruits to chilling. Postharvest Biology and Technology, 20, 81-89. doi: 10.1016/S0925-5214(00)00115-0 [ Links ]
Shadmani, N., Ahmad, S. H., Saari, N., Ding, P., & Tajidin, N. E. (2015). Chilling injury incidence and antioxidant enzyme activities of Carica papaya L. ‘Frangi’ as influenced by postharvest hot water treatment and storage temperature. Postharvest Biology and Technology, 99, 114-119. doi: 10.1016/j.postharvbio.2014.08.004 [ Links ]
Shao, X., & Tu, K. (2012). Hot air treatment improved the chilling resistance of loquat fruit under cold storage. Journal of Food Processing and Preservation, 38(2014), 694-703. doi: 10.1111/jfpp.12019 [ Links ]
Soleimani-Aghdam, M., Jannatizadeh, A., Sheikh-Assadi, M., & Malekzadeh, P. (2016). Alleviation of postharvest chilling injury in anthurium cut flowers by salicylic acid treatment. Scientia Horticulturae, 202, 70-76. doi: 10.1016/j.scienta.2016.02.025 [ Links ]
Ummarat, N., Matsumoto, T. K., Wall, M. M., & Seraypheap, K. (2011). Changes in antioxidants and fruit quality in hot water-treated “Hom Thong” banana fruit during storage. Scientia Horticulturae, 130(4), 801-807. doi: 10.1016/j.scienta.2011.09.006 [ Links ]
U.S. Department of Agriculture (USDA-APHIS). (2014). Treatment schedules. Retrieved June 15, 2014 from <https://www.aphis.usda.gov/aphis/ourfocus/planthealth/import-information/sa_quarantine_ treatments/ct_quarantine-treatment> [ Links ]
Vicente, A. R., Martínez, G. A., Chaves, A. R., & Civello, P. M. (2006). Effect of heat treatment on strawberry fruit damage and oxidative metabolism during storage. Postharvest Biology and Technology, 40(2), 116-122. doi: 10.1016/j.postharvbio.2005.12.012 [ Links ]
Wang, B., Wang, J., Liang, H., Yi, J., Zhang, J., Lin, L., Wu, Y., Feng, X., Cao, J., & Jiang, W. (2008). Reduced chilling injury in mango fruit by 2,4-dichlorophenoxyacetic acid and the antioxidant response. Postharvest Biology and Technology, 48, 172-181. doi: 10.1016/j.postharvbio.2007.10.005 [ Links ]
Wang, J., Mao, L., Li, X., Zhang, H., Zhang, M., & Ju, G. (2016). Reduction of active oxygen metabolism and mitigation of chilling injury in Hami melon fruit as influenced by postharvest hot water treatment. Nongye Gongcheng Xuebao/Transactions of the Chinese Society of Agricultural Engineering, 32(2), 280-286. doi: doi.org/10.11975/j.issn.1002-6819.2016.02.040 [ Links ]
Zaharah, S.S., & Singh, Z. (2011). Postharvest nitric oxide fumigation alleviates chilling injury, delays fruit ripening and maintains quality in cold-stored ‘Kensington Pride’ mango. Postharvest Biology and Technology, 60, 202-210. doi: 10.1016/j.postharvbio.2011.01.011 [ Links ]
Zhang, M., Liu, W., Li, C., Shao, C., Jiang, X., Zhao, H., & Ai, W. (2019) Postharvest hot water dipping and hot water forced convection treatments alleviate chilling injury for zucchini fruit during cold storage. Scientia Horticulturae. 249, 219-227. doi: 10.1016/j.scienta.2019.01.058 [ Links ]
Zhang, X., Shen, L., Li, F., Meng, D., & Sheng, J. (2013). Arginase induction by heat treatment contributes to amelioration of chilling injury and activation of antioxidant enzymes in tomato fruit. Postharvest Biology and Technology, 79, 1-8. doi: 10.1016/j.postharvbio.2012.12.019 [ Links ]
Zhang, Z., Nakano, K., & Maezawa, S. (2009). Comparison of the antioxidant enzymes of broccoli after cold or heat shock treatment at different storage temperatures. Postharvest Biology and Technology, 54, 101-105. doi: 10.1016/j.postharvbio.2009.05.006 [ Links ]
Zhang, Z., Gao, Z., Li, M., Hu, M., Gao, H., & Yang, B. (2012). Hot water treatment maintains normal ripening and cell wall metabolism in mango (Mangifera indica L.) fruit. HortScience, 47, 1466-1471. doi: 10.21273/HORTSCI.47.10.1466 [ Links ]
Zhang, Z., Zhu, Q., Hu, M., Gao, Z., An, F., Li, M., & Jiang, Y. (2017). Low-temperature conditioning induces chilling tolerance in stored mango fruit. Food Chemistry, 219, 76-84. doi: 10.1016/j.foodchem.2016.09.123 [ Links ]
Recibido: 28 de Marzo de 2022; Aprobado: 12 de Agosto de 2022











 texto em
texto em 



