Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.28 no.3 Chapingo sep./dic. 2022 Epub 13-Dic-2022
https://doi.org/10.5154/r.rchsh.2022.03.003
Artículo científico
Alternaria alternata, Fusarium oxysporum y Fusarium verticillioides agentes causales de la pudrición de brócoli en México
1Universidad Politécnica de Pénjamo. Carretera Irapuato - La Piedad km 44, El Derramadero, Pénjamo, Guanajuato, C. P. 36921, MÉXICO.
2Universidad de Sonora, Departamento de Agricultura y Ganadería. Carretera Bahía de Kino km 21, Hermosillo, Sonora, C. P. 83340, MÉXICO.
3Universidad Estatal de Sonora, Ingeniería en Horticultura. Av. Ley federal del trabajo s/n, Hermosillo, Sonora, C. P. 83000, MÉXICO.
El brócoli es una de las hortalizas de mayor importancia económica en México, y una de las enfermedades que reduce su rendimiento y calidad es la pudrición del florete, la cual se ha asociado a diferentes fitopatógenos. El objetivo del presente trabajo fue identificar morfológica y molecularmente a los agentes causales de la pudrición del florete en el cultivo de brócoli en México. Se colectaron floretes con síntomas de pudrición en diferentes municipios del estado de Guanajuato (León, San Francisco del Rincón, Valle de Santiago, Abasolo, Juventino Rosas y Dolores Hidalgo). Los aislados obtenidos se identificaron con base en sus características culturales, morfológicas y moleculares (mediante PCR-ITS) como Alternaria alternata (AA), Fusarium oxysporum (FO) y Fusarium verticillioides (FV). La patogenicidad de estas especies fúngicas se corroboró mediante los postulados de Koch. La frecuencia de aislamiento de los hongos fue de 55, 26 y 19 % para AA, FV y FO, respectivamente, del total de muestras analizadas. La secuencia obtenida de un aislado representativo de cada hongo se comparó con las reportadas en el banco de genes del NCBI, donde los mayores porcentajes de similitud fueron 99.6, 98.9 y 98.2 % para FO, FV y AA, respectivamente, con lo cual se confirmaron los resultados de la identificación morfológica. Este es el segundo reporte de la presencia de AA y FO asociados a la pudrición del florete de brócoli en México, y el primer reporte de FV como parte del complejo de agentes causales de esta enfermedad.
Palabras clave Brassica oleracea var. italica; identificación morfológica; necrosis; PCR; ITS
Broccoli is one of the most economically important vegetables in Mexico, and one of the diseases that reduces its yield and quality is head rot, which has been associated with different phytopathogens. The objective of this study was to morphologically and molecularly identify the causal agents of head rot in broccoli cultivation in Mexico. Florets with rot symptoms were collected in different municipalities of the state of Guanajuato (León, San Francisco del Rincón, Valle de Santiago, Abasolo, Juventino Rosas and Dolores Hidalgo). The isolates obtained were identified based on their cultural, morphological and molecular characteristics (by PCR-ITS) as Alternaria alternata (AA), Fusarium oxysporum (FO) and Fusarium verticillioides (FV). The pathogenicity of these fungal species was corroborated by Koch's postulates. The fungal isolation frequency was 55, 26 and 19 % for AA, FV and FO, respectively, of the total samples analyzed. The sequence obtained from a representative isolate of each fungus was compared with those reported in the NCBI gene bank, where the highest similarity percentages were 99.6, 98.9 and 98.2 % for FO, FV and AA, respectively, thus confirming the morphological identification results. This is the second report of the presence of AA and FO associated with broccoli head rot in Mexico, and the first report of FV as part of the complex of causal agents of this disease.
Keywords Brassica oleracea var. italica; morphological identification; necrosis; PCR; ITS
Introducción
El brócoli (Brassica oleracea var. italica) es una de las hortalizas de mayor importancia económica en México, después del chile verde (Capsicum annuum L.), la papa (Solanum tuberosum L.), la cebolla (Allium cepa L.), el jitomate (Lycopersicum esculentum Mill.) y la sandía (Citrullus lanatus). En 2020 se cultivaron 33,930 ha de brócoli en México, con una producción total de 583,645 t (Secretaría de Agricultura y Desarrollo Rural - Servicio de Información Agroalimentaria y pesquera [SADER-SIAP], 2020). Actualmente, el principal estado productor es Guanajuato, con 24,233 ha de brócoli.
Al igual que en muchas especies vegetales, las enfermedades causadas por fitopatógenos son un problema significativo para la producción de crucíferas alrededor del mundo (Akram et al., 2020; Dillard, Cobb & Lamboy, 1998; Fraire-Cordero et al., 2010; Pattanamahakul & Strange, 1999). En México y varias partes del mundo, una de las enfermedades que reduce el rendimiento y la calidad del brócoli es la pudrición del florete, la cual se presenta cuando coincide el desarrollo del cultivo con precipitaciones pluviales superiores a 10 mm (con temperatura aproximada de 30 °C y humedad relativa de 70 %), y el problema se agrava si esto ocurre en el momento de cosecha. Las pérdidas ocasionadas por esta enfermedad son superiores al 40 % (Editorial Agro Cultivos S. C de R. L. de C. V. [EAC], 2017).
Dicha enfermedad se ha asociado a diferentes fitopatógenos en distintas regiones. En 2009 se reportó al hongo Alternaria brassicicola como agente causal de la pudrición de floretes de brócoli en la provincia de Shanghai, China (Liu et al., 2009), mientras que Li et al. (2009) identificaron a la bacteria Pseudomonas fluorescens en campos de brócoli con síntomas de pudrición en la provincia de Zhejiang. En otro estudio se aisló e identificó a Alternaria alternata en floretes de brócoli con el mismo síntoma en Tanggu, distrito de Tianjin, China (Guo, Cui, Zhu, Song, & Wang, 2015). Finalmente, en 2018 se publicó el primer reporte de Fusarium tricinctum como causante de la pudrición en el mismo cultivo en la provincia de Hubei (Zhao, Li, Yan, Huang, & Zheng, 2018).
En México, el trabajo de Fraire-Cordero et al. (2010) es un antecedente importante para la investigación y conocimiento de la pudrición de florete en el cultivo de brócoli. En esa investigación se reportó la presencia de Alternaria tenuissima, Alternaria alternata y Fusarium oxysporum como hongos causantes de dicha enfermedad en brócoli de las variedades comerciales Marathon, Patron (Compañía Sakata) y ‘Monaco’ (Compañía Syngenta-Rogers) en Guanajuato, específicamente en el municipio de Apaseo el Grande. A pesar de la importancia de este reporte, la investigación estuvo restringida a una sola área geográfica, de ahí la necesidad actual de aumentar el área de estudio para generar información a nivel regional de los fitopatógenos involucrados en el desarrollo de esta enfermedad en el estado de Guanajuato.
Ochoa, Hernández-Montiel, Latisnere-Barragán, León-de la Luz, y Larralde-Corona (2007) señalan que el estudio de los agentes causales de enfermedades a nivel mundial sugiere que la problemática de cada región es distinta, tanto por cuestiones de manejo, como por condiciones de suelo y clima. Por lo anterior, y dado que la pudrición del florete puede ser ocasionada por diferentes patógenos, es fundamental identificar y caracterizar a los microorganismos asociados con la pudrición de florete en cada región. Esto permitiría generar información sobre la frecuencia e importancia de dichos patógenos, con la finalidad de hacer un diagnóstico correcto de la enfermedad, ya que de esto depende, en gran medida, la elección de un método de manejo apropiado que pueda evitar daños y pérdidas severas del cultivo.
Con base en lo anterior, el objetivo del presente trabajo fue identificar, morfológica y molecularmente, a los agentes causales de la pudrición del florete de brócoli en los municipios de León, San Francisco del Rincón, Valle de Santiago, Abasolo, Juventino Rosas y Dolores Hidalgo del estado de Guanajuato, México.
Materiales y métodos
Colecta de muestras
Durante julio y agosto de 2017, se colectaron 64 floretes de brócoli de la variedad Avenger (Compañía Sakata), en etapa de cosecha con síntomas de pudrición, en los municipios de León (16 floretes), San Francisco del Rincón (10 floretes), Valle de Santiago (12 floretes), Abasolo (9 floretes), Juventino Rosas (9 floretes) y Dolores Hidalgo (8 floretes), Guanajuato, México. Las muestras se trasladaron al laboratorio de microbiología de la Universidad Politécnica de Pénjamo. A su llegada, las muestras se almacenaron a 4 °C y se procesaron en un periodo máximo de 24 h.
Aislamiento e identificación morfológica del agente causal
Los floretes colectados se lavaron con agua corriente y se realizaron cortes de tejido para la prueba de flujo bacteriano, la cual consistió en colocar los trozos en un tubo de ensayo que contenía 3 mL de agua destilada estéril y agitar por 5 min (Jiménez, Contreras, & Nass, 2004).
Descartada la presencia de flujo bacteriano, se realizaron aislamientos. Para ello, se tomaron secciones pequeñas (1 cm2) de cada florete de brócoli, se desinfestaron con hipoclorito de sodio al 1.5 % durante 2 min, se lavaron tres veces con agua destilada estéril y se colocaron en papel secante esterilizado. Posteriormente, los trozos se colocaron en cajas de Petri con medio papa dextrosa agar (PDA) y se incubaron a 28 °C durante 7 días. Cada colonia fúngica desarrollada se aisló y purificó mediante cultivo monospórico.
De las muestras de brócoli, con síntomas de pudrición del florete, se aislaron tres grupos de cepas fúngicas con características diferentes. Un grupo presentó características morfológicas similares a Alternaria alternata (AA) (Chen & Zhong, 2017), mientras que los otros dos se identificaron como Fusarium oxysporum (FO) (Leslie & Summerell, 2006) y Fusarium verticillioides (FV) (Morales-Rodríguez, Yáñez-Morales, Silva-Rojas, García-de los Santos, & Guzmán-de Peña, 2007). De cada grupo se seleccionaron dos aislamientos representativos para realizar las pruebas de patogenicidad.
Pruebas de patogenicidad
Se utilizaron plantas sanas de brócoli variedad Avenger (Compañía Sakata) producidas bajo condiciones de invernadero (28 ± 2 °C y humedad relativa de 70 %). Para ello, se sembraron semillas de brócoli en macetas de plástico que contenían una mezcla de sustrato de peat moss, perlita y vermiculita, en una proporción de 70, 20 y 10 % (v/v), respectivamente. Las plantas se regaron constantemente con agua destilada y se fertilizaron dos veces por semana (100 mg·L-1 de N, 44 mg·L-1 de P y 83 mg·L-1 de K), hasta el desarrollo del florete, momento en el cual se inocularon los aislados.
La inoculación se realizó con los aislamientos seleccionados de AA (León y San Francisco del Rincón), FO (Juventino Rosas y Dolores Hidalgo) y FV (Juventino Rosas y Valle de Santiago), desarrollados en medio de cultivo carbonato de calcio para AA, y medio PDA para FO y FV. Después de 15 días de incubación a 28 °C, se prepararon suspensiones conidiales en agua destilada estéril a una concentración de 1 x 106 conidios·mL-1. Para la inoculación, se realizó una herida sobre la superficie de cada florete (domo) con una aguja hipodérmica esterilizada, y se colocaron 100 µL de cada suspensión conidial sobre cada herida.
Se utilizaron 10 plantas por aislado inoculado y 10 plantas como testigo (a las cuales se les realizaron heridas similares a las descritas con anterioridad, pero se inocularon con agua destilada estéril), bajo un arreglo completamente al azar. Todas las plantas se cubrieron con bolsas de polietileno transparente para asegurar una alta humedad relativa (cercana al 100 %) y facilitar el proceso de infección. A las 72 h se retiraron las bolsas y las plantas se mantuvieron en el invernadero bajo las condiciones descritas anteriormente (28 ± 2 °C y humedad relativa de 70 %) hasta el desarrollo de los síntomas. El ensayo se realizó por triplicado. Al final de cada experimento (25 días post-inoculación), los hongos se reaislaron de los floretes infectados para completar los postulados de Koch.
Extracción de ADN
A partir de aislados purificados, se realizó la extracción de ADN utilizando el protocolo de CTAB al 3 % (Zhang, Uyemoto, & Kirkpatrick, 1998), con algunas modificaciones. Se transfirió un trozo de micelio a un tubo de 1.5 mL y se maceró con 800 µL de buffer de extracción CTAB (3 % de bromuro de hexadeciltrimetilamonio, 1.4 M de NaCl, 20 mM de EDTA, 100 mM de Tris-HCl, pH de 8 y 0.2 % de mercapto-etanol) precalentado a 60 °C; posteriormente, la mezcla se incubó a 60 °C durante 30 min. Las muestras se extrajeron con cloroformo-alcohol isoamílico (24:1), se les agregaron 15 µL de RNAsa A (1 µg·µL-1) y se incubaron a 37 °C durante 10 min. La capa acuosa de ADN se precipitó con 600 µL de isopropanol a -20 °C. La pastilla de ADN se lavó con etanol al 70 % y se secó a temperatura ambiente.
La cantidad y la pureza de las muestras de ADN se evaluó por medio de un espectrofotómetro NanoDrop (ND-1000-UV-Vis, NanoDrop Technologies, EUA). Finalmente, el ADN obtenido se almacenó a -20 °C para su posterior análisis.
Identificación molecular del agente causal
Para la amplificación de las regiones del espaciador transcrito interno (ITS, por sus siglas en inglés) del ADN de los aislados obtenidos, se utilizó la técnica de la reacción en cadena de la polimerasa (PCR, por sus siglas en inglés) con los primers universales ITS1 (5’TCCGTAGGTGAACCTGCGG3’) e ITS4 (5’ TCCTCCGCTTATTGATATGC3’), los cuales amplifican una región de 500 a 750 pb (White, Bruns, Lee, & Taylor, 1990).
La PCR se realizó en tubos eppendorf de 0.2 mL, con un volumen total de reacción de 25 µL que contenía 1 µL de ADN, 1X de buffer, 2 mM de MgCl2, 0.2 µM de cada primer, 0.2 mM de cada nucleótido trifosfatado (dNTP) y 1 unidad de Taq polimerasa (Invitrogen Life Technologie, Brasil). La reacción se llevó a cabo en un termociclador automático (C1000 Thermal Cycler, BioRad, EUA), con un ciclo de desnaturalización a 95 °C durante 4 min, 30 ciclos sucesivos de PCR de tres fases (desnaturalización a 95 °C durante 1 min, alineación a 60 °C durante 1 min y elongación a 72 °C durante 2 min) y un ciclo de extensión final a 72 °C durante 5 min.
Los productos de la PCR se analizaron mediante electroforesis en geles de agarosa al 1 %, teñidos con bromuro de etidio (2 mg·µL-1), y visualizados en un transiluminador UV (Gel Doc XR+ Gel Documentation System, Bio-Rad, EUA). Finalmente, los productos de la PCR se purificaron con el kit de E.Z.N.A® Cycle Pure (P692-02, Omega, EUA), siguiendo las especificaciones del fabricante, y se secuenciaron (ABI PRISM 377, Applied Biosystems, EUA). Las secuencias obtenidas se compararon contra todas las reportadas en la base de datos del banco de genes del NCBI (National Center for Biotechnology Information, www.ncbi.nih.gov) mediante el programa BLAST.
Análisis filogenético
El método Clustal W (Thompson, Higgins, & Gibson, 1994) se utilizó para alinear las secuencias ITS de los aislados de Fusarium, junto con 27 secuencias representativas de distintas especies de ese género reportadas en el banco de genes del NCBI. Las secuencias ITS de Alternaria alternata también se alinearon con otras especies de Alternaria del banco de genes. Los árboles filogenéticos se construyeron por el método de máxima verosimilitud utilizando el programa MEGA versión 11 (Tamura, Stecher, & Kumar, 2021). La estabilidad de los nodos se estimó por análisis de confianza (bootstrap) de 1,000 réplicas.
Resultados y discusión
Aislamiento e identificación morfológica del agente causal
De los 64 floretes de brócoli con síntomas de pudrición colectados en campo (Figura 1), se obtuvieron 185 aislados fúngicos: 102 se identificaron como Alternaria alternata y 83 presentaron características del género Fusarium (35 se identificaron como Fusarium oxysporum y 48 como Fusarium verticillioides).
El hongo A. alternata se aisló con una frecuencia del 55 % y presentó las siguientes características morfológicas en medio PDA: micelio de color café o verde oliva oscuro (Figura 2A), conidios obclavados, muriformes, elípticos u ovoides en cadenas (de 1 a 5 septas transversales y 0 a 3 longitudinales, de 13.22 a 50.30 µm de largo y de 8.7 a 13.3 µm de ancho) (Figura 2B y 2C) (Chen & Zhong, 2017).
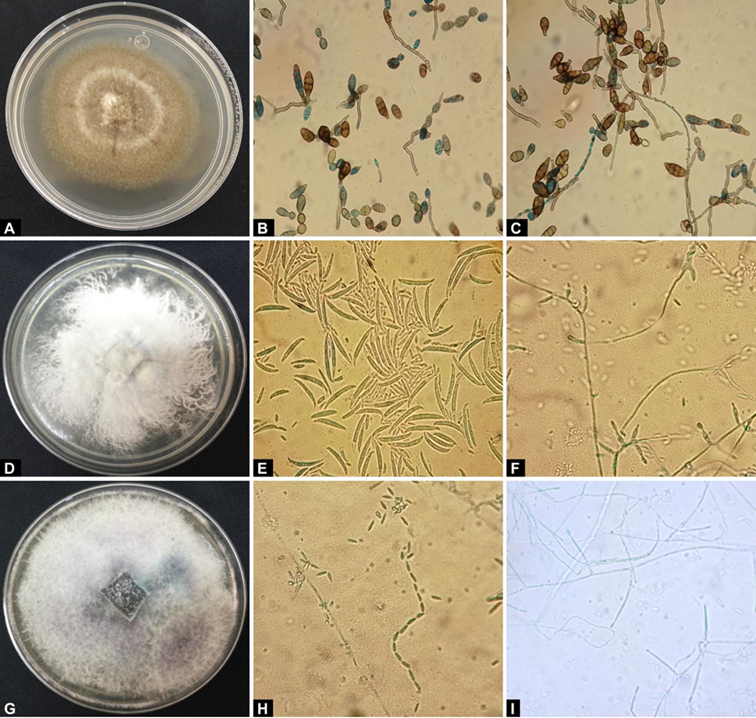
Figura 2 Análisis macroscópico y microscópico de aislamientos fúngicos causantes de la pudrición de brócoli: A) crecimiento micelial de A. alternata (aislado L1-3F-A4) en medio PDA, B) y C) características morfológicas típicas de A. alternata, D) crecimiento micelial de F. oxysporum (aislado L1-8F-A1) en medio PDA, E) y F) características morfológicas típicas de F. oxysporum, G) crecimiento micelial de F. verticillioides (aislado L7-5F-A3) en medio PDA, y H) e I) características morfológicas típicas de F. verticillioides.
Para los hongos del género Fusarium, F. oxysporum se aisló con una frecuencia del 19 % y presentó las siguientes características morfológicas en medio PDA: micelio de color rosa (Figura 2D), macroconidios alargados, curvos y extremos puntiagudos (con tres a cinco células de 28.76 a 40.5 µm de largo y 3.9 a 4.2 µm de ancho) (Figura 2E), microconidios de forma oval (de 5.2 a 7.5 µm de largo y 1.8.1 a 2.2 µm de ancho) y fiálides cortas (Figura 2 F). De acuerdo con estas características culturales y morfológicas, los aislados se identificaron como Fusarium oxysporum (Leslie & Summerell, 2006).
En el caso de F. verticillioides, éste se aisló con una frecuencia del 26 % y presentó las siguientes características en medio PDA: micelio de color blanco con tonalidad púrpura en el centro de la caja (Figura 2G), macroconidios escasos (cuando presentes fueron largos, ligeramente rectos, y célula apical curva y otra basal en forma de pie con tres a cinco septas), microconidios abundantes (en cadenas largas, ovaladas y base aplanada) (Figura 2H y 2I) y clamidosporas ausentes (Morales-Rodríguez et al., 2007).
Con base en estos resultados, se puede inferir que el principal agente fitopatógeno que causa la pudrición del florete en el cultivo del brócoli en el estado de Guanajuato es A. alternata, con una frecuencia de aislamiento de más de la mitad (55 %) de las muestras analizadas en este estudio. En este sentido, es importante mencionar que no se detectó la presencia bacterias en ninguna muestra analizada, esto mediante la prueba de flujo bacteriano.
Pruebas de patogenicidad
Los floretes de brócoli inoculados con suspensiones conidiales de los aislados AA, FO y FV mostraron síntomas de pudrición (Figura 3A, 3B y 3C). El desarrollo de pequeñas lesiones oscuras inició 10 días después de la inoculación, y éstas aumentaron de tamaño hasta cubrir todo el florete entre los 20 y 25 días post-inoculación. Los floretes testigo no desarrollaron síntomas de la enfermedad (Figura 3D).

Figura 3 Sintomatología inducida por inoculación de hongos fitopatógenos en floretes de brócoli: A) pudrición en brócoli inducida por A. alternata (aislado L1-3F-A4), B) pudrición en brócoli inducida por F. oxysporum (aislado L1-8F-A1), C) pudrición en brócoli inducida por F. verticillioides (aislado L7-5F-A3) y D) planta control.
Para cumplir con los postulados de Koch, se realizaron aislamientos a partir de tejido sintomático; AA, FO y FV fueron reaislados a partir de tejido inoculado, confirmando así su patogenicidad y su importancia como agentes causales de la pudrición del florete en brócoli en los municipios de Guanajuato evaluados en el presente estudio.
Alternaria alternata es, principalmente, un hongo saprófito común en suelo y tejido vegetal en descomposición (Thoma, 2003). No obstante, ha sido reportado como patógeno de diferentes cultivos de importancia agronómica alrededor del mundo, como la papa en Israel (Droby, Dinoor, Prusky, & Barkai-Golan, 1984), el tomate en California (Morris, Connolly, & Clair, 2000), el durazno en Japón (Inoue & Nasu, 2000) y los cítricos en China (Huang et al., 2015), en los cuales induce síntomas como manchas foliares, lesiones en frutos, manchas hundidas oscuras en frutos, tizones en ramas, caída de frutos y hojas jóvenes, entre otros síntomas. En China, A. alternata ha sido reportado como uno de los principales patógenos del brócoli, al causar clorosis y pudriciones, lo cual provoca una mayor senescencia y una menor vida útil del producto (Guo et al., 2015). Además del florete, este hongo puede afectar severamente al follaje del brócoli, provocando manchas foliares circulares con anillos concéntricos rodeados de un halo amarillo, lo cual causa pérdidas económicas importantes de esta hortaliza (Nira et al., 2022).
En México, A. alternata y F. oxysporum han sido reportados como agentes causales de la pudrición o manchado del brócoli (Fraire-Cordero et al., 2010), específicamente en el municipio de Apaseo el Grande, Guanajuato. En dicho reporte también se destaca la presencia de Alternaria tenuissima como agente causal de la enfermedad, lo cual contrasta con los resultados de la presente investigación, ya que se detectó por primera vez a Fusarium verticillioides como parte del complejo de agentes causales de la enfermedad y no al hongo A. tenuissima. Fraire-Cordero et al. (2010) reportaron que la frecuencia de aislamiento del género Alternaria osciló entre el 70 y 80 %, y del género Fusarium entre el 20 y 30 %. Lo anterior difiere con nuestra investigación, en donde se encontró una frecuencia de aislamiento menor (55 %) para AA y una frecuencia mayor (45 %) para el género Fusarium (FO y FV). Esto se puede deber a que en el presente estudio el muestreo abarcó una región más amplia de zonas productoras de brócoli del estado de Guanajuato (León, San Francisco del Rincón, Valle de Santiago, Abasolo, Juventino Rosas y Dolores Hidalgo), en comparación con un solo municipio (Apaseo el Grande).
La identificación de Fusarium oxysporum y F. verticillioides, como agentes causales de la pudrición del florete de brócoli, representa un paso importante en la búsqueda de estrategias que puedan minimizar el impacto en la producción. En Brassicas, la marchitez por Fusarium (Fusarium oxysporum f. sp. conglutinans) es una de las enfermedades más importantes y devastadoras en repollo, coliflor y brócoli alrededor del mundo (Mehraj et al., 2020). En estos cultivos, Fusarium oxysporum f. sp. conglutinans causa amarillamiento de las hojas, marchitez, defoliación y, eventualmente, la muerte de las plantas infectadas (Liu, Fang, Yang, Zhang, & Lv, 2018; Mehraj et al., 2020). En contraste, Fraire-Cordero et al. (2010) reportaron a Fusarium oxysporum como agente causal de síntomas del manchado y pudrición de florete en brócoli en Guanajuato, México, lo cual coincide con los resultados de nuestro estudio, ya que F. oxysporum es un miembro más del complejo de hongos asociados con la pudrición del florete en nuestro país, por lo que este sería el segundo reporte de la presencia de este patógeno como agente causal de la enfermedad.
El Fusarium verticillioides se ha identificado, principalmente, como patógeno en el cultivo del maíz, en donde produce toxinas en el tejido y grano que dañan la salud de animales y humanos (Duncan & Howard, 2010; Oren, Ezrati, Cohen, & Sharon, 2003). Sin embargo, este hongo también ha sido reportado en otros cultivos. Akram et al. (2020) realizaron el primer reporte de este patógeno en col china (Brassica rapa L. parachinensis), en donde produce síntomas de pudrición en hojas y flores. Adicionalmente, en el presente estudio, las pruebas de patogenicidad con Fusarium verticillioides, aislado a partir de floretes con síntomas de pudrición, confirmaron que este hongo forma parte del complejo de agentes causales de esta enfermedad, siendo este el primer reporte en México y en el mundo.
Identificación molecular del agente causal
La amplificación por PCR del ADN extraído de los aislados permitió obtener amplicones de aproximadamente 546 y 573 pb de la región ITS de Fusarium spp. y Alternaria alternata, respectivamente (datos no mostrados). Una parte de los productos de PCR purificados fueron secuenciados directamente en ambas direcciones con los primers ITS1 e ITS4. Las secuencias de ADN obtenidas de aislados representativos se depositaron en el banco de genes del NCBI y se obtuvieron los siguientes números de acceso: OL721612, OL721613 y OL721614, para los aislados L7-5F-A3, L1-8F-A1 y L1-3F-A4, respectivamente.
El análisis BLAST reveló que la secuencia del aislado L7-5F-A3 comparte los mayores porcentajes de similitud (98.9 a 98.72 %) con cepas de Fusarium verticillioides aisladas en India (números de accesión MN652651.1, MN652650.1, MN652649.1, MN652645.1, MN652644.1 y MN652643.1), Canadá (número de accesión MG515226.1), China (números de accesión MW928602.1 y MW386816.1), Jordania (números de accesión MN335235.1, MN335234.1, MN335233.1, MN335232.1 y MN335231.1) y Nigeria (número de accesión MT742824.1).
El aislado L1-8F-A1 mostró 99.63 % de identidad con aislados de Fusarium oxysporum identificados en Kenia, China, India y Nigeria (números de accesión MT420633.1, MH707084.1, KU671046.1 y MW260086.1, respectivamente). Finalmente, la secuencia del aislado L1-3F-A4 presentó 98.26 % de similitud con cepas de Alternaria alternata identificadas en Pakistán (número de accesión MN548780.1) y China (números de accesión MH892844.1 y KY397985.1). Lo anterior confirma los resultados encontrados con la identificación morfológica.
Han sido reportados otros fitopatógenos en diferentes regiones del mundo como causantes de síntomas de pudrición en brócoli, tales como la bacteria Peudomonas fluorescens (Li et al., 2009), Alternaria brassicicola (Liu et al., 2009), Alternaria alternata (Fraire-Cordero et al., 2010; Guo et al., 2015), Alternaria tenuissima, Fusarium oxysporum (Fraire-Cordero et al., 2010) y Fusarium tricinctum (Zhao et al., 2018). En la presente investigación se confirma la presencia de Alternaria alternata y Fusarium oxysporum como agentes causales de la pudrición del florete de brócoli, y se reporta por primera vez a Fusarium verticillioides como agente causal de la enfermedad en campos de cultivo en Guanajuato. Este resultado refuerza la necesidad de identificación y caracterización precisa de los fitopatógenos asociados con las enfermedades en cada región para el desarrollo de estrategias de manejo más eficientes.
Análisis filogenético
Las secuencias de las regiones ITS de los aislados de Fusarium asociados con síntomas de pudrición se compararon con 27 secuencias representativas de distintas especies de ese género reportadas en el banco de genes del NCBI (Figura 4A). Las secuencias ITS de Alternaria alternata también se alinearon con otras especies de Alternaria del banco de genes (Figura 4B), y en ambos casos se utilizó Penicillium spp. como grupo externo. El análisis indicó que los aislados L1-8F-A1, L7-5F-A3 y L1-3F-A4 se agruparon en la misma rama filogenética que las cepas pertenecientes a Fusarium oxysporum, Fusarium verticillioides y Alternaria alternata, respectivamente, lo cual concuerda con los resultados encontrados en la identificación morfológica y molecular.
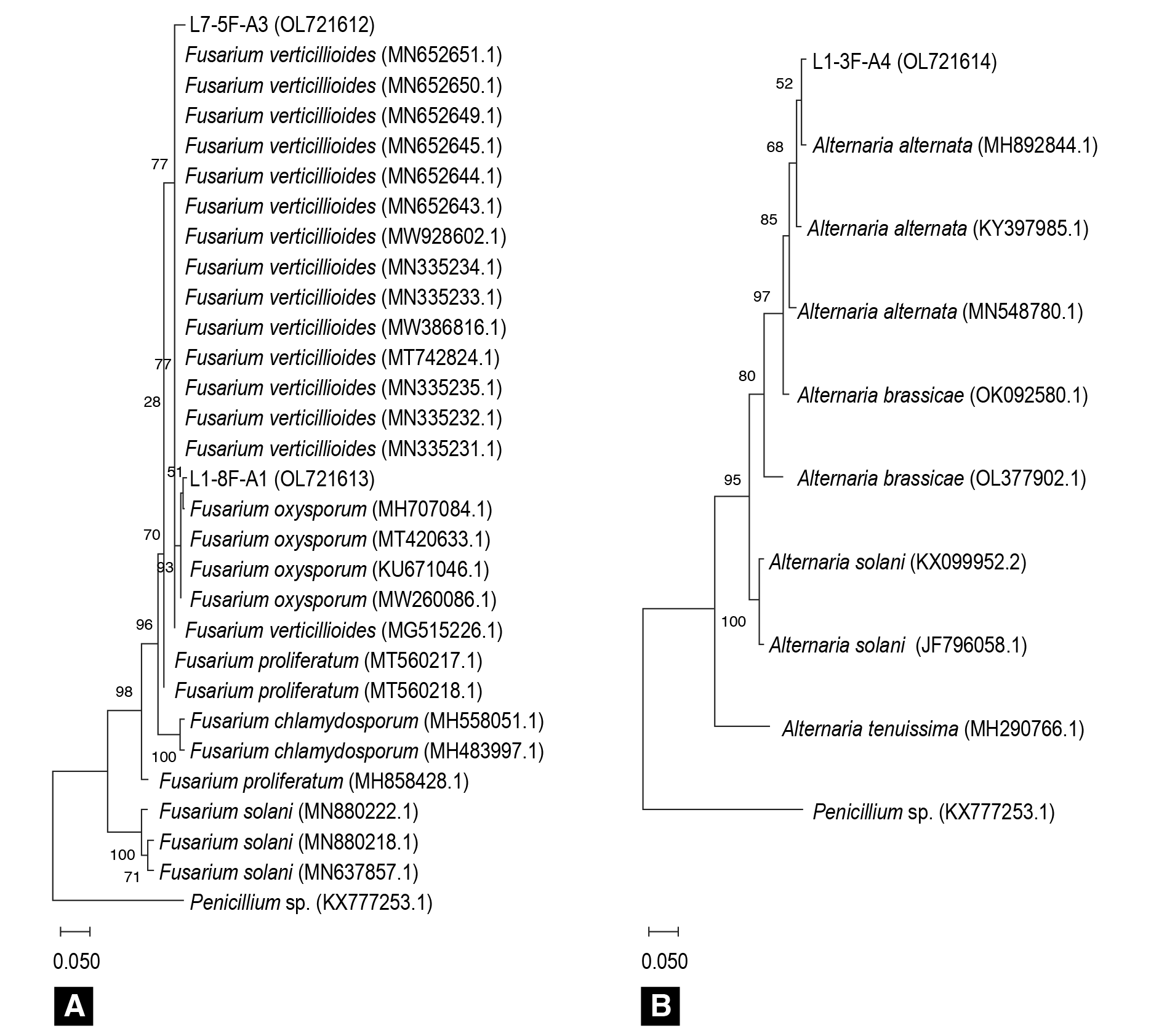
Figura 4 Árboles filogenéticos de máxima verosimilitud basados en secuencias ITS que muestran las relaciones filogenéticas de los aislados L1-8F-A1, L7-5F-A3 y L1-3F-A4 con otras especies de Fusarium (A) y Alternaria (B). Penicillium spp. (KY777253.1) se incluyó como grupo externo. Los valores de Bootstrap están indicados en los nodos. Los números de accesiones de las secuencias se muestran entre paréntesis.
Conclusión
Con base en las características culturales, morfológicas y moleculares se identificó a Alternaria alternata, Fusarium oxysporum y Fusarium verticillioides como agentes causales de la pudrición del florete en brócoli en el estado de Guanajuato, México. Este es el segundo reporte de Alternaria alternata y Fusarium oxysporum como agentes causales de la pudrición del florete en brócoli cultivado en México, y el primer reporte en identificar a Fusarium verticillioides como parte del complejo de agentes causales de esta enfermedad.
References
Akram, W., Ahmad, A., Juxian, G., Yasin, N. A., Akbar, M., Luo, W., & Li, G. (2020). Occurrence of head rot disease caused by Fusarium verticillioides on Chinese flowering cabbage (Brassica rapa L subsp. parachinensis) in China. Crop Protection, 134, 105180. doi: 10.1016/j.cropro.2020.105180 [ Links ]
Chen, Y., & Zhong, J. (2017). First report of Alternaria alternata causing leaf spot of Aloe vera in China. Plant Disease, 101(8), 1544-1544. doi: 10.1094/PDIS-04-12-0343-PDN [ Links ]
Dillard, H. R., Cobb, A. C., & Lamboy, J. S. (1998). Transmission of Alternaria brassicicola to cabbage by flea beetles (Phyllotreta cruciferae). Plant Disease, 82(2), 153-157. doi: 10.1094/PDIS.1998.82.2.153 [ Links ]
Droby, S., Dinoor, A., Prusky, D., & Barkai-Golan, R. (1984). Pathogenicity of Alternaria alternata on potato in Israel. Phytopathology, 74(5), 537-542. doi: 10.1094/Phyto-74-537 [ Links ]
Duncan, K. E., & Howard, R. J. (2010). Biology of maize kernel infection by Fusarium verticillioides. Molecular Plant-Microbe Interactions, 23(1), 6-16. doi: 10.1094/MPMI-23-1-0006 [ Links ]
Editorial Agro Cultivos S. C de R. L. de C. V. (EAC) (2017). Manejo integrado de enfermedades en brócoli. México: EAC. Retrieved from https://www.horticultivos.com/cultivos/cruciferas/brocoli/manejo-integrado-de-enfermedades-en-brocoli/ [ Links ]
Fraire-Cordero, M. L., Nieto-Ángel, D., Cárdenas-Soriano, E., Gutiérrez-Alonso, G., Bujanos-Muñiz, R., & Vaquera-Huerta, H. (2010). Alternaria tenuissima, A. alternata y Fusarium oxysporum hongos causantes de la pudrición del florete de brócoli. Revista Mexicana de Fitopatología, 28(1), 25-33. Retrieved from https://www.redalyc.org/articulo.oa?id=61214206003 [ Links ]
Guo, H., Cui, Y., Zhu, E., Song, Z., & Wang, C. (2015). Effect of antagonistic yeast Pichia membranaefaciens on black spot decay of postharvest broccoli. European Journal of Plant Pathology, 143(2), 373-383. doi: 10.1007/s10658-015-0689-5 [ Links ]
Huang, F., Fu, Y., Nie, D., Stewart, J. E., Peever, T. L., & Li, H. (2015). Identification of a novel phylogenetic lineage of Alternaria alternata causing citrus brown spot in China. Fungal Biology, 119(5), 320-330. doi: 10.1016/j.funbio.2014.09.006 [ Links ]
Inoue, K., & Nasu, H. (2000). Black spot of peach caused by Alternaria alternata (Fr.) Keissler. Journal of General Plant Pathology, 66(1), 18-22. doi: 10.1007/PL00012916 [ Links ]
Jiménez, O., Contreras, N., & Nass, H. (2004). Xanthomonas albilineans agente causal de la escaldadura foliar de la Caña de Azúcar (Saccharum sp) en los estados Lara y Yaracuy. Revista de la Facultad de Agronomía, 21(3), 233-245. Retrieved from http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0378-78182004000300003 [ Links ]
Leslie, F. J., & B. Summerell A. (2006). The Fusarium laboratory manual. USA: Blackwell Publishing. [ Links ]
Li, B., Wang, G. L., Wu, Z. Y., Qiu, W., Tang, Q. M., & Xie, G. L. (2009). First report of bacterial head rot of broccoli caused by Pseudomonas fluorescens in China. Plant Disease, 93(11), 1219-1219. doi: 10.1094/PDIS-93-11-1219A [ Links ]
Liu, Y., Xu, Z., Zhu, P., Liu, Y., Zhang, Z., Xu, L., & Toyoda, H. (2009). Postharvest black spot disease in broccoli caused by Alternaria brassicicola. Annual Report of The Kansai Plant Protection Society, 51, 11-15. doi: 10.4165/kapps.51.11 [ Links ]
Liu, X., Fang, Z. Y., Yang, L. M., Zhang, Y. Y., & Lv, H. H. (2018). First report of Brussels sprouts and Broccoli yellows caused by Fusarium oxysporum in China. Plant Disease, 102(12), 2638-2638. doi: 10.1094/PDIS-12-17-1970-PDN [ Links ]
Mehraj, H., Akter, A., Miyaji, N., Miyazaki, J., Shea, D. J., Fujimoto, R., & Doullah, M. (2020). Genetics of clubroot and Fusarium wilt disease resistance in Brassica vegetables: The application of marker assisted breeding for disease resistance. Plants, 9(6), 726. doi: 10.3390/plants9060726 [ Links ]
Morales-Rodríguez, I., Yáñez-Morales, M. J., Silva-Rojas, H. V., García-de los Santos, G., & Guzmán-de Peña, D. A. (2007). Biodiversity of Fusarium species in Mexico associated with ear rot in maize, and their identification using a phylogenetic approach. Mycopathologia, 163(1), 31-39. doi: 10.1007/s11046-006-0082-1 [ Links ]
Morris, P. F., Connolly, M. S., & Clair, D. A. (2000). Genetic diversity of Alternaria alternata isolated from tomato in California assessed using RAPDs. Mycological Research, 104(3), 286-292. doi: 10.1017/S0953756299008758 [ Links ]
Nira, S. T., Hossain, M. F., Mahmud, N. U., Hassan, O., Islam, T., & Akanda, A. M. (2022). Alternaria leaf spot of broccoli caused by Alternaria alternata in Bangladesh. Plant Protection Science, 58(1), 49-56. doi: 10.17221/44/2020-PPS [ Links ]
Ochoa, J. L., Hernández-Montiel, L. G., Latisnere-Barragán, H., León-de la Luz, J., & Larralde-Corona, C. P. (2007). Aislamiento e identificación de hongos patógenos de naranja Citrus sinensis L. Osbeck cultivada en Baja California Sur, México. CYTA-Journal of Food, 5(5), 352-359. doi: 10.1080/11358120709487712 [ Links ]
Oren, L., Ezrati, S., Cohen, D., & Sharon, A. (2003). Early events in the Fusarium verticillioides-maize interaction characterized by using a green fluorescent protein-expressing transgenic isolate. Applied and Environmental Microbiology, 69(3), 1695-1701. doi: 10.1128/AEM.69.3.1695-1701.2003 [ Links ]
Pattanamahakul, P., & Strange, R. N. (1999). Identification and toxicity of Alternaria brassicicola, the causal agent of dark leaf spot disease of Brassica species grown in Thailand. Plant Pathology, 48(6), 749-755. doi: 10.1046/j.1365-3059.1999.00406.x [ Links ]
Secretaría de Agricultura y Desarrollo Rural - Servicio de Información Agroalimentaria y pesquera (SADER-SIAP). (2020). Anuario estadístico de la producción agrícola. Retrieved from https://nube.siap.gob.mx/cierreagricola/ [ Links ]
Tamura, K., Stecher, G., & Kumar, S. (2021). MEGA11: Molecular evolutionary genetics analysis version 11. Molecular Biology and Evolution, 38(7), 3022-3027. doi: 10.1093/molbev/msab120 [ Links ]
Thoma, B. P. (2003). Alternaria spp.: from general saprophyte to specific parasite. Molecular Plant Pathology, 4(4), 225-236. doi: 10.1046/J.1364-3703.2003.00173.X [ Links ]
Thompson, J. D., Higgins, D. G., & Gibson, T. J. (1994). CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. Nucleic Acids Research, 22(22), 4673-4680. doi: 10.1093/nar/22.22.4673 [ Links ]
White, T. J., Bruns, T., Lee, S., & Taylor, W. J. (1990). Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis, M. A., Gelfand, D. H., Sninsky, J. J., & White, T. J. (Eds.), PCR Protocols: A Guide to Methods and Applications (pp. 315-322). New York: Academic Press, Inc. [ Links ]
Zhang, Y. P., Uyemoto, J. K., & Kirkpatrick, B. C. (1998). A small-scale procedure for extracting nucleic acids from woody plants infected with various phytopathogens for PCR assay. Journal of Virological Methods, 71(1), 45-50. doi: 10.1016/s0166-0934(97)00190-0 [ Links ]
Zhao, A. N., Li, J., Yan, S. L., Huang, J. B., & Zheng, L. (2018). First report of Fusarium tricinctum causing rot of broccoli heads post-harvest in China. Plant Disease, 102(1), 239-239. doi: 10.1094/PDIS-02-17-0218-PDN [ Links ]
Recibido: 05 de Febrero de 2022; Aprobado: 12 de Agosto de 2022











 texto en
texto en 




