Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.28 no.2 Chapingo may./ago. 2022 Epub 01-Ago-2022
https://doi.org/10.5154/r.rchsh.2021.07.015
Artículos científicos
Reanálisis de la acción de la citoquinina: los cambios anatómicos de la hoja juegan un papel clave en la promoción del crecimiento impulsada por la 6-bencilaminopurina en lechuga cultivada en maceta
1Universidad de Buenos Aires, Facultad de Agronomía. Av. 4453, San Martín, Buenos Aires, C1417DSE, ARGENTINA.
2Universidad Nacional de Mar del Plata, Facultad de Ciencias Agrarias. Ruta 226, Balcarce, Buenos Aires, B7620ZAA, ARGENTINA.
3Comisión de Investigaciones Científicas. La Plata, Provincia de Buenos Aires, ARGENTINA.
Las plantas cultivadas en charolas de germinación de celdas pequeñas frecuentemente son sometidas a restricciones radicales. Las puntas de las raíces son una fuente de citoquinina, y la biosíntesis y el transporte de esta hormona a la parte aérea restringe severamente el desarrollo de los brotes. La aplicación de citoquinina al follaje ha demostrado ser efectiva para contrarrestar los efectos negativos en muchos cultivos hortícolas, pero los procesos fisiológicos involucrados permanecen inciertos. El objetivo de este trabajo fue evaluar el efecto de asperjar citoquinina 6-bencilaminopurina (BAP) sobre el crecimiento y desarrollo de plántulas de lechuga, concentrándose en los mecanismos morfo-fisiológicos relacionados con la respuesta de la planta. Se realizaron dos experimentos en un invernadero; para ello, se cultivaron plántulas de lechuga (Lactuca sativa L. Crimor INTA) durante 35 días en charolas de germinación de 128, 200 y 288 celdas (17.37, 13.90 y 6.18 cm3·celda-1, respectivamente), después se asperjaron con soluciones de BAP (0, 5, 50 o 100 mg·L-1), antes del trasplante o 7 días después de este. Las plántulas se trasplantaron en macetas más grandes (3,000 cm3), donde crecieron por 60 días. La disminución de la celda redujo la tasa de asimilación neta de la planta y la tasa fotosintética neta, pero el impacto en la tasa de crecimiento relativo fue un poco menor debido al incremento de la relación del área foliar. Las aspersiones de BAP incrementaron la acumulación de biomasas y ampliaron el desarrollo del área fotosintética; asimismo, se promovió la asimilación de carbono. Estos efectos fueron destacables en las plantas cultivadas en celdas menores, y cuando la hormona fue suministrada en la etapa de pre-trasplante.
Palabras clave volumen de la celda; restricción radical; trasplantes; hortalizas
Plants raised in small cell trays are often subjected to root growth restrictions. Root tips are a source of cytokinin, and insufficient biosynthesis and transport of this hormone to the aerial part severely impairs shoot development. Exogenous supply of cytokinin to the foliage has been shown to effectively counteract these effects in several horticultural crops, but the physiological processes involved are still unclear. The aim of this work was to study the effect of spraying the cytokinin 6-benzylaminopurine (BAP) on growth and development of plug lettuce seedlings focusing on the morpho-physiological mechanisms involved in plant response. Two experiments were conducted in a greenhouse. Lettuce (Lactuca sativa L. Crimor INTA) seedlings were grown for 35 days in 128-, 200- and 288-cells trays (17.37, 13.90 and 6.18 cm3·cell-1 respectively), after which they were sprayed with BAP (6-benzylaminopurine) solutions (0, 5, 50 or 100 mg·L-1) either immediately before transplant, or 7 days after transplant. Seedlings were transplanted into larger (3,000 cm3) pots in which they grew for further 60 days. Decreasing plug cell volume resulted in a steep decrease in plant net assimilation rate and leaf net photosynthetic rate, but the impact on the relative growth rate was somewhat lower due to an increased leaf area ratio. BAP sprays increased plant biomass accumulation and enhanced the development of photosynthetic area, in parallel with a strong promotion of carbon assimilation, and these effects were more remarkable in plants raised in smaller plugs, and when hormone was supplied at the pre-transplant stage.
Keywords plug cell volume; root restriction; transplants; vegetables
Introducción
En los sistemas de producción vegetal modernos, el trasplante ha sustituido la siembra directa de manera importante. El trasplante en contenedores permite un incremento en los rendimientos, uniformidad del cultivo y un mayor control en la calendarización de la producción, en comparación con la siembra directa. Sin embargo, la necesidad de reducir los costos del trasplante ha impulsado el uso de charolas de germinación con celdas pequeñas. Esto implica una limitación física al desarrollo del sistema radical (Di Benedetto, 2011). Las consecuencias de las restricciones al desarrollo temprano de la raíz pueden extenderse hacia el ciclo de vida de la planta, afectando negativamente la producción.
La lechuga es uno de los cultivos más importantes a nivel mundial (Stagnari, Galieni, & Pisante, 2015; Shehata, Schmidhalter, Valšíková, & Junge, 2016; Kim, Moon, Tou, Mou, & Waterland, 2016), y frecuentemente se cultiva en charolas de germinación de celdas pequeñas, por lo que es necesario superar las restricciones radicales para minimizar pérdidas en el rendimiento. Los efectos de la restricción radical sobre el crecimiento de los brotes son causados, principalmente, por un bajo suministro de citoquininas desde las raíces, y pueden ser parcialmente superados por el suministro exógeno de esta hormona (Richards & Rowe, 1977), pero su aplicación en hortalizas sólo ha cobrado atención recientemente (Di Benedetto, Giardina, de Lojo, Gandolfo, & Hakim, 2020a). Las citoquininas son sintetizadas en los ápices de las raíces y transportadas a través del xilema al brote, donde promueven la división celular, la expansión foliar y el desarrollo del aparato fotosintético, además de retrasar la senescencia, lo cual resulta en un mayor desarrollo y tamaño de la planta (Hönig, Plíhalová, Husičková, Nisler, & Doležal, 2018; Glanz-Idan, Tarkowski, Turečková, & Wolf, 2020).
El suministro exógeno de citoquinina al follaje puede contrarrestar los efectos de la restricción radical en varias especies hortícolas y ornamentales (Di Benedetto, Tognetti, & Galmarini, 2010; Di Benedetto et al., 2020b). La aspersión temprana de citoquinina sintética 6-bencilaminopurina (BAP) a menudo promueve la tasa de crecimiento relativo relacionada con un aumento de la tasa de asimilación neta y la tasa fotosintética, más que con un aumento de la partición de carbono al brote (Di Benedetto, Tognetti, & Galmarini, 2015a). Asimismo, dicha hormona puede mejorar la fijación de carbono mediante el desarrollo y el mantenimiento de cloroplastos funcionales y la síntesis de clorofila (Boonman et al., 2007; Cortleven & Schmülling, 2015; Liu, Li, & Zhong, 2017).
Se ha comprobado que la citoquinina suministrada a plantas in vitro aumenta el contenido de clorofila (Muniz-de Oliveira et al., 2008a; Dobránszki & Drienyovszki, 2014), mientras que en plantas en etapa avanzada ayuda a postergar la senescencia (Hönig et al., 2018). No obstante, no se encontraron cambios importantes en el contenido de clorofila después del suministro exógeno de BAP en algunas ornamentales con restricción de raíces como Epipremnum aureum (Di Benedetto et al., 2015a) y Ficus benjamina (Di Benedetto, Galmarini, & Tognetti, 2020c), a pesar del efecto promotor de la hormona en la tasa de asimilación neta. Es importante dilucidar si la citoquinina puede promover la concentración de clorofila en lechuga bajo restricciones radicales, dada la asociación entre la clorofila y la calidad de la lechuga.
Las citoquininas también se asocian positivamente con la concentración de nitrógeno y las proteínas fotosintéticas en las hojas, mediante la regulación de la expresión de los genes relacionados con la captación de nitrógeno y la asimilación de carbono (Ruffel et al., 2011). Dicha hormona también mejora el transporte del nitrógeno a las hojas (Ookawa, Naruoka, Sayama, & Hirasawa, 2004) y dentro de ellas (Gu et al., 2018), desde las hojas más viejas y sombreadas hacia las más jóvenes e iluminadas por el sol, donde se estimula la expresión de la rubisco (Ookawa et al., 2004; Boonman et al., 2007). La citoquinina retrasa la senescencia asociada con los niveles de nitrógeno, proteínas y rubisco de las hojas, así como las tasas de fotosíntesis (Jordi et al., 2000).
Estudios sobre Epipremnum aureum y Ficus benjamina con restricción radical mostraron un aumento en la concentración de nitrógeno foliar como resultado de las aspersiones de BAP (Di Benedetto et al., 2010; Di Benedetto, Galmarini, & Tognetti, 2018; 2020c), que a su vez se asoció con un aumento en la tasa de asimilación neta (TAN) respecto de los testigos no tratados. El aumento en el contenido de nitrógeno foliar en plantas de lechuga a las que se les suministró citoquinina también podría ser un atributo deseable desde el punto de vista de la calidad nutricional.
Los cambios en la asimilación de carbono provocados por la citoquinina también pueden ser consecuencia de un aumento de la difusión de CO2 debido a cambios anatómicos, aunque se han reportado resultados contradictorios. Bosselaers (1983) reportó una disminución de la densidad estomática en hojas de Phaseolus vulgaris tratadas con BAP, pero no con otra citoquinina (kinetina). En cambio, Gandolfo et al. (2014) encontraron un aumento de la densidad estomática de Impatiens wallerana al aplicar BAP, el cual fue más pronunciado en las plántulas sometidas a una restricción radical severa. Este efecto dependió de la concentración de la BAP, siendo las dosis más bajas (5 mg·L-1) las más efectivas.
La proporción de espacios intercelulares en el mesófilo de la hoja, los cuales influye en la difusión del CO2 dentro de ésta, también se modifica por la citoquinina, aunque algunos trabajos han reportado el efecto contrario. Bosselaers (1983) encontró una disminución en la proporción de espacios aéreos intercelulares en Phaseolus vulgaris tratado con kinetina y BAP; respuesta similar a la reportada por Muniz-de Oliveira et al. (2008b) en Annona glabra. Sin embargo, Gandolfo et al. (2014) encontraron que en las hojas de Impatiens wallerana la proporción de espacios intercelulares aumentó cuando fueron tratadas con 5 mg·L-1 de BAP, pero con concentraciones mayores revirtieron el efecto.
Varios reportes indican que la citoquinina puede promover un incremento en el grosor de la hoja (Bosselaers, 1983; Di Benedetto, Tognetti, & Galmarini, 2015b, 2018), lo cual podría jugar un papel en la difusión del CO2. El incremento en el grosor de la hoja, como consecuencia de la aplicación de citoquinina, sería una respuesta de interés en lechuga debido a su asociación con la vida útil poscosecha (Lee, Nath, Goswami, & Nou, 2017).
Investigaciones realizadas sobre lechugas cabeza de mantequilla de verano rociadas con BAP y cultivadas en pequeñas macetas sugieren que esta especie también responde a la citoquinina exógena, al aumentar la tasa de asimilación neta, aunque los procesos biológicos implicados continúan siendo desconocidos (Campolongo et al., 2020). La comprensión de la respuesta de la lechuga a la citoquinina bajo diferentes grados de restricciones radicales es necesaria, no sólo para obtener mayores rendimientos comerciales, sino también por su impacto potencial en los atributos de calidad. Para optimizar el uso comercial de este tratamiento, también se necesita información sobre el mejor momento de aplicación (ya sea previa o posterior al trasplante) (de Lojo, Gandolfo, Boschi, Giardina, & Di Benedetto, 2019; Hakim, Gandolfo, Giardina, & Di Benedetto, 2017).
El objetivo de este estudio fue evidenciar si las aspersiones de BAP pueden mejorar la acumulación de biomasa en lechugas mediante una asimilación alta de carbono, dependiendo del tamaño de la celda, la concentración de la hormona y el momento de aplicación; asimismo, documentar los cambios causados por BAP en los contenidos de clorofila y nitrógeno, aunados a cambios en la anatomía de la hoja, lo cual podría explicar la promoción de la asimilación de carbono mediante esta hormona.
Materiales y métodos
El experimento se llevó a cabo en la Facultad de Agronomía de la Universidad de Buenos Aires, Argentina (34° 35’ 59’’ latitud sur y 58° 22’ 23’’ longitud oeste), desde el 6 de marzo hasta el 15 de mayo de 2017, y se repitió una vez del 5 de marzo al 21 de mayo de 2018.
Las semillas de lechuga (Lactuca sativa L.) Crimor INTA se sembraron y cultivaron en charolas de germinación con 128, 200 y 288 celdas (17.37, 13.90 y 6.18 cm3 por celda, respectivamente), en sustrato Klasmann411® (GmbH, Alemania) por 35 días. El sustrato contenía turba rubia de 0-5 mm, pH de 6 y estructura extra fina con Hydro S como agente humectante. Las plántulas de lechuga se asperjaron con diferentes concentraciones de BAP (0, 5, 50 o 100 mg·L-1) (EC 214-927-5, Sigma-Aldrich®, EUA) cuando el primer par de hojas verdaderas se desarrollaron (tratamientos pre-trasplante para la BAP). Adicionalmente, las plántulas sin tratamiento pre-trasplante se asperjaron con BAP siete días después del trasplante (tratamientos post-trasplante). La BAP se diluyó previamente en alcohol etílico al 80 %.
Las plántulas de lechuga se trasplantaron a macetas de 3 L llenas con un medio de Sphagnum maguellanicum - residuo de río - perlita (40:40:20, v/v) y se cultivaron por 60 días aproximadamente. Los residuos de río son el resultado de la acumulación de residuos vegetales bajo un ambiente anaeróbico, que se degradaron en las orillas de ríos o lagos ubicados en climas subtropicales con precipitaciones pluviales mayores a 1,000 mm. Al principio del experimento, la porosidad total (%), la porosidad con aire (%), la capacidad del contenedor (%) y la densidad aparente (g·cm-3) fueron 63.50, 17.06, 10.06 y 0.35, respectivamente. Las malezas se retiraron manualmente.
Las plantas se regaron con agua de grifo de alta calidad (pH de 6.64 y conductividad eléctrica de 0.486 dS·m-1), utilizando rocío elevado intermitente y una fertirrigación semanal (1, 0.5, 1 y 1.5 de N:P:K:Ca, v/v). La concentración de nutrientes se modificó conforme el desarrollo de la plántula: 50 mgN·L-1 desde la protrusión radical hasta la expansión de las primeras hojas verdaderas, 100 mgN·L-1 de esta etapa hasta el trasplante y 150 mg·L-1 durante los experimentos en las macetas. El volumen de solución de la fertilización varió de acuerdo con el volumen de la maceta.
La temperatura ambiental promedio de cada media hora se registró utilizando un data logger (H08-001-02, HOBO®, EUA), protegido de la irradiación directa con papel aluminio. La radiación solar global se registró con un data logger PAR. Las temperaturas promedio oscilaron entre 14.4 y 16.1 °C, y la radiación fotosintéticamente activa promedio varió de 13.46 a 17.33 mol fotones·m-2·día-1. Las macetas se acomodaron a una densidad de 6 plantas·m-2, evitando sombreo mutuo.
Las plantas para mediciones (diez por tratamiento) que implicasen su destrucción se cosecharon en la etapa del trasplante y posteriormente en intervalos de 20 días. Las raíces se lavaron y se registraron los pesos frescos (PF) de raíz, tallo, hoja y peciolo, así como la longitud de raíz. Los pesos secos (PS) se obtuvieron después de secar las raíces, los tallos y las hojas a 80 °C hasta peso constante (aproximadamente 96 h). El número de hojas se registró y el área foliar de cada una de ellas se determinó utilizando el programa ImageJ®.
La tasa de aparición foliar (TAF), la tasa de expansión relativa del área foliar (TERAF), la tasa de crecimiento relativo (TCR), la tasa de asimilación neta (TAN) y la relación de área foliar (RAF) se calcularon de acuerdo con Di Benedetto y Tognetti (2016).
La TAF se calculó como la pendiente del número de hojas visibles (incluidas las desenrolladas > 1 cm) contra el tiempo (en semanas). La TERAF se calculó como la pendiente de la regresión del logaritmo natural de las áreas foliares totales contra el tiempo (en días). La TCR de toda la planta se determinó como la pendiente de la regresión lineal del logaritmo natural de los PS contra el tiempo (en días), y la TCR promedio se calculó a partir de la TCR/TAN. La TAN promedio se calculó como:
donde W 0 es el valor extrapolado del PS (g) en el momento cero, k w es la TCR (días-1), A 0 es el valor extrapolado del área foliar (cm2) en el momento cero, k a es la TERAF (días-1), t es el tiempo (días) en el punto medio del periodo experimental y e es la base de logaritmo natural.
La tasa fotosintética neta se midió en concentraciones ambientales de O2 y CO2 a una densidad de flujo de fotones en saturación (> 1,700 µmol de fotones·m-2·s-1), entre las 11:30 y las 13:00 horas de un día soleado, justo antes de la cosecha final. Se seleccionó la hoja más joven, completamente expandida, de tres plantas de cada tratamiento hormonal para las mediciones, las cuales se realizaron en un sistema fotosintético portátil (LI-COR LI-6200, LI-COR®, EUA).
Para el análisis de clorofila, se cortaron discos de las hojas de la zona central, cerca de la nervadura central, y se colocaron en viales que contenían 3 cm3 de N, N-dimetilformamida. Dichos discos se infiltraron al vacío y se almacenaron durante tres días en completa oscuridad, momento en el cual la clorofila se había eluido completamente hacia el disolvente. La absorbancia a 647 y 664 nm se midió con un espectrofotómetro (Metrolab 1600, Metrolab UV-Vis, Argentina), y el contenido de clorofila se calculó según lo indicado por Inskeep y Bloom (1985).
La concentración de nitrógeno foliar en el muestreo final se analizó por el método Kjeldahl. Las muestras de hojas se introdujeron en un tubo con ácido sulfúrico y se calentaron por aproximadamente 1.5 h para elevar la temperatura hasta 310-320 °C. Después de 1 h de digestión, los tubos se retiraron y se enfriaron hasta 20 °C. El ácido digerido se diluyó a 10 mL con agua y se transfirió una alícuota de 3 mL a otro tubo, donde se añadió el reactivo de Nessler. La absorbancia a 500 nm se midió con un espectrofotómetro.
Los azúcares no reductores de las hojas en el muestreo final se analizaron por el método de la Antrona. Las hojas se extrajeron con etanol al 70 % (v/v) y los extractos se evaporaron al vacío hasta su secado. Posteriormente, se pasaron por agua caliente y se aclararon con hidróxido de aluminio. El reactivo Antrona (5 mL) se pipeteó en tubos Pyrex y se enfrió en agua helada. La solución a ensayar (1 mL) se colocó en capas sobre el ácido, enfriando durante 5 min más, y luego se mezcló vigorosamente mientras seguía sumergida en agua helada. Los tubos se cubrieron holgadamente con tapones de corcho, se calentaron a 80 °C en un baño de agua de ebullición vigorosa y nivel constante, y luego se enfriaron en agua durante 5 min.
En la cosecha final, se colectaron muestras de hojas jóvenes completamente expandidas para examinar la anatomía foliar; es decir, el grosor total de la hoja y el volumen de los espacios intercelulares. El tejido de la región media de la lámina se fijó en una mezcla de etanol, formalina, ácido acético glacial y agua destilada (70, 5, 5 y 20 %, respectivamente) antes de deshidratarlo en una serie de etanol y alcohol tert-butílico. Las muestras se seccionaron en trozos de 10 a 20 µm con un micrótomo rotatorio y se tiñeron con safranina cristal-violeta verde rápido. Los datos obtenidos fueron las medias de tres hojas por tratamiento, utilizando diez cortes transversales por hoja. Los datos anatómicos cuantitativos se obtuvieron con el programa Image Pro Express versión 6.0 (Media Cybernetics, EUA).
El diseño experimental fue un factorial aleatorizado con tres bloques de cinco repeticiones de cada tratamiento (volumen de celda x concentración de BAP x experimento). La unidad experimental fue una maceta. Los datos se sometieron a un análisis de varianza de tres vías utilizando el programa STATISTICA 8 (StatSoft). Dado que no hubo diferencias significativas entre los dos experimentos anuales, estos se agruparon para el análisis (Cuadro 1). La comparación de medias se realizó mediante la prueba de Tukey (P ≤ 0.05). Las pendientes de las regresiones de TERAF, TCR y TAN se obtuvieron con el programa SMATR (Warton, Duursma, Falster, & Taskinen, 2012).
Cuadro 1 Resultados del análisis de varianza de tres vías con volumen de celda (VC), tratamiento BAP y experimento (gl = 2, 6 y 1, respectivamente) como factores.
| Variable | VC | BAP | Experimento | VC x BAP | VC x E | BAP x E | VC x BAP x E |
|---|---|---|---|---|---|---|---|
| Tasa de aparición foliar | *** | *** | ns | *** | ns | ns | ns |
| Tasa de expansión relativa del área foliar | *** | *** | ns | *** | ns | ns | ns |
| Área foliar total | *** | *** | ns | *** | ns | ns | ns |
| Área foliar individual | *** | *** | ns | *** | ns | ns | ns |
| Grosor de la hoja | *** | *** | ns | ** | ns | ns | ns |
| Espacios intercelulares | *** | *** | ns | ** | ns | ns | ns |
| Clorofila | * | * | ns | * | ns | ns | ns |
| Nitrógeno foliar | *** | *** | ns | *** | ns | ns | ns |
| Azúcares no reductores | *** | *** | ns | *** | ns | ns | ns |
| Tasa de crecimiento relativo | *** | *** | ns | *** | ns | ns | ns |
| Tasa de asimilación neta | *** | *** | ns | *** | ns | ns | ns |
| Relación de área foliar | *** | *** | ns | *** | ns | ns | ns |
| Tasa fotosintética | *** | *** | ns | *** | ns | ns | ns |
*** = P ≤ 0.001; ** = P ≤ 0.01; * = P ≤ 0.05; ns = no significativo.
Resultados
Desarrollo del área foliar
Durante el experimento, la TAF y la TERAF estuvieron directamente relacionadas con el volumen de la celda en las plantas testigo. Una aplicación de BAP, tanto en pre- como en post-trasplante, incrementó significativamente la TAF y la TERAF (Cuadro 2).
Cuadro 2 Tasa de aparición foliar (TAF) y tasa de expansión relativa del área foliar (TERAF) de plantas de lechuga cultivadas en charolas de germinación de 128, 200 o 288 celdas por charola y asperjadas con citoquinina 6-bencilaminopurina (BAP) en pre- y post-trasplante (5, 50 o 100 mg·L-1).
| Tratamiento | TAF (hojas·semana-1) | TERAF (cm2·cm-2·día-1) | |||||
|---|---|---|---|---|---|---|---|
| 128 celdas | 200 celdas | 288 celdas | 128 celdas | 200 celdas | 288 celdas | ||
| Testigo | 0.241 bAz | 0.229 cB | 0.188 dC | 0.0616 eA | 0.0552 dB | 0.0520 dC | |
| BAP pre-5 | 0.248 abA | 0.242 aA | 0.196 cB | 0.0645 cA | 0.0656 bA | 0.0615 dB | |
| BAP pre-50 | 0.256 abA | 0.241 aB | 0.228 bC | 0.0633 dA | 0.0631 cA | 0.0622 dB | |
| BAP pre-100 | 0.255 abA | 0.241 aB | 0.252 aA | 0.0652 cA | 0.0644 bA | 0.0655 bA | |
| BAP post-5 | 0.264 aA | 0.238 aB | 0.256 aA | 0.0668 cA | 0.0635 cB | 0.0672 aA | |
| BAP post-50 | 0.267 aA | 0.242 aB | 0.253 aB | 0.0680 bA | 0.0650 abB | 0.0650b B | |
| BAP post-100 | 0.271 aA | 0.243 aA | 0.232 bB | 0.0728 aA | 0.0678 aB | 0.0636 cC | |
zMedias con letras minúsculas iguales no difieren estadísticamente (Tukey, P ≤ 0.05) entre el testigo y los tratamientos con aspersiones de BAP. Medias con letras mayúsculas iguales no difieren estadísticamente (Tukey, P ≤ 0.05) entre plantas de charolas de germinación de diferente número de celdas. Las pendientes de la RLA y la TERAF fueron estadísticamente diferentes de cero (Tukey, P ≤ 0.001) en todos los casos.
Las variables de desarrollo del área foliar (incluyendo TAF, TERAF, área foliar total y área foliar individual) fueron afectadas significativamente por el tratamiento con BAP, el tamaño de celda y su interacción (Cuadro 1). En la última cosecha, las plantas de lechuga cultivadas en charolas de germinación de 288 celdas tuvieron áreas foliares totales e individuales significativamente más bajas que las cultivadas en charolas de germinación con celdas más grandes. La aspersión con BAP antes del trasplante, en cualquier dosis, incrementó significativamente el área foliar, independientemente del tamaño de la celda. No obstante, la máxima promoción de área foliar en las plantas de las charolas de germinación con 200 celdas se alcanzó a concentraciones de BAP más altas que en las plantas cultivadas en charolas de germinación de 128 y 288 celdas. La aspersión de BAP en post-trasplante también promovió la acumulación de área foliar en comparación con el testigo (Cuadro 3).
Cuadro 3 Área foliar total y área foliar individual promedio en la cosecha final de plantas de lechuga cultivadas en charolas de germinación de 128, 200 y 288 celdas, y asperjadas en pre- o post-trasplante con citoquinina 6-bencilaminopurina (BAP) (5, 50 o 100 mg·L-1) (n = 6).
| Tratamiento | Área foliar total (cm2·planta-1) | Área foliar individual (cm2·hoja-1) | |||||
|---|---|---|---|---|---|---|---|
| 128 celdas | 200 celdas | 288 celdas | 128 celdas | 200 celdas | 288 celdas | ||
| Testigo | 506.2 bA | 503.5 cA | 328.0 eB | 21.62 cA | 21.11 cA | 16.77 dB | |
| BAP pre-5 | 662.0 aA | 611.8 aB | 415.2 dC | 25.14 bA | 26.86 aA | 17.97 dB | |
| BAP pre-50 | 603.1 aA | 570.3 bB | 568.6 aB | 25.00 bA | 23.76 bB | 23.58 aB | |
| BAP pre-100 | 561.3 aA | 572.7 bA | 509.2 bB | 23.49 bcA | 23.54 bA | 20.74 cB | |
| BAP post-5 | 623.3 aA | 580.5 bB | 575.7 aB | 24.71 bA | 23.53 bB | 23.44 aB | |
| BAP post-50 | 693.3 aA | 490.2 cC | 530.7 bB | 27.73 aA | 24.88 bB | 21.13 bC | |
| BAP post-100 | 605.1 aB | 636.4 aA | 478.2 cC | 24.75 bB | 26.92 aA | 22.07 abC | |
zMedias con letras minúsculas iguales no difieren estadísticamente (Tukey, P ≤ 0.05) entre el testigo y los tratamientos con aspersiones de BAP. Medias con letras mayúsculas iguales no difieren estadísticamente (Tukey, P ≤ 0.05) entre plantas de charolas de germinación de diferente número de celdas.
Acumulación de biomasa
Se observó un efecto altamente significativo del tamaño de celda, el tratamiento con BAP y su interacción, sobre la TCR, TAN y RAF (Cuadro 1). El efecto de las aplicaciones exógenas de BAP sobre la acumulación de PS en la lechuga se muestra en la Figura 1. Se encontraron incrementos de la TCR, en relación con los testigos, en las plantas cultivadas en charolas de germinación de 288 celdas; sin embargo, la mayoría de las concentraciones de BAP aumentaron la TCR también en las plantas cultivadas en 128 y 200 celdas, aunque en menor medida (Figura 1A). En cuanto a los componentes de la TCR, se encontró un incremento relativo en la TAN (Figura 1B) y una disminución relativa en la RAF, como consecuencia de la aplicación de BAP. En ambos casos, las respuestas más altas se encontraron en las plantas cultivadas en charolas de germinación de 288 celdas.

Figura 1 Efecto del asperjado de diferentes concentraciones (5, 50, o 100 mg·L-1) de citoquinina 6-bencilaminopurina (BAP) en pre- o post-trasplante: a) tasa de crecimiento relativo (TCR), b) tasa de asimilación neta (TAN) y c) relación de área foliar (RAF) en lechugas. Los datos están expresados como porcentajes de cambio en los valores del testigo. Los datos de los testigos de las charolas de germinación de 128, 200 y 288 celdas fueron 0.0823, 0.0808 y 0.0788 (g·g-1·día-1) para TCR, 21.28, 16.73 y 13.21 (g·cm-2·día-1 x 10-5) para TAN, y 287.09, 537.97 y 611.49 (cm2·g-1) para RAF, respectivamente.
Para analizar la contribución de los cambios en la TAN y en la RAF sobre la variación debida a la BAP en la TCR, se realizó un análisis de regresión, el cual mostró que la TAN estaba fuerte y directamente asociadas con la TCR. Mientras tanto, se encontró una asociación inversa y moderada entre TCR y RAF (Figura 2).
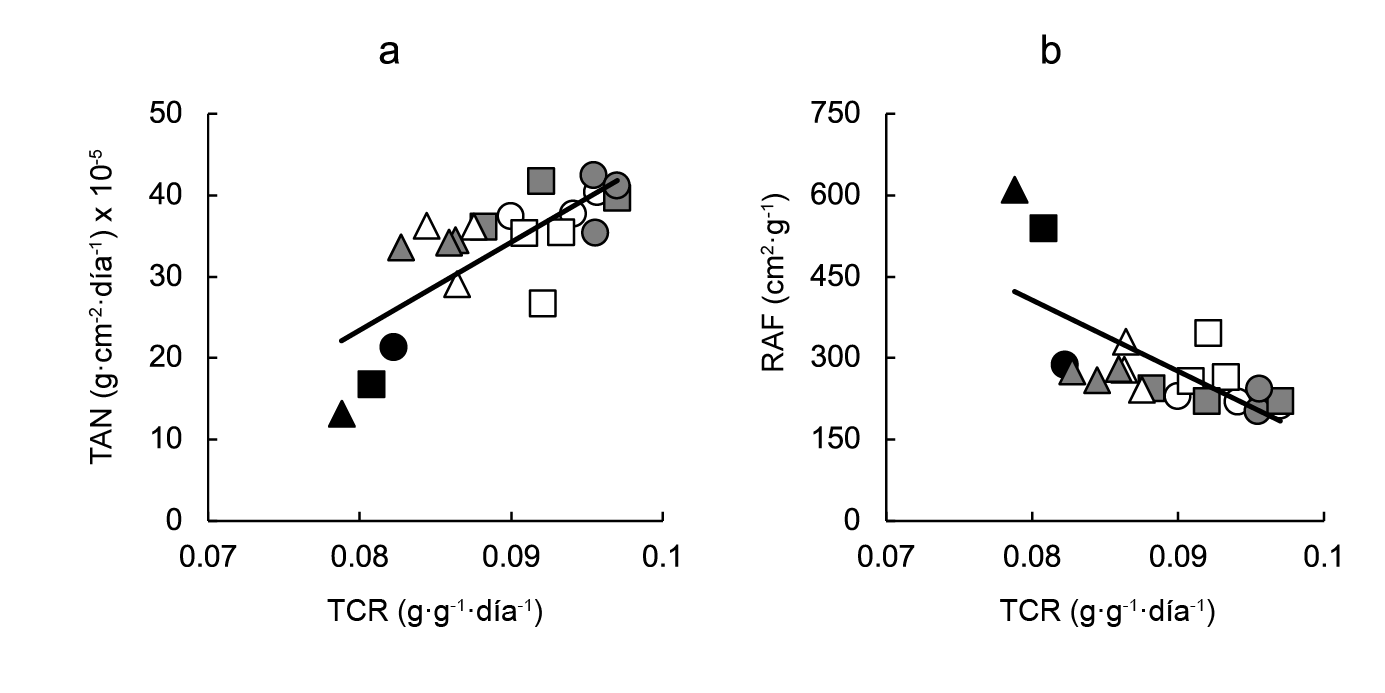
Figura 2 Contribución de los cambios: a) tasa de asimilación neta (TAN) y b) relación de área foliar (RAF) sobre la variación en la tasa de crecimiento relativo (TCR) de plantas de lechuga cultivadas en charolas de germinación de 128, 200 y 288 celdas, y asperjadas con diferentes concentraciones (0, 5, 50 o 100 mg·L-1) de citoquinina 6-bencilaminopurina (BAP) en pre- y post-trasplante. Las ecuaciones de la regresión lineal son TAN = 1081.60TCR - 63.11 (r2 = 0.581; P < 0.001) y RAF = -13106.00TCR + 1455.30 (r2 = 0.495; P < 0.05). Los símbolos indican testigos (negro), BAP en pre-trasplante (blanco) y BAP en post-trasplante (gris), correspondientes a charolas de germinación de 128 (círculos), 200 (cuadros) y 288 (triángulos) celdas.
Fijación de carbono
La tasa fotosintética al final del experimento se vio afectada significativamente por el tamaño de celda, el tratamiento con BAP y su interacción (Cuadro 1). Esta variable mostró un comportamiento similar al de la TAN; es decir, un incremento general significativo con la aplicación de BAP en relación con las plantas testigo, observándose las mayores respuestas en las plantas cultivadas en charolas de germinación de 288 celdas (Figura 3A). De acuerdo con estos resultados, la tasa fotosintética se correlacionó linealmente con la TAN (Figura 3B).

Figura 3 Efecto de la aplicación de diferentes concentraciones (5, 50, o 100 mg·L-1) de citoquinina 6-bencilaminopurina (BAP) sobre la tasa fotosintética relativa (a). Los datos están expresados como cambios porcentuales observados después de la aplicación de BAP. El panel b muestra la interrelación entre la tasa de asimilación neta (TAN) y la tasa fotosintética neta (mol CO2·m-2·s-1). La ecuación de la regresión lineal fue TAN = 2.40tasa fotosintética + 9.00 (r2 = 0.631; P ≤ 0.001). Los símbolos indican testigos (negro), BAP en pre-trasplante (blanco) y BAP en post-trasplante (gris), correspondientes a charolas de germinación de 128 (círculos), 200 (cuadros) y 288 (triángulos) celdas. Los datos de los testigos de las charolas de germinación de 128, 200 y 288 celdas fueron 7.93, 5.22 y 4.16 mol CO2·m2·s-1, respectivamente.
Anatomía foliar
Al final de los experimentos, el grosor de la hoja y el porcentaje de espacios intercelulares se vieron afectados significativamente (P ≤ 0.001) por el tamaño de celda, el tratamiento con BAP y su interacción (Cuadro 1). Los valores más bajos en ambas variables se observaron en las plantas cultivadas en las charolas de germinación con las celdas más pequeñas. Las aspersiones de BAP, tanto en pre- como en post-trasplante, aumentaron los valores de grosor de la hoja, independientemente del tamaño de celda. Por otra parte, las aplicaciones de BAP antes del trasplante fueron más efectivas que las posteriores en cuanto a la promoción del porcentaje de espacios intercelulares (Cuadro 4).
Cuadro 4 Grosor de la hoja y porcentaje de espacios intracelulares foliares en la hoja más joven completamente expandida de plantas de lechuga cultivadas en charolas de germinación de 128, 200 y 288 celdas, y asperjadas con diferentes concentraciones (0, 5, 50 o 100 mg·L-1) de citoquinina 6-bencilaminopurina (BAP) en pre- y post-trasplante (n = 6).
| Tratamientos | Grosor de hoja (µmm) | Espacios intercelulares (%) | |||||
|---|---|---|---|---|---|---|---|
| 128 celdas | 200 celdas | 288 celdas | 128 celdas | 200 celdas | 288 celdas | ||
| Testigo | 178.03 cAz | 164.77 cA | 157.20 bB | 60.91 cA | 38.06 bB | 23.84 cC | |
| BAP pre-5 | 227.27 bA | 213.64 bB | 202.65 aC | 71.90 aB | 47.32 aB | 47.77 aB | |
| BAP pre-50 | 242.42 aB | 263.64 aA | 206.44 aC | 66.93 aA | 29.64 cC | 43.77 aB | |
| BAP pre-100 | 261.36 aB | 280.30 aA | 212.12 aC | 72.99 aA | 36.60 bB | 42.94 aB | |
| BAP post-5 | 196.97 bB | 217.80 bA | 177.27 bC | 59.92 cA | 29.72 cB | 24.33 cB | |
| BAP post-50 | 200.76 bA | 215.91 bA | 155.30 bB | 68.89 aA | 35.61 bB | 29.47 bB | |
| BAP post-100 | 210.23 bA | 202.65 bA | 160.88 bB | 63.00 bA | 32.81 bB | 34.08 bB | |
zMedias con letras minúsculas iguales no difieren estadísticamente (Tukey, P ≤ 0.05) entre el testigo y los tratamientos con aspersiones de BAP. Medias con letras mayúsculas iguales no difieren estadísticamente (Tukey, P ≤ 0.05) entre plantas de charolas de germinación de diferente número de celdas.
Concentración de metabolitos foliares
Los efectos del tamaño de celda, el tratamiento BAP y su interacción fueron significativos (P < 0.05) para la clorofila y altamente significativos (P < 0.001) para los contenidos de nitrógeno y azúcar (Cuadro 1). En las plantas testigo, la concentración de clorofila no se vio afectada por el tamaño de celda, y las aspersiones de BAP tuvieron poco efecto, aunque en algunos casos las diferencias entre los tratamientos o el tamaño de celda fueron estadísticamente significativas (Cuadro 5). El contenido de nitrógeno en la hoja por unidad de superficie foliar de las plantas testigo fue el más alto en las charolas de germinación de 128 celdas, y los valores disminuyeron paralelamente a la disminución del tamaño de la celda (Cuadro 5). Se observaron aumentos significativos (P ≤ 0.05) debidos a la aplicación de BAP en función de la concentración y del momento de la aplicación, especialmente en charolas de germinación de 128 y 200 celdas.
Cuadro 5 Contenido de clorofila foliar y nitrógeno foliar en la cosecha final de plantas de lechuga cultivadas en charolas de germinación de 128, 200 y 288 celdas, y asperjadas con diferentes concentraciones (0, 5, 50 o 100 mg·L-1) de citoquinina 6-bencilaminopurina (BAP) en pre- y post-trasplante (n = 6).
| Tratamiento | Clorofila (mg·m-2) | Nitrógeno foliar (mg·cm-2) | |||||
|---|---|---|---|---|---|---|---|
| 128 celdas | 200 celdas | 288 celdas | 128 celdas | 200 celdas | 288 celdas | ||
| Testigo | 213.50 aAz | 211.69 bA | 205.22 cA | 0.971 dA | 0.652 cdB | 0.567 bC | |
| BAP pre-5 | 195.92 bB | 192.04 cB | 228.49 aA | 1.439 aA | 0.489 dB | 0.425 cB | |
| BAP pre-50 | 211.94 aB | 224.87 aA | 209.88 cB | 1.160 bA | 0.723 cB | 0.645 aC | |
| BAP pre-100 | 208.59 aB | 214.79 bB | 233.10 aA | 1.141 bA | 0.648 cdB | 0.436 cC | |
| BAP post-5 | 175.23 cC | 186.35 cB | 202.90 cA | 0.965 dA | 0.458 dB | 0.371 dC | |
| BAP post-50 | 211.95 aA | 191.52 cB | 219.70 bA | 1.033 cA | 1.085 bA | 0.560 bB | |
| BAP post-100 | 213.76 aB | 229.01 aA | 184.02 dC | 1.422 aB | 1.563 aA | 0.532 bC | |
zMedias con letras minúsculas iguales no difieren estadísticamente (Tukey, P ≤ 0.05) entre el testigo y los tratamientos con aspersiones de BAP. Medias con letras mayúsculas iguales no difieren estadísticamente (Tukey, P ≤ 0.05) entre plantas de charolas de germinación de diferente número de celdas.
La concentración de azúcares no reductores fue sustancialmente menor en las plantas cultivadas en las celdas más pequeñas, en comparación con las plantas de 128 y 200 celdas, independientemente del tratamiento con BAP. En general, la aplicación de BAP dio lugar a concentraciones más elevadas, sin importar el tamaño de celda (Cuadro 6).
Cuadro 6 Concentración de azúcares no reductores en los brotes en la cosecha final de plantas de lechuga cultivadas en charolas de germinación de 128, 200 o 288 celdas y asperjadas con diferentes concentraciones (0, 5, 50 o 100 mg·L-1) de citoquinina 6-bencilaminopurina (BAP) en pre- y post-trasplante (n = 6).
| Tratamiento | Azúcares no reductores (mg·g-1 peso fresco) | ||
|---|---|---|---|
| 128 celdas | 200 celdas | 288 celdas | |
| Testigo | 3.11 dAz | 2.97 dB | 1.23 dC |
| BAP pre-5 | 3.60 cA | 3.59 cA | 1.70 bB |
| BAP pre-50 | 5.95 bA | 5.60 bA | 1.57 bA |
| BAP pre-100 | 6.62 aB | 7.75 aA | 1.13 bcC |
| BAP post-5 | 3.91 cA | 3.97 cA | 2.51 aB |
| BAP post-50 | 3.62 cA | 3.58 cA | 1.53 bB |
| BAP post-100 | 6.63 aA | 1.83 eB | 1.39 cdB |
zMedias con letras minúsculas iguales no difieren estadísticamente (Tukey, P ≤ 0.05) entre el testigo y los tratamientos con aspersiones de BAP. Medias con letras mayúsculas iguales no difieren estadísticamente (Tukey, P ≤ 0.05) entre plantas de charolas de germinación de diferente número de celdas.
Relación entre la fijación de carbono y las variables anatómicas foliares
Tanto la tasa de asimilación neta (Figura 4 a ) como la tasa fotosintética (Figura 4 b ) se correlacionaron directamente con el grosor de la hoja, y los mejores ajustes se obtuvieron con ecuaciones curvilíneas (Figura 4 a y b, respectivamente). Ambas variables relacionadas con la fijación de carbono también se correlacionaron directamente con la proporción de espacios intercelulares (Figura 4c y d).
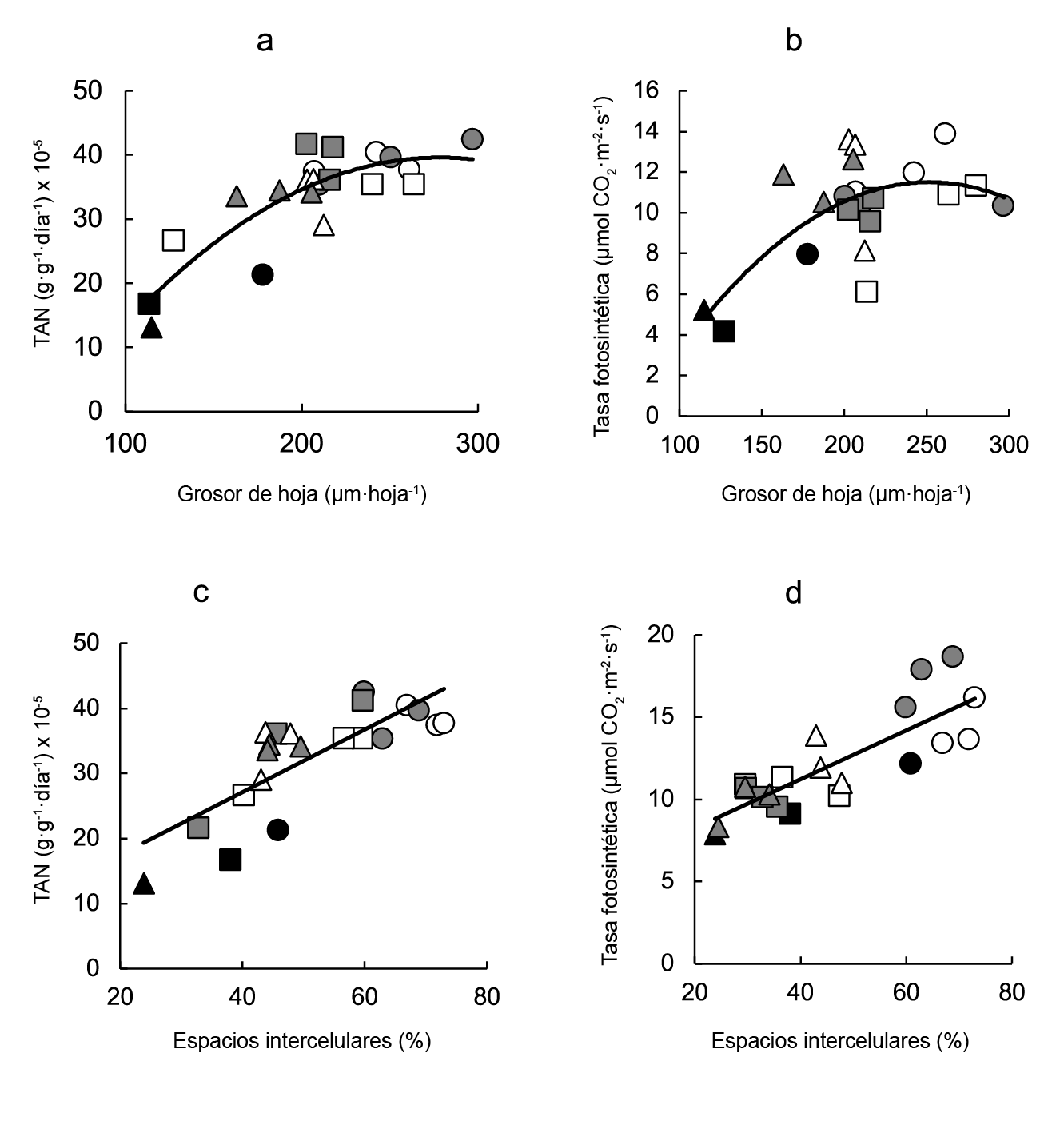
Figura 4 Relación entre la asimilación de carbono y las variables anatómicas foliares. Las ecuaciones de regresión fueron: a) TAN = -0.0008grosor de la hoja2 + 0.455grosor de la hoja - 23.63 (r2 = 0.726; P ≤ 0.001), b) tasa fotosintética = -0.0004grosor de la hoja2 + 0.181grosor de la hoja - 11.25 (r2 = 0.442; P ≤ 0.001), c) TAN = 0.48espacios intercelulares + 7.87 (r2 = 0.618; P ≤ 0.001) y d) tasa fotosintética = 0.15espacios intercelulares + 5.28 (r2 = 0.679; P ≤ 0.001). Los símbolos indican testigos (negro), BAP en pre-trasplante (blanco) y BAP en post-trasplante (gris), correspondientes a charolas de germinación de 128 (círculos), 200 (cuadros) y 288 (triángulos) celdas.
Relación entre fijación de carbono y contenido de nitrógeno foliar
Se observó una asociación directa entre la TAN, o la tasa fotosintética, y el contenido de nitrógeno foliar por unidad de superficie. Los mejores ajustes se obtuvieron con una relación curvilínea, alcanzando la respuesta de la planta un óptimo por encima (Figura 5a y b), aunque las correlaciones fueron un poco más débiles que las observadas entre la fijación de carbono y las variables anatómicas foliares.

Figura 5 Relación entre la asimilación de carbono y las variables metabólicas foliares. Las ecuaciones de regresión fueron: a) TAN = 7.78contenido de nitrógeno foliar + 37.12 (r2 = 0.558; P ≤ 0.001) y b) tasa fotosintética = 2.00contenido de nitrógeno foliar2 + 11.14 (r2 = 0.338; P ≤ 0.01). Los símbolos indican testigos (negro), BAP en pre-trasplante (blanco) y BAP en post-trasplante (gris), correspondientes a charolas de germinación de 128 (círculos), 200 (cuadros) y 288 (triángulos) celdas.
Relación entre el grosor de la hoja y las variables anatómicas o metabólicas de las hojas
La posibilidad de autocorrelación entre el grosor de la hoja y otras variables analizadas (porcentaje de espacios intercelulares, nitrógeno por unidad de superficie, clorofila por unidad de superficie y concentración de azúcares no reductores) se estudió mediante un análisis de regresión. Mientras que se observaron relaciones no significativas entre la proporción de espacios intercelulares (Figura 6a), el contenido de nitrógeno de la hoja (Figura 6b), el contenido de clorofila (Figura 6c) y el grosor de la hoja, se encontró una correlación significativa entre el contenido de azúcares no reductores y el grosor de la hoja (Figura 6d) (r2 = 0.606).

Figura 6 Relación entre grosor de la hoja y las variables anatómicas y metabólicas de las hojas. Las ecuaciones de la regresión lineal son: a) Espacios intercelulares = 0.15grosor de la hoja + 14.17 (r2 = 0.103), b) contenido de nitrógeno foliar = 0.001grosor de la hoja + 0.22 (r2 = 0.076), c) contenido de clorofila = 0.07grosor de la hoja + 194.25 (r2 = 0.021) y d) azúcares no reductores = 0.04grosor de la hoja - 5.67 (r2 = 0.606; P ≤ 0.001). Los símbolos indican testigos (negro), BAP en pre-trasplante (blanco) y BAP en post-trasplante (gris), correspondientes a charolas de germinación de 128 (círculos), 200 (cuadros) y 288 (triángulos) celdas.
Cuando todos los datos de la tasa fotosintética se graficaron contar el volumen del mesófilo foliar (Figura 7a), se encontró una relación directa significativa (r2 = 0.612). Sin embargo, relaciones más altas se encontraron al analizar los datos de pre- y post-trasplante por separado (r2 = 0.757 y r2 = 0.866, respectivamente) (Figura 7).
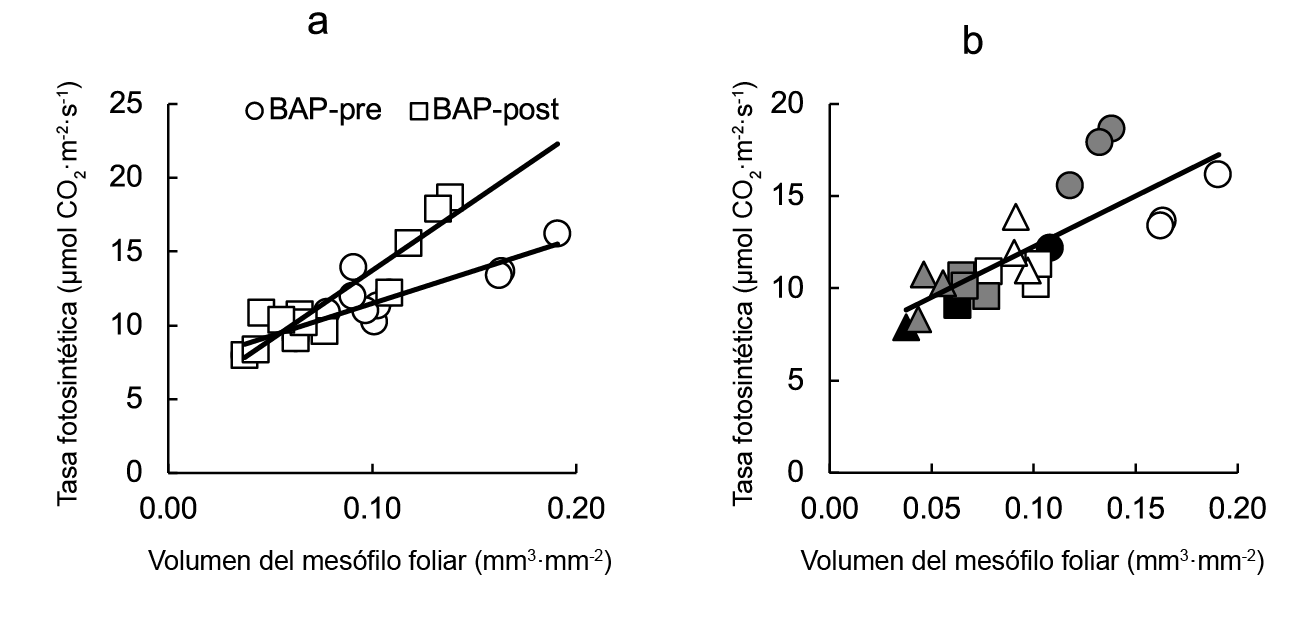
Figura 7 Relación entre la tasa fotosintética y el volumen del mesófilo foliar de plantas de lechuga aspejadas con BAP en pre- y post-trasplante (a). La figura b muestra la diferencia de los datos para cada tratamiento (número de celdas y aspersiones con BAP). Las ecuaciones de regresión lineal son: tasa fotosintéticaBAP pre-transplante = 0.0004volumen de espacio aéreo + 7.06 (r2 = 0.757), tasa fotosintéticaBAPpost-transplante = 0.0009volumen de espacio aéreo + 4.29 (r2 = 0.866) y tasa fotosintéticadatos combinados = 54.92volumen de espacio aéreo + 6.77 (r2 = 0.612). Los símbolos indican testigos (negro), BAP en pre-trasplante (blanco) y BAP en post-trasplante (gris), correspondientes a charolas de germinación de 128 (círculos), 200 (cuadros) y 288 (triángulos) celdas.
Discusión
Diversos artículos realizados en especies hortícolas y ornamentales indica que los efectos de la restricción de raíces debida a macetas de trasplante pequeñas pueden ser, al menos parcialmente, superados mediante el suministro exógeno de citoquinina (Di Benedetto et al., 2020b). La aplicación de esta hormona, ya sea en etapas previas o tempranas después del trasplante, a menudo revierte la restricción radical al promover la asimilación de carbono, lo cual finalmente resulta en la recuperación del desarrollo de la planta y la acumulación de biomasa, aunque esto puede depender de la severidad de la restricción radical, la concentración de la hormona y el momento de la aplicación de citoquinina (Di Benedetto et al., 2020a). Los datos obtenidos en este trabajo coinciden, en gran medida, con informes de otras especies, ya que se observó un aumento en la acumulación de biomasa de la planta y una promoción del desarrollo del área fotosintética (Cuadro 2) asociado a una producción foliar más rápida y a una mayor área foliar individual.
La disminución del volumen de las celdas (de 128 a 288), por charola dio lugar a una marcada reducción de los valores de la TAN (Figura 1b) y de la fotosíntesis neta (Figura 3a). Sin embargo, el impacto en la TCR fue, en general, menor (Figura 1a), debido al aumento progresivo de la RAF observado en las plantas cultivadas en celdas más pequeñas (Figura 1c). Por ello, el cambio en la asignación de recursos, priorizando el desarrollo del área foliar, se puede considerar como una respuesta adaptativa que tiende a compensar el fuerte impacto negativo de la restricción radical sobre la fijación de carbono. El deterioro de la asimilación de carbono debido a la restricción de las raíces se ha reportado en cultivos hortícolas y ornamentales como el tomate (Shi, Ding, Dong, Zhou, & Yu, 2008), pothos (Di Benedetto et al., 2015b) y ficus (Di Benedetto et al., 2020c).
Como se esperaba, la aplicación exógena de citoquinina contrarrestó, en general, el impacto negativo de la restricción radical en el crecimiento de la planta, dando como resultado un mayor desarrollo del área foliar y un mayor crecimiento de la planta que los testigos no tratados (Cuadro 3); principalmente, se observó un aumento de la TAN promedio (Figura 1c) y de la tasa fotosintética neta (Figura 3a). Además, las aspersiones de BAP fueron relativamente más efectivas para promover la TAN en las plántulas cultivadas en las celdas más pequeñas (es decir, las cultivadas en charolas de germinación de 288 celdas). Esto es coherente con las expectativas, ya que se supone que las plantas sometidas a una severa restricción radical producen la menor cantidad de citoquinina, la cual se sintetiza en los ápices de las raíces (Zhang et al., 2014).
Trabajos realizados en otras especies han demostrado que la respuesta de las plantas al aumento de la concentración de BAP suele alcanzar un máximo, lo cual sugiere la existencia de una concentración óptima de dicha hormona en los tejidos (Araki, Rattin, Di Benedetto, & Miravé, 2007). En concordancia con esto, los resultados obtenidos en este trabajo muestran que al duplicar la concentración de BAP de 50 a 100 mg·L-1 no se observó un efecto significativo en la promoción del crecimiento, encontrándose respuestas similares cuando el BAP se aplicó en cualquiera de las etapas (pre- o post-trasplante).
A pesar de promover el desarrollo del área foliar, el tratamiento con BAP produjo una disminución de la RAF, lo cual fue más notable en las plantas cultivadas en las celdas más pequeñas. Dicha disminución se podría atribuir a un mayor crecimiento de las raíces, junto con una menor área foliar específica, que a su vez se asoció con un mayor grosor de las hojas (Cuadro 5) y una mayor concentración de azúcar en las plantas asperjadas, en comparación con los testigos (Cuadro 6). Así, las plantas tratadas con BAP mostraron cambios morfo-fisiológicos que tendieron a compensar los efectos provocados por la restricción radical.
Los procesos fisiológicos involucrados en la promoción del crecimiento mediada por la citoquinina en plantas con raíces restringidas han recibido poca atención. Se sabe que las citoquininas promueven el desarrollo del aparato fotosintético, incluyendo la ultra-estructura del cloroplasto y la síntesis de la clorofila, especialmente durante la transición de etioplasto a cloroplasto (Cortleven & Schmülling, 2015).
Entre los procesos más importantes relacionados con la asimilación de carbono, la citoquinina incrementa la abundancia de proteínas para ejercer su papel en el desarrollo y la función del cloroplasto. La citoquinina aumenta la expresión de genes nucleares relacionados con los plastos, como CAB, que codifican las proteínas de unión de la clorofila del fotosistema II, y también los genes que codifican las subunidades pequeñas y grandes de la rubisco (Cortleven & Schmülling, 2015; Liu et al., 2017). Asimismo, la citoquinina acelera la biosíntesis de la clorofila, promoviendo la síntesis del precursor ácido 5-aminolevulínico y aumentando la actividad de la NADPH:protoclorofilida oxidorreductasa, que convierte la protoclorofilida en clorofilida (Cortleven & Schmülling, 2015).
Se ha planteado la hipótesis de que los efectos promotores del crecimiento de la citoquinina exógena sobre las plántulas con raíces restringidas se podrían explicar por el aumento del contenido de clorofila o de nitrógeno, lo cual, en última instancia, daría lugar a la promoción de la tasa fotosintética (Di Benedetto et al., 2020c).
Los resultados obtenidos muestran que el contenido de nitrógeno se vio afectado principalmente por el tamaño de la celda (Cuadro 5), siendo significativamente variable el impacto de las aplicaciones de BAP. La variación en el contenido de nitrógeno sólo podría explicar los cambios en la fijación de carbono a valores de nitrógeno muy bajos (es decir, inferiores a 0.5 mg·cm-2), observados en las plantas cultivadas en las celdas más pequeñas (Figura 5). Debido a la fertirrigación aplicada semanalmente, la disponibilidad de nitrógeno en el sustrato se puede considerar como no limitante, y bajo estas condiciones se espera que las plantas C3, como la lechuga, sinteticen grandes cantidades de proteínas fotosintéticas, lo cual hace que la fotosíntesis limitada por la actividad de la rubisco sea mayormente improbable (Sage & Coleman, 2001).
Adicionalmente, se observó que la concentración de clorofila en las hojas no fue modificada por la BAP, ni en la aplicación previa ni en la posterior al trasplante, independientemente del tamaño de la celda (Cuadro 5). Además, cualquier variación en la concentración de clorofila entre los tratamientos no se asoció con las variables de fijación de carbono, lo cual contrasta con la sugerencia de Croft et al. (2017), ya que afirman que el contenido de clorofila en las hojas se puede considerar como un indicador de la capacidad fotosintética de las mismas. Aunque la razón de esta aparente discrepancia no está clara, hay que tener en cuenta que la promoción de la síntesis de clorofila por parte de la citoquinina se ha observado sobre todo en plántulas cultivadas en oscuridad (Cortleven & Schmülling, 2015), y que estudios realizados con plantas cultivadas en invernadero de varias especies también han mostrado una falta de respuesta de la clorofila a las aspersiones de BAP (Di Benedetto et al., 2015a). Esto se puede interpretar desde un punto de vista eco-fisiológico, ya que los valores máximos de intensidad lumínica diaria en los presentes experimentos estaban cerca de los reportados como intensidades de saturación para lechuga (Wang, Lu, Tong, & Yang, 2016), por lo que no se esperaría que cualquier aumento adicional en la captura de luz promueva significativamente la fotosíntesis.
Otra posible explicación de la promoción de la fijación del carbono, inducida por citoquinina en plantas con raíces con espacio restringido, es que los cambios morfo-anatómicos impulsados por la hormona pueden afectar la difusión del carbono hacia los cloroplastos. En este estudio, la proporción de los espacios intercelulares se vio severamente disminuida al reducir el volumen de las celdas. Por el contrario, la BAP indujo una notable recuperación de sus valores en las plantas cultivadas en bandejas de 288 celdas, particularmente en las aplicaciones previas al trasplante (Cuadro 4). Esta respuesta, junto con un incremento en el grosor de la hoja observado frecuentemente en plantas tratadas con BAP (Cuadro 4), generó un incremento en el volumen del espacio libre por unidad de superficie foliar, el cual estuvo fuertemente correlacionado con la tasa fotosintética (Figura 4b); esto puede ayudar a la difusión del CO2 hacia los cloroplastos.
Bosselaers (1983) abordó la posible asociación entre la promoción de la fotosíntesis por la citoquinina y el aumento de la difusión de gases en su estudio sobre los cambios estructurales de las hojas de Phaseolus como consecuencia de la aplicación de kinetina o BAP. Sin embargo, en ese estudio se concluyó que los cambios debidos a la aplicación de citoquinina parecían tener poco impacto en la resistencia a la difusión de las hojas. No obstante, hay que considerar que en el estudio de Booselaers las plantas no estaban restringidas radicalmente, y que se aplicaron altas dosis de hormonas durante cinco días consecutivos, lo cual pudo haber aumentado la concentración endógena de citoquinina por encima de los niveles óptimos.
En cualquier caso, existe interés en estudiar el impacto de la anatomía foliar en la difusión de CO2 (Evans, Kaldenhoff, Genty, & Terashima, 2009; Kaldenhoff, 2012; Han et al., 2018; Ren, Weraduwage, & Sharkey, 2019; Roig-Oliver et al., 2020). Un trabajo reciente de Rhodospatha oblongata sometida a ambientes lumínicos contrastantes enfatiza el impacto de las hojas más gruesas, con parénquima esponjoso más grande y mayores espacios intercelulares, en la tasa fotosintética máxima (Mantuano, Ornellas, Aidar, & Mantovani, 2021). Por ello, el papel de la citoquinina en los cambios de la anatomía foliar asociados a la capacidad fotosintética merece más estudios.
En condiciones de irradiación no limitante, la tasa fotosintética neta de las plantas C3 suele estar limitada por el CO2 (Sage & Coleman, 2001), condición que, probablemente, ha impulsado la evolución de las plantas (Beerling, 2012). Décadas de estudios centrados en el efecto del enriquecimiento de CO2 en aire libre en la biología de las plantas han puesto de manifiesto que las plantas C3, a diferencia de las C4, aumentan su tasa fotosintética y la producción de biomasa (Long, Ainsworth, Leakey, Nösberger, & Ort, 2006; Donohue, Roderick, McVicar, & Farquhar, 2013). En lechuga, el enriquecimiento de CO2 (de 355 a 800-900 ppm [Mortensen, 1994], de 400 a 800 ppm [Kitaya, Niu, Kozai, & Ohashi, 1998] y de 200 a 1,000 ppm [Becker & Kläring, 2016] ) ha mostrado una promoción de la acumulación de masa seca en la parte aérea, que va del 18 al 100 %, dependiendo de los experimentos.
La posibilidad de que la reversión de la restricción radical por citoquinina se vea mediada por cambios en la vía de difusión del CO2 hacia los cloroplastos es coherente con el hecho de que varias respuestas de las plantas observadas en el presente trabajo son similares a las reportadas en plantas de lechuga cultivadas bajo enriquecimiento de CO2, como el aumento del grosor de la hoja (Giri, Armstrong, & Rajashekar, 2016), el aumento de la concentración de azúcar (Becker & Kläring, 2016) y la disminución del área foliar específica (Kitaya et al., 1998), siendo esta última una variable que depende tanto del grosor de la hoja como de la concentración de metabolitos. En el presente trabajo, se encontró una correlación significativa entre la concentración de azúcar y el grosor de la hoja (Figura 6d), lo cual podría estar asociado al agrandamiento de las células del mesófilo impulsado por efecto osmótico. Además, los aumentos en la concentración de azúcar y en el grosor de la hoja son características de calidad deseables en la lechuga, especialmente porque contribuyen a una vida poscosecha prolongada (Zhang et al., 2007; Lin et al., 2013).
La lechuga es un cultivo hortícola importante en todo el mundo, y maximizar tanto la producción como la calidad es un objetivo central que se debe alcanzar. Los sistemas de producción modernos pueden imponer condiciones estresantes que deben ser superadas para lograr este objetivo (Rao, Laxman, & Shivashankara, 2016; Wien & Stützel, 2020). Se ha sugerido el uso de diferentes bioestimulantes como mitigadores de estrés abiótico, incluyendo las restricciones radicales durante el almácigo, y muchos de estos compuestos contienen hormonas vegetales, como la auxina y la citoquinina (Bulgari, Franzoni, & Ferrante, 2019; Di Benedetto et al., 2020a, 2020b).
El presente trabajo muestra que la producción y ciertos atributos de la lechuga se pueden incrementar en plantas con raíces restringidas cuando se someten a una aplicación exógena única de citoquinina. Además, dichas respuestas se pueden asociar con ciertas características anatómicas foliares, las cuales pueden mejorar la difusión de CO2 y, por lo tanto, incrementar la capacidad fotosintética de las plantas.
Conclusiones
La asimilación de carbono de las plántulas de lechuga cultivadas en celdas pequeñas se vio potenciada por la aplicación exógena de BAP. Este efecto se asoció a cambios en la anatomía foliar, como el aumento de la proporción de espacios de aire libre y del grosor de la hoja, que en conjunto pueden favorecer la difusión de CO2 hacia los cloroplastos. Por el contrario, a pesar de suposiciones previas, no se observaron cambios en la concentración de clorofila, mientras que el aumento de la concentración de nitrógeno en las hojas por unidad de superficie foliar pareció desempeñar un papel relativamente menor. Se encontró una correlación significativa entre el aumento de la concentración de azúcar impulsados por el BAP y el grosor de las hojas, lo cual puede representar características de calidad deseables en esta especie.
En resumen, el presente trabajo muestra que tanto la producción, como ciertos atributos de calidad de la lechuga, pueden ser promovidos en plantas con raíces restringidas cuando son sometidas a una aplicación exógena de citoquinina, en asociación con cambios anatómicos en las hojas que podrían potenciar la capacidad fotosintética de la planta.
Agradecimientos
Este trabajo fue financiado por el Programa de Ciencia de la Universidad de Buenos Aires 2018-2020 mediante el subsidio 145BA y por el Programa de Ciencia de la Universidad de Mar del Plata mediante AGR 555/18.
REFERENCIAS
Araki, A., Rattin, J., Di Benedetto, A., & Miravé, P. (2007). Temperature and cytokinin relationships on lettuce (Lactuca sativa L.) and celery (Apium graveolens L.) nursery growth and yield. International Journal of Agricultural Research, 2(8), 725-730. doi: 10.3923/ijar.2007.725.730 [ Links ]
Becker, C., & Kläring, H. P. (2016). CO2 enrichment can produce high red leaf lettuce yield while increasing most flavonoid glycoside and some caffeic acid derivative concentrations. Food Chemistry, 199, 736-745. doi: 10.1016/j.foodchem.2015.12.059 [ Links ]
Beerling, D. J. (2012). Atmospheric carbon dioxide: a driver of photosynthetic eukaryote evolution for over a billion years?. Philosophical Transactions of the Royal Society B, 367(1588), 477-482. doi: 10.1098/rstb.2011.0276 [ Links ]
Boonman, A., Prinsen, E., Gilmer, F., Schurr, U., Peeters, A., Voesenek, L., & Pons, T. L. (2007). Cytokinin import rate as a signal for photosynthetic acclimation to canopy light gradients. Plant Physiology, 143(4), 1841-1852. doi: 10.1104/pp.106.094631 [ Links ]
Bosselaers, J. P. (1983). Cytokinin effects on leaf architecture in Phaseolus vulgaris L. Journal of Experimental Botany, 34(8), 1007-1017. doi: 10.1093/jxb/34.8.1007 [ Links ]
Bulgari, R., Franzoni, G., & Ferrante, A. (2019). Biostimulants application in horticultural crops under abiotic stress conditions. Agronomy, 9(6), 306-336. doi: 10.3390/agronomy9060306 [ Links ]
Campolongo, L., Carnelos, D., Miglioli, J. L., Fuginuma, P., Giardina, E., & Di Benedetto, A. (2020). Physiological mechanism involved in the response to four lettuce varieties to a pre-transplant root restriction and a 6, benzyl aminopurine (BAP) spray. Asian Journal of Agricultural and Horticultural Research, 5(4), 27-43. doi: 10.9734/AJAHR/2020/v5i430059 [ Links ]
Cortleven, A., & Schmülling, T. (2015). Regulation of chloroplast development and function by cytokinin. Journal of Experimental Botany, 66(16), 4999-5013. doi: 10.1093/jxb/erv132 [ Links ]
Croft, H., Chen, J. M., Luo, X., Bartlett, P., Chen, B., & Staebler, R. M. (2017). Leaf chlorophyll content as a proxy for leaf photosynthetic capacity. Global Change Biology, 23(9), 3513-3524. doi: 10.1111/gcb.13599 [ Links ]
De Lojo, J., Gandolfo, E., Boschi, C., Giardina, E., & Di Benedetto, A. (2019). Pot cell volume, growing media quality and benzyl aminopurine (BAP) spray effects for nursery growth of Impatiens walleriana. International Journal of Plant Soil Science, 27(6), 1-13. doi: 10.9734/IJPSS/2019/v27i630091 [ Links ]
Di Benedetto, A., Tognetti, J., & Galmarini, C. (2010). Biomass production in ornamental foliage plants: Crop productivity and mechanisms associated to exogenous cytokinin supply. American Journal of Plant Science and Biotechnology, 4(1), 1-22. Retrieved from https://www.researchgate.net/profile/Adalberto-Di-Benedetto/publication/264311222 [ Links ]
Di Benedetto, A. (2011). Root restriction and posttransplant effects for bedding pot plants. In: Aquino, J. C. (Ed), Ornamental plants: types, cultivation and nutrition (pp. 47-79). New York, USA: Nova Science Publishers, Inc. USA. Retrieved from https://www.researchgate.net/profile/256678851 [ Links ]
Di Benedetto, A., Galmarini, C., & Tognetti, J. (2015a). Exogenous cytokinin promotes Epipremnum aureum L. growth through enhanced dry weight assimilation rather than through changes in partitioning. American Journal of Experimental Agriculture, 5(5), 419-434. doi: 10.9734/AJEA/2015/13398 [ Links ]
Di Benedetto, A., Galmarini, C., & Tognetti, J. (2015b). Effects of combined or single exogenous auxin and/or cytokinin applications on growth and leaf area development in Epipremnum aureum. Journal of Horticultural Science &. Biotechnology, 90(6), 643-654. doi: 10.1080/14620316.2015.11668727 [ Links ]
Di Benedetto, A., & Tognetti, J. (2016). Técnicas de análisis de crecimiento de plantas: su aplicación a cultivos intensivos. Revista de Investigaciones Agropecuarias, 42(3), 258-282. Retrieved from https://www.redalyc.org/pdf/864/86449712008.pdf [ Links ]
Di Benedetto, A., Galmarini, C., & Tognetti, J. (2018). New insight into how thigmomorphogenesis affects Epipremnum aureum L.: Interactions between vine training system and exogenous auxin and cytokinin action in plant development. Horticulture Brasileira, 36(3), 330-340. doi: 10.1590/S0102-053620180308 [ Links ]
Di Benedetto, A., Giardina, E., de Lojo, J., Gandolfo, E., & Hakim, G. (2020a). Exogenous benzyl amino purine (BAP) applications for the ornamental pot industry. In: Kortesmäki, S. (Ed), Cytokinins: biosynthesis and uses (pp. 1-56). New York, USA: Nova Science Publishers , Inc. Retrieved from https://novapublishers.com/shop/cytokinins-biosynthesis-and-uses/ [ Links ]
Di Benedetto, A., Rattin, J., Carnelos, D., Tognetti, J., Lozano-Miglioli, J., Giardina, E., Araki, A., Coro, M., Pico-Estrada, O., Teruel, J., Di Matteo, J., Gerasi, J., Barrera, L., Alonso, E., & Grigoli, L. (2020b). Technological uses of exogenous cytokinins in vegetables. In: Kortesmäki, S. (Ed), Cytokinins: biosynthesis and uses (pp. 107-155). New York, USA: Nova Science Publishers , Inc. Retrieved from https://novapublishers.com/shop/cytokinins-biosynthesis-and-uses/ [ Links ]
Di Benedetto, A., Galmarini, C., & Tognetti, J. (2020c). Differential growth response of green and variegated Ficus benjamina to exogenous cytokinin and shade. Ornamental Horticulture, 26(2), 259-276. doi: 10.1590/2447-536x.v26i2.2089 [ Links ]
Dobránszki, J., & Drienyovszki, N. M. (2014). Cytokinin-induced changes in the chlorophyll content and fluorescence of in vitro apple leaves. Journal of Plant Physiology, 171(16), 1472-1478. doi: 10.1016/j.jplph.2014.06.015 [ Links ]
Donohue, R. J., Roderick, M. L., McVicar, T. R., & Farquhar, G. D. (2013). Impact of CO2 fertilization on maximum foliage cover across the globe's warm, arid environments. Geophysical Research Letters, 40(12), 3031-3035. doi: 10.1002/grl.50563 [ Links ]
Evans, J. R., Kaldenhoff, R., Genty, B., & Terashima, I. (2009). Resistances along the CO2 diffusion pathway inside leaves. Journal of Experimental Botany, 60(8), 2235-2248. doi: 10.1093/jxb/erp117 [ Links ]
Gandolfo, E., de Lojo, J., Gómez, D., Pagani, A., Molinari, J., & Di Benedetto, A. (2014). Anatomical changes involved in the response of Impatiens wallerana to different pre-transplant plug cell volumes and BAP sprays. European Journal of Horticultural Science, 79(4), 226-232. Retrieved from https://www.pubhort.org/ejhs/2014/file_4435011.pdf [ Links ]
Giri, A., Armstrong, B., & Rajashekar, C. B. (2016). Elevated carbon dioxide level suppresses nutritional quality of lettuce and spinach. American Journal of Plant Science, 7(1), 246-258. doi: 10.4236/ajps.2016.71024 [ Links ]
Glanz-Idan, N., Tarkowski, P., Turečková, V., & Wolf, S. (2020). Root-shoot communication in tomato plants: cytokinin as a signal molecule modulating leaf photosynthetic activity. Journal of Experimental Botany, 71(1), 247-257. doi: 10.1093/jxb/erz399 [ Links ]
Gu, J., Li, Z., Mao, Y., Struik, P. C., Zhang, H., Liu, L., Wang, Z., & Yang, J. (2018). Roles of nitrogen and cytokinin signals in root and shoot communications in maximizing of plant productivity and their agronomic applications. Plant Science, 274, 320-331. doi: 10.1016/j.plantsci.2018.06.010 [ Links ]
Hakim, G., Gandolfo, E., Giardina, E., & Di Benedetto, A. (2017). The effect of the pre-transplant pot media quality on pansy garden performance. International Journal of Plant Soil Science, 19(4), 1-12. doi: 10.9734/IJPSS/2017/36877 [ Links ]
Han, J., Lei, Z., Flexas, J., Zhang, Y., Carriquí, M., Zhang, W., & Zhang, Y. (2018). Mesophyll conductance in cotton bracts: anatomically determined internal CO2 diffusion constraints on photosynthesis. Journal of Experimental Botany, 69(22), 5433-5443. doi: 10.1093/jxb/ery296 [ Links ]
Hönig, M., Plíhalová, L., Husičková, A., Nisler, J., & Doležal, K. (2018). Role of cytokinins in senescence, antioxidant defense and photosynthesis. International Journal of Molecular Science, 19(12), 4045. doi: 10.3390/ijms19124045 [ Links ]
Inskeep, W. P., & Bloom, P. R. (1985). Extinction coefficients of chlorophyll a and b in N, N-dimethylformamide and 80% acetone. Plant Physiology, 77(2), 483-485. doi: 10.1104/pp.77.2.483 [ Links ]
Jordi, W., Schapendonk, A., Davelaar, E., Stoopen, G. M., Pot, C. S., de Visser, R., van Rhijn, J. A., Gan, S., & Amasino, R. M. (2000). Increased cytokinin levels in transgenic P (SAG12)-IPT tobacco plants have large direct and indirect effects on leaf senescence, photosynthesis and N partitioning. Plant Cell Environment, 23(3), 279-289. doi: 10.1046/j.1365-3040.2000.00544.x [ Links ]
Kaldenhoff, R. (2012). Mechanisms underlying CO2 diffusion in leaves. Current Opinion in Plant Biology, 15(3), 276-281. doi: 10.1016/j.pbi.2012.01.011 [ Links ]
Kim, M. J., Moon, Y., Tou, J. C., Mou, B., & Waterland, N. L. (2016). Nutritional value, bioactive compounds and health benefits of lettuce (Lactuca sativa L.). Journal of Food Composition and Analysis, 49, 19-34. doi: 10.1016/j.jfca.2016.03.004 [ Links ]
Kitaya, Y., Niu, G. H., Kozai, T., & Ohashi, M. (1998). Photosynthetic photon flux, photoperiod, and CO2 concentration affect growth and morphology of lettuce plug transplants. HortScience, 33(6), 988-991. doi: 10.21273/HORTSCI.33.6.988 [ Links ]
Lee, J. S., Nath, U. K., Goswami, G., & Nou, I. S. (2017). Assessment of different growing conditions for enhanced postharvest quality and shelf-life of leaf lettuce (Lactuca sativa L.). Agronomy Research, 15(5), 1944-1955. doi: 10.15159/AR.17.062 [ Links ]
Lin, K. H., Huang, M. Y., Huang, W. D., Hsu, M. H., Yang, Z. W., & Yang, C. M. (2013). The effects of red, blue, and white light-emitting diodes on the growth, development, and edible quality of hydroponically grown lettuce (Lactuca sativa L. var. capitata). Scientia Horticulturae-Amsterdam, 150, 86-91. doi: 10.1016/j.scienta.2012.10.002 [ Links ]
Liu, X., Li, Y., & Zhong, S. (2017). Interplay between light and plant hormones in the control of Arabidopsis seedling chlorophyll biosynthesis. Frontiers in Plant Science , 8, 1433. doi: 10.3389/fpls.2017.01433 [ Links ]
Long, S. P., Ainsworth, E. A., Leakey, A. D., Nösberger, J., & Ort, D. R. (2006). Food for thought: lower-than-expected crop yield stimulation with rising CO2 concentrations. Science, 312(5782), 1918-1921. doi: 10.1126/science.1114722 [ Links ]
Mantuano, D., Ornellas, T., Aidar, M., & Mantovani, A. (2021). Photosynthetic activity increases with leaf size and intercellular spaces in an allomorphic lianescent aroid. Functional Plant Biology, 48(6), 557-566. doi: 10.1071/FP20215 [ Links ]
Mortensen, L. M. (1994). Effects of elevated CO2 concentrations on growth and yield of eight vegetable species in a cool climate. Scientia Horticulturae-Amsterdam, 58(3), 177-185. doi: 10.1016/0304-4238(94)90149-X [ Links ]
Muniz-de Oliveira, L., Paiva, R., Ferreira-de Santana, J., Alves, E., Cravo-Nogueira, R., & Dionísio-Pereira, F. (2008a). Effect of cytokinins on in vitro development of autotrophism and acclimatization of Annona glabra L. In Vitro Cellular & Development Biology, 44(2), 128-135. doi: 10.1007/s11627-008-9119-0 [ Links ]
Muniz-de Oliveira, L., Paiva, R., Aloufa, M. A., Mauro-de Castro, E., Ferreira-de Santana, J., & Cravo-Nogueira, R. (2008b). Effects of cytokinins on the leaf anatomy and growth of Annona glabra L. during in vitro and ex vitro culture. Ciencia Rural, 38(5), 1447-1451. Retrieved from https://periodicos.ufsm.br/cr/article/view/57028 [ Links ]
Ookawa, T., Naruoka, Y., Sayama, A., & Hirasawa, T. (2004). Cytokinin effects on ribulose- 1, 5-bisphosphate carboxylase/oxygenase and nitrogen partitioning in rice during ripening. Crop Science, 44(6), 2107-2115. doi: 10.2135/cropsci2004.2107 [ Links ]
Rao, N. S., Laxman, R. H., & Shivashankara, K. S. (2016). Physiological and morphological responses of horticultural crops to abiotic stresses. In: Srinivasa-Rao, N. K., Shivashankara, K. S., & Laxman, R. H. (Ed), Abiotic Stress Physiology of Horticultural Crops (pp. 3-17). New Delhi: Springer. doi: 10.1007/978-81-322-2725-0_1 [ Links ]
Ren, T., Weraduwage, S. M., & Sharkey, T. D. (2019). Prospects for enhancing leaf photosynthetic capacity by manipulating mesophyll cell morphology. Journal of Experimental Botany, 70(4), 1153-1165. doi: 10.1093/jxb/ery448 [ Links ]
Richards, D., & Rowe, R. N. (1977). Effects of root restriction, root pruning and 6-nenzylaminopurine on the growth of peach seedlings. Annals of Botany, 41(4), 729-740. doi: 10.1093/oxfordjournals.aob.a085347 [ Links ]
Roig-Oliver, M., Bresta, P., Nadal, M., Liakopoulos, G., Nikolopoulos, D., Karabourniotis, G., Bota, J., & Flexas, J. (2020). Cell wall composition and thickness affect mesophyll conductance to CO2 diffusion in Helianthus annuus under water deprivation. Journal of Experimental Botany , 71(22), 7198-7209. doi: 10.1093/jxb/eraa413 [ Links ]
Ruffel, S., Krouk, G., Ristova, D., Shasha, D., Birnbaum, K. D., & Coruzzi, G. M. (2011). Nitrogen economics of root foraging: Transitive closure of the nitrate-cytokinin relay and distinct systemic signaling for N supply vs. demand. Proceedings of the National Academy of Sciences, USA, 108(45), 18524-18529. doi: 10.1073/pnas.1108684108 [ Links ]
Sage, R. F., & Coleman, J. R. (2001). Effects of low atmospheric CO2 on plants: more than a thing of the past. Trends Plant Science , 6(1), 18-24. doi: 10.1016/S1360-1385(00)01813-6 [ Links ]
Shehata, S. M., Schmidhalter, U., Valšíková, M., & Junge, H. (2016). Effect of bio-stimulants on yield and quality of head lettuce grown under two sources of nitrogen. Gesunde Pflanzen, 68(1), 33-39. doi: 10.1007/s10343-016-0357-5 [ Links ]
Shi, K., Ding, X. T., Dong, D. K., Zhou, Y. H., & Yu, J. Q. (2008). Root restriction-induced limitation to photosynthesis in tomato (Lycopersicon esculentum Mill.) leaves. Scientia Horticulturae-Amsterdam, 117(3), 197-202. doi: 10.1016/j.scienta.2008.04.010 [ Links ]
Stagnari, F., Galieni, A., & Pisante, M. (2015). Shading and nitrogen management affect quality, safety and yield of greenhouse-grown leaf lettuce. Scientia Horticulturae-Amsterdam, 192, 70-79. doi: 10.1016/j.scienta.2015.05.003 [ Links ]
Wang, J., Lu, W., Tong, Y., & Yang, Q. (2016). Leaf morphology, photosynthetic performance, chlorophyll fluorescence, stomata development of lettuce (Lactuca sativa L.) exposed to different ratios of red light to blue light. Frontiers in Plant Science , 7, 250. doi: 10.3389/fpls.2016.00250 [ Links ]
Warton, D. I., Duursma, R. A., Falster, D. S., & Taskinen, S. (2012). Smatr 3-an R package for estimation and inference about allometric lines. Methods in Ecology and Evolution, 3(3), 257-259. doi: 10.1111/j.2041-210X.2011.00153.x [ Links ]
Wien, H. C., & Stützel, H. (2020). The physiology of vegetable crops. USA: CABI. https://www.cabi.org/bookshop/book/9781786393777/ [ Links ]
Zhang, F. Z., Wagstaff, C., Rae, A. M., Sihota, A. K., Keevil, C. W., Rothwell, S. D., Clarkson, G. J., Michelmore, E. W., Truco, M. J., Dixon, M. S., & Taylor, G. (2007). QTLs for shelf life in lettuce co-locate with those for leaf biophysical properties but not with those for leaf developmental traits. Journal of Experimental Botany , 58(6), 1433-1449. doi: 10.1093/jxb/erm006 [ Links ]
Zhang, K., Novak, O., Wei, Z., Gou, M., Zhang, X., Yu, Y., Yang, H., Cai, Y., Strnad, M., & Liu, C. J. (2014). Arabidopsis ABCG14 protein controls the acropetal translocation of root-synthesized cytokinins. Nature Communications, 5(1), 1-12. doi: 10.1038/ncomms4274 [ Links ]
Recibido: 22 de Junio de 2021; Aprobado: 05 de Enero de 2022











 texto en
texto en 


