Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.28 no.1 Chapingo ene./abr. 2022 Epub 01-Ago-2022
https://doi.org/10.5154/r.rchsh.2021.03.004
Articles
Propagación in vitro de familias de plantas selectas de tomate de cáscara (Physalis ixocarpa Brot. ex Horm.)
1Universidad Autónoma Chapingo, Departamento de Fitotecnia. Carretera México-Texcoco km 38.5, Chapingo, Estado de México, C. P. 56230, MÉXICO.
El objetivo fue propagar de manera in vitro plantas selectas de Physalis ixocarpa, aclimatizarlas y describir su ciclo fenológico. Se evaluó la respuesta in vitro de ápices de tallo en familias de las variedades Tecozautla 04, Manzano Tepetlixpa y Morado San Miguel. Los ápices se cultivaron en un medio con las sales inorgánicas Murashige y Skoog (100 %), suplementado con 0.4 mg·L-1 de tiamina, 60 mg·L-1 de L-cisteína, 100 mg·L-1 de myo-inositol, 0.5 mg·L-1 de ácido nicotínico, 0.5 mg·L-1 de ácido pantoténico, 3 % de sacarosa y 7 g·L-1 de agar, sin reguladores del crecimiento y el pH ajustado a 5.7 ± 0.1. El enraizamiento in vitro se hizo durante 30 días, con 16 h de luz a 3,000 µmol⋅m-2⋅s-1. Las variables evaluadas in vitro fueron altura de plántula, vigor, callo, longitud de raíz, número de hojas, raíces, tallos y botones. Las plantas producidas in vitro se aclimatizaron y trasplantaron en invernadero para dar seguimiento a su ciclo fenológico. Las variables evaluadas en aclimatación y ciclo fenológico fueron altura de planta, número de hojas, botones, flores y bolsas. Se usó un diseño completamente al azar para la evaluación in vitro, y bloques completos al azar para invernadero. Las familias con mejores respuestas morfogénicas in vitro fueron Tecozautla 04 y Manzano, y en el desarrollo fenológico presentaron mayor altura de planta. En la aclimatación, la sobrevivencia fue de 100 % en todos los clones. Las respuestas in vitro, la aclimatación y la fenología dependieron de la variedad y de las familias.
Palabras clave aclimatización; cultivo in vitro; fenología
The objective was to propagate select Physalis ixocarpa plants in vitro, acclimatize them and describe their phenological cycle. The in vitro response of stem apices was evaluated in families from the Tecozautla 04, Manzano Tepetlixpa and Morado San Miguel varieties. The apices were cultured in a medium containing Murashige and Skoog inorganic salts (100 %), supplemented with 0.4 mg·L-1 thiamine, 60 mg·L-1 L-cysteine, 100 mg·L-1 myo-inositol, 0.5 mg·L-1 nicotinic acid, 0.5 mg·L-1 pantothenic acid, 3 % sucrose and 7 g·L-1 agar, without growth regulators and the pH adjusted to 5.7 ± 0.1. In vitro rooting was done for 30 days, with 16 h of light at 3,000 µmol⋅m-2⋅s-1. The variables evaluated in vitro were seedling height, vigor, callus presence, root length, and number of leaves, roots, stems and buds. Plants produced in vitro were acclimatized and transplanted in greenhouses to follow their phenological cycle. The variables evaluated in acclimatization and phenological cycle were plant height and number of leaves, buds, flowers and set fruits. A completely randomized design was used for the in vitro evaluation, and randomized complete blocks for the greenhouse. The families with the best morphogenic responses in vitro were Tecozautla 04 and Manzano, and in phenological development they presented greater plant height. In acclimatization, survival was 100% in all clones. In vitro responses, acclimatization and phenology depended on the variety and families.
Keywords acclimatization; in vitro culture; phenology
Introducción
El tomate de cáscara (Physalis ixocarpa Brot. ex Horm.) es la séptima hortaliza que más se cultiva en México, y ocupa el 4.8 % respecto de la producción nacional de hortalizas. Los principales estados productores, en orden de importancia, son Sinaloa, Zacatecas, Jalisco, Puebla y Michoacán, con una participación del 55 % (Servicio de Información Agroalimentaria y Pesquera [SIAP], 2021). De acuerdo con el Servicio Nacional de Inspección y Certificación de Semillas (SNICS, 2021), se dispone de 16 variedades registradas y mejoradas por selección. No obstante, dadas las condiciones ambientales drásticas y la demanda en el mercado nacional e internacional de dicha hortaliza, se requieren variedades con mejores características agronómicas y resistentes a fitopatógenos.
Los métodos genotécnicos más adecuados para la generación de variedades mejoradas son la selección masal visual estratificada (SMVE), la selección familial de medios hermanos (SFMH) y la selección combinada de medios hermanos (SCMH) (Peña-Lomelí & Márquez, 1990). Lo anterior debido a que las plantas presentan autoincompatibilidad de tipo gametofítica (Kant-Pandey, 1957), la cual impide la generación de líneas endogámicas para la formación de híbridos.
Una estrategia para generar híbridos en tomate de cáscara es cruzar poblaciones con cierto grado de endogamia, generada mediante cruzas fraternales o planta a planta en familias élite de alto rendimiento, hasta encontrar una combinación híbrida entre progenitores de rendimiento superior. Sin embargo, la producción comercial de semilla híbrida requiere la propagación y mantenimiento del genotipo de los progenitores a lo largo de las generaciones (Santiaguillo-Hernández, Cervantes-Santana, & Peña-Lomelí, 2004). Esto puede ser posible a través de la reproducción vegetativa por cultivo in vitro (van Groenendael & de Kroon, 1990; Manzo-González et al., 1998).
Uno de los propósitos del cultivo in vitro en los programas de mejoramiento genético es la propagación clonal de las líneas parentales para la producción de semilla híbrida (Dore, 1987). Un método de propagación en cultivo in vitro es a través de ramificación axilar mejorada, usando puntas de tallos y brotes laterales como explantes. La ventaja de este tipo de micropropagación es que se forma muy poco callo, y el grado de anormalidad y variabilidad genética se reduce, lo cual garantiza la estabilidad genética de las plantas propagadas (George & Debergh, 2008).
Respecto al cultivo in vitro de Physalis ixocarpa, se han empleado diferentes fuentes como explantes. Ramírez-Malagón y Ochoa-Alejo (1991) evaluaron la respuesta morfogénica de explantes de hipocótilos cultivados en el medio Murashige y Skoog (1962) (MS), en combinación con benciladenina (BA), ácido naftalenacético (ANA) y 2,4-diclorofenoxiacético (2,4-D). La inducción de brotes y raíces se realizó con una combinación de citoquininas y auxinas. Manzo-González et al. (1998) utilizaron como explantes segmentos de tallo, hoja, peciolo y yemas axilares de las variedades Rendidora, Salamanca y Tamazula, y emplearon el medio de cultivo MS suplementado con ácido 2,4-diclorofenoxiacético (2,4-D), ácido naftalenacético (ANA), benziladenina (BA) y ácido indolacético (AIA).
Andrade-Rodríguez, López-Peralta, González-Hernández, García-Velázquez, y Peña-Lomelí (2005) estudiaron la capacidad de inducción y alargamiento in vitro, enraizamiento in vivo, aclimatación y estabilidad cromosómica de plantas de 10 variedades de Physalis ixocarpa Brot., entre ellas dos variedades silvestres. Además, las plantas regeneradas in vitro se llevaron a la fase de aclimatación en un invernadero mediante el uso de sustrato estéril compuesto por tierra negra y hojas (proporción 1:3) en macetas cubiertas con vasos de plástico transparentes de 1 L.
Es fundamental evaluar las diferentes variedades de tomate de cáscara para conocer su respuesta de regeneración en cultivo in vitro, así como adecuar el medio de cultivo a los genotipos de interés agronómico para un programa de mejoramiento genético; esto debido a que la regeneración in vitro está determinada, principalmente, por el genotipo de las plantas. Dicha influencia se ha observado en la respuesta a la organogénesis de cuatro cultivares de Dianthus caryophyllus L. (Kallak, Reidla, Hilpus, & Virumäe, 1997) y en la inducción de embriogénesis en el cultivo de microsporas de 50 genotipos diferentes de Capsicum annuum L., usando reguladores del crecimiento y carbón activado (Cheng, Ma, Jiao, Quiao, & Li, 2013).
La etapa de aclimatación es la más crítica para las plantas obtenidas in vitro, ya que determina el éxito de la sobrevivencia total de las plantas al trasplante bajo condiciones de invernadero o campo. Los estomas de las plantas cultivadas in vitro son incapaces de cerrar cuando se han retirado por primera vez del cultivo in vitro, lo cual provoca una excesiva evapotranspiración después del trasplante en condiciones ex vitro (Drew, Kavanagh, & Maynard, 1992). Esto produce que las plantas en condiciones ex vitro se marchiten y puedan llegar a morir por pérdida de agua. Para evitar esto, se provee un ambiente de transición adecuado aplicado a la aclimatación en un tiempo de una a varias semanas (Grout & Millam, 1985). En este ambiente de transición, la humedad relativa se debe mantener en un rango de 70 a 100 % mediante un sistema de nebulización (Teixeira-da Silva et al., 2017).
Con base en lo antes expuesto, el presente trabajo se realizó con el objetivo de evaluar la respuesta de familias selectas de tres variedades de tomate de cáscara al cultivo in vitro, así como establecer y evaluar el protocolo para aclimatación de plantas provenientes del cultivo in vitro, y estudiar la fenología de las plantas obtenidas por dicho medio.
Materiales y métodos
El trabajo consistió de dos etapas, y se realizó en el Laboratorio de Cultivo de Tejidos del Departamento de Fitotecnia y en los invernaderos del Campo Agrícola Experimental de la Universidad Autónoma Chapingo. En la primera se llevó a cabo la obtención de yemas axilares y ápices de plantas selectas clonadas con antelación y aclimatadas en el invernadero, las cuales se establecieron bajo condiciones asépticas para su micropropagación y evaluación en el Laboratorio de Cultivo de Tejidos. En la segunda etapa, los clones obtenidos se trasladaron a un invernadero para su aclimatación en un túnel de plástico con humedad relativa constante, después de lo cual se trasplantaron en el invernadero a macetas con tezontle regadas con la solución nutritiva de Steiner (1984) al 100 %.
Se establecieron semillas botánicas de 12 familias de medios hermanos maternos (FMHM) derivadas de tres generaciones de cruzas fraternales de las variedades Diamante, Tecozautla 04, Manzano Tepetlixpa y Morado San Miguel, tres familias por cada variedad. Las familias fueron proporcionadas por el Programa de Mejoramiento Genético de Tomate de Cáscara de la Universidad Autónoma Chapingo. Las 12 familias originales se obtuvieron mediante un ciclo de selección masal y uno de selección familial (Peña-Lomelí & Márquez, 1990). Las 12 familias selectas se sembraron en primavera de 2017 en charolas de poliestireno de 200 cavidades con turba como sustrato. Después de cinco semanas, se trasplantaron a 54 macetas por familia con dos plantas por maceta, las cuales se mantuvieron en un invernadero. Veinte días después del trasplante, se llevó a cabo una selección con base en el mejor individuo por maceta. Se tomaron datos de número de flores, número de frutos, vigor y sanidad de todas las plantas, los cuales únicamente se usaron como criterio para seleccionar los 10 mejores individuos por familia.
De los mejores individuos de cada una de las 12 FMHM establecidas por semilla, se tomaron yemas axilares y ápices de los tallos para su desinfestación, su micropropagación en el Laboratorio de Cultivo de Tejidos, y posterior aclimatación y trasplante en el invernadero. De estas plantas clonadas, en diciembre de 2017 se colectaron yemas axilares y ápices de plantas sanas de las variedades Tecozautla 04, Manzano Tepetlixpa y Morado San Miguel. De los clones originales, debido a respuestas desfavorables en el cultivo in vitro, sólo se obtuvieron clones de las variedades Tecozautla (uno de la familia 2 y otro de la familia 3), Morado San Miguel (dos clones diferentes de la familia 2, dos clones diferentes de la familia 3 y un clon de la familia 1) y Manzano Tepetlixpa (un clon de la familia 2). Es decir, se estudiaron ocho familias clonales, lo cual se debió a que no todas las familias originales tuvieron una respuesta favorable al cultivo in vitro.
El tratamiento de desinfección de yemas consistió en lavar vigorosamente con detergente y Tween 20, separando cuidadosamente ápices y yemas. En seguida, los explantes se sumergieron en una solución de alcohol diluido en agua al 70 % durante 3 min, luego se pasaron a una solución de hipoclorito de sodio (Cloralex®) diluido en agua al 7 % durante 15 min, después se enjuagaron tres veces en agua estéril y, finalmente, se realizó la siembra in vitro.
Para la multiplicación de los ápices y las yemas, se utilizó el medio de cultivo con las sales inorgánicas Murashige y Skoog (1962) al 100 %, suplementado con 0.4 mg·L-1 de tiamina, 60 mg·L-1 L-cisteína, 100 mg·L-1 de myo-inositol, 0.5 mg·L-1 de ácido nicotínico, 0.5 mg·L-1 de ácido pantoténico, 3 % de sacarosa y 7 g·L-1 de agar. El medio de cultivo se ajustó a un pH de 5.7 ± 0.1 y se vertió en tarros de conserva de vidrio claro con volumen de 460 mL (78.3 mm de diámetro y 134.95 mm altura) y tapa con rosca twist-off. A cada tarro se le agregaron 50 mL de medio de cultivo. Los tarros, bisturís, tijeras, cristales y el agua se esterilizaron en una autoclave durante 20 min a 121 °C y presión de 1.5 kg·cm-2. Posteriormente, con los explantes desinfestados y los materiales esterilizados, se sembraron los explantes en una campana de flujo laminar. Una vez sembrados las yemas y los ápices en los tarros, se trasladaron al área de cultivo del laboratorio durante 30 días, con 16 h de luz e iluminación de 3,000 µmol⋅m-2·s-1.
Para la aclimatación, se utilizó como sustrato turba, la cual se esterilizó y se depositó en vasos de unicel de 240 mL. En esta etapa, se extrajeron las plántulas de los frascos de cultivo in vitro, se enjuagaron con agua, se tomaron datos y se trasplantaron a los vasos. Después, los vasos se colocaron en un mini invernadero con un sistema de nebulización de ocho riegos por día, con 1 h de intervalo entre los riegos de 5 min. Con este sistema de nebulización se mantuvo una humedad relativa de 60 a 100 %, y temperatura media de 25 °C. Todo el sistema de aclimatación se mantuvo activo durante 15 días.
Una vez que las plántulas estaban aclimatadas, se trasplantaron al invernadero en macetas de polietileno negro de 18 L, con tezontle como sustrato. Las macetas se regaron por goteo con solución Steiner al 100 % (Steiner, 1984 ). Los datos se tomaron cada dos semanas.
Para evaluar la respuesta a la micropropagación a través del enraizamiento en el laboratorio, se usó un diseño experimental completamente al azar. La unidad experimental se conformó de tres plantas por frasco, con cuatro repeticiones por familia. Se registraron datos de altura de planta in vitro (cm), vigor de tallo (escala ordinal 1, 2, 3), presencia de callo (proporción binomial), sanidad (proporción binomial), longitud de raíz (cm), número de hojas, raíces, tallos y botones.
Para evaluar la aclimatación, se estableció un diseño de bloques completos al zar con cuatro repeticiones, donde la unidad experimental consistió de siete plantas. Se registraron los datos de altura de planta (cm), número de hojas, botones y flores, y se determinó el porcentaje de aclimatización. Para estudiar la fenología de los clones trasplantados en el invernadero, se empleó un diseño de bloques completos al azar con cuatro repeticiones. La unidad experimental fueron siete plantas, y los datos registrados fueron altura de planta, número hojas, flores y bolsas.
Con los datos obtenidos se realizaron análisis de varianza y pruebas de comparación de medias de Tukey (P ≤ 0.05) para las variables en las tres etapas, excepto para vigor de plántula (donde utilizó la prueba de Kruskall-Wallis), y para la presencia de callo y sanidad (donde se realizó la comparación de proporciones binomiales; P ≤ 0.05).
Resultados y discusión
La altura de planta in vitro de las ocho familias clonales mostró una ligera diferencia entre sí, con las mayores alturas en las familias 2 de Tecozautla 04 y Manzano Tepetlixpa, y la familia 3a de Morado San Miguel. Los valores menores fueron de la familia 1 de Morado San Miguel y la familia 3 de Tecozautla 04 (Cuadro 1). Las plantas de la familia 2b de la variedad Morado San Miguel presentaron mayor altura, al igual que las plantas de la familia clonal 2 de la variedad Tecozautla 04 (Figuras 1a y 1b).
Cuadro 1 Comparación de medias de altura de planta, longitud de raíz, número de hojas, raíces, tallos y botones de plantas de tomate de cáscara (Physalis ixocarpa Brot. ex Horm.) in vitro.
| Variedad | Familia | ALT | NH | LR | NR | NT | NB |
|---|---|---|---|---|---|---|---|
| Morado San Miguel | 1 | 4.16 bz | 7.3 b | 1.86 c | 9.6 b | 1.6 a | 1.4 ab |
| Morado San Miguel | 2 a | 8.26 ab | 5.5 b | 15.76 a | 29.9 b | 1.1 ab | 0.4 c |
| Morado San Miguel | 2 b | 8.26 ab | 7.3 b | 7.27 bc | 26.0 b | 1.0 b | 0.3 c |
| Morado San Miguel | 3 a | 9.04 a | 5.4 b | 11.66 ab | 65.5 a | 0.9 b | 0.9 bc |
| Morado San Miguel | 3 b | 6.53 ab | 8.8 b | 5.51 bc | 34.7 b | 1.4 ab | 0.4 c |
| Manzano Tepetlixpa | 2 | 9.79 a | 8.3 b | 6.58 bc | 14.5 b | 1.0 b | 0.0 c |
| Tecozautla 04 | 2 | 10.5 a | 14.7 a | 10.63 ab | 22.1 b | 1.1 ab | 0.0 c |
| Tecozautla 04 | 3 | 4.45 b | 5.3 b | 8.53 bc | 20.5 b | 1.2 ab | 2.1 a |
| DMSH | 4.38 | 4.9 | 6.88 | 27.6 | 0.6 | 1.0 |
ALT = altura de planta (cm); NH = número de hojas; LR = longitud de raíz (cm); NR = número de raíces; NT = número de tallos; NB = número de botones. DMSH = diferencia mínima significativa honesta. zMedias con la misma letra dentro de cada columna no difieren estadísticamente (Tukey, P ≤ 0.05).

Figura 1 Plantas de las familias clonales cultivadas in vitro. a) Planta de la familia 2b de Morado San Miguel, b) planta de la familia 3 de Tecozautla 04, c) sistema radicular de la familia 3 de Tecozautla 04, d) plantas de cultivo in vitro al inicio de la aclimatación y e) plantas de cultivo in vitro después de 15 días de aclimatización.
Para el número de hojas, la familia 2 de la variedad Tecozautla 04 presentó la mayor cantidad en relación con las demás familias, entre las cuales no hubo diferencias significativas en dicha variable (Cuadro 1). Por otro lado, la mayor longitud de raíz la obtuvo la familia 2a de Morado San Miguel, y el menor valor fue de la familia 1 de la misma variedad (Cuadro 1). La familia 3a, de la misma variedad, presentó el mayor desarrollo radical, y en las demás familias, el número de raíces no fue significativamente diferente (Cuadro 1). El sistema radicular de las plantas se desarrolló en mayor o menor medida dependiendo de la familia y la variedad. Las plantas de la familia clonal 3 de la variedad Tecozautla 04 presentaron un desarrollo vigoroso de raíces (Figura 1c).
El mayor número de tallos desarrollados por explante correspondió a la familia 1 de Morado San Miguel; sin embargo, no hubo diferencia significativa en relación con las familias 2a y 3b de la misma variedad, y con ambas familias de Tecozautla 04. Las familias 3a y 2b de Morado San Miguel, y la familia 2 de Manzano Tepetlixpa, presentaron el menor número de tallos (Cuadro 1).
La familia 3 de la variedad Tecozautla 04 presentó el mayor número de botones, pero sin diferencia significativa en relación con la familia 1 de Morado San Miguel. Las demás familias presentaron menor número de botones, sin mostrar diferencias significativas entre sí (Cuadro 1).
Las plantas que desarrollaron el mayor vigor del tallo correspondieron a la familia 2 de Tecozautla, sin mostrar diferencia significativa con la familia 2 de Manzano Tepetlixpa. Las familias 1 de la variedad Morado San Miguel y 3 de Tecozautla 04 desarrollaron el menor vigor en sus tallos (Cuadro 2).
Cuadro 2 Prueba de Kruskall-Wallis para vigor de tallo y comparación de proporciones binomiales para presencia de callo y sanidad en plantas de tomate de cascara (Physalis ixocarpa Brot. ex Horm.) regeneradas in vitro.
| Variedad | Familia | R(x) | Callo | Sanidad |
|---|---|---|---|---|
| Morado San Miguel | 1 | 23.08 ey | 0.667 abz | 0.417 ab |
| Morado San Miguel | 2 a | 49.21 c | 0.167 cd | 0.583 a |
| Morado San Miguel | 2 b | 47.00 cd | 0.333 bc | 0.250 abc |
| Morado San Miguel | 3 a | 53.23 bc | 0.909 a | 0.182 bcd |
| Morado San Miguel | 3 b | 41.67 cd | 0.833 a | 0.083 cd |
| Manzano Tepetlixpa | 2 | 66.96 ab | 0.750 a | 0.000 d |
| Tecozautla 04 | 2 | 71.83 a | 0.000 d | 0.000 d |
| Tecozautla 04 | 3 | 31.46 de | 0.333 bc | 0.167 bcd |
| Tc | 34.43 ** |
Tc = estadístico de la prueba de Kruskall-Wallis; R(x) = rango promedio para vigor de tallo; Callo = proporción binomial de la presencia de callo; Sanidad = proporción binomial de plantas sanas. yRangos con la misma letra no son diferentes (Kruskall-Wallis, P ≤ 0.05). zProporciones con la misma letra dentro de cada columna no difieren estadísticamente (Tukey, P ≤ 0.05). **Significativo con P ≤ 0.01.
Los explantes de las familias 3a y 3b de la variedad Morado San Miguel, y la 2 de Manzano Tepetlixpa, desarrollaron más callos, mientras que las familias 2 de Tecozautla 04 y la 2a de Morado San Miguel presentaron menor cantidad de callos. En cuanto a la sanidad, las plantas de las familias 1, 2a y 2b de Morado San Miguel presentaron más problemas de enfermedad. Las familias 2 de Manzano Tepetlixpa, la 2 de Tecozautla 04, y la 3b y 3a de Morado San Miguel no presentaron problemas de sanidad (Cuadro 2).
La respuesta al número de raíces incrementó de manera exitosa in vitro con el medio MS al 100 % sin adición de reguladores del crecimiento, y varió en función del genotipo. Esto coincide con lo reportado por Manzo-González et al. (1998), quiénes lograron inducir la formación de raíces con el medio MS al 100 % y sin reguladores del crecimiento en las variedades Rendidora, Salamanca y Tamazula de tomate de cáscara, donde obtuvieron diferente número de raíces entre las variedades. Andrade-Rodríguez et al. (2005), al enraizar in vivo 10 variedades de tomate de cáscara provenientes de cultivo in vitro en MS al 100 % sin adición de reguladores del crecimiento, obtuvieron número y longitud de raíces diferentes de acuerdo con el genotipo empleado.
Las respuestas diferenciadas al cultivo in vitro obtenidas entre las familias clonales de las tres variedades estuvo en función del genotipo particular de cada una. Esto fue demostrado por Andrade-Rodríguez et al. (2005), quienes observaron que la capacidad de propagación in vitro del tomate de cáscara varió en función del genotipo de la variedad utilizada. Muktadir, Habib, Mian, y Akhond (2016) también encontraron respuestas diferentes en el cultivo in vitro de cinco variedades de Solanum melongena L. respecto al número de brotes regenerados por explante y su enraizamiento.
Al inicio de la aclimatación, la familia 1 de Morado San Miguel presentó la menor altura respecto de las otras familias, entre las que no hubo diferencias significativas (Cuadro 3). Después de dos semanas bajo aclimatación, las familias 1 y 3b de la variedad Morado San Miguel, y la 2 de Tecozautla 04, presentaron la menor altura (Figura 2a). En general, las familias clonales de mayor altura al inicio de la aclimatación la conservaron durante todo el periodo evaluado.
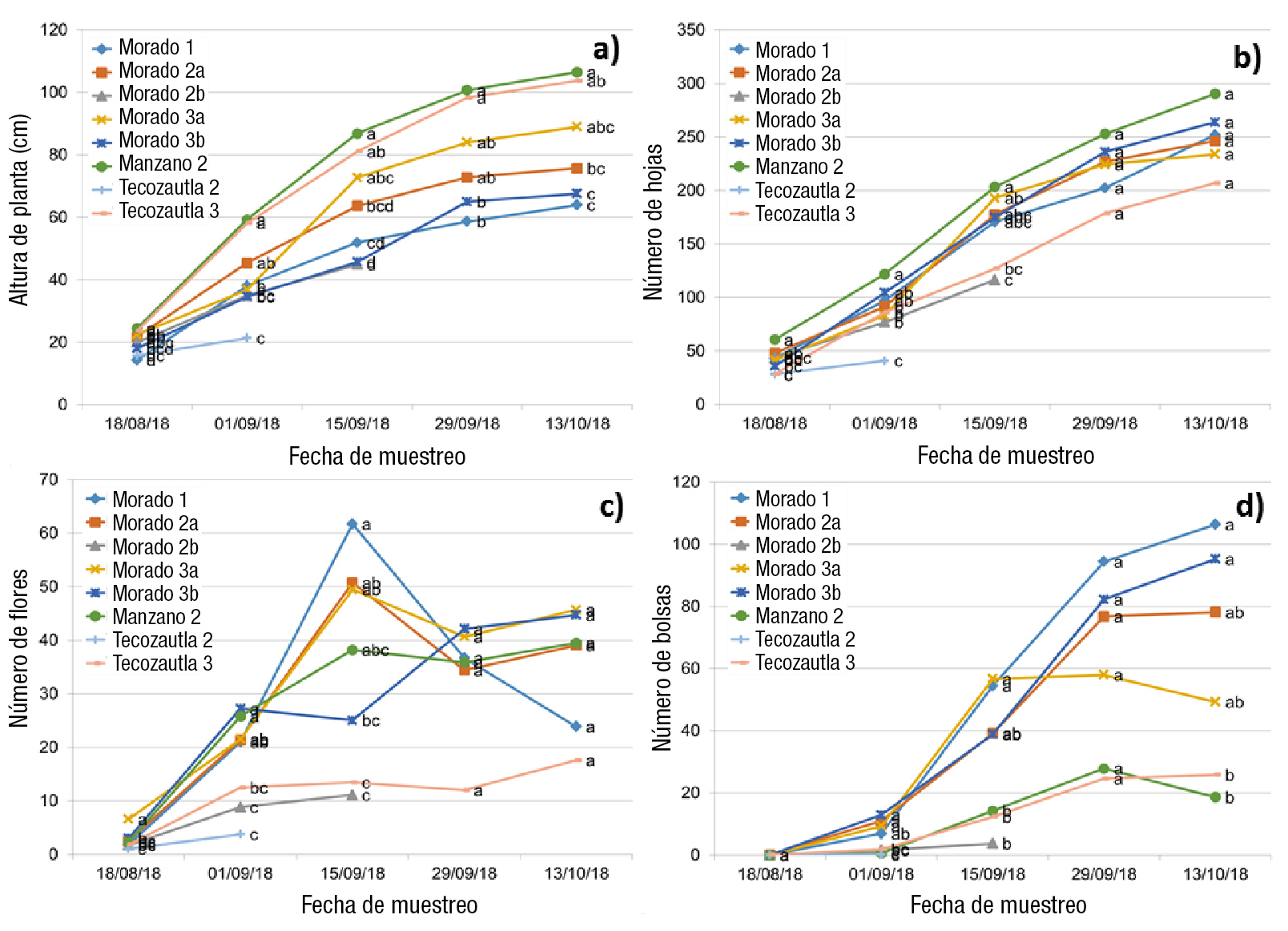
Figura 2 Comparación de medias entre familias de clones de tres variedades de tomate de cáscara (Physalis ixocarpa Brot. ex Horm.) bajo invernadero durante 75 días a partir de la aclimatización. a) Altura de planta, b) número de hojas, c) número de flores y d) número de bolsas. Medias con la misma letra, para cada fecha y variable, no difieren estadísticamente (Tukey, P ≤ 0.05).
En cuanto al número de hojas, al comenzar la aclimatación, la familia 3b de Morado San Miguel fue la que presentó más hojas, y la familia 3 de Tecozautla tuvo el menor número de hojas (Cuadro 3). Después de la aclimatación, el mayor número de hojas correspondió a la familia 1 de Morado San Miguel, y la menor cantidad de hojas fue para la familia 2 de la variedad Tecozautla 04 (Figura 2b).
Cuadro 3 Comparación de medias de la altura de planta, número de hojas, flores, botones y tallos tomados de plantas de tomate de cáscara (Physalis ixocarpa Brot. ex Horm.) regeneradas in vitro para aclimatación.
| Variedad | Familia | ALT | NH | NF | NB | NT |
|---|---|---|---|---|---|---|
| Morado San Miguel | 1 | 4.42 bz | 11.6 de | 0.0 b | 1.3 cd | 1.6 a |
| Morado San Miguel | 2 a | 12.95 a | 13.6 cde | 0.3 a | 2.3 bc | 1.2 ab |
| Morado San Miguel | 2 b | 13.66 a | 16.7 abcd | 0.1 ab | 3.0 ab | 1.3 ab |
| Morado San Miguel | 3 a | 12.92 a | 18.6 abc | 0.2 ab | 4.0 a | 1.5 ab |
| Morado San Miguel | 3 b | 12.38 a | 21.3 a | 0.0 b | 0.8 d | 1.4 ab |
| Manzano Tepetlixpa | 2 | 10.87 a | 14.2 bcde | 0.0 b | 1.5 cd | 1.3 ab |
| Tecozautla 04 | 2 | 10.88 a | 19.8 ab | 0.1 ab | 1.8 bcd | 1.3 ab |
| Tecozautla 04 | 3 | 11.28 a | 10.1 e | 0.1 ab | 2.2 bcd | 1.1 b |
| DMSH | 2.96 | 5.8 | 0.3 | 1.4 | 0.5 |
ALT = altura de planta (cm); NH = número de hojas; NF = número de flores; NB = número de botones; NT = número de tallos. DMSH = diferencia mínima significativa honesta. zMedias con la misma letra dentro de cada columna no difieren estadísticamente (Tukey, P ≤ 0.05).
El mayor número de botones lo presentaron las familias 3a y 2b de la variedad Morado San Miguel, y la menor cantidad de botones fueron de las familias 1 y 3b de Morado San Miguel, 2 y 3 de Tecozautla 04, y 2 de Manzano Tepetlixpa (Cuadro 3). Después de la aclimatación, todas las familias presentaron una cantidad de botones que no eran significativamente diferentes entre sí (Figura 2c).
Respecto a la cantidad de flores previo a la aclimatación, la familia 2a de Morado San Miguel fue la que presentó más flores, y las únicas familias que no presentaron flores fueron la 1 y 3b de la misma variedad (Cuadro 3). Posterior a la aclimatación, la familia que desarrolló más flores fue la 3a de Morado San Miguel, y la familia 2 de Tecozautla 04 resultó con menor número de flores (Figura 2d). La familia con mayor número de tallos fue la 1 de Morado San Miguel, aunque solo superó significativamente a la familia 3 de Tecozautla, que fue la de menor valor (Cuadro 3).
Al inicio de la etapa de aclimatación, las plantas presentaron una transpiración excesiva (Figura 1d), debido a las condiciones anatómicas de las hojas provenientes del cultivo in vitro. No obstante, para todas las familias clonales de las tres variedades se obtuvo el 100 % de sobrevivencia, con excelente respuesta al protocolo establecido y al control de la humedad relativa mediante nebulización (Figura 1e). Esto coincide con los resultados de Andrade-Rodríguez et al. (2005), quienes obtuvieron un porcentaje igual de sobrevivencia al aclimatar ocho variedades mejoradas y dos silvestres de Physalis ixocarpa Brot. Manzo-González et al. (1998) también lograron 100 % de sobrevivencia en la aclimatación de plantas de tomate de cáscara de las variedades Rendidora, Salamanca y Tamazula obtenidas in vitro.
El éxito logrado en la aclimatación se debió, en primer lugar, a la inducción de un sistema de raíces funcional in vitro aceptable en todas las familias clonales (Cuadro 1). Un buen sistema radicular es indispensable para garantizar un alto porcentaje de sobrevivencia en las condiciones ex vitro después del trasplante (Teixeira-da Silva et al., 2017). Esto debido a que las raíces generadas in vitro continúan su crecimiento durante el proceso de aclimatación ex vitro (Clapa, Fira, & Joshee, 2013; George & Debergh, 2008). En segundo lugar, el mantenimiento de la humedad relativa alta y su disminución gradual mejoran el proceso de adaptación de la morfología y fisiología, principalmente de las hojas. Lo anterior fue demostrado por Shekhawat, Kannan, Manokari, y Ravindran (2015), quienes al aclimatizar plantas de Passiflora foetida L. provenientes de cultivo in vitro, manteniendo la humedad relativa al 100 % las primeras dos semanas y disminuyéndola las dos semanas posteriores, lograron una supervivencia del 100 % después de la aclimatización.
El desarrollo fenológico de las plantas clonadas de las variedades evaluadas muestra un comportamiento diferenciado. La variedad Morado San Miguel tuvo un crecimiento de tipo postrado o rastrero, mientras que Tecozautla 04 y Manzano Tepetlixpa presentaron un crecimiento erecto. Al inicio del trasplante al invernadero, las plantas provenientes de la aclimatización presentaron una buena altura (Figuras 3a y 3b).

Figura 3 Plantas aclimatadas cultivadas bajo invernadero. a) Planta de la familia 2b de Morado San Miguel, b) planta de la familia 2 de Manzano Tepetlixpa, c) flores de la familia 1 de Morado San Miguel a los 75 días después de la aclimatación, d) frutos de la familia 2b de Morado San Miguel, e) fruto de la cruza interclonal Tecozautla 3 x Manzano Tepetlixpa 2 y f) fruto de la cruza interclonal Morado San Miguel 1 x Morado San Miguel 2a.
Para la variable altura de planta, la familia 2 de Manzano Tepetlixpa presentó la mayor altura, y las familias 1 y 3b de Morado San Miguel, el menor valor durante la evaluación (Figura 2a). Además, se pudo observar que el incremento de altura de las plantas en todas las familias no decrece durante el ciclo fenológico evaluado. Cabe señalar que al final del ciclo, las familias 2 de Tecozautla 04 y 2b de Morado San Miguel se eliminaron debido a la presencia de fitopatógenos.
Respecto al número de hojas, al inicio de la evaluación, la familia 1 de la variedad Morado San Miguel presentó más hojas, y la familia 2 de Tecozautla 04 tuvo el menor número de hojas. No obstante, al final de la evaluación, la cantidad de hojas entre las familias de las tres variedades no fue significativamente diferente (Figura 2b). El incremento en el número de hojas continúa hasta las últimas semanas de evaluación, fenómeno que no ocurre en plantas provenientes de semilla; esto de acuerdo con las cuatro fases fenológicas del tomate de cáscara descritas por Cartujano, Fernández, y Jankiewics (1987). El incremento se debido, probablemente, a una mayor juvenilidad de las plantas obtenida in vitro. Sería recomendable estudiar de manera conjunta la fenología de plantas provenientes de semilla y clonadas in vitro.
Para el número de flores, al inicio de la evaluación, la familia 3a de Morado San Miguel presentó el mayor valor, y la familia 2 de Tecozautla 04, el menor. Al final de la evaluación, las familias 3 de Tecozautla 04 y 1 de Morado San Miguel tuvieron la menor cantidad de flores en relación con las demás familias (Figuras 2c y 3c). Al inicio del ciclo, el número de flores sufre un incremento hasta la semana 10, pero a partir de ahí se presenta un decremento en la formación de botones y flores, lo cual se debe al continuo crecimiento de órganos generativos que provocan competencia entre ellos (Cartujano et al., 1987).
En relación con la variable número de bolsas, las familias 1 y 3b de la variedad Morado San Miguel presentaron los valores más altos, mientras que las familias de Tecozautla 04 y Manzano Tepetlixpa desarrollaron menos bolsas (Figuras 2d y 3d). Esto debido, principalmente, al hábito de crecimiento, ya que las variedades de tipo rastrero presentan mayor número de bolsas que las de crecimiento erecto, por lo que son un poco más productivas (Cartujano et al., 1987; Peña-Lomelí, Ponce-Valerio, Sánchez-del Castillo, & Magaña-Lira, 2014).
De lo anterior, se puede afirmar que las variables evaluadas y su expresión obedecen, principalmente, al hábito de crecimiento de cada variedad. Respecto al número de bolsas y flores, las familias de Morado San Miguel expresaron el mayor valor, esto como resultado de un mayor nivel de ramificación presente por su hábito rastrero, lo cual significa que producen más frutos, pero de menor tamaño (Cartujano et al., 1987; Peña-Lomelí et al., 2014). En cuanto a la altura, y al número de hojas y de flores, se puede confirmar que las plantas provenientes de cultivo in vitro presentan un menor valor en comparación con las plantas provenientes de semilla. No obstante, el ciclo de vida de las plantas obtenidas por propagación in vitro comprendió alrededor de 98 días, contados a partir del cultivo in vitro en el laboratorio hasta el desarrollo de los primeros frutos.
El proceso de propagación tuvo las etapas de regeneración, enraizamiento, aclimatación y desarrollo bajo invernadero, lo cual, de cierta manera, coincide con el ciclo de vida de las plantas provenientes de semilla (Mulato, Fernández, & Jankiewics, 1987). Las primeras dos etapas tuvieron lugar en el laboratorio. La regeneración duró dos semanas (Figuras 1a y 1b), y el enraizamiento se dio en dos semanas (Figura 1c). Posteriormente, los clones se llevaron al invernadero, donde la aclimatación duró otras dos semanas (Figuras 1d y 1e); en esta etapa aparecieron los primeros botones y flores. Después del trasplante bajo invernadero (Figura 3a), el desarrollo vegetativo (Figura 3b) y reproductivo (Figura 3c) ocurrió durante ocho semanas, donde la polinización y el desarrollo de frutos comprendió las últimas seis semanas (Figura 3d).
El vigor expresado por las plantas obtenidas in vitro, en comparación con las de semilla, se puede deber a los cambios anatómicos y fisiológicos que experimentaron, principalmente en las hojas, en la etapa de transición de condiciones in vitro a ex vitro, lo cual provoca un desarrollo lento (Driver & Suttle, 1986). No obstante, se realizó polinización controlada manualmente (Peña-Lomelí, Magaña-Lira, Gámez-Torres, Mendoza-Celino, & Pérez-Grajales, 2018) para la cruza entre cinco familias clonales, con lo que se obtuvo amarre normal de frutos y producción de semilla híbrida interclonal (Figura 3e y 3f).
Conclusiones
Se estableció con éxito el protocolo de cultivo in vitro y aclimatación, en el cual se obtuvo un porcentaje de sobrevivencia de 100 % en todas las familias clonales de las tres variedades.
La respuesta al cultivo in vitro de las familias clonales dependió del genotipo, sobresaliendo las variedades Tecozautla 04 y Manzano Tepetlixpa, y con menor respuesta la variedad Morado San Miguel.
La fenología de las familias clonales presentó un desarrollo normal, similar a la fenología de plantas de semilla, donde el ciclo completo desde el cultivo in vitro hasta la producción de semilla duró 14 semanas.
References
Andrade-Rodríguez, M., López-Peralta, M. C., González-Hernández, V. A., García-Velázquez, A., & Peña-Lomelí, A. (2005). Efecto del genotipo en la micropropagación de tomate de cáscara. Revista Chapingo Serie Horticultura, 11(1), 31-37. doi: 10.5154/r.rchsh.2003.06.040 [ Links ]
Cartujano, E. F., Fernández, O.,V. M., & Jankiewicz, L. S. (1987). Tomate de cáscara variedad rendidora: desarrollo y fenología. Revista Chapingo, 56-57, 48-50. [ Links ]
Cheng, Y., Ma, R., Jiao, Y., Qiao, N., & Li, T. (2013). Impact of genotype, plant growth regulators and activated charcoal on embryogenesis induction in microspore culture of pepper (Capsicum annuum L.). South African Journal of Botany, 88, 306-309. doi: 10.1016/j.sajb.2013.08.012 [ Links ]
Clapa, D., Fira, A., & Joshee, N. (2013). An efficient ex vitro rooting and acclimatization method for horticultural plants using float hydroculture. HortScience, 48(9), 1159-1167. doi: 10.21273/HORTSCI.48.9.1159 [ Links ]
Dore, C. (1987). Application of tissue culture to vegetable crop improvement. In: Green, C. E., Somers, D. A., Hackett, W. P., & Biesboer, D. D. (Eds.), Plant tissue and cell culture (pp 419-32). New York: Alan R. Liss. [ Links ]
Drew, A. P., Kavanagh, K. L., & Maynard, C. A. (1992). Acclimatizing micropropagated black cherry by comparison with half-sib seedlings. Physiologia Plantarum, 86(3), 459-464. doi: 10.1111/j.1399-3054.1992.tb01344.x [ Links ]
Driver, J. A., & Suttle, G. R. L. (1986). Nursery handling of propagules. In: Bonga, J. M., & Durzan, D. J. (Eds.), Cell and tissue culture in forestry (pp. 320-31), Dordrecht: Martinus Nijhoff Publishers. doi: 10.1007/978-94-009-4484-8_17 [ Links ]
George, E. F., & Debergh, P. C. (2008). Micropropagation: uses and methods. In: George, E. F., Michael, A. H., & De-Klerk, G. J. (Eds), Plant propagation by tissue culture (pp. 29-64). Netherlands: Springer. [ Links ]
Grout, B. W., & Millam, S. (1985). Photosynthetic development of micropropagated strawberry plantlets following transplanting. Annals of Botany, 55(1), 129-131. doi: 10.1093/oxfordjournals.aob.a086872 [ Links ]
Kallak, H., Reidla, M., Hilpus, I., & Virumäe, K. (1997). Effects of genotype, explant source and growth regulators on organogenesis in carnation callus. Plant Cell, Tissue and Organ Culture, 51, 127-135. doi: 10.1023/A:1005932229770 [ Links ]
Kant-Pandey, K. (1957). Genetics of self-incompatibility in Physalis ixocarpa Brot. A new system. American Journal of Botany, 44(10), 879-887. doi: 10.1002/j.1537-2197.1957.tb08275.x [ Links ]
Manzo-González, A., Ledesma-Hernández, A., Villatoro-López, J. C., Álvarez-Escareño, I., Rodríguez-de la O, J. L., & Peña-Lomelí, A. (1998). Regeneración in vitro de tomate de cáscara (Physalis ixocarpa Brot.). Revista Chapingo Serie Horticultura , 4(1), 45-49. doi: 10.5154/r.rchsh.1997.06.044 [ Links ]
Muktadir, M. A., Habib, M. A., Mian, M. A. K., & Akhond, M. A. Y. (2016). Regeneration efficiency based on genotype, culture condition and growth regulators of eggplant (Solanum melongena L.). Agriculture and Natural Resources, 50(1), 38-42. doi: 10.1016/j.anres.2014.10.001 [ Links ]
Mulato, J., Fernández, V. M., & Jankiewicz, S. (1987). Tomate de cáscara: desarrollo y fenología. Revista Chapingo, 56-57, 44-47. [ Links ]
Murashige, T., & Skoog, F. (1962). A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum , 15, 473-497. doi: 10.1111/j.1399-3054.1962.tb08052.x [ Links ]
Peña-Lomelí, A., & Márquez, F. (1990). Mejoramiento genético de tomate de cáscara (Physalis ixocarpa Brot). Revista Chapingo, 71-72, 84-88. [ Links ]
Peña-Lomelí, A., Ponce-Valerio, J. J., Sánchez-del Castillo, F., & Magaña-Lira, N. (2014). Desempeño agronómico de variedades de tomate de cáscara en invernadero y campo abierto. Revista Fitotecnia Mexicana, 37(4), 381-391. doi: 10.35196/rfm.2014.4.381 [ Links ]
Peña-Lomelí, A., Magaña-Lira, N., Gámez-Torres, A., Mendoza-Celino, F. A. & Pérez-Grajales, M. (2018). Manual pollination in two tomatillo (Physalis ixocarpa Brot. ex Horm.) varieties under greenhouse conditions. Revista Chapingo Serie Horticultura , 24(1), 5-12. doi: 10.5154/r.rchsh.2017.02.011 [ Links ]
Ramírez-Malagón, R., & Ochoa-Alejo, N. (1991). Adventitious shoot formation and plant regeneration from tissues of tomatillo (Physalis ixocarpa, Brot.). Plant Cell and Organ Culture , 25, 185-188. doi: 10.1007/BF00036209 [ Links ]
Santiaguillo-Hernández, J. F., Cervantes-Santana, T., & Peña-Lomelí, A. (2004). Selección para rendimiento y calidad de fruto de cruzas planta x planta entre dos variedades de tomate de cáscara (Physalis ixocarpa Brot.). Revista Fitotecnia Mexicana , 27(1), 85-91. Retrieved from https://www.revistafitotecniamexicana.org/documentos/27-1/11a.pdf [ Links ]
Servicio de Información Agroalimentaria y Pesquera (SIAP) . (2021). Avance de siembras y cosechas: Resumen nacional por cultivo. Retrieved on February 22, 2021 from Retrieved on February 22, 2021 from http://infosiap.siap.gob.mx:8080/agricola_siap_gobmx/AvanceNacionalSinPrograma.do [ Links ]
Servicio Nacional de Inspección y Certificación de Semillas (SNICS). (2021). Catálogo nacional de variedades vegetales. Retrieved on February 22, 2021 from Retrieved on February 22, 2021 from https://www.gob.mx/snics/articulos/el-catalogo-nacional-de-variedades-vegetales-cnvv?idiom=es [ Links ]
Shekhawat, M., Kannan, N., Manokari, M., & Ravindran, C. P. (2015). In vitro regeneration of shoots and ex vitro rooting of an important medicinal plant Passiflora foetida L. through nodal segment cultures. Journal of Genetic Engineering and Biotechnology, 13, 209-214. doi: 10.1016/j.jgeb.2015.08.002 [ Links ]
Steiner, A. A. (1984). The universal nutrient solution. In: Proceedings 6 th International Congress on Soilless Culture (pp. 633-650). Nueva York, USA: International Society for Soilless Culture [ Links ]
Teixeira-da Silva, J. A., Hossain, M. M., Sharma, M., Dobránszki. J., Cardoso, J. C., & Zeng, S. (2017). Acclimatization of in vitro-derived Dendrobium. Horticultural Plant Journal, 3(3), 110-124. doi: 10.1016/j.hpj.2017.07.009 [ Links ]
van Groenendael, J., & de Kroon, H. (1990). Clonal growth in plants: regulation and function. The Hague, The Netherlands: S.P.B. Academic P/ublishing. [ Links ]
Recibido: 12 de Marzo de 2021; Aprobado: 03 de Diciembre de 2021











 texto en
texto en 



