Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo. Serie horticultura
versão On-line ISSN 2007-4034versão impressa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.27 no.2 Chapingo Mai./Ago. 2021 Epub 13-Dez-2021
https://doi.org/10.5154/r.rchsh.2020.06.014
Artículos científicos
Control biorracional de Phytophthora capsici en plantas de chile mediante Streptomyces spp.
1Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco (CIATEJ). Camino Arenero, núm. 1227, El Bajío del Arenal, Zapopan, Jalisco, C. P. 45019, MÉXICO.
2Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco (CIATEJ) - Subsede Sureste. Tablaje Catastral 31264, Carretera Sierra Papacal-Chuburná Puerto km 5.5, Parque Científico y Tecnológico de Yucatán, Mérida, Yucatán, C. P. 97302, MÉXICO.
La marchitez del chile, causada por Phytophthora capsici, es una de las principales amenazas durante la producción del cultivo. Por lo anterior, el objetivo de este trabajo fue evaluar el efecto de Streptomyces spp. en el control biológico de P. capsici en condiciones in vitro e in vivo. La actividad antagónica in vitro de las cepas ABV38, ABV39 y ABV45 se realizó mediante ensayos de confrontación dual. El sobrenadante del caldo de cultivo (SNC) del crecimiento de las cepas se irrigó en plantas de chile inoculadas con P. capsici CH11 (PC CH11) para evaluar la supresión de la marchitez. La identificación molecular de las cepas se realizó mediante el análisis de la secuencia parcial del gen ARNr 16S. En condiciones in vitro, las cepas ABV38, ABV39 y ABV45 inhibieron el crecimiento micelial de PC CH11 en 51, 28 y 50 %, respectivamente. En la evaluación in vivo, los SNC de las cepas ABV38 y ABV45 mostraron un efecto supresor de la marchitez, con una supervivencia de las plantas de 77 y 94 %, respectivamente. La cepa ABV39 no mostró un efecto supresor de la marchitez (supervivencia de 0 %), al igual que las plantas no tratadas. La identificación molecular indicó que las cepas ABV39, ABV38 y ABV45 pertenecen al género Streptomyces; de las cuales, ABV38 y ABV45 poseen potencial para el control biorracional de la marchitez del chile.
Palabras clave actinobacterias; actinomicetos; Capsicum annuum L.; marchitez; control biológico; oomiceto
Pepper wilt, caused by Phytophthora capsici, is one of the main threats faced during pepper production. Therefore, this study aimed to evaluate the effect of Streptomyces spp. in the biological control of P. capsici under in vitro and in vivo conditions. The in vitro antagonistic activity of strains ABV38, ABV39 and ABV45 was examined by means of dual confrontation tests. Broth culture supernatant (BCS) from the growth of the strains was irrigated on pepper plants inoculated with P. capsici CH11 (PC CH11) to evaluate wilt suppression. Molecular identification of the strains was carried out by analyzing the partial sequence of the 16S rRNA gene. Under in vitro conditions, strains ABV38, ABV39 and ABV45 inhibited the mycelial growth of PC CH11 by 51, 28 and 50 %, respectively. In the in vivo evaluation, the BCSs of strains ABV38 and ABV45 showed a wilt suppressive effect, with plant survival of 77 and 94 %, respectively. Strain ABV39 did not show a wilt suppressive effect (0 % survival), and nor did the untreated plants. Molecular identification indicated that strains ABV39, ABV38 and ABV45 belong to the genus Streptomyces, of which ABV38 and ABV45 have potential for biorational control of pepper wilt.
Keywords actinobacteria; actinomycetes; Capsicum annuum L.; wilt; biological control; oomycete
Introducción
Las especies de Phytophthora (> 60) son una amenaza para diferentes plantas de importancia agronómica y ecológica, ya que causan enfermedades como la marchitez o pudrición de la raíz, corona, tallos, hojas y frutos (Drenth & Guest, 2004; Jung et al., 2018). Entre dichas especies, Phytophthora capsici (PC) es considerado un patógeno destructivo que afecta a cultivos agrícolas como las cucurbitáceas, berenjena (Solanum melongena L.), tomate (Solanum lycopersicum L.) y chile (Capsicum annuum L.) (Lamour, Stam, Jupe, & Huitema, 2012). En México, el chile es uno de los principales cultivos hortícolas de importancia económica. Durante 2018, México se ubicó como el segundo productor y exportador a nivel mundial de chile, con una producción de casi 3.4 millones de toneladas y un valor de 844 millones de dólares (Servicio de Información Agroalimentaria y Pesquera [SIAP], 2019). A pesar de lo anterior, las enfermedades debidas a fitopatógenos, como la marchitez causada por PC, han afectado la productividad del cultivo de chile.
Las zoosporas de Phytophthora spp. son su principal propágulo de supervivencia, dispersión e infección; además, debido a su motilidad pueden localizar activamente a sus hospedantes (Judelson & Blanco, 2005; Stanghellini, Kim, Rasmussen, & Rorabaugh, 1996). El uso de fungicidas químicos ha sido el principal método de control de PC; sin embargo, su uso constante incrementa el riesgo de resistencia del patógeno (Wu et al., 2020). Por lo anterior, se requieren otras alternativas que permitan, en conjunto, un manejo integrado de plagas y enfermedades enfocadas hacia el desarrollo de una agricultura sustentable (Lamichhane et al., 2017). En las últimas décadas, el uso de microorganismos antagonistas para el control de enfermedades en plantas ha demostrado ser una alternativa, esto debido a que los microorganismos son específicos para un fitopatógeno, inofensivos para especies no blanco, inocuos para el hombre y amigables con el ambiente (O’Brien, 2017).
Las actinobacterias (comúnmente llamadas actinomicetos) poseen potencial como agentes de control biológico, ya que tienen la capacidad de inhibir o reducir el crecimiento de fitopatógenos a través de mecanismos directos e indirectos como la producción de antibióticos, enzimas líticas, hiperparasitismo, competencia y la inducción de resistencia sistémica en las plantas (Kurth et al., 2014; Sharma & Salwan, 2018). Las actinobacterias han demostrado su potencial in vitro como antagonistas para diferentes especies de Phytophthora.
Sadeghi, Koobaz, Azimi, Karimi, y Akbari (2017) demostraron que cepas de Streptomyces spp. inhiben el crecimiento micelial de P. drechsleri de 30 a 78 %. Fonseca-Ardila, Castellanos-Suárez, y León-Sicard (2011) mencionan que aislados actinobacterianos de extractos fermentados de chipaca (Bidens pilosa L.) inhiben el crecimiento micelial de P. infestans de 33 a 77 %. Arfaoui, Adam, Bezzahou, y Daayf (2018) aislaron bacterias (100 aislados) del rizoplano de plantas de soya (Glycine max [L.] Merr.), y encontraron que nueve aislados, pertenecientes a los géneros Streptomyces spp. (3), Bacillus spp. (4), Paenibacillus sp. (1) y Lysobacter sp. (1), redujeron el porcentaje de crecimiento micelial de P. sojae de 14 a 85 %. Chen, Chen, y Tsay (2016) reportaron la actividad antagónica de S. plicatus B4-7 contra varias especies de Phytophthora, y Evangelista-Martínez (2014) demostró el potencial antagonista de Streptomyces sp. CA-CIS-1.16CA (aislado de suelo de la reserva de la biosfera “Los Petenes”) contra varios hongos fitopatógenos, entre ellos PC.
Las actinobacterias son una fuente de productos naturales prominente. De acuerdo con Bérdy (2012), las actinobacterias aportaron el 40.8 % de todos los metabolitos bioactivos de origen microbiano. Nguyen et al. (2015) demostraron que el ácido pirrolidón carboxílico, aislado de Streptomyces griseus H7602, redujo el crecimiento micelial de PC desde concentraciones de 8 a 128 µg∙mL-1. En estudios similares, Joo (2005) y Chen et al. (2016) evaluaron la actividad del caldo de cultivo libre de células de S. plicatus B4-7 y S. halstedii AJ-7, respectivamente; en pruebas in vitro, ambos cultivos inhibieron la germinación de zoosporas de PC. Lee, Moon, Yun, Yoo, y Hwang (2004) aislaron el producto natural tiobutacina de Lechevalieria aerocolonigenes VK-A9, compuesto que inhibió la germinación in vitro de zoosporas de PC a una concentración de 10 µg·mL-1. Por lo anterior, el objetivo de este trabajo fue evaluar el efecto de Streptomyces spp. en el control biológico de Phytophthora capsici en condiciones in vitro e in vivo.
Materiales y métodos
Material vegetal
Se utilizaron semillas de chile serrano var. Camino Real F1 (Harris Moran®, Seed Company). Las semillas se lavaron con agua corriente para eliminar la cubierta de fungicida y se sembraron en tres charolas plásticas de germinación con 72 cavidades (6×12, una semilla por cavidad); para ello, se utilizó como sustrato una mezcla de arena-turba (Mix No. 3, Sunshine®) en proporción 1:1 (v/v), esterilizada a 120 °C durante 6 h a una presión de 1.05 kg·cm-2. Cada charola se colocó dentro de una base y se cubrió con un domo de plástico transparente, luego se colocaron en un cuarto de incubación a 21 ± 1 °C con un fotoperiodo de 16/8 h (luz/oscuridad). El riego se realizó con agua corriente una vez por semana.
Material microbiológico
Se utilizaron actinobacterias de la colección de microorganismos del Laboratorio de Fitopatología de la Unidad de Biotecnología Vegetal del CIATEJ. Las actinobacterias utilizadas fueron ABV38, ABV39 y ABV45, aisladas previamente de la rizosfera de Agave spp. (Rincón-Enríquez, López-Pérez, & Quiñones-Aguilar, 2014). En pruebas anteriores, dichas actinobacterias inhibieron el crecimiento in vitro de Phytophthora capsici CH11 (PC CH11) (Reyes-Tena, Fernández-Pavia, Rincón-Enríquez, López-Pérez, & Quiñones-Aguilar, 2014). Los aislados actinobacterianos se cultivaron de manera rutinaria en medio de cultivo agar papa-dextrosa (PDA) con pH 7 (NaOH 3 M) y se incubaron a 21 ± 1 °C en oscuridad durante 15 días. La cepa de PC CH11 se cultivó en agar V8 clarificado (50 mL·L-1 de jugo V8, 0.5 g·L-1 de CaCO3 y 15 g·L-1 de agar) e incubó a 21 ± 1 °C en oscuridad durante 10 días.
Bioensayo de actividad antagónica dual
Las actinobacterias ABV38, ABV39 y ABV45 se probaron para determinar su actividad en la inhibición del crecimiento in vitro de PC CH11 en ensayos de confrontación dual. Un disco de un aislado actinobacteriano de 6 mm de diámetro de 15 días de crecimiento se depositó a 1 cm del borde de la caja Petri con medio de cultivo PDA. Las cajas Petri se pre-incubaron antes de inocular el oomiceto fitopatógeno durante 0, 3 y 5 días a 21 ± 1 °C en oscuridad (Evangelista-Martínez, 2014). Después del tiempo de pre-incubación, se depositó un disco de PC CH11 de 6 mm de diámetro (10 días de crecimiento) a 1 cm del borde de la caja Petri y enfrente del disco con actinobacteria. Cajas inoculadas solo con PC CH11 a 1 cm del borde sirvieron como testigo. La actividad antagónica se determinó a los 24 días después de la inoculación a partir del área de inhibición del crecimiento de PC CH11. El crecimiento de PC CH11 en las cajas testigo fue en toda la superficie del medio de cultivo. Para la evaluación, se estableció un diseño experimental completamente al azar con tres repeticiones, en donde se evaluaron tres tratamientos por actinobacteria, correspondientes a los tiempos de pre-incubación (0, 3 y 5 días).
Producción de sobrenadante del caldo de cultivo
Un disco de cada actinobacteria en PDA de 6 mm de diámetro se inoculó de manera independiente en matraces Erlenmeyer de 250 mL con 125 mL de medio de cultivo (caldo de papa-dextrosa, pH 7) previamente esterilizado (121 °C a 1.05 kg·cm-2 durante 20 min). Los matraces se colocaron en un incubador orbital a 30 °C y 200 rpm durante 20 días. Se inocularon cuatro matraces por cada actinobacteria. Después de la incubación, el caldo de cultivo se centrifugó a 13,000 rpm durante 15 min. El sobrenadante del caldo de cultivo (SNC) de cada actinobacteria (no filtrado) se recuperó y almacenó a 4 °C hasta su uso.
Producción de zoosporas de Phytophthora capsici CH11
La producción de zoosporas se realizó mediante la técnica de Ristaino (1990), con ligeras modificaciones. Se utilizaron cultivos de PC CH11 de 10 días de crecimiento en agar V8 clarificado (50 mL·L-1 de jugo V8, 0.5 g·L-1 de CaCO3 y 15 g·L-1 de agar). El medio de cultivo de cada caja Petri se cortó a la mitad, y una de las mitades se colocó en otra caja Petri estéril. Con ayuda de un bisturí, se cortaron las mitades del agar V8 clarificado en cuadros de ~1 cm2 y se agregó agua destilada estéril hasta cubrir los cuadros de agar. Las cajas Petri se colocaron en un cuarto de incubación a 21 ± 1 °C en oscuridad. El agua destilada se renovó diariamente durante cinco días. Finalmente, las cajas Petri se llevaron a 4 °C durante 1 h para inducir la liberación de las zoosporas. La suspensión se ajustó a 500 zoosporas·mL-1 con ayuda de un hemocitómetro.
Evaluación del control biorracional de Phytophthora capsici CH11 in vivo
Tres días antes de la aplicación de los tratamientos, las plantas de chile serrano se regaron con abundante agua corriente, y el exceso de agua del contenedor base se eliminó para evitar contaminación cruzada. Se aplicaron, de manera independiente, 10 mL del SNC de las actinobacterias ABV38, ABV39 y ABV45 por cada planta de chile de 25 días de edad. Como testigo negativo se aplicaron 10 mL de agua destilada estéril por planta, y como testigo químico se utilizó el producto comercial Infinito® (Bayer®, México), recomendado para el control de oomicetos, el cual contiene fluopicolide (62.5 g·L-1) y propamocarb clorhidrato (625 g·L-1). Para el testigo químico, se preparó una suspensión a 3 mL∙L-1 del producto concentrado y se agregaron 10 mL por planta. Después de la aplicación de los tratamientos, cada planta se inoculó con 3 mL de la suspensión de zoosporas (500 zoosporas·mL-1) de PC CH11, a una concentración final en el sustrato de 50 zoosporas·g-1. Las plantas testigo se inocularon con 3 mL de agua destilada estéril. Después de la inoculación del oomiceto fitopatógeno, las plantas se incubaron a 21 ± 1 °C con un fotoperiodo de 16/8 h (luz/oscuridad) durante 10 días. No se aplicaron más riegos a las plantas.
Para esta prueba, se utilizó un diseño experimental completamente al azar con 10 tratamientos: T1) ABV38, T2) ABV38 + PC CH11, T3) ABV39, T4) ABV39 + PC CH11, T5) ABV45, T6) ABV45 + PC CH11, T7) testigo (plantas sanas), T8) testigo + PC CH11 (plantas enfermas), T9) testigo químico y T10) testigo químico + PC CH11. Los tratamientos se aplicaron en charolas con las plantas de chile. Una charola contaba con 12 columnas, cada una con seis plantas de chile. Se excluyeron las columnas extremas de la charola. Las 10 columnas internas se aleatorizaron para aplicar los tratamientos. La unidad experimental constó de seis plantas de chile, y los tratamientos se realizaron por triplicado. El porcentaje de supervivencia de las plantas se determinó con la siguiente fórmula:
Identificación molecular de las cepas de actinobacterias
La identificación de los aislados actinobacterianos ABV38, ABV39 y ABV45 se realizó mediante la amplificación parcial del gen ARNr 16S por medio de la reacción en cadena de la polimerasa (PCR, por sus siglas en inglés), para ello se utilizaron los oligonucleótidos fD1 (5’-CCGAATTCGTCGACAACAGAGTTTGATCCTGGCTCAG-3’) y rD1 (5’-CCCGGGATCCAAGCTTAAGGAGGTGATCCAGCC-3’) (Weisburg, Barns, Pelletier, & Lane, 1991). La extracción del ADN, la PCR y la secuenciación de los fragmentos amplificados se realizó en el Laboratorio de Biotecnología y Patología de Semillas del Colegio de Postgraduados. Los fragmentos amplificados se secuenciaron en ambos sentidos utilizando los iniciadores 8F, 1492R, U514, 800R, fD1 y rD1 (Edwards, Rogall, Blockerl, Emde, & Bottger, 1989; Stackebrandt & Liesack, 1993).
Las secuencias consenso de las cepas ABV38, ABV39 y ABV45 se compararon en la base de datos del GenBank/EMBL/DDBJ a través del NCBI (http://www.ncbi.nlm.nih.gov/) utilizando el programa BLAST (Basic Local Alignment Search Tool) (McGinnis & Madden, 2004). Se utilizaron las secuencias de referencia y de cepas tipo filogenéticamente relacionadas con cada actinobacteria. Las secuencias se alinearon con CLUSTAL W (Thompson, Higgins, & Gibson, 1994) y la construcción del árbol filogenético se realizó mediante el método Neighbor-Joining (NJ) (Saitou & Nei, 1987) con 1,000 replicaciones Bootstrap utilizando el programa MEGA-X (Kumar, Stecher, Li, Knyaz, & Tamura, 2018). El modelo de sustitución de nucleótidos seleccionado para NJ fue Kimura-2 parámetros (Kimura, 1980). Las secuencias parciales del gen ARNr 16S de las cepas ABV38, ABV39 y ABV45 se depositaron en la base de datos del GenBank bajo los números de accesión MT435538, MT435539 y MT435540, respectivamente.
Análisis estadístico
Las variables respuesta (porcentaje de inhibición y de supervivencia) se sometieron a un análisis de varianza y una prueba de comparación de medias de Tukey (P ≤ 0.05), para lo cual se empleó el paquete estadístico StatGraphics Centurion XV (StatPoint Inc., 2005). Los datos de porcentaje de supervivencia se transformaron con ArcSen√x previo a su análisis.
Resultados
Actividad antagónica in vitro
Las cepas ABV38, ABV39 y ABV45 presentaron diferente grado de inhibición del crecimiento in vitro de PC CH11 (Figura 1). La pre-incubación (5 días) de las cepas ABV38, ABV39 y ABV45 mostró diferencias significativas (P ≤ 0.05) en la inhibición del crecimiento de PC CH11 (con un incremento de 14.9, 10.4 y 9 %, respectivamente), en comparación con los tratamientos sin pre-incubación (Figura 1). La cepa ABV39 mostró la menor reducción (28 %) del crecimiento micelial de PC CH11 a los 5 días de pre-incubación, mientras que las cepas ABV38 y ABV45 presentaron un porcentaje de inhibición de 51 y 50 %, respectivamente, en el mismo tiempo de pre-incubación (Figura 1 y 2). Los resultados de la actividad antagónica in vitro indican claramente el potencial de las cepas ABV38 y ABV45 como agentes de control biológico de PC CH11, al presentar diferencias significativas en la inhibición del crecimiento micelial de dicho fitopatógeno con respecto a la cepa ABV39 en cualquier tiempo de pre-incubación (Figura 1 y 2).
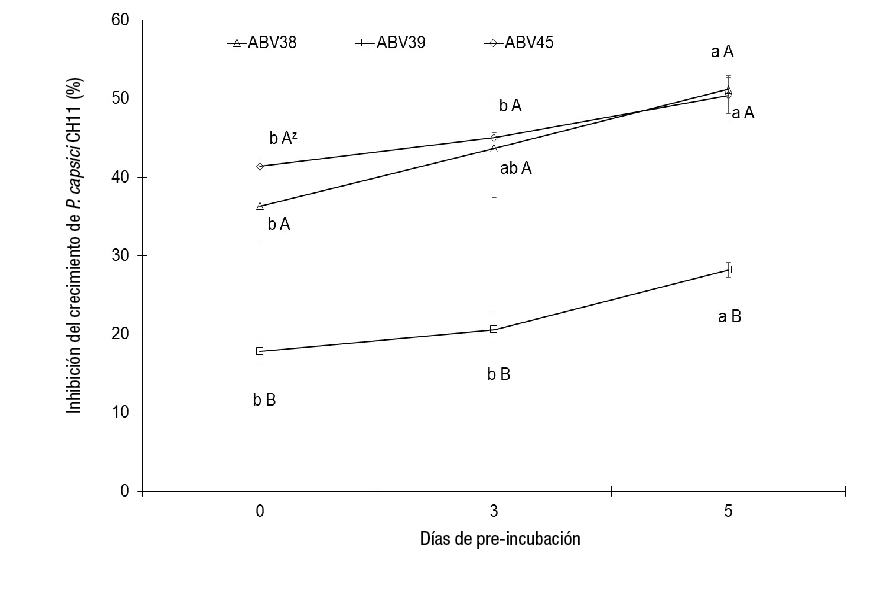
Figura 1 Comportamiento de la capacidad de inhibición del crecimiento in vitro de Phytophthora capsici CH11 por distintas cepas de Streptomyces spp. (media ± desviación estándar). zMedias con la misma letra entre tiempo de pre-incubación (minúscula) o por cepas (mayúscula) no difieren estadísticamente (Tukey, P ≤ 0.05).
Control biorracional de P. capsici CH11 in vivo
El Cuadro 1 presenta el porcentaje de supervivencia de las plantas de chile serrano en los distintos tratamientos. Los resultados indican que el SNC de las cepas ABV45 (T6; 94 %), ABV38 (T2; 77 %) y el testigo químico (T10; 100 %), aplicados a plantas de chile inoculadas con PC CH11, mostraron diferencias significativas en el porcentaje de supervivencia respecto del testigo (T8; 0 %). Las plantas tratadas con el SNC de la cepa ABV39 (T4; 0 %) no mostraron un efecto de control de PC CH11.
Cuadro 1 Efecto de la aplicación del sobrenadante del caldo de cultivo de actinobacterias sobre el porcentaje de supervivencia de plantas de chile serrano var. Camino Real a los 10 días después de la inoculación con Phytophthora capsici CH11.
| Tratamiento | Supervivencia (%) |
|---|---|
| T1) Streptomyces sp. ABV38 | 100 az |
| T2) Streptomyces sp. ABV38 + P. capsici CH11 | 77 b |
| T3) Streptomyces sp. ABV39 | 100 a |
| T4) Streptomyces sp. ABV39 + P. capsici CH11 | 0 c |
| T5) Streptomyces sp. ABV45 | 100 a |
| T6) Streptomyces sp. ABV45 + P. capsici CH11 | 94 a |
| T7) Testigo (plantas sanas) | 100 a |
| T8) Testigo + P. capsici CH11 (plantas enfermas) | 0 c |
| T9) Testigo químico | 100 a |
| T10) Testigo químico + P. capsici CH11 | 100 a |
zMedias con la misma letra no difieren estadísticamente (Tukey, P ≤ 0.05).
El experimento in vivo demostró que la aplicación del SNC de las cepas ABV38 y ABV45 tuvo un efecto supresor de la marchitez en las plantas de chile causada por PC CH11, mientras que en el tratamiento testigo inoculado con PC CH11 se observó una severa defoliación y marchitez a los 10 días después de inocular al oomiceto fitopatógeno (Figura 3). La aplicación del SNC de las actinobacterias no afectó la supervivencia de las plántulas de chile no inoculadas con PC CH11 (Cuadro 1); sin embargo, se observó una disminución de la longitud de las raíces debido a la aplicación del caldo de cultivo (Figura 3).
Identificación molecular
El análisis comparativo de las secuencias del gen ARNr 16S de las cepas de actinobacteria ABV38 (1,404 pb), ABV39 (1,403 pb) y ABV45 (1,231 pb) confirmó que las tres cepas pertenecen al género Streptomyces (Figura 4). El análisis de dichas secuencias indicó que las cepas ABV38, ABV39 y ABV45 están filogenéticamente relacionadas con S. thioluteus NBRC 13341 (99.36 %), S. galbus DSM 40480 (99.29 %) y S. cinnamoneus NBRC 15926 (99.76 %), respectivamente. No obstante, se necesitan otros estudios para establecer si las cepas ABV38, ABV39 y ABV45 representan nuevas especies para el género Streptomyces.

Figura 4 Árbol filogenético Neighbor-Joining basado en secuencias parciales del gen ARNr 16S que muestra las relaciones filogenéticas entre las cepas ABV38, ABV39 y ABV45 con otras especies del género Streptomyces. Los números a un lado de las ramas son valores Bootstrap (%). La secuencia de Streptosporangium fragile DSM 43847 se utilizó como grupo externo. El número de accesión de cada secuencia se muestra entre paréntesis. Barra = 0.01 sustituciones por posición de nucleótido.
Discusión
El género Streptomyces es una fuente potencial de agentes de biocontrol contra Phytophthora spp. (Arfaoui et al., 2018; Sadeghi et al., 2017; Thampi & Bhai, 2017). En el presente estudio, se examinó la actividad antagónica de tres cepas de Streptomyces contra PC en condiciones in vitro e in vivo. En condiciones in vitro, las cepas ABV38 y ABV45 mostraron la capacidad de inhibir el crecimiento micelial de PC CH11 en confrontación directa, mientras que la cepa ABV39 presentó una actividad débil. Metabolitos secundarios con actividad antioomiceto podrían estar implicados en los mecanismos de inhibición del crecimiento micelial de PC.
Chen et al. (2016) reportan que el caldo fermentado de S. plicatus B4-7 (libre de células), cultivado en caldo de avena, inhibió el crecimiento micelial de P. capsici, P. cinnamomi, P. palmivora y P. parasitica en un 55, 65, 43.8 y 35 %, respectivamente. Yang, Zhang, y Li (2019) mencionan que los metabolitos del extracto etanólico del caldo fermentado de S. corchorusii AUH-1 inhibieron el crecimiento micelial de P. capsici y P. parasitica var. nicotianae en un 67.2 y 78.9 %, respectivamente. En este estudio, Streptomyces sp. ABV38 y ABV45 exhibieron porcentajes de inhibición de 51 y 50 %, respectivamente, en el crecimiento micelial de PC. No obstante, se requieren estudios posteriores para determinar qué metabolito o metabolitos están implicados en la inhibición de P. capsici y su modo de acción.
Durante la evaluación in vivo del SNC de las cepas ABV38 y ABV45, aplicado a plantas de chile, el caldo mostró un efecto supresor de la marchitez causada por PC CH11. En estudios con Streptomyces spp., Nguyen et al. (2012) mostraron que el sobrenadante del cultivo de S. griseus H7602 redujo la marchitez de las raíces de chile inoculadas con PC, y en estudios posteriores demostraron que la actividad antioomiceto se debió al ácido pirrolidón carboxílico (Nguyen et al. 2015). Chen et al. (2016) demostraron que el caldo fermentado obtenido del crecimiento de S. plicatus B4-7 inhibió completamente la germinación in vitro de zoosporas de PC y redujo en un 75 % la enfermedad de la pudrición de la corona en plantas de pimiento morrón inoculadas con zoosporas de PC. En este caso, el compuesto purificado del caldo de cultivo con mayor actividad antioomiceto fue la borrelidina. Sellem et al. (2017) encontraron que el sobrenadante del cultivo liofilizado de Streptomyces sp. TN258 inhibió completamente la germinación de oosporas de P. ultimum a una concentración de 12.5 mg·mL-1.
En cuanto a los metabolitos secundarios, Lee, Sherman, y Hwang (2008) encontraron que la tiobutacina, aislada de L. aerocolonigenes VK-A9, exhibió la lisis de zoosporas de PC. Islam, Laatsch, y von Tiedemann (2016) observaron la actividad zoosporicida del macrotetrolido dinactina aislado de Streptomyces sp., ya que detuvo la motilidad y causó la subsecuente lisis de zoosporas de P. capsici y del oomiceto fitopatógeno Plasmopara viticola. Abdalla et al. (2011) aislaron y purificaron compuestos del caldo de cultivo de Streptomyces sp. ANK313, uno nuevo (khatmiamicina) y otros ya conocidos, los cuales inhibieron la motilidad y ocasionaron la lisis de las zoosporas de P. viticola.
En este estudio, el SNC de las cepas de Streptomyces sp. ABV38 y ABV45 suprimió la marchitez de las plantas de chile cuando se inocularon con zoosporas de PC CH11. Los resultados de la prueba in vivo sugieren que los metabolitos secundarios de los SNC podrían estar implicados en el control de la enfermedad al actuar directamente contra las zoosporas. Estudios posteriores son necesarios para identificar qué compuesto o compuestos del SNC están implicados en la supresión de la marchitez causada por PC.
Por otra parte, el producto comercial Infinito®, utilizado como control químico, exhibió un 100 % de control sobre PC CH11 al no presentar plantas de chile con marchitez a los 10 días después de la inoculación. En estudios in vitro, se ha demostrado que el fluopicolide y el propamocarb clorhidrato tienen efecto en la reducción del crecimiento micelial, la formación de esporangios, la motilidad de las zoosporas y su germinación en las distintas etapas de desarrollo de Phytophthora spp. (Hu, Hong, Stromberg, & Moorman, 2007; Toquin, Latorse, & Beffa, 2019).
A pesar de que el SNC de Streptomyces sp. ABV39 no exhibió un efecto supresor de la marchitez de PC CH11, en estudios previos, la co-inoculación de plantas de chile poblano con esporas de Streptomyces sp. ABV39 y hongos micorrízicos arbusculares redujeron la severidad de la marchitez con respecto al testigo inoculado con PC (Reyes-Tena, Rincón-Enríquez, López-Pérez, & Quiñones-Aguilar, 2017). Los resultados sugieren que Streptomyces sp. ABV39 no es útil para el control biorracional de PC; sin embargo, podría ser utilizado como agente de biocontrol.
Conclusiones
Las cepas ABV38, ABV39 y ABV45 de Streptomyces sp. mostraron diferente grado de control sobre el crecimiento in vitro de P. capsici CH11 dependiente del tiempo de incubación. La pre-incubación de 5 días de las tres cepas incrementó significativamente la inhibición del crecimiento de P. capsici CH11. La evaluación in vivo mostró el control biorracional del sobrenadante del cultivo de las cepas ABV38 y ABV45 en la supresión de la marchitez causada por P. capsici CH11 en plantas de chile en condiciones controladas. La identificación molecular de las cepas ABV38, ABV39 y ABV45 indicó que pertenecen al género Streptomyces. En general, las cepas ABV38 y ABV45 poseen potencial para el control biorracional de la marchitez del chile.
Agradecimientos
Los autores agradecen al Fondo Mixto CONACYT-Gobierno del Estado de Aguascalientes por el financiamiento del proyecto “Desarrollo de una tecnología para el control biológico de la marchitez del chile por medio de actinomicetos nativos del Estado de Aguascalientes” (AGS-2011-C02-181930), y a la Dra. Sylvia Patricia Fernández Pavía del Laboratorio de Patología Vegetal del IIAF-UMSNH por proveer amablemente la cepa de Phytophthora capsici CH11. El primer autor agradece al CONACYT por la beca otorgada para sus estudios de doctorado (CVU 424465), y al Fondo Mixto CONACYT-Gobierno del Estado de Aguascalientes por el apoyo para participar en el proyecto
REFERENCIAS
Abdalla, M. A., Win, H. Y., Islam, M. T., von Tiedemann, A., Schüffler, A., & Laatsch, H. (2011). Khatmiamycin, a motility inhibitor and zoosporicide against the grapevine downy mildew pathogen Plasmopara viticola from Streptomyces sp. ANK313. The Journal of Antibiotics, 64(10), 655-659. doi: 10.1038/ja.2011.68 [ Links ]
Arfaoui, A., Adam, L. R., Bezzahou, A., & Daayf, F. (2018). Isolation and identification of cultivated bacteria associated with soybeans and their biocontrol activity against Phytophthora sojae. BioControl, 63(4), 607-617. doi: 10.1007/s10526-018-9873-9 [ Links ]
Bérdy, J. (2012). Thoughts and facts about antibiotics: Where we are now and where we are heading. The Journal of Antibiotics , 65, 385-395. doi: 10.1038/ja.2012.27 [ Links ]
Chen, Y. Y., Chen, P. C., & Tsay, T. T. (2016). The biocontrol efficacy and antibiotic activity of Streptomyces plicatus on the oomycete Phytophthora capsici. Biological Control, 98, 34-42. doi: 10.1016/j.biocontrol.2016.02.011 [ Links ]
Drenth, A., & Guest, D. I. (2004). Biology of Phytophthora. In: Drenth, A., & Guest, D. I. (Eds.), Diversity and management of Phytophthora in Southeast Asia (pp. 29-58). Canberra, Australia: ACIAR Monograph. [ Links ]
Edwards, U., Rogall, T., Blockerl, H., Emde, M., & Bottger, E. C. (1989). Isolation and direct complete nucleotide determination of entire genes. Characterization of a gene coding for 16S ribosomal RNA. Nucleic Acids Research, 17(19), 7843-7853. doi: 10.1093/nar/17.19.7843 [ Links ]
Evangelista-Martínez, Z. (2014). Isolation and characterization of soil Streptomyces species as potential biological control agents against fungal plant pathogens. World Journal of Microbiology and Biotechnology, 30(5), 1639-1647. doi: 10.1007/s11274-013-1568-x [ Links ]
Fonseca-Ardila, Y. A., Castellanos-Suárez, D. E., & León-Sicard, T. E. (2011). Efecto antagónico in vitro de actinomicetos aislados de purines de chipaca (Bidens pilosa L.) frente a Phytophthora infestans (Mont) de Bary. Revista Facultad Nacional de Agronomía Medellín, 64(2), 6111-6119. Retrieved from http://www.redalyc.org/articulo.oa?id=179922664008 [ Links ]
Hu, J., Hong, C., Stromberg, E. L., & Moorman, G. W. (2007). Effects of propamocarb hydrochloride on mycelial growth, sporulation, and infection by Phytophthora nicotianae isolates from Virginia nurseries. Plant Disease, 91(4), 414-420. doi: 10.1094/PDIS-91-4-0414 [ Links ]
Islam, M. T., Laatsch, H., & von Tiedemann, A. (2016). Inhibitory effects of macrotetrolides from Streptomyces spp. on zoosporogenesis and motility of peronosporomycete zoospores are likely linked with enhanced ATPase activity in mitochondria. Frontiers in Microbiology, 7, 1824. doi: 10.3389/fmicb.2016.01824 [ Links ]
Joo, G. J. (2005). Production of an anti-fungal substance for biological control of Phytophthora capsici causing phytophthora blight in red-peppers by Streptomyces halstedii. Biotechnology Letters, 27(3), 201-205. doi: 10.1007/s10529-004-7879-0 [ Links ]
Judelson, H. S., & Blanco, F. A. (2005). The spores of Phytophthora: weapons of the plant destroyer. Nature Reviews Microbiology, 3, 47-58. doi: 10.1038/nrmicro1064 [ Links ]
Jung, T., Pérez-Sierra, A., Durán, A., Jung, M. H., Balci, Y., & Scanu, B. (2018). Canker and decline diseases caused by soil- and airborne Phytophthora species in forests and woodlands. Persoonia, 40, 182-220. doi: 10.3767/persoonia.2018.40.08 [ Links ]
Kimura, M. (1980). A simple method for estimating evolutionary rates of base substitutions through comparative studies of nucleotide sequences. Journal of Molecular Evolution, 16, 111-120. doi: 10.1007/BF01731581 [ Links ]
Kumar, S., Stecher, G., Li, M., Knyaz, C., & Tamura, K. (2018). MEGA X: Molecular evolutionary genetics analysis across computing platforms. Molecular Biology and Evolution, 35(6), 1547-1549. doi: 10.1093/molbev/msy096 [ Links ]
Kurth, F., Mailänder, S., Bönn, M., Feldhahn, L., Herrmann, S., Große, I., Buscot, F., Schrey, S. D., & Tarkka, M. T. (2014). Streptomyces-induced resistance against oak powdery mildew involves host plant responses in defense, photosynthesis, and secondary metabolism pathways. Molecular Plant-Microbe Interactions, 27(9), 891-900. doi: 10.1094/MPMI-10-13-0296-R [ Links ]
Lamichhane, J. R., Dürr, C., Schwanck, A. A., Robin, M. H., Sarthou, J. P., Cellier, V., Aubertot, J. N. (2017). Integrated management of damping-off diseases. A review. Agronomy for Sustainable Development, 37, 10. doi: 10.1007/s13593-017-0417-y [ Links ]
Lamour, K. H., Stam, R., Jupe, J., & Huitema, E. (2012). The oomycete broad-host-range pathogen Phytophthora capsici. Molecular Plant Pathology, 13(4), 329-337. doi: 10.1111/j.1364-3703.2011.00754.x [ Links ]
Lee, J. Y., Moon, S. S., Yun, B. S., Yoo, I. D., & Hwang, B. K. (2004). Thiobutacin, a novel antifungal and antioomycete antibiotic from Lechevalieria aerocolonigenes. Journal of Natural Products, 67(12), 2076-2078. doi: 10.1021/np049786v [ Links ]
Lee, J. Y., Sherman, D. H., & Hwang, B. K. (2008). In vitro antimicrobial and in vivo antioomycete activities of the novel antibiotic thiobutacin. Pest Management Science, 64(2), 172-177. doi: 10.1002/ps.1494 [ Links ]
McGinnis, S., & Madden, T. L. (2004). BLAST: at the core of a powerful and diverse set of sequence analysis tools. Nucleic Acids Research, 32, 20-25. doi: 10.1093/nar/gkh435 [ Links ]
Nguyen, X. H., Naing, K. W., Lee, Y. S., Kim, Y. H., Moon, J. H., & Kim, K. Y. (2015). Antagonism of antifungal metabolites from Streptomyces griseus H7602 against Phytophthora capsici. Journal of Basic Microbiology, 55(1), 45-53. doi: 10.1002/jobm.201300820 [ Links ]
Nguyen, X. H., Naing, K. W., Lee, Y. S., Tindwa, H., Lee, G. H., Jeong, B. K., … Kim, K. Y. (2012). Biocontrol potential of Streptomyces griseus H7602 against root rot disease (Phytophthora capsici) in pepper. The Plant Pathology Journal, 28(3), 282-289. doi: 10.5423/PPJ.OA.03.2012.0040 [ Links ]
O’Brien, P. A. (2017). Biological control of plant diseases. Australasian Plant Pathology, 46(4), 293-304. doi: 10.1007/s13313-017-0481-4 [ Links ]
Reyes-Tena, A., Fernández-Pavia, S., Rincón-Enríquez, G., López-Pérez, L., & Quiñones-Aguilar, E. (2014). Selección de actinomicetos antagonistas a diferentes cepas de Phytophthora capsici. Revista Mexicana de Fitopatología, 32, S53. Retrieved from http://rmf.smf.org.mx/suplemento/docs/Volumen322014/Integrado/SUPLEMENTOINTEGRADO_32_2014.pdf [ Links ]
Reyes-Tena, A., Rincón-Enríquez, G., López-Pérez, L., & Quiñones-Aguilar, E. E. (2017). Effect of mycorrhizae and actinomycetes on growth and bioprotection of Capsicum annuum L. against Phytophthora capsici. Pakistan Journal of Agricultural Sciences, 54(3), 513-522. doi: 10.21162/PAKJAS/17.4245 [ Links ]
Rincón-Enríquez, G., López-Pérez, L., & Quiñones-Aguilar, E. E. (2014). Efectividad biológica in vitro de actinomicetos sobre el agente causal del tizón de halo en frijol. Revista Fitotecnia Mexicana, 37(3), 229-234. Retrieved from http://www.scielo.org.mx/pdf/rfm/v37n3/v37n3a8.pdf [ Links ]
Ristaino, J. B. (1990). Intraspecific variation among isolates of Phytophthora capsici from pepper and cucurbit fields in North Carolina. Phytopathology, 80(11), 1253-1259. doi: 10.1094/Phyto-80-1253 [ Links ]
Sadeghi, A., Koobaz, P., Azimi, H., Karimi, E., & Akbari, A. R. (2017). Plant growth promotion and suppression of Phytophthora drechsleri damping-off in cucumber by cellulase-producing Streptomyces. BioControl , 62(6), 805-819. doi: 10.1007/s10526-017-9838-4 [ Links ]
Saitou, N., & Nei, M. (1987). The neighbor-joining method: a new method for reconstructing phylogenetic trees. Molecular Biology and Evolution , 4(4), 406-425. doi: 10.1093/oxfordjournals.molbev.a040454 [ Links ]
Sellem, I., Triki, M. A., Elleuch, L., Cheffi, M., Chakchouk, A., Smaoui, S., & Mellouli, L. (2017). The use of newly isolated Streptomyces strain TN258 as potential biocontrol agent of potato tubers leak caused by Pythium ultimum. Journal of Basic Microbiology , 57(5), 393-401. doi: 10.1002/jobm.201600604 [ Links ]
Servicio de Información Agroalimentaria y Pesquera (SIAP). (2019). Panorama agroalimentario 2019. Mexico: Author. Retrieved from https://nube.siap.gob.mx/gobmx_publicaciones_siap/pag/2019/Atlas-Agroalimentario-2019 [ Links ]
Sharma, V., & Salwan, R. (2018). Biocontrol potential and applications of actinobacteria in agriculture. In: Singh, B. P., Gupta, V. K., & Passari, A. K. (Eds.), New and Future Developments in Microbial Biotechnology and Bioengineering (pp. 93-108). India: Elsevier. doi: 10.1016/B978-0-444-63994-3.00006-0 [ Links ]
Stackebrandt, E., & Liesack, W. (1993). Nucleic acids and classification. In: Goodfellow, M., & O'Donnell, A. G. (Eds.), Handbook of New Bacterial Systematics (pp. 152-189). USA: Academic Press. Retrieved from https://books.google.com.mx/books?redir_esc=y&hl=es&id=pmYXAQAAIAAJ&focus=searchwithinvolume&q=1492 [ Links ]
Stanghellini, M. E., Kim, D. H., Rasmussen, S. L., & Rorabaugh, P. A. (1996). Control of root rot of peppers caused by Phytophthora capsici with a nonionic surfactant. Plant Disease, 80(10), 1113-1116. doi: 10.1094/PD-80-1113 [ Links ]
StatPoint Inc. (2005). User Manual: StatGraphics Centurion , ver. XV. Virginia, USA: Author. Retrieved from http://www.statgraphics.com [ Links ]
Thampi, A., & Bhai, R. S. (2017). Rhizosphere actinobacteria for combating Phytophthora capsici and Sclerotium rolfsii, the major soil borne pathogens of black pepper (Piper nigrum L.). Biological Control, 109, 1-13. doi: 10.1016/j.biocontrol.2017.03.006 [ Links ]
Thompson, J. D., Higgins, D. G., & Gibson, T. J. (1994). CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. Nucleic Acids Research , 22(22), 4673-4680. doi: 10.1093/nar/22.22.4673 [ Links ]
Toquin, V., Latorse, M. P., & Beffa, R. (2019). Fluopicolide: a new anti-oomycete fungicide. In: Jeschke, P., Witschel, M., Krämer, W., & Schirmer, U. (Eds.), Modern Crop Protection Compounds (pp. 871-878). USA: John Wiley & Sons, Inc. doi: 10.1002/9783527699261.ch21 [ Links ]
Weisburg, W. G., Barns, S. M., Pelletier, D. A., & Lane, D. J. (1991). 16S ribosomal DNA amplification for phylogenetic study. Journal of Bacteriology, 173(2), 697-703. doi: 10.1128/jb.173.2.697-703.1991 [ Links ]
Wu, J., Xue, Z., Miao, J., Zhang, F., Gao, X., & Liu, X. (2020). Sensitivity of different developmental stages and resistance risk assessment of Phytophthora capsici to fluopicolide in China. Frontiers in Microbiology , 11, 185. doi: 10.3389/fmicb.2020.00185 [ Links ]
Yan, Y., Zhang, S., & Li, K. (2019). Antagonistic activity and mechanism of an isolated Streptomyces corchorusii stain AUH-1 against phytopathogenic fungi. World Journal of Microbiology and Biotechnology , 35, 145. doi: 10.1007/s11274-019-2720-z [ Links ]
Recibido: 03 de Junio de 2020; Aprobado: 13 de Enero de 2021











 texto em
texto em 





