Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo. Serie horticultura
versão On-line ISSN 2007-4034versão impressa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.24 no.3 Chapingo Set./Dez. 2018
https://doi.org/10.5154/r.rchsh.2017.09.035
Periodo apropiado de muestreo foliar para el diagnóstico nutrimental en tres cultivares de mango
1Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias-Campo Experimental Santiago Ixcuintla. Entronque Carretera Internacional México-Nogales km 6, Santiago Ixcuintla, Nayarit, C. P. 63300, MÉXICO.
2Universidad Autónoma de Nayarit, Unidad Académica de Agricultura. Carretera Tepic-Compostela km 9, Apdo. Postal 49, Xalisco, Nayarit, C. P. 63780, MÉXICO.
3Investigadores independientes. MÉXICO
En Nayarit, México, es común realizar análisis foliares en mango para su diagnóstico nutrimental; sin embargo, se desconoce el periodo adecuado para llevar a cabo el muestreo foliar, por lo que se emplean procedimientos extrapolados de otras regiones productoras, lo cual origina diagnósticos incorrectos. El objetivo de esta investigación fue identificar el periodo apropiado para realizar el muestreo foliar (PAMF) en mangos ‘Ataúlfo’, ‘Kent’ y ‘Tommy Atkins’ cultivados sin riego. De 2006 a 2007 se trabajó con huertos comerciales del norte, centro y sur de Nayarit. En ‘Ataúlfo’ y ‘Kent’ se consideraron los flujos vegetativos de primavera (FVP) y verano (FVV), y en ‘Tommy Atkins’ los FVP y otoño (FVO). Los muestreos foliares se realizaron mensualmente e iniciaron cuando la hoja alcanzó 5 cm de longitud y concluyeron hasta su abscisión. Para cada nutrimento, se obtuvo un modelo matemático para generar funciones que predijeran su concentración durante la vida de la hoja. Posteriormente, se calcularon las derivadas de cada función, con lo que se identificó el periodo en que la concentración de nutrimentos presentó la menor variación y así definir el PAMF. En ‘Ataúlfo’, el PAMF para los FVP y FVV fue de 9 a 11 y de 3.3 a 5.3 meses de edad, respectivamente; en ‘Kent’, este periodo fue de 8 a 10.5 (FVP) y de 3.2 a 5.0 (FVV) meses, y en ‘Tommy Atkins’ correspondió a hojas de 8.7 a 12.2 (FVP) y de 8.6 a 9.4 (FVO) meses. El procedimiento matemático empleado fue adecuado para identificar el PAMF en los tres cultivares de mango.
Palabras clave: Mangifera indica; flujos vegetativos; nutrición mineral; análisis foliar
In Nayarit, Mexico, it is common to perform leaf analyses in mango for nutrient diagnosis; however, the appropriate period to carry out leaf sampling is unknown, so procedures extrapolated from other producing regions are used, which leads to incorrect diagnoses. The aim of this research was to identify the appropriate leaf sampling period (ALSP) in 'Ataúlfo', 'Kent' and 'Tommy Atkins' mangos grown without irrigation. From 2006 to 2007 we worked with commercial orchards in the north, center and south of Nayarit. In 'Ataúlfo' and 'Kent' the spring (SpVF) and summer vegetative flushes (SuVF) were considered, and in 'Tommy Atkins' the SpVP and autumn one (AVF). Leaf samplings were performed monthly, starting when the leaf reached 5 cm in length and concluding upon its abscission. For each nutrient, a mathematical model was obtained to generate functions that predicted its concentration during the life of the leaf. Subsequently, we calculated the derivatives of each function, which enabled us to identify the period in which the concentration of nutrients presented the least variation and thus define the ALSP. In 'Ataúlfo', the ALSP for the SpVF and SuVF was from 9 to 11 and 3.3 to 5.3 months of age, respectively; in 'Kent', this period was from 8 to 10.5 (SpVF) and 3.2 to 5.0 (SuVF) months, and in 'Tommy Atkins' it corresponded to leaves from 8.7 to 12.2 (SpVF) and 8.6 to 9.4 (AVF) months. The mathematical procedure used was adequate to identify the ALSP in the three mango cultivars.
Keywords: Mangifera indica; vegetative flushes; mineral nutrition; leaf analysis
Introducción
Los estudios sobre concentración nutrimental foliar en mango han sido enfocados en las variaciones debidas a la edad, posición de la hoja (Koo & Young, 1972; Pathak & Pandey, 1976), el tipo de suelo, el efecto del cultivar, y diferencias entre brotes terminales con y sin fructificar (Samra, Chadha, & Thakur, 1978; Young & Koo, 1971). Además, los resultados han variado según el flujo vegetativo, la época de muestreo (Rajput, Chadha, & Thakur, 1985) y la etapa fenológica en que se realiza el muestreo foliar (Ponchner, Rojas, & Bornemisza, 1993).
Avilán (1971) describió dos fases críticas de la concentración de nutrientes en mango ‘Kent’ de Venezuela. La primera de incremento de la concentración nutrimental foliar, que comienza con el término de la cosecha y se extiende hasta la floración; la segunda de disminución de la cantidad de nutrimentos, que coincide con la formación de los frutos y es la más crítica. Sin embargo, Castro-López, Salazar-García, González-Durán, Medina-Torres, y González-Valdivia (2012) encontraron resultados diferentes en los cultivares Ataúlfo, Kent y Tommy Atkins en México, ya que la concentración de nutrimentos en hojas del flujo vegetativo de primavera (FVP) fue más afectada por las últimas etapas del desarrollo floral (estado coliflor a antesis). Mientras que en hojas de flujo vegetativo de verano (FVV) u otoño (FVO), los cambios nutrimentales ocurrieron en mayor medida por el crecimiento del fruto (Castro-López et al., 2012). No obstante, debe existir un periodo de mínima variación en la concentración de la mayoría de los nutrimentos, el cual sería el adecuado para realizar el muestreo foliar con fines de diagnóstico nutrimental (Salazar-García, González-Durán, & Ibarra-Estrada, 2015).
El principal criterio para determinar la época adecuada para el muestreo foliar es que la concentración nutrimental sea estable. Sin embargo, esto se obtiene a partir de gráficas descriptivas, por lo que la identificación del periodo de menor variación nutrimental es visual (Quiñones, Soler, & Legaz, 2013). Lo anterior dificulta determinar la etapa exacta de estabilidad, ya que sólo se tienen datos de las fechas en las que se realizó análisis nutrimental foliar, y generalmente el intervalo entre muestreos es muy amplio (Benítez-Pardo, Hernández-Montoya, Osuna-Enciso, Valenzuela-López, & Galván-Piña, 2003; Young & Koo, 1971).
El uso de funciones matemáticas y sus respectivas derivadas han sido útiles para determinar el periodo apropiado para el muestreo foliar (PAMF), ya que ayudan a identificar la etapa en la que ocurre la menor variación en la concentración de nutrimentos durante la vida de la hoja. Este procedimiento se utilizó para establecer el PAMF en aguacate ‘Hass’ (Salazar-García et al., 2015). No obstante, en mango no se encontró información al respecto.
En el estado de Nayarit, México, los análisis foliares son cada vez más usados para diagnosticar el estado nutrimental de los huertos de mango. Sin embargo, las fechas para colectar las hojas son determinadas a priori, sin considerar la edad de las hojas ni el flujo vegetativo del que provienen, o extrapoladas de otras regiones productoras. Por lo anterior, el objetivo de esta investigación fue identificar el periodo apropiado para realizar el muestreo foliar de mangos ‘Ataúlfo’, ‘Kent’ y ‘Tommy Atkins’ cultivados sin riego con fines de diagnóstico nutrimental.
Materiales y métodos
La investigación se realizó durante 2006 y 2007 en siete huertos comerciales sin riego de los cultivares Ataúlfo (dos huertos), Kent (tres huertos) y Tommy Atkins (dos huertos) establecidos a 8 x 8 m en los municipios Acaponeta (zona norte), San Blas y Tepic (zona centro) y Compostela (zona sur) de Nayarit (Cuadro 1). En esta región, el clima es cálido subhúmedo (García, 1998), y las temperaturas promedio máxima y mínima son de 28 y 18 °C, respectivamente. Las lluvias ocurren de junio a Octubre (1,089 a 1,324 mm) y la precipitación del mes más seco es menor a 50 mm.
Cuadro 1 Localización y características de los huertos de mango.
| Cultivar | Localidad, municipio | Coordenadas | Altitud (msnm) | Edad (años) | Clasificación de suelos |
|---|---|---|---|---|---|
| Ataúlfo | Atonalisco, Tepic | LN 21° 36’ 46.9’’ LO 104° 49’ 43.6’’ | 601 | 12 | Luvisol crómico |
| Chacala, Compostela | LN 21° 10’ 20.3’’ LO 105° 10’ 32.7’’ | 42 | 11 | Cambisol eútrico | |
| Kent | Buenavista, Acaponeta | LN 22° 27’ 44’’ LO 105° 26’ 55.8’’ | 11 | 10 | Cambisol eútrico |
| Las Palmas, San Blas | LN 21° 37’ 05.0’’ LO 105° 09’ 30.1’’ | 139 | 20 | Acrisol húmico | |
| Chacala, Compostela | LN 21° 10’ 05.2’’ LO 105° 10’ 31.5’’ | 54 | 17 | Cambisol eútrico | |
| Tommy Atkins | Buenavista, Acaponeta | LN 22° 27’ 44’’ LO 105° 26’ 55.8’’ | 14 | 18 | Cambisol eútrico |
| Chacala, Compostela | LN 21° 10’ 14.3’’ LO 105° 09’ 52.2’’ | 38 | 17 | Cambisol eútrico |
Análisis de suelo
Al inicio del estudio (mayo 2006), en cada huerto se eligieron al azar 10 árboles y de cada uno se obtuvo una muestra compuesta por cuatro submuestras (una por cada punto cardinal) de la zona de goteo del árbol, de 0-30 cm de profundidad, ya que es el lugar de mayor abundancia de raíces finas (Salazar-García, Ramírez-Murillo, & Gómez-Aguilar, 1993). De las 40 submuestras, se obtuvo una muestra compuesta a la que se le analizaron sus características físicas y químicas en un laboratorio acreditado por el programa North American Proficiency Testing (NAPT) de la Soil Science Society of America. Se le determinó textura; pH (1:2 agua) (McLean, 1982); materia orgánica por el método de Walkley y Black (Nelson & Sommers, 1982); N-inorgánico (Dahnke, 1990); P-Bray (Bray & Kurtz, 1945); K, Ca, Mg y Na extraídos con acetato de amonio (Doll & Lucas, 1973); Fe, Zn, Cu y Mn por el método DTPA (Lindsay & Norvell, 1978), y B por el método de agua caliente y Azometina-H (Bingham, 1982). Los nutrimentos se cuantificaron con un espectrofotómetro de absorción atómica (Thermo Series S, Madison, Wisconsin, USA), con excepción del P y B, los cuales se determinaron en un espectrofotómetro (Genesys™ 20, Thermo Scientific, Madison, Wisconsin, USA).
Muestreo foliar
En cada huerto se identificaron árboles que, a juicio del productor, tenían una producción anual ≥ 100 kg, lo cual supera la media actual (11 t·ha-1) de mango en la región (Servicio de Información Agroalimentaria y Pesquera [SIAP], 2016). De estos árboles, se seleccionaron al azar 20 y en cada uno se etiquetaron 20 brotes de cada flujo vegetativo en estado de rompimiento de yemas (día cero). En cada cultivar de mango se estudiaron dos flujos vegetativos cuyas fechas de inicio fueron: 05 de enero para el FVP (Ataúlfo, Kent y Tommy Atkins), 22 de junio para el FVV (Ataúlfo y Kent) y 21 de Septiembre para el FVO (Tommy Atkins). Una vez establecido el día cero, se contabilizaron los días después de la brotación de la hoja (ddbh) hasta su abscisión.
Se realizaron muestreos foliares mensuales para cada flujo vegetativo, alternando entre árboles nones y pares (10 árboles por fecha de muestreo), los cuales iniciaron cuando la hoja tenía ≥ 5 cm de longitud y terminaron cuando ocurrió la senescencia y abscisión. Para evitar la contaminación de las hojas con el suelo, éstas se sujetaron del peciolo, con un hilo de algodón, al brote que las sostenía. En cada muestreo se colectaron 20 hojas completas (lámina + peciolo) y sanas por árbol, de las posiciones seis y siete basipétala. En total se realizaron 15 muestreos foliares del FVP en los tres cultivares de mango (de febrero de 2006 a abril de 2007), 12 muestreos de los cultivares Ataúlfo y Kent del FVV (de Agosto de 2006 a julio de 2007) y 12 muestreos del cultivar Tommy Atkins del FVO (de Octubre de 2006 a Septiembre de 2007). Adicionalmente, en cada muestreo se midió la longitud de la lámina de 10 hojas de cada árbol.
Las hojas se lavaron y secaron en un horno con aire forzado a 65 °C durante 48 h. Posteriormente, se trituraron en un molino de acero inoxidable (MF10, IKA®), se tamizaron en malla núm. 1.0 (35 hoyos·cm-2) y se enviaron al laboratorio antes mencionado para determinar las concentraciones de N-total, NO3, P, K, Ca, Mg, S, Fe, Cu, Mn, Zn y B. La determinación de N-total se realizó mediante el método semi-microKjeldahl (Alcántar-González, & Sandoval-Villa, 1999; Bremner & Mulvaney, 1982), el cual se basa en la oxidación húmeda de la materia orgánica usando ácido sulfúrico y un catalizador; mientras que para NO3 se empleó el método de nitración con ácido salicílico (Alcántar-González, & Sandoval-Villa, 1999; Etchevers et al., 2000). El K se extrajo con agua destilada y se cuantificó en un espectrofotómetro de absorción atómica (ICE 3000™, Thermo Scientific) (Alcántar-González, & Sandoval-Villa, 1999; Etchevers et al., 2000). El P y S se determinaron utilizando los métodos de vanadato-molibdato amarillo y turbidimetría, respectivamente. El B se determinó por el método de calcinación azometina-H (Enríquez, 1989) con un espectrofotómetro (Genesys™ 20, Thermo Scientific, Madison, Wisconsin, USA). Para el Ca, Mg, Cu, Fe, Mn y Zn se empleó el método de digestión en microondas HNO3+HCl (Alcántar-González, & Sandoval-Villa, 1999; Etchevers et al., 2000). Estos últimos nutrimentos se cuantificaron por absorción atómica en un espectrofotómetro (ICAP 7200™, Thermo Scientific).
Determinación del periodo apropiado para el muestreo foliar
En esta determinación se siguió el procedimiento descrito por Salazar-García et al. (2015). Para cada huerto y flujo vegetativo, se generaron funciones matemáticas empleando los DDBH como variable independiente y las concentraciones de cada nutrimento como variables dependientes. La ecuación general fue: Nutrimento = β0 + β1D + β2D2 + β3D3 + β4D4 + β5D5; donde D son los días después de la brotación y β los coeficientes matemáticos. Posteriormente, para cada nutrimento se seleccionó la mejor función matemática por orden de respuesta (del primero hasta el sexto orden) con el procedimiento “Stepwise” del programa Statistical Analysis System (SAS Institute, 2009). Los criterios para elegir las mejores funciones fueron: 1) mayor valor de R2, 2) menor cuadrado medio del error (CME) y 3) el valor del coeficiente de Mallows (Cp) (Draper & Smith, 1981; Neter, Li, & Kutner, 1985). Una vez identificadas las mejores funciones, se calcularon sus coeficientes matemáticos (β0,…, βn) por el procedimiento REG (SAS Institute, 2009). Los valores predichos para cada día de la evolución nutrimental se calcularon sustituyendo el valor de DDBH en la ecuación general.
Una vez seleccionadas las mejores funciones matemáticas de cada nutrimento, se calcularon las derivadas para cada día. Los valores obtenidos se graficaron en SigmaPlot (Systat Software Inc., 2006) para identificar los periodos de menor variación, referidos aquí como de mayor estabilidad, de cada nutriente. Los valores pueden ser positivos o negativos, y conforme se aproximan a cero la tasa de cambio de la concentración de cada nutriente es menor; por lo que el criterio para determinar el PAMF fue que el resultado de la derivada fuera igual o cercano a cero (Granville, Smith, & Longley, 1963). Después, para cada cultivar de mango se elaboró una tabla con los periodos de mayor estabilidad para macro y micronutrimentos, así como los PAMF de cada flujo vegetativo.
Resultados y discusión
Propiedades de los suelos
Se presentaron algunas diferencias en las características del suelo de los huertos de mango donde se realizó el estudio (Cuadro 2). Los huertos de Chacala y Atonalisco tuvieron las texturas más arcillosas. El pH del suelo varió de 4.7 en Chacala a 6.7 en Las Palmas, y en los huertos de ‘Tommy Atkins’ y ‘Kent’ (Buenavista) se ubicó dentro de los límites en los que prospera el mango (5.0 a 6.5) (Chávez-Contreras, Vega-Piña, Tapia-Vargas, & Miranda-Salcedo, 2001). Por su parte, en los huertos de ‘Ataúlfo’ se registraron los pH más ácidos (4.7 a 4.9); este tipo de suelos suelen favorecer deficiencias nutrimentales foliares, principalmente de Ca y Mg (Salazar-García, 2002). No se detectaron problemas de salinidad y respecto a la materia orgánica, solamente en los huertos de Buenavista el contenido fue muy bajo. Adicionalmente, fueron evidentes las concentraciones bajas y muy bajas de Ca, Mg, Zn y B, y la de Mn fue clasificada de moderadamente alta a muy alta.
Cuadro 2 Propiedades del suelo (de 0-30 cm de profundidad) de los huertos de mango.
| Ataúlfo | Kent | Tommy Atkins | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Propiedad | Atonalisco | Chacala | Buenavista | Chacala | Las Palmas | Buenavista | Chacala | ||
| Textura | Ar1 | Ar | Fr | M-A-L | Ar | Fr | Ar | ||
| pH (1:2) | 4.9 FA | 4.7 FA | 5.1 FA | 6.6 MoAc | 6.7 N | 6.4 MoAc | 5.5 FA | ||
| CE (dS·m-1) | 0.170 | 0.08 | 0.60 | 0.16 | 0.11 | 0.26 | 0.08 | ||
| M.O. (%) | 3.0 MoA | 3.4MoA | 1.2 MoB | 4.7 MuA | 3.6 A | 1.4 MoB | 3.7 A | ||
| CIC (meq·100 g-1) | 7.59 | 7.47 | 4.9 | 15.0 | 18.9 | 5.86 | 9.90 | ||
| mg·kg-1 | |||||||||
| N-Inórganico | 11.4 M | 15.6 M | 81.4 MuA | 17.7 M | 8.94 MoB | 6.23 MoB | 12.2 M | ||
| P-Bray | 23.4 MoA | 25.2 MoA | 62.1 MuA | 10.8 MoB | 6.98 B | 9.2 MoB | 13.1 M | ||
| K | 357 M | 108 B | 384 M | 218 MoB | 346 M | 227 MoB | 225 MoB | ||
| Ca | 572 B | 687 B | 572 B | 2404 MoA | 2432 MoA | 858 B | 1230 MoB | ||
| Mg | 174 B | 160 B | 56 MuB | 280 MoB | 323 M | 71 MuB | 332 M | ||
| Na | 68 B | 34 MuB | 33 MuB | 38 MuB | 41 MuB | 31 MuB | 36 MuB | ||
| Fe | 18.6 M | 17.4 M | 53.4 A | 8.56 MoB | 7.14 MoB | 56.8 A | 25.9 MoA | ||
| Zn | 0.78 B | 0.42 B | 0.40 B | 0.44 B | 0.53 B | 0.75 B | 0.84 MoB | ||
| Mn | 29 MoA | 73.1 MuA | 47.9 A | 23.8 MoA | 28.9 MoA | 60.5 MuA | 98.4 MuA | ||
| Cu | 0.43 MoB | 2.42 A | 1.63 MoA | 2.05 MoA | 1.26 MoA | 1.45 MoA | 1.47 MoA | ||
| B | 0.42 MoB | 0.63 M | 0.55 MoB | 0.81 M | 0.63 M | 0.61 M | 0.78 M | ||
1Ar: arcillosa; Fr: franca; M-A-L: migajón-arcillo-limosa; FA: fuertemente ácido; MoAc: moderadamente ácido; N: neutro; MuB: muy bajo; B: bajo; MoB: moderadamente bajo; M: mediano; MoA: moderadamente alto; A: alto; MuA: muy alto; FuA: fuertemente alto y ModA: moderadamente ácido; CE: conductividad eléctrica; M.O.: contenido de materia orgánica; CIC: capacidad de intercambio catiónico.
Periodo apropiado para el muestreo foliar
Como los resultados del análisis foliar varían con el flujo vegetativo y la época de muestreo, Rajput et al. (1985) sugieren establecer una época adecuada de muestreo para cada flujo, esto para evitar resultados erróneos. En este trabajo, los periodos de estabilidad nutrimental foliar (PENF) mostraron diferencias entre los cultivares de mango, así como entre sus correspondientes flujos vegetativos (Cuadro 3).
Cuadro 3 Periodo de estabilidad nutrimental foliar en días (PENF; celdas sombreadas) y periodo apropiado para el muestreo foliar (PAMF; celdas entre líneas gruesas verticales) para cada flujo vegetativo de los mangos ‘Ataulfo’ y ‘Kent’.
| Ataúlfo | Primavera | PENF | PAMF | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Agosto | Septiembre | Octubre | Noviembre | Diciembre | Fecha | DDBH1 | |||||||||||||||||
| N, P, K, Ca, Mg, S | 249-331 | del 8 de Octubre al 2 de Diciembre | 276-331 | ||||||||||||||||||||
| Fe, Cu, Mn, Zn, B | 276-336 | 276-331 | |||||||||||||||||||||
| Verano | PENF | PAMF | |||||||||||||||||||||
| Agosto | Septiembre | Octubre | Noviembre | Diciembre | Fecha | DDBH | |||||||||||||||||
| N, P, K, Ca, Mg, S | 94-170 | del 30 de Septiembre al 29 de Noviembre | 100-160 | ||||||||||||||||||||
| Fe, Cu, Mn, Zn, B | 100-160 | 100-160 | |||||||||||||||||||||
| Kent | Primavera | PENF | PAMF | ||||||||||||||||||||
| Agosto | Septiembre | Octubre | Noviembre | Diciembre | Fecha | DDBH | |||||||||||||||||
| N, P, K, Ca, Mg, S | 241-316 | del 3 de Septiembre al 17 de Noviembre | 241-316 | ||||||||||||||||||||
| Fe, Cu, Mn, Zn, B | 215-318 | 241-316 | |||||||||||||||||||||
| Verano | PENF | PAMF | |||||||||||||||||||||
| Agosto | Septiembre | Octubre | Noviembre | Diciembre | Fecha | DDBH | |||||||||||||||||
| N, P, K, Ca, Mg, S | 96-150 | del 27 de Septiembre al 19 de Noviembre | 96-150 | ||||||||||||||||||||
| Fe, Cu, Mn, Zn, B | 75-157 | 96-150 | |||||||||||||||||||||
1Días después de la brotación de la hoja.
‘Ataúlfo’. En el FVP, el PENF para N, P, K, Ca y Mg fue de 249 a 331 DDBH (Cuadro 3; Figura 1A), y para el S de 175 a 226 DDBH. En el caso de micronutrimentos, el PENF ocurrió entre 276 y 236 DDBH (Cuadro 3; Figura 1B). Aunque la concentración de Mn no presentó estabilidad, dicho periodo aplica para este nutrimento. Por lo anterior, tanto para macro como micronutrimentos, el PAMF se delimitó del 8 de Octubre al 2 de Diciembre (276 a 331 DDBH).

Figura 1 Longitud de hoja, valor de la derivada y periodos de estabilidad nutrimental (espacio entre las líneas verticales) para macro (A y C) y micronutrimentos (B y D) en mango ‘Ataúlfo’. Datos de dos huertos.
Para el FVV, los macronutrimentos se estabilizaron entre 94 y 170 DDBH (Cuadro 3; Figura 1C) y los micronutrimentos entre 100 a 160 DDBH (Cuadro 3; Figura 1D). En ambos casos el PAMF fue del 30 de Septiembre al 29 Noviembre (100 a 160 DDBH; Cuadro 3). En este caso, al igual que en el FVP, el PENF de los micronutrimentos se ajustó al Mn a pesar de que en este nutrimento no se registró un periodo de estabilidad.
Para el mango ‘Manila’ cultivado en Veracruz, México, se recomienda hacer el muestreo foliar en junio-julio o Agosto-Septiembre, cuando las hojas de primavera tienen de cuatro a siete meses de edad (Mosqueda-Vázquez et al., 1996). Al comparar estos resultados con los obtenidos del cv. Ataúlfo no se encontró coincidencia, ya que en ‘Ataúlfo’ el PAMF para el FVP fue cuando las hojas tenían de nueve a once meses de edad. Lo anterior evidencia la necesidad de obtener información específica para cada cultivar de mango y condición de cultivo.
‘Kent’. En este cultivar, el PENF en el FVP para macronutrimentos fue de 241 a 316 DDBH (Cuadro 3; Figura 2A) y para micronutrimentos entre 215 y 318 DDBH (Cuadro 3; Figura 2B). Al igual que en ‘Ataúlfo’, el S no mostró un PENF que coincidiera con los demás macronutrimentos; no obstante, entre 241 y 316 DDBH el valor de su derivada mostró una menor tasa de cambio. La inestabilidad del S pudo ser ocasionada por las frecuentes aspersiones de químicos que contienen este elemento para controlar enfermedades como antracnosis y cenicilla (Espinoza-Aburto et al., 2006).
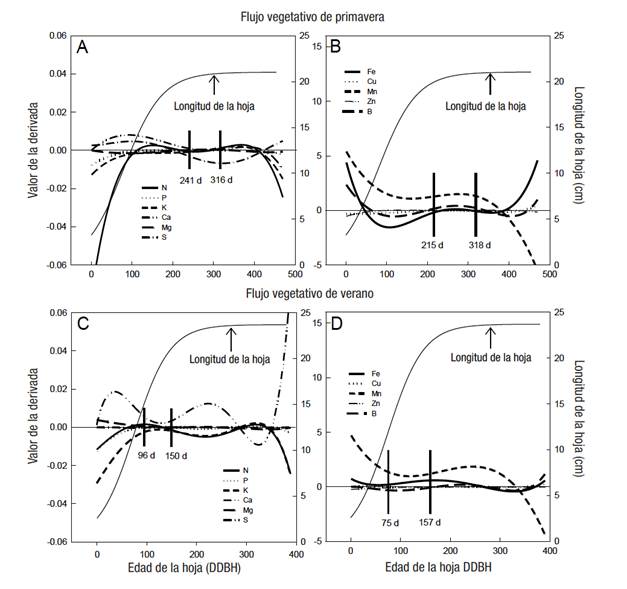
Figura 2 Longitud de hoja, valor de la derivada y periodos de estabilidad nutrimental (espacio entre las líneas verticales) para macro (A y C) y micronutrimentos (B y D) en mango ‘Kent’. Datos de tres huertos.
En el FVV, el PENF para macro y micronutrimentos fue entre 96 y 150 DDBH y 75 a 157 DDBH, respectivamente (Cuadro 3; Figuras 2D y 2C). De acuerdo con lo anterior, el PAMF fue del 26 de Septiembre al 19 de Noviembre (96 a 150 DDBH) (Cuadro 3). Los muestreos foliares son apropiados con edades de hoja entre ocho a diez meses (hojas de primavera) y tres a cinco meses (hojas de verano). Estos resultados no coinciden con los reportados por Benítez-Pardo et al. (2003), quienes para el mismo cultivar de mango, pero en el estado de Sinaloa (ubicado al norte de Nayarit), recomiendan analizar hojas de dos a cuatro meses de edad, aunque no especificaron el tipo de flujo vegetativo estudiado; además, dicho periodo de muestreo fue propuesto con un criterio visual (gráfico) y no matemático.
‘Tommy Atkins’. El PENF del FVP para macronutrimentos ocurrió de 195 a 370 DDBH y de 261 a 365 DDBH para micronutrimentos (Cuadro 4; Figuras 3A y 3B). Para el FVO, el PENF para macro y micronutrimentos fue de 256 a 282 DDBH y de 258 a 284 DDBH, respectivamente (Cuadro 4; Figuras 3C y 3D). De acuerdo con esto, el PAMF del FVP fue del 23 de Septiembre al 05 de enero (261 a 365 DDBH) y del 6 al 30 de junio (258 a 282 DDBH) para FVO (Cuadro 4). Este último resultado difiere de lo mencionado por Rajput et al. (1985), ya que sugieren que en climas subtropicales el mes para realizar muestreo de hojas del FVO es Octubre (abril en el hemisferio norte).

Figura 3 Longitud de hoja, valor de la derivada y periodo de estabilidad nutrimental (espacio entre las líneas verticales) para macro (A y C) y micronutrimentos (B y D) en mango ‘Tommy Atkins’. Datos de dos huertos.
Cuadro 4 Periodo de estabilidad nutrimental foliar en días (PENF; celdas sombreadas) y periodo apropiado para el muestreo foliar (PAMF; celdas entre líneas gruesas verticales) para cada flujo vegetativo del cv. Tommy Atkins.
| Primavera | PENF | PAMF | |||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Julio | Agosto | Septiembre | Octubre | Noviembre | Diciembre | Enero | Fecha | DDBH1 | |||||||||||||||||||||||
| N, P, K, Ca, Mg, S | 195-370 | 23 de Septiembre al 5 de enero | 261-365 | ||||||||||||||||||||||||||||
| Fe, Cu, Mn, Zn, B | 261-365 | 261-365 | |||||||||||||||||||||||||||||
| Otoño | PENF | PAMF | |||||||||||||||||||||||||||||
| Mayo | Junio | Julio | Agosto | Septiembre | Octubre | Noviembre | Fecha | DDBH | |||||||||||||||||||||||
| N, P, K, Ca, Mg, S | 256-282 | del 6 al 30 junio | 258-282 | ||||||||||||||||||||||||||||
| Fe, Cu, Mn, Zn, B | 258-284 | 258-282 | |||||||||||||||||||||||||||||
1Días después de la brotación de la hoja.
No se encontró información disponible de mango sobre periodos de muestreo para hojas del FVV; probablemente porque el FVP, que ocurre después de la floración, es el más importante en la mayoría de las regiones productoras de mango.
Conclusiones
Los periodos de mayor estabilidad de la concentración nutrimental foliar difirieron entre los tres cultivares de mango estudiados, sus flujos vegetativos y el nutriente en cuestión. El procedimiento matemático empleado en la presente investigación fue adecuado para identificar el periodo apropiado para realizar los muestreos foliares para el análisis de la mayoría de nutrimentos en los tres principales cultivares de mango (Ataulfo, Kent y Tommy Atkins) en Nayarit, México.
Agradecimientos
Al Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias, al Fondo Mixto del estado de Nayarit (proyecto 2005-C01-25/A-1) y al Consejo Nacional de Ciencia y Tecnología-Fondo Institucional de Fomento Regional para el Desarrollo Científico, Tecnológico y de Innovación (proyecto 115830) por el financiamiento. Además, se agradece el apoyo técnico de Mariela Castro López, así como de los productores Alvino Hernández, Juan J. Salazar, Armando Arrambide, Santos Ramos, Benito Carrillo y Alberto Ramos por facilitar sus huertos para la investigación.
REFERENCIAS
Alcántar-González, G., & Sandoval-Villa, M. (1999). Manual de análisis químico de tejido vegetal. Chapingo, México: Sociedad Mexicana de la Ciencia del Suelo, A.C. [ Links ]
Avilán, R. L. (1971). Variaciones de los niveles de N, P, K y Ca en las hojas de mango (Mangifera indica L.) a través de un ciclo de producción. Agronomía Tropical, 21(1), 3-10. Retrieved from http://www.sian.inia.gob.ve/revistas_ci/Agronomia%20Tropical/at2101/arti/avilan_l.htm [ Links ]
Benítez-Pardo, D., Hernández-Montoya, M., Osuna-Enciso, M. T., Valenzuela-López, M., & Galván-Piña, B. (2003). Muestreo y análisis foliar relacionados con fenología en mango en el sur de Sinaloa, México. Terra, 21(2), 73-283. Retrieved from http://www.redalyc.org/articulo.oa?id=57315595013 [ Links ]
Bingham, F. T. (1982). Boron. In: Miller, R. H., Keeney, D. R., & Page, A. L. (Eds.), Methods of soil analysis, part 2 (pp. 431-446). Madison, WI, USA: American Society of Agronomy and Soil Science Society of America. [ Links ]
Bray, R. H., & Kurtz, L. T. (1945). Determination of total, organic and available phosphorus in soil. Soil Science, 59, 39-45. Retrieved from http://garfield.library.upenn.edu/classics1987/A1987J041400001.pdf [ Links ]
Bremner, J. M., & Mulvaney, C. S. (1982). Total nitrogen. In: Page, A. L., Miller, R. H., & Keeney, D. R. (Eds), Methods of soil analysis. Agronomy no. 9. Part. 2 (pp. 595-694). Madison, WI, USA: American Society of Agronomy and Soil Science Society of America . [ Links ]
Castro-López, M. G., Salazar-García, S., González-Durán, I. J. L., Medina-Torres, R., & González-Valdivia, J. (2012). Evolución nutrimental foliar en tres cultivares de mango en Nayarit, México. Revista Mexicana de Ciencias Agrícolas, 3(4), 685-700. Retrieved from http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2007-09342012000400005 [ Links ]
Chávez-Contreras, X., Vega-Piña, A., Tapia-Vargas, L. M., & Miranda-Salcedo, M. A. (2001). Mango, su manejo y producción en el trópico seco de México. Michoacán, México: Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. [ Links ]
Dahnke, W. C. (1990). Testing soils for available nitrogen. In: Westerman, R. L. (Ed.), Soil Testing and Plant Analysis (pp. 120-140). Madison, WI, USA: American Society of Agronomy and Soil Science Society of America . [ Links ]
Doll, E. C., & Lucas, R. E. (1973). Testing soil for potassium, calcium and magnesium. In: Walsh, L. M., & Beaton, J. D. (Eds.), Soil Testing and Plant Analysis (pp. 133-152). Madison, WI, USA: Soil Science Society of America. [ Links ]
Draper, N. R., & Smith, H. (1981). Applied Regression Analysis. USA: John Wiley & Sons, Inc. [ Links ]
Enríquez, R. S. (1989). Análisis de Boro en suelos y plantas mediante el método de azometina-H. Terra, 7, 13-20. [ Links ]
Espinoza-Aburto, J., Arias-Suárez, J. F., Miranda-Salcedo, M. A., Rico-Ponce, H. R., Mercado, J., López-Acosta, A., Vargas-Gómez, E., & Teniente-Oviedo, R. (2006). Guía práctica para la producción de mango en Michoacán. Michoacán, México: Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias . [ Links ]
Etchevers, B. J. D., Goijberg, G., López, R. R. M., Padilla, C. J., Alvarado-López, J., Hidalgo, M. C., Cruz, H. M. L., Guerrero P. A., Gutiérrez, B., & Miranda C. E. (2000). Manual de procedimientos analíticos para análisis de suelos y plantas del laboratorio de fertilidad de suelos. Texcoco, México: Instituto de Recursos Naturales - Colegio de Postgraduados. [ Links ]
García, E. (1998). Climas (clasificación de Köppen, modificado por García), escala 1:1,000,000. México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CANABIO). [ Links ]
Granville, W. A., Smith, P. F., & Longley, W. R. (1963). Elements of the differential and integral calculus. USA: John Wiley & Sons Inc. [ Links ]
Koo, R. C. J., & Young, T. W. (1972). Effect of age and position on the mineral composition of mango leaves. USA. Proceeding of the American Society for Horticultural Science, 97, 792-794. [ Links ]
Lindsay, W. L., & Norvell, W. A. (1978). Development of a DTPA soil test for zinc, iron, manganese, and copper. Soil Science Society of America Journal, 42(3), 421-428. doi:10.2136/sssaj1978.03615995004200030009x [ Links ]
McLean, E. O. (1982). Soil pH and lime requirement. In: Page, A. L., Miller, R. H., & Keeney, D. R. (Eds.), Methods of Soil Analysis, Part 2. (pp. 133-152). Madison, WI, USA: American Society of Agronomy and Soil Science Society of America . [ Links ]
Mosqueda-Vázquez, R., de los Santos-Rosa, F., Becerra-León, E. N., Cabrera-Míreles, H., Ortega-Zaleta, D. A., & del Ángel-Pérez, A. L. (1996). Manual para cultivar mango en la planicie costera del golfo de México. Veracruz: Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. [ Links ]
Nelson, D. W., & Sommers, L. E. (1982). Total carbon, organic carbon and organic matter. In: Page, A. L., Miller, R. H., & Keeney, D. R. (Eds.), Methods of Soil Analysis, Part 2 (pp. 539-594). Madison, WI, USA: American Society of Agronomy and Soil Science Society of America . [ Links ]
Neter, J., Li, W., & Kutner, M. H. (1985). Applied linear statistical models. USA: McGraw-Hill. [ Links ]
Pathak, R. A., & Pandey, R. M. (1976). Sampling for mineral content in leaves of mango cultivar 'Dashehari'. Scientia Horticulturae, 5(3), 255-264. doi: 10.1016/0304-4238(76)90090-X [ Links ]
Ponchner, S., Rojas, R., & Bornemisza, E. (1993). Variación estacional de nutrimentos en árboles de mango (Mangifera indica L.) en tres suelos del Pacífico seco de Costa Rica. I. macronutrimentos. Agronomía Costarricense, 17(2), 21-30. Retrieved from http://www.mag.go.cr/rev_agr/v17n02_021.pdf [ Links ]
Quiñones, A., Soler, E., & Legaz, F. (2013). Determination of foliar sampling conditions and standard leaf nutrient levels to assess mineral status of loquat tree. Journal of Plant Nutrition, 36(2), 284-298. doi: 10.1080/01904167.2012.739248 [ Links ]
Rajput, M. S., Chadha K. L., & Thakur, R. S. (1985). Standardization of leaf sample size for nutrient analysis in mango. Indian Journal of Horticulture, 42, 210-212. [ Links ]
Salazar-García, S. (2002). Nutrición del aguacate, principios y aplicaciones. México: Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias - Instituto de la Potasa y el Fósforo. [ Links ]
Salazar-García, S., González-Durán, I. J. L., & Ibarra-Estrada, M. E. (2015). Identification of the appropriate leaf sampling period for nutrient analysis in ‘Hass’ avocado. HortScience, 50(1), 130-136. Retrieved from http://hortsci.ashspublications.org/content/50/1/130.full.pdf+html [ Links ]
Salazar-García, S., Ramírez-Murillo, P. E., & Gómez-Aguilar R. (1993). Desarrollo radical de portainjertos de mango en función del cultivar injertado, la edad del árbol y la textura del suelo. Revista Fitotecnia Mexicana, 16, 12-20. [ Links ]
Samra, J. S., Chadha K. L. , & Thakur, R. S. (1978). Comparison of some mango cultivars in terms of their macro-nutrient status in fruiting and non-fruiting terminals. Indian Journal of Horticulture, 35, 184-187. [ Links ]
Servicio de Información Agroalimentaria y Pesquera (SIAP). (2016). Atlas agroalimentario 2016. México, D.F.: Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. [ Links ]
Statistical Analysis System (SAS Institute). (2009). SAS user’s guide version 9.1. Cary: Author. [ Links ]
Systat Software Inc. (2006). SigmaPlot: Exact graphs and data analysis. U.S.A: Author. [ Links ]
Young, T. W., & Koo, R. C. (1971). Variations in minerals of Florida mango leaves. U.S.A.: Florida State Horticultural Society. [ Links ]
Recibido: 22 de Septiembre de 2017; Aprobado: 03 de Abril de 2018











 texto em
texto em 


