Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo. Serie horticultura
versão On-line ISSN 2007-4034versão impressa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.24 no.2 Chapingo Mai./Ago. 2018
https://doi.org/10.5154/r.rchsh.2017.06.020
Rendimiento y concentración de antocianinas en Hibiscus sabdariffa L. con aplicación foliar de micronutrimentos
1Universidad Michoacana de San Nicolás de Hidalgo, Facultad de Agrobiología. Paseo Lázaro Cárdenas s/n esq. Berlín, Colonia Viveros, Uruapan, Michoacán, C. P. 60190, MÉXICO.
2Colegio de Posgraduados, Campus Montecillo. Carretera México-Texcoco km 36.5, Montecillo, Texcoco, México, C. P. 56230, MÉXICO.
El consumo de alimentos nutracéuticos, como los extractos de cálices de jamaica (Hibiscus sabdariffa L.), mejoran la salud y previenen varias enfermedades, esto atribuido en parte a la actividad de sus antocianinas. La exposición de las plantas a concentraciones altas de algunos metales pesados estimula la síntesis de antocianinas; por ello, el objetivo del presente estudio fue determinar el efecto de la aplicación foliar de Zn y Cu a concentraciones altas sobre el rendimiento de cálices, contenido de antocianinas y características físico-químicas en tres genotipos de jamaica. Se sembraron los genotipos Criolla Guerrero, Criolla Michoacán y Reina Roja bajo condiciones de lluvia estacional. El follaje de las plantas en etapa vegetativa se asperjó con soluciones de Zn y Cu por separado, realizando en total cuatro aplicaciones de 300 mg∙L-1. Ambos elementos redujeron el rendimiento de cálices en Criolla Guerrero, no lo modificaron en Criolla Michoacán y en Reina Roja el Zn incrementó el rendimiento en 15.9 %, logrando 1,232 kg∙ha-1. En todos los genotipos, las aplicaciones de estos elementos mejoraron el contenido de antocianinas y acidez titulable, y disminuyeron el contenido de ácido ascórbico. Criolla Michoacán presentó el mayor incremento de antocianinas, con Cu 187 % y con Zn 175 %; sin embargo, este genotipo no superó al contenido final de antocianinas en Reina Roja, que con Cu registró 22.68 mg∙g-1. Por lo que la aplicación de estos elementos es una alternativa para incrementar el contenido de antocianinas, a las cuales se les atribuyen algunas cualidades nutracéuticas.
Palabras clave: acidez titulable; ácido ascórbico; antioxidantes; jamaica
The consumption of nutraceutical foods, such as extracts of roselle (Hibiscus sabdariffa L.) calyces, improve health and prevent several diseases, attributable in part to the activity of their anthocyanins. Exposure of plants to high concentrations of some heavy metals stimulates the synthesis of anthocyanins; therefore, the objective of this study was to determine the effect of foliar application of Zn and Cu at high concentrations on calyx yield, anthocyanin content and physicochemical characteristics in three roselle genotypes. The Criolla Guerrero, Criolla Michoacán and Reina Roja genotypes were sown under rainfed conditions. The foliage of the plants in vegetative stage was sprayed with Zn and Cu solutions separately, making in total four applications of 300 mg. L-1. Both elements reduced the calyx yield in Criolla Guerrero, did not modify it in Criolla Michoacán and in Reina Roja the Zn increased the yield by 15.9 %, achieving 1,232 kg. ha-1. In all genotypes, the applications of these elements improved the content of anthocyanins and titratable acidity and decreased the content of ascorbic acid. Criolla Michoacán had the highest increase in anthocyanins, with 187 % Cu and with 175 % Zn; however, this genotype did not exceed the final anthocyanin content in Reina Roja, which with Cu recorded 22.68 mg. g-1. Therefore, the application of these elements is an alternative to increase the content of anthocyanins, to which some nutraceutical qualities are attributed.
Keywords: titratable acidity; ascorbic acid; antioxidants; roselle
Introducción
Los alimentos funcionales producen efectos fisiológicos benéficos al ser consumidos de manera regular, debido a que son fuente de componentes biológicamente activos. En general, se dice que mejoran la salud, por lo que se utilizan en el tratamiento y prevención de diversas enfermedades (Norberto et al., 2013). Dichas propiedades se asocian a la presencia de fitoquímicos como glucosinolatos (compuestos de azufre en las alliáceas pero principalmente en brasicáceas), terpenoides (carotenoides, monoterpenoides y fitosteroles) y varios grupos de polifenoles (principalmente flavonas, isoflavonas, estilbenos, ácido elágico y antocianinas) (Chen, Remondetto, & Subirade, 2006).
Las antocianinas otorgan el color rojo y azul a órganos de plantas como frutos, flores y hojas (Pojer, Mattivi, Johnson, & Stockley, 2013). Este tipo de polifenoles tienen propiedades farmacológicas como reducción de la enfermedad coronaria y efectos anticancerígenos, antitumorales, antiinflamatorios y antidiabéticos; además, mejoran la agudeza visual y el comportamiento cognitivo. Los efectos farmacológicos de las antocianinas están relacionados con su actividad antioxidante (Hopkins, Lamm, Funk, & Ritenbaugh, 2013; Kim, Joo, & Yoo, 2009).
Como fuente importante de antocianinas destacan los cálices de jamaica (Hibiscus sabdariffa L.); las cuales se consumen principalmente como bebidas refrescantes (Prenesti, Berto, Daniele, & Taso, 2007). El color de los cálices de Hibiscus varía desde verde amarillento hasta rojo intenso, y se encuentra relacionado con el contenido de estos fitoquímicos (Christian & Jackson, 2009). Así, las variedades de cálices oscuros contienen entre cinco y siete veces más concentración de antocianinas que las de cálices claros; por su parte, las variedades verdes y amarillas carecen de estos compuestos (Salinas-Moreno, Zúñiga-Hernández, Jiménez-de la Torre, Serrano-Altamirano, & Sánchez-Feria, 2012).
Las condiciones ambientales en la producción de jamaica tienen un efecto directo en el contenido de los principales polifenoles presentes en los cálices. De acuerdo con el sitio de producción, la cantidad de antocianinas puede incluso duplicarse en algunas variedades (Juliani et al., 2009). El incremento en el contenido de antocianinas en los cálices podría mejorar la calidad nutracéutica y con ello aumentar el valor del producto. Actualmente, en la comercialización de jamaica, los criterios de calidad más importantes son la acidez de los extractos y el contenido de antocianinas; este último se relaciona con el número de extracciones que pueden realizarse a partir de los cálices (Galicia-Flores, Salina-Moreno, Espinosa-García, & Sánchez-Feria, 2008).
Diversos tipos de estrés en las plantas, como el ataque de patógenos, radiación UV-B, temperaturas bajas, limitaciones de N, sequía, así como la aplicación de compuestos prooxidantes como H2O2, ácido salicílico o metales pesados (cobre, cromo, zinc, hierro, níquel, cobalto), pueden causar cambios en el metabolismo y así modificar la concentración de flavonoides (Xing, Huang, & Liu, 2010). La exposición a metales pesados puede ocasionar incremento en la producción de especies reactivas o radicales libres como el superóxido, el peróxido de hidrogeno y radicales hidroxilo (Stohs & Bagchi, 1995). Bajo estas condiciones los genes de algunas plantas se activan y modulan la biosíntesis de flavonoides como las antocianinas; en consecuencia, los niveles de estos fitoquímicos se incrementan durante la exposición al estrés (Hernández, Alegre, van Breusegem, & Munné-Bosch, 2009). La síntesis inductiva de antocianinas es el resultado de la activación de genes y se realiza con la finalidad de incrementar la respuesta antioxidante de la planta para mantener el estatus fisiológico de tejidos, directa o indirectamente afectado por el estrés (Ling-Peng, Xin-Jiao, & Hai-Hu, 2012).
Las antocianinas tienen la capacidad de proteger a la planta contra el estrés oxidativo, debido a su capacidad de estabilizar los electrones desapareados de los radicales libres, esto mediante la donación de átomos de hidrógeno. Se ha reportado que las antocianinas tienen mayor capacidad antioxidante que las vitaminas C y E (Hernández et al., 2009; Sytar et al., 2013). Además, diversos tipos de antocianinas como la 3-sambubiósido de delfinidina y la 3-sambubiósido de cianidina, presentes en cálices de jamaica, también tienen la capacidad de formar complejos con metales y de esta manera proteger a la planta contra efectos dañinos (Castañeda-Ovando, Galán-Vidal, Pacheco-Hernández, Rodríguez, & Páez-Hernández, 2009; Galicia-Flores et al., 2008).
En algunas especies de plantas como Arabidopsis thaliana, la exposición in vitro a metales esenciales (Cu, Zn y Mn) y no esenciales (Pb y Hg) estimuló la síntesis de antocianinas; dicho efecto fue proporcional a la dosis del elemento (Baek et al., 2012). El Cu a dosis de 250 µM fue el más eficaz para incrementar los niveles de polifenoles de 2 a 32.5 µg. g-1 de materia fresca (MF) y con Zn el aumento máximo fue con 1,000 µM (14 µg. g-1 MF). No obstante, dosis altas de estos elementos redujeron la longitud de raíces y brotes en A. thaliana (Baek et al., 2012). La aplicación de otros elementos como As también provocó aumento en la concentración de antocianinas; de esta manera, en Lemna gibba el contenido mayor de estos metabolitos se encontró con 1.5 mg de As por L (45 mg. 100 g-1 de MF) (Alves-Leão, Alves-de Oliveira, Arantes-Felipe, Santos-Fernese, & Soares-Gusman, 2014). En Atriplex hortensis var. Purpurea y A. rosea expuestas a tratamientos con distintas concentraciones de Cu, Ni, Pb y Zn no se observaron cambios en la concentración de antocianinas (Sai et al., 2015). De acuerdo con Alves-Leão et al. (2014), las plantas responden de manera diferente al estrés por metales pesados, lo cual depende del tipo de metal, la concentración y la duración del estrés.
En cálices de jamaica se ha documentado que la aplicación de sulfato de cobalto y de níquel (20 a 25 mg. kg-1 de suelo, respectivamente) incrementaron la concentración de antocianinas y de otros flavonoides (Aziz, Gad, & Badran, 2007); sin embargo, la aplicación vía foliar podría hacer más eficiente esta respuesta. Por otra parte, el Zn y Cu son nutrimentos que se venden como fertilizantes foliares y, por tratarse de elementos esenciales, contribuyen a mejorar la nutrición de la planta, lo que además ocasiona un mejor rendimiento agrícola. Los estudios sobre la inducción de estrés oxidativo en el cultivo de jamaica mediante la aplicación de metales pesados para incrementar la concentración de antocianina son limitados, por lo que el objetivo de la presente investigación fue determinar el efecto de la aplicación foliar de Zn y Cu a concentraciones altas sobre el rendimiento de cálices, concentración de antocianinas y características físico-químicas en tres genotipos de jamaica.
Materiales y métodos
Localización del estudio
El experimento se estableció en campo bajo condiciones de lluvia estacional en la población de Cajones, perteneciente al municipio Gabriel Zamora, Michoacán, México (19º 10’ 49” latitud norte y 101º 58' 13” longitud oeste, a 503 msnm). El clima de este lugar es Aw0 que corresponde a cálido subhúmedo con lluvias en verano (García, 2004).
Establecimiento del experimento y aplicación de tratamientos
El 8 de julio de 2015 se realizó la siembra de los genotipos de jamaica: Criolla Guerrero (CG), Criolla Michoacán (CM) y Reina Roja (RR) (Figura 1); los cuales son altamente comercializados en Guerrero y Michoacán. Para el estudio, las semillas fueron proporcionadas por productores de estos estados. Los tres genotipos se sometieron a aspersiones foliares con Zn y Cu por separado, y al testigo (sin aplicación foliar, 0). La combinación de genotipos con tratamientos generó nueve combinaciones (CG-0, CG-Zn, CG-Cu, CM-0, CM-Zn, CM-Cu, RR-0, RR-Zn, RR-Cu), que se distribuyeron en campo bajo un diseño experimental de bloques completos al azar en arreglo de parcelas divididas, con cuatro repeticiones. La parcela grande fue el genotipo y la parcela chica los micronutrimentos. En total fueron 36 unidades experimentales, cada una con tres surcos de 3 m de longitud y separación de 0.8 m. Se sembraron dos semillas por mata cada 0.5 m para una densidad de población de cinco plantas por m2. A partir de los 15 días después de la emergencia se realizaron aplicaciones foliares hasta punto de goteo con 300 mg. L-1 de zinc (Zn) y de cobre (Cu), más un testigo sin aspersión. En total se realizaron cuatro aplicaciones cada una con intervalos de siete días.

Figura 1 Genotipos de jamaica utilizados en el presente estudio: A) Criolla Guerrero, B) Reina Roja y C) Criolla Michoacán.
Las fuentes de los micronutrimentos fueron: sulfato de zinc heptahidratado (ZnSO4. 7H2O) y sulfato cúprico pentahidratado (CuSO4. 5H2O). Adicionalmente, a cada mezcla se le agregó 1 mL. L-1 de adherente Inex®. Para su aplicación, se utilizó una bomba de 15 L de capacidad equipada con una boquilla de cono vacío (hueco).
La fertilización al suelo se realizó con 80 y 40 kg. ha-1 de N y P2O5, aplicados como urea (46-0-0) y superfosfato de calcio triple (0-46-0). Además, se aplicó 100 % de P2O5 y 50 % de N a los 15 días después de la siembra (dds), y el resto del N a los 45 dds.
Determinación del rendimiento y componentes del rendimiento
La cosecha se realizó a madurez fisiológica, cuando los frutos iniciaron con coloración café y las semillas presentaron coloración negra. Esta etapa varió entre genotipos, en Criolla Guerrero y Reina Roja ocurrió aproximadamente a los 145 dds y en Criolla Michoacán a los 156 dds. Del surco central de cada unidad experimental se cosecharon los cálices sin fruto, y en estas estructuras se midieron los componentes del rendimiento: longitud y diámetro de cálices, número de cálices por planta y peso de 10 cálices. Posteriormente, se secaron en una estufa de circulación de aire forzado a 50 °C hasta peso constante.
Determinación de características físico-químicas en cálices secos
De cada repetición de los diferentes tratamientos se prepararon por duplicado extractos acuosos; para lo cual, 15 g de cálices en base seca se pulverizaron en un molino (marca IKA® modelo MF 10) con malla de 0.5 mm. Del polvo se pesaron 2.5 g que se colocaron en frascos de vidrio (marca Schott Duran®) de 250 mL, en donde se agregaron 200 mL de agua destilada. La mezcla se dejó reposar 24 h a temperatura ambiente en oscuridad, posteriormente los extractos se colocaron en baño maría a 40 °C por 15 min. En los extractos obtenidos se midió: pH con un potenciómetro Beckman pH Meter® (método 981.12), sólidos solubles totales (método 932.12) con un refractómetro digital marca ATAGO® (escala 0 a 32 %), acidez titulable como porcentaje del ácido cítrico presente (método 942.15) y contenido de ácido ascórbico (método 967.21) con 2,6-diclorofenolindofenol. Las determinaciones se realizaron de acuerdo con la metodología de la Association of Official Analytical Chemists (AOAC, 1980).
La concentración de antocianinas se determinó con el método de Abdel-Aal y Hucl (1999), para lo cual se pesaron 100 mg de cada muestra pulverizada y se transfirieron a tubos de centrifuga, a cada muestra se le agregaron 10 mL de solución extractora de metanol acidificado (metanol: HCl 1.5N en proporción 85:15 v/v). La mezcla se dejó reposar por 24 h en condiciones de oscuridad a 4 °C. Posteriormente, para evitar variación en el volumen de la solución extractora por efecto de evaporación, se aforó al volumen inicial. Las muestras se centrifugaron a 5,000 rpm por 20 min en una centrifuga Heraeus™ Biofuge Primo R. Se realizó una dilución 1:10 (100 µL del extracto concentrado + 900 µL de metanol acidificado). Finalmente, se leyó la absorbancia del extracto diluido a una longitud de onda de 533 nm en un espectrofotómetro Genesys® 10 UV (Termo Spectronic), como blanco se usó la solución extractora.
El contenido de antocianinas se estimó como equivalentes de cianidina-3-glucósido con la ecuación: A = (Ab/ɛ)(Ve/1,000)PM(1/Ph)(10 6 ), donde A es la concentración de antocianinas, Ab es la absorbancia del extracto, ɛ es el coeficiente de extinción molar de la cianidina-3-glusósido (25,965 cm-1. mol-1), Ve es el volumen total del extracto, PM es el peso molecular de la cianidina-3-glucósido (449) y Ph es el peso de la muestra. El contenido total de antocianinas se expresó en mg de antocianinas por g de materia seca de cálices.
Análisis estadístico
Los datos de las variables se analizaron mediante un análisis de varianza y prueba de comparación de medias entre tratamientos (Tukey, P ≤ 0.05), ambos con el paquete Statistical Analysis System (SAS, 2002).
Resultados y discusión
Rendimiento de cálices y componentes del rendimiento
La aplicación de Zn y Cu no modificó estadísticamente (P ≤ 0.05) la longitud y diámetro de cálices, pero redujeron el número de cálices por planta en Criolla de Guerrero y Reina Roja. En estos mismos genotipos, el Zn incrementó de manera significativa el peso de los cálices, mientras que el Cu favoreció esta variable solo en Reina Roja (Cuadros 1 y 2). Esto generó variación en el rendimiento en la interacción genotipo x micronutrimento; así, en Criolla Guerrero el suministro foliar de estos micronutrimentos redujeron el rendimiento, con Zn la disminución fue 21 % y con Cu 12 %, aunque estas reducciones no difirieron estadísticamente (P ≤ 0.05). Dicho resultado puede ser atribuido a que estos elementos provocaron, en las plantas de Criolla Guerrero, reducciones en el tamaño del dosel vegetal (índice de área foliar) y en el diámetro del tallo; en promedio, estas variables fueron 15 % menores que en plantas sin aplicación.
Cuadro 1 Nivel de significancia de las variables evaluadas en cálices de jamaica (Hibiscus sabdariffa).
| Factor | Rendimiento | Longitud | Diámetro | Número de cálices por planta | Peso de 10 cálices |
|---|---|---|---|---|---|
| Genotipo (G) | ** | ** | ** | ** | *** |
| Micronutrimento (M) | ns | ns | ns | ** | ** |
| Interacción G x M | ** | ** | * | ** | ** |
*, ** P ≤ 0.01 y 0.05, respectivamente; ns = no significativo (P ≥ 0.05)
Cuadro 2 Prueba de comparación de medias de las variables evaluadas en cálices de jamaica (Hibiscus sabdariffa).
| Genotipos | Micronutrimento | Longitud (cm) | Diámetro (cm) | Número de cálices | Peso de 10 cálices (g) |
|---|---|---|---|---|---|
| Criolla Guerrero | 01 | 3.5 cz | 3.4 ab | 32.6 bc | 4.35 e |
| Zn | 3.6 c | 3.6 ab | 23.5 d | 4.78 d | |
| Cu | 3.8 bc | 3.7 a | 30.7 c | 4.05 e | |
| Criolla Michoacán | 0 | 3.1 c | 2.0 d | 34.8 ab | 3.42 f |
| Zn | 3.2 c | 2.0 d | 36.4 a | 3.27 f | |
| Cu | 3.3 c | 2.0 d | 34.3 ab | 3.08 f | |
| Reina Roja | 0 | 4.5 ab | 2.9 c | 17.3 e | 7.83 c |
| Zn | 4.8 a | 3.1 bc | 14.9 ef | 11.03 b | |
| Cu | 4.4 ab | 2.9 c | 12.9 f | 11.82 a | |
| Media general | 3.81 | 2.80 | 26.35 | 5.96 | |
| DMSH | 0.80 | 0.48 | 3.03 | 0.37 | |
| CV (%) | 8.10 | 6.80 | 4.80 | 12.30 | |
10 = sin aplicación de micronutrimentos, Zn = aplicación de Zn, Cu = aplicación de Cu, DMSH = diferencia mínima significativa honesta, CV = coeficiente de variación.
zMedias con letras iguales dentro de cada columna no difieren estadísticamente (Tukey, P ≤ 0.05).
Xing, Huang, y Liu (2010) mencionan que en algunas plantas el uso de metales pesados en concentraciones altas provoca estrés oxidativo, debido a la producción de especies reactivas que dañan los componentes celulares como el ADN, proteínas y lípidos, lo que afecta el crecimiento y rendimiento de los cultivos. Algunas plantas presentan mecanismo para tolerar el estrés por metales pesados como la exclusión del metal, acumulación del metal y la unión de estos con proteínas ricas en cisteína y metaloproteínas. Además, algunos compuestos en las plantas que actúan como señalizadores pueden estimular el sistema antioxidante para combatir los daños oxidativos en los tejidos como parte de su metabolismo o mecanismo de defensa (Thounaojam et al., 2012). Así, en Criolla Michoacán, la aplicación de estos elementos no provocaron modificaciones significativas (P ≤ 0.05); mientras que en Reina Roja, el Zn incrementó el rendimiento 15.9 %, por lo que esta combinación presentó el rendimiento de cálices más alto (1,232 kg. ha-1) de todos los tratamientos evaluados (Figura 2).
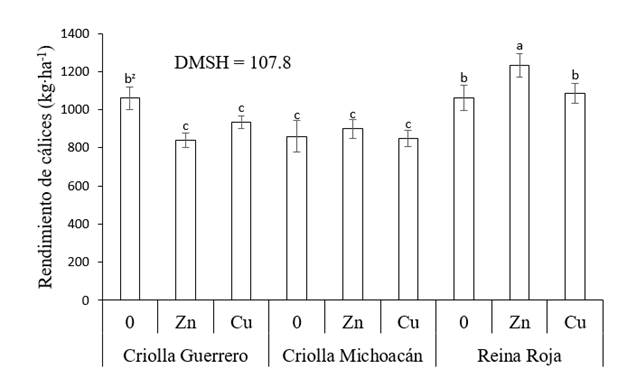
Figura 2 Rendimiento de cálices secos de jamaica (Hibiscus sabdariffa) en función del genotipo y aplicación de micronutrimentos. 0 = sin aplicación de micronutrimentos, Zn = aplicación de Zn, Cu = aplicación de Cu y DMSH = diferencia mínima significativa honesta. zMedias con letra igual entre barras no difieren estadísticamente (P ≤ 0.05).
Los resultados indican que los genotipos estudiados mostraron diferente grado de sensibilidad a las altas concentraciones de micronutrimentos suministrados vía foliar (300 mg. L-1 por aplicación); respuesta que también puede ser atribuida a las diferencias entre genotipos. En este sentido, Reina Roja presenta hojas de mayor grosor y tamaño que los otros dos genotipos; asimismo, Criolla Michoacán es el genotipo con el ciclo de cultivo más prolongado. Ambas características pudieron haber reducido el estrés provocado por la aplicación de metales pesados. Las diferencias en el efecto a la aplicación de estos micronutrimentos se han observado en otros cultivos agrícolas como trigo (Triticum aestivum L.), arroz (Oryza sativa L.) y frijol (Phaseolus vulgaris L.), ya que solo en algunos casos el rendimiento agronómico se mejoró con el uso de Zn (Ram et al., 2016).
Resultados similares a los de este trabajo en Reina Roja con aplicación foliar de Zn son reportados por Aziz et al. (2007), quienes mencionan que en jamaica con suministro al suelo de Co (20 y 40 mg. kg-1) y Ni (25 y 50 mg.kg-1), por separado y combinaciones, obtuvieron un incremento en el rendimiento de cálices frescos y secos de hasta 137 %, donde el componente del rendimiento que más se favoreció fue el número de frutos. De igual manera, los cultivares ‘Jumbo’, ‘Drakkar’, ‘Cossair’ y ‘Pactol’ de Brassica napus L. sometidos a concentraciones de 2,000 µM de ZnSO4 y 250 µM de CdCl2 presentaron variación en la producción de materia seca. El ZnSO4 aumentó 71 % la producción de ‘Jumbo’, mientras que en los otros cultivares ocasionó reducciones de 34 % y el Cd en todos los genotipos provocó el abatimiento de 40 % en sus rendimientos (Ghnaya, Charles, Hourmant, Hamida, & Branchard, 2009). Lo anterior confirma el hecho de que cada especie responde de manera diferente al estrés por metales pesados (Alves-Leão et al., 2014).
Independientemente de la aplicación de metales pesados, se encontró que Reina Roja presentó el rendimiento de cálices más alto, seguido de Criolla Guerrero y Criolla Michoacán, esto como consecuencia de que los cálices de Reina Roja fueron los más largos y de mayor peso. El genotipo con el diámetro de cálices mayor fue Criolla Guerrero, mientras que Criolla Michoacán presentó más cálices por planta, pero ambos fueron los de menor peso (Cuadro 2). Esto demuestra variación en el rendimiento y en los componentes del rendimiento entre estos genotipos. Resultados similares fueron encontrados por Atta et al. (2011) en ecotipos de jamaica cultivados en campo bajo condiciones de clima cálido y lluvia estacional en Nigeria.
Características físico-químicas del extracto de cálices
La aplicación de Cu y Zn en dosis elevadas provocó diferencias altamente significativas (P ≤ 0.01) en la acidez titulable, contenidos de antocianinas y de ácido ascórbico, y en ninguno de los genotipos modificó el pH ni los sólidos solubles totales (Cuadro 3). Sin embargo, por ser menos ácidos los cálices de Criolla Guerrero, en cualquier combinación con micronutrimentos, estos presentaron los valores más elevados de pH en comparación con los otros tratamientos (Cuadro 4).
Cuadro 3 Nivel de significancia de las características físico-químicas de cálices de jamaica (Hibiscus sabdariffa).
| Factor | pH | Sólidos solubles totales | Acidez titulable | Antocianinas | Ácido ascórbico |
|---|---|---|---|---|---|
| Genotipo (G) | ** | ns | ** | ** | ** |
| Micronutrimentos (M) | ns | ns | ** | ** | ** |
| Interacción G x M | ns | ns | ** | ** | ** |
*, ** P ≤ 0.01 y 0.05, respectivamente; ns = no significativo (P ≥ 0.05).
Cuadro 4 Prueba de comparación de medias de las características físico-químicas evaluadas en cálices de jamaica (Hibiscus sabdariffa).
| Genotipos | Micronutrimento | pH | Sólidos solubles totales (%) | AT (%) | ácido ascórbico (mg∙100 g -1 ) |
|---|---|---|---|---|---|
| Criolla Guerrero | 01 | 3.93 az | 0.45 a | 8.3 d | 59.9 bc |
| Zn | 3.90 a | 0.45 a | 11.7 c | 39.2 ef | |
| Cu | 3.92 a | 0.42 a | 11.1 c | 33.0 f | |
| Criolla Michoacán | 0 | 3.38 c | 0.37 a | 21.2 a | 82.4 a |
| Zn | 3.36 c | 0.45 a | 23.1 a | 48.7 d | |
| Cu | 3.43 c | 0.42 a | 17.9 b | 44.2 de | |
| Reina Roja | 0 | 3.64 b | 0.37 a | 12.2 c | 66.7 b |
| Zn | 3.62 b | 0.40 a | 12.0 c | 62.2 b | |
| Cu | 3.58 b | 0.37 a | 12.2 c | 51.0 cd | |
| Media general | 3.64 | 0.41 | 14.4 | 54.15 | |
| DMSH | 0.15 | 0.12 | 1.82 | 9.21 | |
| CV (%) | 1.3 | 12.90 | 5.23 | 5.74 | |
10 = sin aplicación de micronutrimentos, Zn = aplicación de Zn, Cu = aplicación de Cu, DMSH = diferencia mínima significativa honesta, CV = coeficiente de variación.
zMedias con letras iguales dentro de cada columna no difieren estadísticamente (Tukey, P ≤ 0.05).
La respuesta de acidez titulable por suministro de micronutrimentos varío en función del genotipo. En Criolla Guerrero se registró un aumento de 41 % con Zn y 33.7 % con Cu, mientras que en Reina Roja no se detectaron diferencias significativas (P ≤ 0.05) y en Criolla Michoacán el Cu redujo la acidez titulable en 15.6 %. De todas las combinaciones de tratamientos, Criolla Michoacán sin aplicación de estos metales y con Zn presentó el más alto porcentaje de acidez titulable, y el más bajo correspondió a Criolla Guerrero.
En la mayoría de los casos, la concentración de ácido ascórbico disminuyó cuando se aplicó Cu y Zn. Criolla Michoacán mostró mayor reducción, 40.9 % con Zn y de 55.8 % con Cu. En Criolla Guerrero con aspersiones de Zn, los cálices presentaron 34.6 % menos de ácido ascórbico y con Cu el decremento fue de 44.9 %, mientras que en Reina Roja el Cu causó la disminución de 23.5 % de ácido ascórbico (Cuadro 4).
Con Zn y Cu, la concentración de antocianinas incrementó en todos los genotipos. En Criolla Michoacán se registró el mayor aumento, donde se aplicó Zn los cálices registraron 175 % más de antocianinas y 187 % con Cu. En Criolla Guerrero, el Zn incrementó 60 % el contenido de antocianinas y el Cu 39 %. El incremento más bajo lo presentaron los cálices de Reina Roja, con Cu 30 % y con Zn la concentración de antocianinas no difirió estadísticamente (P ≤ 0.05) al tratamiento testigo. No obstante, debido al contenido alto de antocianinas en el testigo de Reina Roja, más del doble que Criolla Guerrero y Criolla Michoacán, este genotipo registró 22.7 mg. g-1 de antocianinas en los cálices secos con la aplicación foliar de Cu, superior a todas las combinaciones de tratamientos (Figura 3).
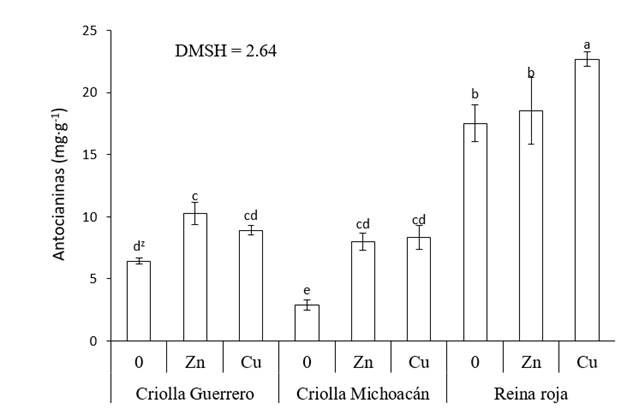
Figura 3 Concentración de antocianinas en cálices de jamaica (Hibiscus sabdariffa) en función del genotipo y aplicación de micronutrimentos. 0 = sin aplicación de micronutrimentos, Zn = aplicación de Zn, Cu = aplicación de Cu y DMSH = diferencia mínima significativa honesta. zMedias con letras iguales entre barras no difieren estadísticamente (P ≤ 0.05).
Las antocianinas son pigmentos producidos por el metabolismo secundario que pueden incrementar su concentración en las plantas como respuesta al estrés oxidativo, causado por diversos factores, entre ellos la exposición a concentraciones altas de metales (Azis et al., 2007). En el presente estudio, el suministró vía foliar de soluciones de Cu y Zn (300 mg. L-1) a concentraciones superiores a las requeridas por los cultivos provocaron que los tres genotipos de jamaica aumentarán el contenido de antocianinas en sus cálices con respecto al testigo. Las propiedades antioxidantes de las antocianinas surgen de su alta reactividad como donadores de electrones, de la capacidad de los radicales para estabilizar y deslocalizar al electrón no apareado y de su capacidad para quelar los iones metálicos de transición (Alves-Leão et al., 2014).
Resultados similares a los del presente estudio se han documentado en varios cultivos, como en lenteja de agua (Lemna gibba) por exposiciones con arsénico (Alves-Leão et al., 2014), en Arabidopsis thaliana bajo condiciones in vitro por la adición al medio de cultivo de Cu, Zn, Mn, Pb y Hg (Baek et al., 2012) y en Capsicum annum con la aplicación foliar de Cu y Zn a las hojas jóvenes (Stavreva-Veselinovska, Ziranovik, & Djokic, 2010).
Con el uso de Zn y Cu se incrementó el porcentaje de acidez titulable, lo cual es importante, ya que la acidez tiene un efecto antibacterial y contribuye a la absorción de iones metálicos en el cuerpo humano. Además, la sensación de frescura percibida al tomar una bebida fría de jamaica está relacionada con esta característica (Prenesti et al., 2007). Tanto el Cu como el Zn redujeron el contenido de ácido ascórbico en todos los genotipos, efecto contrario a lo ocurrido con las antocianinas. Al respecto, se ha encontrado que el contenido de ácido ascórbico en cálices de jamaica es inversamente proporcional a la concentración de antocianinas (Salinas-Moreno et al., 2012). Aunque el ácido ascórbico también presenta actividad antioxidante, ésta es menor a la que tienen las antocianinas (Hernández et al., 2009; Sytar et al., 2013).
Conclusiones
La aplicación de Cu y Zn redujo el rendimiento de cálices en el genotipo Criolla Guerrero, en Criolla Michoacán no lo modificaron y en Reina Roja solo el Zn mejoró su rendimiento; a su vez, estos elementos aumentaron la cantidad de antocianinas y disminuyeron la concentración de ácido ascórbico. En Criolla Michoacán se registraron los incrementos mayores en antocianinas, por lo que fue el genotipo en donde más se mejoró su calidad nutracéutica. La acidez titulable en Criolla Guerrero y Criolla Michoacán fue mayor con Zn y Cu.
La Reina Roja fue el genotipo más sobresaliente por presentar el rendimiento de cálices y concentración de antocianinas más elevados.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología (CONACYT) por el apoyo otorgado (271812), correspondiente a la beca de posdoctorado, y al Laboratorio de Poscosecha de Frutales del Colegio de Postgraduados Campus Montecillo por las facilidades otorgadas para realizar los análisis físicos y químicos.
REFERENCIAS
Abdel-Aal, E. S., & Hucl, P. (1999). A Rapid method for quantifying total anthocyanins in blue aleurone and purple pericarp wheats. Cereal Chemistry, 76(3), 350-354. doi: 10.1094/CCHEM.1999.76.3.350 [ Links ]
Alves-Leão, G., Alves-de Oliveira, J., Arantes-Felipe, R. T., Santos-Fernese, F., & Soares-Gusman, G. (2014). Anthocyanins, thiols, and antioxidant scavenging enzymes are involved in Lemna gibba tolerance to arsenic. Journal of Plant Interactions, 9(1), 143-151. doi: 10.1080/17429145.2013.784815 [ Links ]
Association of Official Analytical Chemists, International (AOAC). (1980). Official Methods of Analysis of AOAC. Washington, D. C. USA.: Author. [ Links ]
Atta, S., Seyni, H. H., Bakasso, Y., Sarr, B., Lona, I., & Saadou, M. (2011). Yield character variability in roselle (Hibiscus sabdariffa L.). African Journal Agricultural Research, 6(6), 1371-1377. doi: 10.5897/AJAR10.334 [ Links ]
Aziz, E. E., Gad, N., & Badran, N. M. (2007). Effect of cobalt and nickel on plant growth, yield and flavonoids content of Hibiscus sabdariffa L. Australian Journal of Basic and Applied Sciences, 1(2), 73-78. Retrieved from http://ajbasweb.com/old/ajbas/73-78.pdf [ Links ]
Baek, S. A., Han, T., Ahn, S. K., Kang, H., Cho, M. R., Lee, S. C., & Im, K. H. (2012). Effects of heavy metals on plant growths and pigment contents in Arabidopsis thaliana. The Plant Pathology Journal, 28(4), 446-452. doi: 10.5423/PPJ.NT.01.2012.0006 [ Links ]
Castañeda-Ovando, A., Galán-Vidal, C. A., Pacheco-Hernández, M. L., Rodríguez, J. A., & Páez-Hernández, M. E. (2009). Evaluación del contenido de metales y su efecto en la estabilidad de antocianinas. CyTA-Journal of Food, 7(3), 225-232. doi: 10.1080/19476330903092837 [ Links ]
Chen, L., Remondetto, G. E., & Subirade, M. (2006). Food protein-based materials as nutraceutical delivery systems. Trends in Food Science & Technology, 17(5), 272-283. doi: 10.1016/j.tifs.2005.12.011 [ Links ]
Christian, K. R., & Jackson, J. C. (2009). Changes in total phenolic and monomeric anthocyanin composition and antioxidant activity of three varieties of sorrel (Hibiscus sabdariffa) during maturity. Journal of Food Composition and Analysis, 22(7), 663-667. doi: 10.1016/j.jfca.2009.05.007 [ Links ]
Galicia-Flores, L. A., Salina-Moreno, Y., Espinosa-García, B. M., & Sánchez-Feria, C. (2008). Caracterización fisicoquímica y actividad antioxidante de extractos de jamaica (Hibiscus sabdariffa L.) nacional e importada. Revista Chapingo Serie Horticultura, 14(2), 121-129. doi: 10.5154/r.rchsh.2007.01.005 [ Links ]
García, E. (2004). Modificación al sistema de clasificación climática de Köppen. México: Instituto de Geografía-Universidad Nacional Autónoma de México. [ Links ]
Ghnaya, A. B., Charles, G., Hourmant, A., Hamida, J. B., & Branchard, M. (2009). Physiological behaviour of four rapeseed cultivar (Brassica napus L.) submitted to metal stress. Comptes Rendus Biologies, 332(4), 363-370. doi: 10.1016/j.crvi.2008.12.001 [ Links ]
Hernández, I., Alegre, L., van Breusegem, F., & Munné-Bosch, S. (2009). How relevant are flavonoids as antioxidants in plants?. Trends in Plant Science, 14(3), 125-132. doi: 10.1016/j.tplants.2008.12.003 [ Links ]
Hopkins, A. L., Lamm, M. G., Funk, J. L., & Ritenbaugh, C. (2013). Hibiscus sabdariffa L. in the treatment of hypertension and hyperlipidemia: A comprehensive review of animal and human studies. Fitoterapia, 85, 84-94. doi: 10.1016/j.fitote.2013.01.003 [ Links ]
Juliani, H. R., Welch, C. R., Wu, Q., Diouf, B., Malainy, D., & Simon, J. E. (2009). Chemistry and quality of Hibiscus (Hibiscus sabdariffa) for developing the natural-product industry in Senegal. Journal of Food Science 74(2), 113-121. doi: 10.1111/j.1750-3841.2009.01076.x [ Links ]
Kim, S. H., Joo, M. H., & Yoo, S. H. (2009). Structural identification and antioxidant properties of major anthocyanins extracted from omija (Schizandra chinensis) fruit. Journal of Food Science, 74(2), 134-140. doi: 10.1111/j.1750-3841.2009.01049.x [ Links ]
Ling-Peng, D., Xin-Jiao, D., & Hai-Hu, M. (2012). Molecular mechanism for cadmium-induced anthocyanin accumulation in Azolla imbricate. Chemosphere, 87(4), 319-325. doi: 10.1016/j.chemosphere.2011.12.005 [ Links ]
Norberto, S., Silva, S., Meireles, M., Faria, A., Pintado, M., & Calhua, C. (2013). Blueberry anthocyanins in health promotion: A metabolic overview. Journal of Functional Foods, 5(4), 1518-1528. doi: 10.1016/j.jff.2013.08.015 [ Links ]
Pojer, E., Mattivi, F., Johnson, D., & Stockley, C. S. (2013). The case for anthocyanin consumption to promote human health: A review. Comprehensive Reviews in Food Science and Food Safety, 12(5), 483-508. doi: 10.1111/1541-4337.12024 [ Links ]
Prenesti, E., Berto, S., Daniele, P. G., & Toso, S. (2007). Antioxidant power quantification of decoction and cold infusions of Hibiscus sabdariffa flowers. Food Chemistry, 100(2), 433-438. doi: 10.1016/j.foodchem.2005.09.063 [ Links ]
Ram, H., Rashid, A., Zhang, W., Duarte, A. P., Phattarakul, N., Simunji, S., & Mahmood , K . (2016). Biofortification of wheat, rice and common bean by applying foliar zinc fertilizer along with pesticides in seven countries. Plant and Soil, 403(1-2), 389-401. doi: 10.1007/s11104-016-2815-3 [ Links ]
Sai, K. S., Mansoura, A. B., Ennajah, A., Leclerc, J. C., Ouerghi, Z., & Karray-Bouraoui, N. (2015). Effect of metal toxicity on growth and pigment contents of annual halophyte (A. hortensis and A. rosea). International Journal of Environmental Research, 9(2), 613-620. Retrieved from https://ijer.ut.ac.ir/article_936_1c4e0fd934c64337f4c1ad3a661308f3.pdf [ Links ]
Salinas-Moreno, Y., Zúñiga-Hernández, A. R. E., Jiménez-de la Torre, L. B., Serrano-Altamirano, V., & Sánchez-Feria, C. (2012). Color en cálices de jamaica (Hibiscus sabdariffa L.) y su relación con características fisicoquímicas en sus extractos acuosos. Revista Chapingo Serie Horticultura, 18(3), 395-407. doi: 10.5154/r.rchsh.2011.08.038 [ Links ]
Statistical Analysis System (SAS Institute). (2002). SAS User’s Guide version 9.0. Cary N.C., USA: Author. [ Links ]
Stavreva-Veselinovska, S. T., Ziranovik, J. B., & Djokic, M. M. (2010). Changes of some biochemical and physiologycal parameters in Capsicum annuum L. as a consequence of increased concentrations of Copper and Zinc. Ecologia Balkanica, 2, 7-13. Retrieved from http://web.uni-plovdiv.bg/mollov/EB/2010/EB-02-2010_RA_02.pdf [ Links ]
Stohs, S. J., & Bagchi, D. (1995). Oxidative mechanisms in the toxicity of metal ions. Free Radical Biology & Medicine, 18(2), 321-336. doi: 10.1016/0891-5849(94)00159-H [ Links ]
Sytar, O., Kumar, A., Latowski, D., Kuczynska, P., Strzałka, K., & Prasad, M. N. V. (2013). Heavy metal-induced oxidative damage, defense reactions, and detoxification mechanisms in plants. Acta Physiologiae Plantarum, 35(4), 985-999. doi: 10.1007/s11738-012-1169-6 [ Links ]
Thounaojam, T. C., Panda, P., Mazumdar, P., Kumar, D., Sharma, G. D., Sahoo, L., & Sanjib, P. (2012). Excess copper induced oxidative stress and response of antioxidants in rice. Plant Physiology and Biochemistry, 53, 33-39. doi: 10.1016/j.plaphy.2012.01.006 [ Links ]
Xing, W., Huang, W., & Liu, G. (2010). Effect of excess iron and copper on physiology of aquatic plant Spirodela polyrrhiza (L.) Schleid. Environmental Toxicology, 25(2), 103-112. doi: 10.1002/tox.20480 [ Links ]
Recibido: 09 de Junio de 2017; Aprobado: 21 de Diciembre de 2017











 texto em
texto em 


