Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.24 no.2 Chapingo may./ago. 2018
https://doi.org/10.5154/r.rchsh.2017.07.025
Identificación de genes Cry1 en aislados de Bacillus thuringiensis y su efecto tóxico contra Milax gagates, plaga en lechuga (Lactuca sativa)
1Universidad de Santander, Grupo de Investigación Biogen. Avenida 4 núm. 10N-61, San José de Cúcuta, Norte de Santander, C. P. 540003, COLOMBIA.
2Universidad Francisco de Paula Santander, Grupo de Investigación Majumba. Avenida Gran Colombia núm. 12E-96, Barrio Colsag, San José de Cúcuta, Norte de Santander, C. P. 540003, COLOMBIA.
Milax gagates constituye una de las principales plagas en el cultivo de lechuga causando considerables pérdidas económicas. El control con molusquicidas elimina total o parcialmente la plaga, pero genera un impacto negativo en el ambiente por su alta toxicidad. El manejo biológico también permite el control de la plaga, pero de manera específica e inocua para el ambiente. Por ello, el objetivo de este trabajo fue evaluar el efecto tóxico de Bacillus thuringiensis, con genes Cry1, contra M. gagates mediante la elaboración de un bioensayo. Se tomaron 75 muestras de suelo de varios municipios de Norte de Santander, Colombia, de donde se obtuvieron 58 colonias aisladas de B. thuringiensis con características similares. De estas colonias, cinco evidenciaron la presencia de genes Cry1, y fueron las empleadas en los bioensayos junto con el control B. thuringiensis var. Kurstaki. Los tratamientos presentaron letalidad ante M. gagates de entre 90 y 100 % a una concentración de 500 μg∙mL-1. La CL99 calculada sugiere el uso de 820 μg∙mL-1 del biopreparado para obtener 100 % de letalidad con cualquiera de los cinco aislados estudiados.
Palabras clave: control biológico; babosas; molusquicidas; bioensayos
Milax gagates is one of the main pests in the cultivation of lettuce, causing considerable economic losses. Control with molluscicides totally or partially eliminates the pest but generates a negative impact on the environment due to their high toxicity. Biological management also allows controlling the pest, but in a specific and safe way for the environment. Therefore, the objective of this work was to evaluate the toxic effect of Bacillus thuringiensis, with Cry1 genes, against M. gagates by means of a bioassay. Seventy-five soil samples were taken from several municipalities in Norte de Santander, Colombia, from where 58 isolated colonies of B. thuringiensis with similar characteristics were obtained. Of these colonies, five showed the presence of Cry1 genes, and were those used in the bioassays together with the control B. thuringiensis var. Kurstaki. The treatments caused 90-100 % lethality to M. gagates at a concentration of 500 μg∙mL-1. The calculated LD99 suggests the use of 820 μg∙mL-1 of the biopreparate to obtain 100 % lethality with any of the five isolates studied.
Keywords: biological control; slugs; molluscicides; bioassays
Introducción
La lechuga (Lactuca sativa L.) es una de las hortalizas más utilizadas para la preparación de alimentos debido a su contenido de agua, polifenoles, carotenoides, fibra, Ca, Fe, K, y vitaminas A, C y E (Vargas-Arcila et al., 2017). De acuerdo con datos de la Food and Agriculture Organization Corporate Statistical Database (FAOSTAT, 2014), la producción mundial de lechuga en 2014 fue de 24,976,317 t, siendo China el principal productor con 13,657,570 t, seguido por Estados Unidos con 3,791,140 t; México y Chile ocupan el 9 y 19 lugar con 406,678 y 89,544 t, respectivamente. El ministerio de Agricultura de Colombia registró que la producción de lechuga en este país pasó de 23,038 t en 2007 a 83,643 t en 2014, aumentando tres veces el área sembrada.
El cultivo de lechuga es dañado seriamente por el ataque de plagas como Trialeurodes vaporariorum (mosca blanca) y Milax gagates (babosas), que afectan la producción y calidad, causando grandes pérdidas económicas. M. gagates y otros gasterópodos son vectores de parásitos como Angiostrongylus costaricensis, A. cantonensis, Angiostoma margaretae y Criptosporidium parvum, causantes de diversas enfermedades en humanos (Neira, Muñoz, Stanley, Gosh, & Rosales, 2010).
Los métodos utilizados para el manejo de babosas en cultivos de lechuga incluyen el control cultural, biológico y químico, que eliminan parcial o totalmente la plaga. Como control biológico se emplea principalmente el nemátodo Phasmarhabditis hermaphrodita y en el químico se utilizan los molusquicidas metaldehído y carbamatos que generan daños en el ambiente por su elevada toxicidad (Garavano et al., 2013).
Los biopesticidas ofrecen alternativas útiles para el control de plagas, como su especificidad e inocuidad para el medio ambiente y seres humanos. Bacillus thuringiensis es el biocontrolador más utilizado y representa aproximadamente 90 % del mercado de biopesticidas. Durante la esporulación B. thuringiensis produce inclusiones cristalinas paraesporales de tipo proteico con actividad insecticida denominadas proteínas Cry (Hung et al., 2016). Esta bacteria actúa principalmente sobre los órdenes Lepidoptera, Diptera, Coleoptera, Hymenoptera, Homoptera, Orthoptera y Mallophaga; aunque también se ha reportado actividad contra nemátodos, ácaros y algunas líneas tumorales (Rojas-Arias, López-Pazos, & Chaparro-Giraldo, 2013; Bravo et al., 2017).
En general, se han identificado alrededor de 950 genes diferentes para toxinas, distribuidos en diferentes grupos: 74 de proteínas Cry, 3 de proteínas Cyt y 3 de proteínas Vip (Crickmore, 2017). Las proteínas Cry se clasifican de acuerdo con la secuencia primaria de aminoácidos (Crickmore, Bone, Williams, & Ellar, 1995). Diversos trabajos han evidenciado la actividad insecticida de las proteínas Cry1 sobre Lepidoptera, y otros órdenes de insectos y gasterópodos (Gao, Li, Dai, Wu, & Yi, 2008; van Frankenhuyzen, 2013).
Debido al impacto negativo en el ambiente generado por el uso de químicos para el manejo de M. gagates en el cultivo de L. sativa se busca la implementación de otras alternativas de control; por lo que el objetivo de esta investigación fue evaluar el efecto tóxico de aislados de B. thuringiensis, identificados con genes Cry1, sobre M. gagates mediante la elaboración de un bioensayo.
Materiales y métodos
Material biológico
Se tomaron 75 muestras de suelo de los municipios Cúcuta, El Zulia, Los Patios, San Cayetano y Villa del Rosario, Norte de Santander, Colombia, las cuales presentaron una textura arcillo-arenosa y un pH entre 4.3 y 9.8. A partir de las muestras de suelo se aislaron 236 colonias que mostraron características morfológicas correspondientes a B. thuringiensis: colonias circulares de 6 a 8 mm de diámetro, aplanadas, de borde irregular lobulado y arborescente, consistencia blanda, aspecto opaco/mate, pigmentación blanco cremoso y bacterias con morfología perteneciente a bacilos rectos de extremos redondos o romos (Galvis-Serrano, 2013).
Del total de los aislados se seleccionaron 172 colonias como Gram positivas, de las cuales 58 presentaron esporas de forma cilíndrica u ovoide no deformante del cuerpo del bacilo en posición terminal o subterminal y con la presencia de cristal paraesporal. Las 58 colonias aisladas fueron identificadas como B. cereus mediante el sistema BBL™ CRYSTAL™ Gram positivo/GP. B. cereus y B. thuringiensis son bioquímicamente idénticos y se diferencian únicamente por la producción de crista paraesporal, por lo que se empleó el medio T3, que contiene por litro 3 g de triptona, 2 g de triptosa, 1.5 g de extracto de levadura, 6.9 g de fosfato de sodio y 0.005 g de MnCl (Khodabandeh, Safaralizadeh, Safavi, & Aramideh, 2014), para la liberación de esporas y cristales de todos los aislados y controles empleados en el bioensayo.
Para el bioensayo se colectaron 1,000 individuos de M. gagates y se utilizaron las 58 colonias aisladas de B. thuringiensis (Bt1 a Bt58) identificadas microbiológica y bioquímicamente. Como control positivo se usó la cepa de B. thuringiensis var. Kurstaki aislada del producto comercial Turilav® .
Aislamiento de B. thuringiensis
Para asilar la bacteria se adicionaron 500 mg de suelo en 10 mL de agua destilada estéril y se incubaron a 65 °C por 30 min con agitación vigorosa. Posteriormente, se inocularon 100 μL de cada muestra en medio LB sólido (10 g de triptona, 10 g de NaCl, 5 g de extracto de levadura y 15 g de agar por litro) y se incubaron a 28-30 °C durante 24 h (Galvis-Serrano, 2013). Se examinaron las colonias crecidas y se seleccionaron por su aspecto y morfología mediante observación al microscopio estereoscópico. Se determinó la forma bacilar, distensión del esporangio, localización, morfología de la espora y presencia del cristal paraesporal mediante la tinción diferencial con verde malaquita.
Identificación molecular
El ADN de los aislados y el control positivo se obtuvo con el kit UltraClean ® Microbial DNA Isolation de la casa comercial MoBio. Para la identificación molecular de genes Cry1 por medio de la reacción en cadena de la polimerasa (PCR, por sus siglas en inglés) se emplearon los cebadores propuestos por Djenane et al. (2017): Un1(f) CATGATTCATGCGGCAGATAAAC y Un1(r) TTGTGACACTTCTGCTTCCCATT. El volumen final de la mezcla para la PCR fue de 50 µL, y contenía 1X de buffer de la ADN polimerasa, 200 µM de dNTP, 1 U de ADN polimerasa, 1 µM de cada cebador y 2 µL de ADN. Las condiciones de amplificación fueron: 95 °C por 5 min para la desnaturalización inicial, seguida de 30 ciclos de 95 °C por 1 min, 60 °C por 30 s y 72 °C por 1 min, y una extensión final a 72 °C por 7 min. Los productos de la PCR se visualizaron en geles de agarosa al 1 % teñidos con bromuro de etidio.
Bioensayo
Mantenimiento de M. gagates. Se utilizaron 25 cajas de polipropileno (17 x 10 x 10 cm) con tapas perforadas cubiertas con tela de malla. A cada caja se le adicionaron 70 g de tierra húmeda estéril y 30 g de lechuga fresca (L. sativa var Capitata) remplazada cada 48 h. Se colocaron entre 30 a 50 babosas por caja. La temperatura promedio de cada caja fue de 25 °C.
Dieta diaria. Se realizó un ensayo para determinar la ingesta de lechuga por día de M. gagates, para lo cual se utilizaron 10 recipientes de poliestireno (icopor) con tapas perforadas cubiertas con tela de malla. En cada recipiente se agregaron 20 g de tierra húmeda estéril, 4 g de lechuga por día y un individuo de M. gagates, con un peso aproximado de 800 mg, y se mantuvieron a 25 °C en promedio. La lechuga se pesó cada 24 h durante siete días para establecer la cantidad consumida.
Formulación bacteriana. Para la obtención del complejo espora-cristal se emplearon los aislados identificados por la PCR de los genes Cry1 y el control B. thuringiensis var Kurstakii, los cuales se inocularon en 100 mL de medio T3 (Khodabandeh et al., 2014) y se colocaron en agitación durante 10 días a 30 °C. Posteriormente, el cultivo se centrifugó a 3,500 g durante 15 min y se realizaron tres lavados consecutivos con NaCl a 1.5 M, eliminándose el sobrenadante en cada oportunidad. El precipitado final se congeló y liofilizó. Para llevar a cabo los bioensayos, el liofilizado se resuspendió en agua destilada estéril hasta alcanzar una concentración de 500 μg∙mL-1 (Carmona, 2002).
Ensayo de toxicidad. Existen reportes con diferentes concentraciones de producto a partir de aislados de B. thuringiensis con genes Cry1, en donde los rangos más utilizados son de 2 a 2,000 μg∙mL-1 y de 0.5 a 2,000 μg∙cm-2 de complejo espora-cristal (Galvis-Serrano, 2013; Ibarra et al., 2003; Monnerat et al., 2007; Peña et al., 2006; Pitre, Hernández-Fernández, & Bernal, 2008; Schünemann, Knaak, & Fiuza, 2014). De acuerdo con la información anterior, en este trabajo se probaron cuatro concentraciones de liofilizado de B. thuringiensis (125, 250, 375 y 500 μg∙mL-1) para evaluar su efecto tóxico sobre M. gagates. Se realizaron dos bioensayos en tiempos diferentes para cada aislado y control.
No se encontraron datos publicados que evidencien el efecto tóxico de B. thuringiensis en M. gagates; sin embargo, existen trabajos sobre la toxicidad de B. thuringiensis sobre otras especies de babosas y en caracoles empleando preparaciones comerciales en concentraciones de 0.2 a 2 g∙L-1 con letalidad de entre 0 y 100 % (Abd-El-Ghany & Abd-El-Ghany, 2017; Kienlen, Gertz, Briard, Hommay, & Chaufaux, 1996; Osman & Mohamed, 1991; Zurbrügg & Nentwig, 2009).
Para cada aislado, en cada una de las cuatro concentraciones, se utilizaron 20 individuos de M. gagates (10 para determinar el efecto tóxico y 10 como testigos), cada uno con peso aproximado de 800 mg, colocados de manera individual en recipientes de poliestireno con tapas perforadas cubiertas con tela de malla. Cada caja contenía 20 g de tierra húmeda estéril y 4 g de lechuga, impregnada con 4 mL de suspensión del liofilizado o 4 mL de agua para el testigo. Se registró la mortalidad cada 12 horas durante siete días y se realizó una regresión Probit (Finney, 1971) con ayuda del paquete estadístico IBM SPSS versión 23 (2014) para determinar la dosis que produjera 50 (CL50) y 99 % (CL99) de mortalidad.
Resultados y discusión
La PCR y la secuenciación de genes son herramientas eficaces para la identificación y el hallazgo de nuevos genes Cry en B. thuringiensis que podrían ser utilizados como potenciales biopesticidas (Vázquez-Ramírez, Rangel-Núñez, Ibarra, & del Rincón-Castro, 2015). Por lo anterior, se realizó la determinación de genes Cry1 en los aislados y el control B. thuringiensis utilizando los cebadores específicos Un1(f) y Un1(r) (Djenane et al., 2017; Gorashi, Tripathi, Kalia, & Gujar, 2014; Salama, Abd-El-Ghany, & Saker, 2015; Zothansanga, Kumar, & Gurusubramanian, 2011), y se observó el producto esperado en cinco aislados (Bt2, Bt23, Bt35, Bt39 y Bt42) y en la cepa comercial B. thuringiensis var Kurstaki (Figura 1). La diferencia en la concentración del producto amplificado se debe, probablemente, a la cantidad de molde utilizado en la PCR o al número de copias de genes Cry1 presentes en las bacterias, ya que los cebadores empleados generan distintos fragmentos con un tamaño entre 274 a 277 pb.
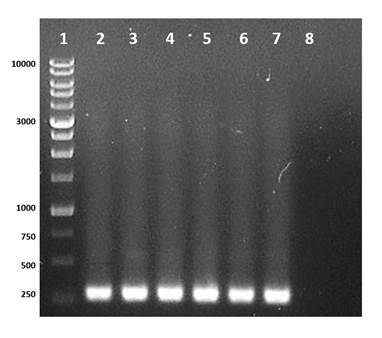
Figura 1 Identificación del gen Cry1 en Bacillus thuringiensis con los cebadores Un1(f) y Un1(r). Línea 1: marcador de peso molecular 1Kb DNA Ladder RTU (rango entre 250 a 10,000 pb); línea 2-6: aislados Bt2, Bt23, Bt35, Bt39 y Bt42 de B. thuringiensis donde se observa el fragmento esperado de ADN entre 274 a 277 pb.; línea 7: control B. thuringiensis var. Kurstaki; línea 8: control negativo.
El aparato bucal de M. gagates posee mandíbulas bien desarrolladas que le permite destruir grandes cantidades de materia vegetal. Se alimentan de toda clase de cultivos, tales como maíz, trigo, soya, girasol, lechuga, col y apio. Durante el día permanecen ocultas bajo tierra protegiéndose de la desecación y por la noche salen en busca de alimento, desplazándose hasta 5 m y logran consumir hasta 50 % de su peso vivo (Serre, 2005). Por ello, en el establecimiento del criadero de M. gagates se esperaba por individuo un consumo diario de 400 mg; sin embargo, se obtuvo un consumo promedio de lechuga al día de 250 mg. Lo anterior pudo deberse a que no se encontraban en su hábitat natural y las características del criadero no recrearon totalmente las condiciones de temperatura, humedad y luz requeridas para el desarrollo de M. gagates, quién presenta su máxima actividad durante la noche bajo concentraciones altas de humedad (Córdoba-Vargas & León-Sicard, 2010).
En el bioensayo, utilizando la concentración de 500 μg∙mL-1, los aislados Bt23 y Bt39, y el control B. thuringiensis var. Kurstaki presentaron 100 % de letalidad en M. gagates con una exposición de cinco a siete días. Con el resto de las concentraciones, los resultados de letalidad observados fueron: con 375 μg∙mL-1 de 70 a 80 %, con 250 μg∙mL-1 de 50 a 60 % y con 125 μg∙mL-1 de 15 a 30 % (Figura 2). Todos los registros se tomaron a los siete días de exposición de M. gagates a la toxina. La muerte se evidenció por el ennegrecimiento de la parte inferior del abdomen y encorvamiento de la babosa (Figura 3). No se observó mortalidad en los controles negativos empleados.
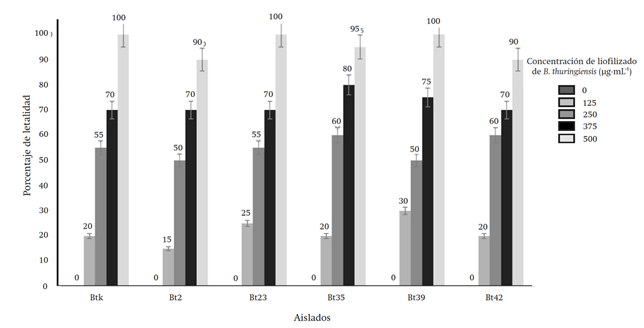
Figura 2 Resultados de letalidad de los aislados (Bt2, Bt23, Bt35, Bt39 y Bt42) y el control B. thuringiensis (Btk) a diferentes concentraciones sobre M. gagates después de siete días de exposición.

Figura 3 Efecto tóxico de B. thuringiensis sobre M. gagates a los cinco días de exposición empleando 500 μg∙mL-1 de liofilizado del aislado Bt39.
El análisis con Probit permitió establecer la CL50 y CL99 de los aislados y control en 310 y 820 μg∙mL-1, respectivamente (Cuadro 1). No se observaron diferencias significativas entre los aislados y el control positivo en cada concentración utilizada. Lo anterior sugiere la posible relación entre el efecto molusquicida y la presencia de genes Cry1 en los aislados de B. thuringiensis y control B. thuringiensis var. Kurstaki.
Cuadro 1 Análisis Probit para determinar la CL50 y CL99 de los resultados obtenidos en los bioensayos utilizando aislados y el control Bacillus thuringiensis var. Kurstaki sobre M. gagates.
| B. thuringiensis (Bt) | Límites de confianza al 95 % para concentración | |||||
| CL50 | CL99 | |||||
| Estimación (μg∙mL -1 ) | Límite inferior | Límite superior | Estimación (μg∙mL -1 ) | Límite inferior | Límite superior | |
| Bt var. Kurstaki | 260 | 200 | 320 | 690 | 550 | 1040 |
| Bt2 | 310 | 240 | 370 | 820 | 650 | 1260 |
| Bt23 | 280 | 210 | 340 | 740 | 580 | 1090 |
| Bt35 | 260 | 200 | 320 | 710 | 560 | 1050 |
| Bt39 | 270 | 200 | 330 | 730 | 580 | 1070 |
| Bt42 | 290 | 220 | 350 | 780 | 620 | 1170 |
Las estrategias de control eficiente son necesarias si se tiene en cuenta que las babosas causan daño al follaje y a las raíces de las plantas de lechuga, ya que la alta humedad del suelo, el alto contenido de materia orgánica, la baja luminosidad y la alta densidad de siembra favorecen sus poblaciones y ocasionan pérdidas de hasta 100 % del cultivo (France, Gerding, Céspedes, & Cortez, 2002). El manejo químico de esta plaga emplea cebos tóxicos compuestos por un atrayente alimenticio y un ingrediente activo (carbamatos o metaldehidos), los cuales son rápidos y efectivos en el control de babosas. Godan (1983) reportó que el género Milax sp. puede presentar resistencia a los molusquicidas. Adicionalmente, el uso de estos químicos puede resultar tóxico para otros organismos como mamíferos, aves, peces e insectos (France et al., 2002). En mamíferos se sabe que la ingesta de metaldehído puede causar depresión del sistema nervioso central y, dependiendo de la cantidad ingerida, puede provocar la muerte (Córdoba-Vargas & León-Sicard, 2010). En consecuencia, se requieren métodos de control menos perjudiciales al ambiente, como el uso de enemigos naturales de las babosas (insectos y nematodos) y el estudio de biopreparados tradicionales como B. thuringiensis.
Gao et al. (2008) reportan actividad pesticida contra el caracol (Oncomelania hupensis) de un aislado de B. thuringiensis, que contenía los genes Cry1A y Cry1C, con porcentaje de letalidad superior a 90 %. Los genes Cry1 son los más comunes en la naturaleza, siendo los más abundantes en diversas cepas de B. thuringiensis caracterizadas molecularmente (Arrieta, Hernández, & Espinoza, 2004; Gao et al., 2008; Jain, Sunda, Sanadhya, Nath, & Khandelwal, 2017). Van Frankenhuyzen (2013) reportó la actividad de las proteínas Cry1 entre diferentes órdenes y encontró toxicidad en Lepidoptera, Coleptera y Diptera; en esta revisión también se plantea la actividad entre clases y filos de las proteínas Cry. Lo anterior podría explicar el efecto tóxico observado en este trabajo, donde los aislados de B. thuringiensis y el control positivo con genes Cry1 mostraron más de 90 % de mortalidad contra M. gagates, a una concentración de 500 μg∙mL-1 de liofilizado del cultivo esporulado. La CL99, calculada en este estudio, sugiere el uso de 820 μg∙mL-1 para alcanzar 100 % de letalidad con cualquiera de los aislados experimentados.
En campo, se espera mayor voracidad de las babosas en el cultivo de la lechuga por encontrarse en su hábitat natural; sin embargo, con una correcta formulación y dosis del biopreparado se esperaría un control biológico efectivo a esta plaga.
Conclusiones
Este estudio nos permite concluir que B. thuringiensis, al presentar genes Cry1, no sólo tienen efecto insecticida, sino que además presenta letalidad en gasterópodos como M. gagates, ofreciendo con ello una alternativa biológica, inocua en los humanos, para el control de este tipo de plagas que afecta considerablemente los cultivos de lechuga.
References
Abd-El-Ghany, A. M., & Abd-El-Ghany, N. M. (2017). Molluscicidal activity of Bacillus thuringiensis strains against Biomphalaria alexandrina snails. Beni-Suef University Journal of Basic and Applied Sciences, 6(4), 1-3. doi: 10.1016/j.bjbas.2017.05.003 [ Links ]
Arrieta, G., Hernández, A., & Espinoza, A. M. (2004). Diversity of Bacillus thuringiensis strains isolated from coffee plantations infested with the coffee berry borer Hypothenemus hampei. Revista de Biología Tropical, 52(3), 757-764. Retrieved from http://www.scielo.sa.cr/scielo.php?pid=S0034-77442004000300036&script=sci_arttext [ Links ]
Bravo, A., Pacheco, S., Gómez, I., García-Gómez, B., Onofre, J., & Soberón, M. (2017). Insecticidal proteins from Bacillus thuringiensis and their mechanism of action. In: Fiuza, L., Polanczyk, R., & Crickmore, N. (Eds), Bacillus thuringiensis and Lysinibacillus sphaericus (pp. 53-66). Cham, Switzerland: Springer International Publishing. doi: 10.1007/978-3-319-56678-8_4 [ Links ]
Carmona, A. (2002). Aislamiento y caracterización parcial de una cepa de Bacillus thurigiensis tóxica a Spodoptera frugiperda (Lepidoptera: Noctuidae). Bioagro, 14(1), 3-10. Retrieved from http://www.redalyc.org/pdf/857/85714101.pdf [ Links ]
Córdoba-Vargas, C. A., & León-Sicard, T. (2010). Efecto del manejo agroecológico y convencional sobre la fluctuación de babosa en cultivos de lechuga en Tenjo Cundinamarca. Acta Biológica Colombiana, 15(1), 115. doi: 10.15446/abc [ Links ]
Crickmore, N. (2017). Bacillus thuringiensis toxin classification. In: Fiuza, L., Polanczyk, R., & Crickmore, N. (Eds), Bacillus thuringiensis and Lysinibacillus sphaericus (pp. 41-52). Cham, Switzerland: Springer International Publishing . doi: 10.1007/978-3-319-56678-8_3 [ Links ]
Crickmore, N., Bone, E. J., Williams, J. A., & Ellar, D. J. (1995). Contribution of the individual components of the δ-endotoxin crystal to the mosquitocidal activity of Bacillus thuringiensis subsp. israelensis. FEMS Microbiology Letters, 131(3), 249-254. doi: 10.1111/j.1574-6968.1995.tb07784.x [ Links ]
Djenane, Z., Nateche, F., Amziane, M., Gomis-Cebolla, J., El-Aichar, F., Khorf, H., & Ferré, J. (2017). Assessment of the antimicrobial activity and the entomocidal potential of Bacillus thuringiensis isolates from Algeria. Toxins, 9(4), 139-158. doi: 10.3390/toxins9040139 [ Links ]
Finney, D. J. (1971). Probit Analysis (pp. 68-72). Cambridge: Cambridge University Press. [ Links ]
Food and Agriculture Organization Corporate Statistical Database (FAOSTAT). (2014). FAO statistics division 2014. Retrieved from http://faostat.fao.org/ [ Links ]
France, A., Gerding, M., Céspedes, C., & Cortez, M. (2002). Control de babosas (Deroceras reticulatum Müller) con Phasmarhabditis hermaphrodita Schneider (Nematoda: Rhabditidae) en suelos con sistema de cero labranza. Agricultura Técnica, 62(2), 181-190. doi: 10.4067/S0365-28072002000200001 [ Links ]
Galvis-Serrano, F. (2013). Caracterización molecular de genes cry1, cry2, cry3 y cry4 en aislados de Bacillus thuringiensis y determinación de su actividad bioinsecticida en larvas de Aedes aegypti. Interciencia, 38(2), 128-131. Retrieved from http://www.redalyc.org/html/339/33926950004/ [ Links ]
Gao, M., Li, R., Dai, S., Wu, Y., & Yi, D. (2008). Diversity of Bacillus thuringiensis strains from soil in China and their pesticidal activities. Biological Control, 44(3), 380-388. doi: 10.1016/j.biocontrol.2007.11.011 [ Links ]
Garavano, M. E., Manetti, P. L., López, A. N., Clemente, N. L., Salvio, C., & Faberi, A. J. (2013). Cebos molusquicidas y molusquicidas líquidos para el control de Deroceras reticulatum (Pulmonata: Stylomatophora), plaga en el cultivo de colza. Revista de Investigaciones Agropecuarias, 39(1), 60-66. Retrieved from http://www.redalyc.org/articulo.oa?id=86426063006 [ Links ]
Godan, D. (1983). Pest slugs and snails. Biology and control (pp. 127-132). Berlin: Springer-Verlag. [ Links ]
Gorashi, N. E., Tripathi, M., Kalia, V., & Gujar, G. T. (2014). Identification and characterization of the Sudanese Bacillus thuringiensis and related bacterial strains for their efficacy against Helicoverpa armigera and Tribolium castaneum. Indian Journal of Experimental Biology, 52(6), 637-649. Retrieved from https://pdfs.semanticscholar.org/90b8/534a663e65b296ad19ff9885e7bb57839406.pdf [ Links ]
Hung, T. P., Truong, L. V., Binh, N. D., Frutos, R., Quiquampoix, H., & Staunton, S. (2016). Fate of insecticidal Bacillus thuringiensis Cry protein in soil: differences between purified toxin and biopesticide formulation. Pest Management Science, 72(12), 2247-2253. doi: 10.1002/ps.4262 [ Links ]
Ibarra, J. E., del Rincón, M. C., Ordúz, S., Noriega, D., Benintende, G., Monnerat, R., & Sánchez, J. (2003). Diversity of Bacillus thuringiensis strains from Latin America with insecticidal activity against different mosquito species. Applied and Environmental Microbiology, 69(9), 5269-5274. doi: 10.1128/AEM.69.9.5269-5274.2003 [ Links ]
IBM SPSS. (2014). Statistics for Windows ver. 23. Retrieved from https://www.ibm.com/us-en/ [ Links ]
Jain, D., Sunda, S. D., Sanadhya, S., Nath, D. J., & Khandelwal, S. K. (2017). Molecular characterization and PCR-based screening of cry genes from Bacillus thuringiensis strains. Biotech, 7(4), 1-8. doi: 10.1007/s13205-016-0583-7 [ Links ]
Khodabandeh, F., Safaralizadeh, M. H., Safavi, S. A., & Aramideh, S. (2014). Virulence of some native Bacillus thuringiensis isolates against Ephestia kuehniella (Zeller) (Lep., Pyralidae) and Pieris brassicae (Lep., Pieridae) larvae isolated from stored products of Urmia city. Archives of Phytopathology and Plant Protection, 47(5), 610-614. doi: 10.1080/03235408.2013.816101 [ Links ]
Kienlen, J. C., Gertz, C., Briard, P., Hommay, G., & Chaufaux, J. (1996). Recherche de la toxicité de diverses souches de Bacillus thuringiensis Berliner vis-à-vis de trois espèces de limaces. Agronomie, 16(6), 347-353. doi: 10.1051/agro:19960602 [ Links ]
Monnerat, R. G., Batista, A. C., de Medeiros, P. T., Martins, E. S., Melatti, V. M., Praça, L. B., & Falcao, R. (2007). Screening of Brazilian Bacillus thuringiensis isolates active against Spodoptera frugiperda, Plutella xylostella and Anticarsia gemmatalis. Biological Control, 41(3), 291-295. doi: 10.1016/j.biocontrol.2006.11.008 [ Links ]
Neira, O., Muñoz, S., Stanley, V., Gosh, C., & Rosales, L. (2010). Cryptosporidium parvum in wild gastropods as bioindicators of fecal contamination in terrestrial ecosystems. Revista Chilena de Infectología, 27(3), 211-218. doi: 10.4067/S0716-10182010000300006 [ Links ]
Osman, G. Y., & Mohamed, A. M. (1991). Bio-efficacy of bacterial insecticide, Bacillus thuringiensis Berl. as biological control agent against snails vectors of Schistosomiasis in Egypt. Anzeiger für Schädlingskunde, 64(7), 136-139. doi: 10.1007/BF01906005 [ Links ]
Peña, G., Miranda-Rios, J., de la Riva, G., Pardo-López, L., Soberón, M., & Bravo, A. (2006). A Bacillus thuringiensis S-layer protein involved in toxicity against Epilachna varivestis (Coleoptera: Coccinellidae). Applied and environmental microbiology, 72(1), 353-360. doi: 10.1128/AEM.72.1.353-360.2006 [ Links ]
Pitre, L., Hernández-Fernández, J., & Bernal, J. (2008). Toxicidad de δ-endotoxinas recombinantes de Bacillus thuringiensis sobre larvas de la polilla guatemalteca (Tecia solanivora) (Lepidóptera: Gelechiidae). Revista Colombiana de Biotecnología, 10(2), 85-96. [ Links ]
Rojas-Arias, A. C., López-Pazos, S. A., & Chaparro-Giraldo, A. (2013). Actividad biológica de Bacillus thuringiensis sobre la polilla guatemalteca de la papa, Tecia solanivora Povolny (Lepidoptera: Gelechiidae). Revista Mutis, 3(2), 31-42. doi: 10.21789/22561498.883 [ Links ]
Salama, H. S., Abd-El-Ghany, N. A., & Saker, M. M. (2015). Diversity of Bacillus thuringiensis isolates from Egyptian soils as shown by molecular characterization. Journal of Genetic Engineering and Biotechnology, 13(2), 101-109. doi: 10.1016/j.jgeb.2015.10.001 [ Links ]
Schünemann, R., Knaak, N., & Fiuza, L. M. (2014). Mode of action and specificity of Bacillus thuringiensis toxins in the control of caterpillars and stink bugs in soybean culture. ISRN Microbiology, 2014, 1-13. doi: 10.1155/2014/135675 [ Links ]
Serre, M. (2005). Manejo de babosas en el cultivo de girasol en siembra directa. Argentina: Pioneer Argentina. Retrieved from http://www.pioneer.com/CMRoot/International/Argentina_Intl/AGRONOMIA/con_agric_inv_lotes/IL_Manejobabosa_girasol_05.pdf [ Links ]
Van Frankenhuyzen, K. (2013). Cross-order and cross-phylum activity of Bacillus thuringiensis pesticidal proteins. Journal of Invertebrate Pathology, 114(1), 76-85. doi: 10.1016/j.jip.2013.05.010 [ Links ]
Vargas-Arcila, M., Cartagena-Valenzuela, J. R., Franco, G., Correa-Londoño, G. A., Quintero-Vásquez, L. M., & Gaviria-Montoya, C. A. (2017). Changes in the physico-chemical properties of four lettuce (Lactuca sativa L.) varieties during storage. Corpoica Cienc Tecnol Agropecuaria, 18(2), 257-273. doi: 10.21930/rcta.vol18_num2_art:632257-273 [ Links ]
Vázquez-Ramírez, M. F., Rangel-Núñez, J. C., Ibarra, J. E., & del Rincón-Castro, M. C. (2015). Evaluación como agentes de control biológico y caracterización de cepas mexicanas de Bacillus thuringiensis contra el gusano cogollero del maíz Spodoptera frugiperda (Lepidotera: Noctuidae). Interciencia, 40(6). Retrieved from http://www.redalyc.org/pdf/339/33938675006.pdf [ Links ]
Zothansanga, L., Kumar, N. S., & Gurusubramanian, G. (2011). PCR pathotyping of native Bacillus thuringiensis from Mizoram, India. Sciense Vision, 11(3), 171-176. Retrieved from https://pdfs.semanticscholar.org/0b59/466b7c801f3abc8308c34f4f39e9b7130eba.pdf [ Links ]
Zurbrügg, C., & Nentwig, W. (2009). Ingestion and excretion of two transgenic Bt corn varieties by slugs. Transgenic Research, 18(2), 215-225. doi: 10.1007/s11248-008-9208-1 [ Links ]
Recibido: 11 de Julio de 2017; Aprobado: 27 de Noviembre de 2017











 texto en
texto en 


