Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.24 no.1 Chapingo ene./abr. 2018
https://doi.org/10.5154/r.rchsh.2017.08.028
Artículo científico
Micropropagación de Stevia rebaudiana en sistemas de inmersión temporal para incursionar en la producción hortícola
1Instituto Tecnológico de Costa Rica, Centro de Investigación en Biotecnología. Avenida 14, Calle 15, Provincia de Cartago, Cartago, C. P. 30101, COSTA RICA.
Stevia rebaudiana, conocida como hierba dulce, produce en sus hojas un edulcorante debido a la presencia de glicósidos de esteviol (esteviósido y rebaudiósido); sin embargo, su semilla presenta problemas de germinación, por lo que se han estudiado diversos sistemas de inmersión temporal (SIT) para su producción. Los objetivos de este estudio fueron escalar la producción in vitro de dos cultivares de S. rebaudiana utilizando RITA®, BIT® y SETIS®, y evaluar la producción de biomasa en campo. Los cultivares estudiados fueron ‘Morita II’ y ‘Silvestre’. Las etapas de producción de ambos cultivares fueron: in vitro, medio líquido (con tres SIT: RITA®, BIT® y SETIS®), invernadero y finalmente se llevaron a campo. En cada SIT se evaluaron cinco medios distintos, variando en cada uno las concentraciones de sacarosa, pantotenato de calcio y ácido giberélico. Los tratamientos produjeron plantas vigorosas, mayor número de hojas, brotes y tasa de multiplicación. Ambos cultivares tuvieron mayor longitud de tallo en BIT. Bajo este mismo sistema ‘Morita II’ produjo ocho brotes por planta, mientras que en SETIS solo tres. ‘Silvestre’ tuvo dos brotes por planta con los dos SIT. En ambos cultivares, sin importar el SIT, la sobrevivencia en invernadero y la producción de follaje en campo fueron muy similares. Por lo anterior, la selección del material deberá hacerse con base en el contenido de esteviósidos y en la adaptación del cultivar al sitio de siembra. Todos los SIT evaluados permitieron el escalamiento de la producción de plantas, y ambos materiales son promisorios para la siembra.
Palabras claves: BIT®; SETIS®; RITA®; micropropagación; stevia
Stevia rebaudiana, known as sweetleaf, produces a sweetener in its leaves due to the presence of steviol glycosides (stevioside and rebaudioside); however, its seed has germination problems, which is why various temporary immersion systems (TIS) have been studied for its production. The objectives of this study were to scale up the in vitro production of two S. rebaudiana cultivars using RITA®, BIT® and SETIS®, and to evaluate the production of biomass in the field. The studied cultivars were ‘Morita II’ and ‘Silvestre’. The production stages of both cultivars were: in vitro, liquid medium (with three TIS: RITA®, BIT® and SETIS®), greenhouse and finally they were taken to the field. In each TIS, five different media were evaluated, varying in each one the concentrations of sucrose, calcium pantothenate and gibberellic acid. The treatments produced vigorous plants, a greater number of leaves and shoots, and a higher multiplication rate. Both cultivars had greater stem length in BIT. Under this same system 'Morita II' produced eight shoots per plant, while in SETIS only three. ‘Silvestre’ had two shoots per plant with the two TIS. In both cultivars, regardless of the TIS, greenhouse survival and foliage production in the field were very similar. Therefore, the selection of the material should be based on the content of steviosides and the adaptation of the cultivar to the planting site. All TIS evaluated allowed scaling-up plant production, and both materials are promising for planting.
Keywords: BIT®; SETIS®; RITA®; micropropagation; stevia
Introducción
Stevia rebaudiana, conocida como hierba dulce de la familia Asteraceae, produce en las hojas un edulcorante natural por la presencia de glicósidos de esteviol (esteviósido y rebaudiósido) que constituyen de 10 a 20 % del peso seco de la hoja (Shivanna, Mahadev, Khanum, & Kaul, 2013). Además de ser un edulcorante sin calorías, se ha documentado el uso medicinal de los esteviósidos como hipoglicémicos, antibióticos, antioxidantes, protector renal y para el cuidado de la piel (Shivanna et al., 2013; Thiyagarajan & Venkatachalam, 2012). En veterinaria, se emplean hojas en la alimentación de animales para mejorar su desarrollo (Atteh et al., 2011).
Dentro de los cultivares de stevia más utilizados destacan ‘Morita II’ y ‘Silvestre’; ambos con características dulces. El primero presenta cerca de 10 a 12 % de rebaudiósidos "A" y de 2 a 4 % de esteviósidos, lo que le proporciona a la planta un sabor más suave y dulce que otras especies. En ‘Silvestre’ las hojas presentan rendimientos de 12 % de glicósidos de esteviól (Thiyagarajan & Venkatachalam, 2012).
Existe una demanda alta a nivel mundial de material en crudo de stevia por su uso para el tratamiento de obesidad y de diabetes, principalmente. Por ello, es necesario contar con una metodología que permita incrementar su tasa de multiplicación para producción comercial, ya que la densidad de siembra en campo es de aproximadamente 70,000 plantas∙ha-1 (Casaccia & Álvarez, 2006). Aunque existen diversas formas de propagar la especie, el proceso de reproducción por semilla no es viable debido a los bajos porcentajes de germinación que presenta y a la alta variabilidad de los resultados (Alvarenga-Venutolo & Salazar-Aguilar, 2015; Goettemoeller & Ching, 1999).
Otro método es la reproducción asexual, el cual es efectivo, barato y produce material homogéneo que conserva las características de la planta madre (Vilchez & Albany, 2014). Sin embargo, si se requiere la propagación masiva se recomienda el empleo de cultivo in vitro de tejidos, ya que permite regenerar plantas a mayor escala por embriogénesis u organogénesis, pero el costo de producción es más alto y requiere una intensa labor manual (Ziv, 2005).
Por otro lado, los medios líquidos reducen los costos de producción al no utilizar el agente gelificante en los protocolos de multiplicación (Cabrera-Jova et al., 2008). En muchas especies se ha reportado mayor producción de propágulos con el uso de medios líquidos, ya que en este sistema los explantes están en contacto directo con el medio de cultivo, lo que hace que la toma de nutrientes sea más efectiva por parte del explante (Berthouly & Etienne, 2005; Preil, 2005; Watt, 2012).
Entre las técnicas de propagación in vitro, los sistemas de inmersión temporal (SIT) permiten superar las limitaciones de los métodos antes descritos, debido a que son semi-automatizados (Ziv, 2005). Dichos sistemas se basan en el contacto de los explantes con el medio de cultivo líquido por cortos períodos de tiempo y la renovación de la atmósfera gaseosa para evitar la hiperhidricidad de los tejidos y la acumulación de gases tóxicos (Basail-Pérez et al., 2012).
Se ha documentado que a mayor tiempo de contacto, entre los microesquejes y el medio de cultivo, aumenta el suministro de nutrientes y reguladores de crecimiento a los explantes (Santos-Pino et al., 2011), lo que puede maximizar su desarrollo (Preil, 2005). Además, con cada inmersión, el ambiente del recipiente de cultivo se renueva con el fin de eliminar compuestos volátiles, tales como etileno (Roels et al., 2006), y promover la recirculación de dióxido de carbono necesaria para la fotosíntesis, mejorando aún más el metabolismo autotrófico del carbono en las hojas (Aragón et al., 2014).
Algunos investigadores señalan que, desde el punto de vista comercial, la micropropagación convencional ha dejado de ser un proceso económicamente eficiente; además, coinciden en que la causa fundamental es debida al uso de agentes gelificantes como soportes de los explantes y el elevado número de operaciones manuales, que implican un costo elevado de mano de obra (Quiala et al., 2012). Con base en estas consideraciones, el presente estudio tuvo como objetivos escalar la producción in vitro de dos cultivares de Stevia rebaudiana utilizando RITA®, BIT® y SETIS®, y evaluar su producción de biomasa en campo.
Materiales y métodos
Material vegetal
Se utilizaron dos cultivares de Stevia rebaudiana: ‘Morita II’ y ‘Silvestre’. El primero fue una donación del Centro de Productos Bióticos del Instituto Politécnico Nacional, Yautepec, Morelos, México. En segundo se adquirió en un vivero del Valle Central de Costa Rica. Ambos cultivares se trabajaron en el invernadero del Centro de Investigación en Biotecnología (CIB) del Instituto Tecnológico de Costa Rica. Estos materiales se utilizaron como plantas madre para la micropropagación debido a su calidad y sanidad.
Aunque ambos cultivares de stevia tienen características dulces, existen diferencias físicas y químicas entre ellas (Figura 1). ‘Morita II’ presenta hojas ovaladas, color verde claro, crece mejor en zonas de clima tropical y es más exigente en cuanto al manejo del cultivo. Por otra parte, ‘Silvestre’ tiene hojas alargadas y dentadas, tonalidades de verde más oscuro y se adapta a diferentes condiciones agroambientales (Thiyagarajan & Venkatachalam, 2012).
Introducción y multiplicación
Para su propagación in vitro, se utilizaron como explantes segmentos nodales que contenía brotes axilares (2 a 3 cm) de las plantas madres. Para ello, los explantes se lavaron con agua y jabón antibacterial, luego se sumergieron en una solución de Agrimycin® (5 g∙L-1) y Benlate® (5 g∙L-1) por 60 min. Pasado este período, se desinfectaron con hipoclorito de calcio (1.8 % i.a.) durante 10 min y se llevaron a la cámara de transferencia de flujo laminar.
En condiciones asépticas, se eliminó el hipoclorito de calcio y se realizaron tres lavados con agua destilada estéril. Por último, los explantes se colocaron en una solución estéril con antioxidantes (ácido cítrico y ácido ascórbico, 100 g∙L-1 de cada uno) antes de colocarse en el medio de cultivo (frascos tipo Gerber® de 5.5 x 5.5 cm). El material se multiplicó cada tres o cuatro semanas pasando cada explante a un tubo de ensayo (14 x 2.2 cm) con 10 mL de medio semi-sólido fresco que contenía el medio base descrito por Murashige y Skoog (1962) enriquecido con 30 g∙L-1 de sacarosa, 2 mg∙L-1 de pantotenato de calcio (PACA) y 0.5 mg∙L-1 de ácido giberélico (AG3).
Prueba de medios líquidos
Para el crecimiento en medio líquido, se realizó una prueba de medios utilizando el SIT RITA® (Alvard, Cote, & Teisson, 1993) con 200 mL de medio de cultivo. Para esta prueba se utilizó el cultivar ‘Morita II’ con un mes de subcultivo in vitro. Cada RITA® se inoculó a una densidad de 10 mL por explante. Al medio base se le adicionaron diferentes concentraciones de sacarosa, kinetina (K, como regulador de crecimiento) y un supresor microbiológico (methylisothiazolone [2-methyl-4-isothiazolin-3-one, MIT] y methylchloroisothiazolinone [5-chloro-2-methyl-4- isothiazolin-3-one, CIT], reactivos químicos Gamma, Laboratorios ARVI S.A.) (Cuadro 1). Cada ensayo se realizó por triplicado y se evaluaron después de tres semanas. Las variables estudiadas fueron elongación (cm), sobrevivencia en invernadero y respuesta morfológica de la planta ante cada medio de cultivo (cantidad de hojas y número de brotes).
Sistemas de inmersión temporal
Para la propagación masiva de stevia se evaluaron tres SIT: RITA® (Alvard et al., 1993), BIT® (Escalona et al., 1999a) y SETIS® (Duchefa Biochemie B.V.) (Figura 2). El sistema BIT® consiste en dos frascos de cultivo de 2 L de capacidad, uno donde se colocaron los explantes y el otro como reservorio para el medio de cultivo a utilizar. Los frascos se conectan entre sí por una manguera que va desde la tapa hasta el fondo del recipiente, lo cual permite la recirculación del medio de cultivo de un frasco a otro. En la tapa del recipiente hay un filtro hidrofóbico (0.22 μm) para garantizar la esterilización del aire de entrada. En general, el sistema BIT es fácil de operar y construir, se puede mantener por largos períodos permitiendo una buena ventilación y el contacto de los explantes con el medio de cultivo (Georgiev, Schumann, Pavlov, & Bley, 2014).
Por otra parte, RITA® consiste en un solo recipiente de polisulfona con capacidad máxima de 500 mL. En la tapa tiene dos orificios con manguera; en uno de ellos se acopla un filtro hidrofóbico (0.22 μm) y en el otro una válvula de apertura y cierre de aire. En el interior del recipiente se coloca una malla donde se establecen los explantes.
El sistema SETIS® consta de dos recipientes horizontales acoplados uno sobre el otro con una capacidad de 3 L. Cada uno presenta una abertura de 80 mm con empaques de silicón y tapas de rosca, se conectan entre sí por una manguera en la parte inferior del recipiente. En sus extremos superiores, un orificio conectado a un filtro permite la entrada de aire estéril.
Los tres SIT se conectaron a electroválvulas, que permiten la entrada o no de aire, y éstas a un temporizador programable con el cual se define la frecuencia y tiempo de inmersión, dada la regulación por un manómetro.
En todos los sistemas se trabajó con la mitad de la capacidad, a una densidad de 10 mL por explante (Alvarenga-Venutolo & Salazar-Aguilar, 2015). El material mantenido in vitro se inoculó con un mes de subcultivado, para ello se introdujeron explantes de 0.5 a 1 cm de longitud (no brotes apicales).
En el Cuadro 2 se detallan las condiciones de cultivo de cada sistema. El tiempo y la frecuencia de inmersión se trabajaron con el programa ya establecido en los laboratorios del Centro Nacional de Innovaciones Biotecnológicas (CENIBiot-CENAT), San José, Costa Rica, donde se realizaron estos ensayos.
Cuadro 2 Condiciones de cultivo en los diferentes sistemas de inmersión temporal evaluados.
| RITA ® | BIT ® | SETIS ® | |
|---|---|---|---|
| Capacidad máxima (L) | 0.500 | 2 | 3 |
| Volumen de trabajo (L) | 0.200 | 1 | 1.5 |
| Número de explantes | 20 | 100 | 150 |
| Volumen del medio por explante (mL) | 10 | 10 | 10 |
| Tiempo de llenado (s) | 30 | 100 | 90 |
| Tiempo de inmersión (min) | 2 | 2 | 2 |
| Tiempo de vaciado (s) | 0 | 170 | 135 |
| Flujo de aire (L∙min-1) | 10 | 15 | 18 |
| Frecuencia de inmersión (h) | 12 | 12 | 12 |
Cada sistema se evaluó por triplicado para cada cultivar de Stevia rebaudiana: ‘Morita II’ y ‘Silvestre’.
Evaluación de las plantas obtenidas en los sistemas de inmersión temporal
Después de un mes de cultivo en los diferentes sistemas, se retiró el material vegetal y en cada tratamiento se evaluó número de brotes y elongación (cm) por explante considerando que todos los explantes dispusieron de 10 mL de medio y el mismo tiempo de inmersión (2 min).
Aclimatación en invernadero
Inmediatamente después de la evaluación de las plantas obtenidas de los SIT, éstas se llevaron a invernadero y se cultivaron en cámaras de humedad construidas con vasos desechables. El sustrato empleado fue tierra y granza de arroz (60:40), y antes de la siembra se le agregaron tres gotas de una solución enraizadora (5 mg∙L-1 de ácido indolbutírico). Al finalizar el período de aclimatación, se midió el porcentaje de sobrevivencia de las plantas con base en el SIT de proveniencia.
Manejo de material en campo
Después de un mes del cultivo en invernadero, cuando las plantas alcanzaron de 10 a 15 cm de longitud, se procedió al traslado a campo. La siembra en campo se trabajó en conjunto con agricultores comercializadores de la zona de San Ramón de la Virgen de Sarapiquí, Costa Rica (10° 21’ 16.9’’ latitud norte y 84° 07’ 00.79’’ latitud oeste, de 200 a 400 msnm). La zona presenta suelo descrito como Inceptisol Dystrandep, temperaturas de 24 a 30 °C y precipitación anual de 5,000 mm.
En el campo, la distancia entre plantas e hileras fue de 30 y 80 cm, respectivamente; lo que resultó en una densidad de 65,000 plantas∙ha-1. Al momento de la siembra el material se fertilizó con abono orgánico (estiércol de ganado vacuno, 100 g∙planta-1); a los ocho días se hizo una aplicación de la fórmula NPK (10:30:10, 5 g∙planta-1), y a los dos meses se realizó una segunda aplicación de abono orgánico. Adicionalmente, se aplicaron 2 mL∙L-1 abono foliar (Nitrofoska®) y 2 mL∙L-1 de ácidos húmicos bajos en potasio (Agroroots® 10-30-10).
Al cabo de 15 días del trasplante se evaluó el porcentaje de sobrevivencia, y a los tres meses se cosechó la biomasa a 15 cm del suelo (parte aérea) para permitirle a la planta rebrotar. En total se recolectaron muestras de 10 plantas por cultivar de stevia (por triplicado) de la misma edad y procedencia. Posteriormente, se determinó la biomasa producida (tallos y hojas) con base en el peso fresco y peso seco.
Análisis estadístico
Para el análisis estadístico y la comparación de medias de los resultados de los SIT se utilizó el programa Minitab 17 (2010), con la prueba Kruskal-Wallis (P ≤ 0.05). Los datos obtenidos en campo se analizaron estadísticamente con el programa Infostat (di Rienzo et al., 2017) y se realizó un análisis de varianza de una vía (P ≤ 0.05).
Resultados y discusión
Introducción y multiplicación del material in vitro
Los brotes axilares proliferaron después de dos a tres semanas de su cultivo en el medio base. Algunos investigadores han enriquecido el medio con kinetina para incrementar el número de brotes, pero en muy baja concentración (Espinal-de Rueda, Delvalle, Cifuentes, & Ramia, 2006); sin embargo, al igual que Alvarenga-Venutolo y Salazar-Aguilar (2015), en este estudio se utilizó AG3 como único regulador de crecimiento. El AG3 induce una gran variedad de efectos fisiológicos, entre ellos la elongación de tallos debido a la activación de los meristemos intercalares (George, Hall, & de Klerk, 2008). Los resultados obtenidos parecen confirmar este efecto, ya que las plantas presentaron rápido crecimiento vertical, tomando ventaja del espacio de cultivo. Esta característica es evidente al cambiar de recipiente (de frasco a tubo de ensayo) durante la multiplicación, observándose una mayor elongación y grosor de los brotes. Dichos resultados podrían explicarse con base en la altura del tubo de ensayo, lo que les permitió a las plantas direccionar su crecimiento verticalmente, ya que el medio de cultivo fue igual en ambos casos. Estos resultados concuerdan con los observados por Sánchez-Chiang y Jiménez (2010), quienes recomiendan seleccionar el recipiente dependiendo de la frecuencia y tiempo de subcultivo.
Prueba de medios líquidos
En cuanto a los medios de cultivo evaluados utilizando RITA®, se observaron diferencias estadísticas significativas entre los medios (P ≤ 0.002). El medio de cultivo 1 (medio base, 30 g∙L-1 de sacarosa, sin supresor microbiano y sin citoquinina) permitió la mayor elongación de los explantes, seguido por el medio 3 (igual al anterior pero con 1 mL∙L-1 de supresor) (Figura 3). No obstante, cuando las plantas obtenidas in vitro se llevaron al invernadero, las provenientes del medio 3 presentaron mayor porcentaje de sobrevivencia durante la aclimatación (92 %) que las del medio 1 (80 %), que presentó el mejor crecimiento in vitro (Figura 4). Además, se pudo observar que el supresor microbiano permitió mantener niveles bajos de contaminación bacteriana durante todo el proceso de micropropación, lo que de acuerdo con los resultados fue una ventaja a la hora de llevar las plantas al invernadero.
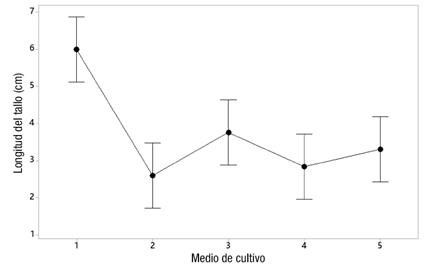
Figura 3 Efecto del medio de cultivo (sacarosa, pantotenato de calcio y ácido giberélico; Murashige & Skoog, 1962) en la longitud del tallo de explantes de Stevia rebaudiana cv. ‘Morita II’. Medio 1: 30 g∙L-1 de sacarosa; medio 2: 40 g∙L-1 de sacarosa; medio 3: 30 g∙L-1 de sacarosa + supresor microbiano; medio 4: 30 g∙L-1 de sacarosa + kinetina; medio 5: 30 g∙L-1 de sacarosa + supresor + kinetina.

Figura 4 Porcentajes de sobrevivencia de plántulas de Stevia rebaudiana cv. ‘Morita II’ en el invernadero. Medio 1: 30 g∙L -1 de sacarosa, medio 2: 40 g∙L -1 de sacarosa, medio 3: 30 g∙L -1 de sacarosa + supresor microbiano, medio 4: 30 g∙L -1 de sacarosa + kinetina y medio 5: 30 g∙L -1 de sacarosa + supresor + kinetina.
El supresor microbiano se utilizó debido a que en ambos materiales de Stevia rebaudiana apareció una bacteria endógena gram negativa en la tercera semana, identificada por secuenciación de ADN como Burkholderia fungorum (datos no mostrados). Este supresor sirve para retrasar la aparición de contaminantes en el cultivo in vitro, lo que permite no desechar gran cantidad de material vegetal y poder llevar más plantas al invernadero.
Las bacterias son los contaminantes in vitro más comunes y ocasionan serios problemas, además de ser difíciles de detectar y eliminar (Orlikowska, Nowak, & Reed, 2017). Su distribución puede ser localizada o sistémica, por xilema o floema, y por lo general no se manifiestan en los primeros subcultivos, ya que la alta presión osmótica, el pH y ciertas hormonas de los medios de cultivo pueden inhibir su crecimiento. Debido a estos factores inhibitorios, muchos microorganismos requieren un período de adaptación a las nuevas condiciones antes de manifestar su presencia, lo que ocurre por lo general en la fase de multiplicación (Hernández & González, 2010).
Los resultados de este estudio muestran que Stevia rebaudiana no es una planta exigente en cuanto al medio de cultivo, ya que el medio base enriquecido con 2 mg∙L-1 de PACA y 0.5 mg∙L-1 AG3 permitió la micropropagación de los explantes, lo que coincide con lo reportado por Alvarenga-Venutolo y Salazar-Aguilar (2015). Sin embargo, estos resultados son contrarios a los obtenidos por Sivaram y Mukundan (2003), quienes encontraron las mayores tazas de multiplicación y crecimiento utilizando citocininas y auxinas en el medio de cultivo. En el presente estudio, la adición de kinetina al medio de cultivo causó crecimiento heterogéneo (en roseta, explantes hiperhidratados, apariencia vidriosa y translúcida tanto de los tallos como de las hojas) (Figura 5), siendo característico de este regulador de crecimiento cuando se encuentra en concentraciones altas (George et al., 2008).
Sistemas de inmersión temporal
Todos los tratamientos evaluados en los SIT (BIT®, SETIS® y RITA®) produjeron plantas vigorosas con niveles bajos de hiperhidricidad, mayor número promedio de hojas y brotes, en general, una mayor tasa de multiplicación que aquellos explantes cultivados en medio semi-sólido.
Los SIT son sistemas automatizados que basan su funcionamiento en el contacto del medio de cultivo con los explantes por intervalos de tiempos regulares y el bombeo de aire limpio a través de un filtro. Este método permite que el exceso de líquido en los explantes se drene por gravedad al finalizar el bombeo y éstos se mantengan húmedos (Santos-Pino et al., 2011; Steinmacher, Guerra, Saare-Surminski, & Lieberei, 2011). El flujo de aire está regulado por temporizadores electrónicos que controlan la frecuencia y los tiempos de inmersión, y válvulas solenoides que permiten encender/apagar el sistema.
De acuerdo con la comparación de medias, ‘Morita II’ mostró mayor longitud de tallo en las plantas cultivadas en el sistema BIT® (11.65 cm), comparado con SETIS® (9 cm) y RITA® (2.85 cm). Asimismo, en ‘Silvestre’ se observó la mayor longitud de tallo con BIT® (13.50 cm). En ambos casos las diferencias fueron estadísticamente significativas (P ≤ 0.05) (Figura 6).

Figura 6 Longitud del tallo de dos cultivares de Stevia rebaudiana: ‘Morita II’ y ‘Silvestre’, según los sistemas de inmersión temporal evaluados.
En general, la composición de los gases en el envase de cultivo está influenciada por el volumen del recipiente, el volumen del medio y la ventilación (Georgiev et al., 2014). En los SIT, el control de la fase gaseosa depende del volumen del recipiente, de los gases producidos por los explantes y de la frecuencia de inmersión por medio del flujo de aire (Basail-Pérez et al., 2012). Adicionalmente, Ziv (2005), al medir la concentración de gases dentro de los SIT, mostró que es tan importante la concentración de O2 como de CO2 en el recipiente de cultivo.
El recipiente BIT, que mostró los mejores resultados en elongación de las plantas, presentó mayor volumen relativo para el intercambio y acumulación de gases. Lo anterior debido a que se usa un recipiente vertical, y el espacio entre los explantes y la parte superior del recipiente es mayor en comparación con el disponible en los otros sistemas evaluados, permitiendo una mayor disponibilidad de gases y espacio para la elongación de los explantes (Figura 2).
Brotación
En ‘Morita II’, la mediana de BIT® fue ocho brotes por planta, mientras que en SETIS® fue de tres brotes, observándose diferencias significativas entre los dos sistemas evaluados (P ≤ 0.05). Para ‘Silvestre’, el número de brotes en ambos casos fue de dos (P = 0.42). Ambos cultivares presentaron elongación similar de plántulas en BIT®; sin embargo, de acuerdo con los resultados de brotación, ‘Morita II’ produce más brotes que ‘Silvestre’.
Estos resultados parecen indicar que ‘Silvestre’ es más sensible a la presencia del AG3, ya que éste induce la elongación de tallos (George et al., 2008). Resultados similares fueron reportados por Escalona et al. (1999b), quienes observaron que el AG3 promovió mejor elongación y uniformidad de brotes en piña (Ananas comosus).
De acuerdo con Thiyagarajan y Venkatachalam (2012), la mayor brotación de stevia en medio sólido se debe al uso de reguladores de crecimiento como kinetina (0.5 mg∙L-1) y bencilaminopurina (1.0 mg∙L-1), logrando hasta un 85.7 % de regeneración. El medio de cultivo utilizado en esta investigación solo se suplementó con AG3, y en las pruebas iniciales de medios la presencia de citocininas causó efectos negativos, por lo que los resultados parecen indicar que el efecto de la brotación se debe al SIT. Vilchez y Albany (2014) atribuyen el aumento del número de brotes de guayabo al tipo de SIT evaluado (RITA® y BIT®).
Tiempo y frecuencia de inmersión
El tiempo y frecuencia de inmersión son dos factores fundamentales para lograr el mayor coeficiente de multiplicación y la mejor calidad de plantas. Aunque en este estudio no se analizaron, los parámetros empleados son recomendado por ciertos investigadores para plantas magnófitas. Castro y González (2002) evaluaron diferentes frecuencias y tiempos de inmersión. En su caso, las frecuencias de 12 h y 3 min de inmersión mostraron mayor número de brotes en relación con frecuencias menores y 1 min de inmersión.
Por otra parte, en cultivo de plátano bajo SIT, los tiempos de inmersión fueron más prolongados, ya que la morfología de la especie es muy diferente a la de stevia. En plátano se evaluaron tiempos de inmersión de 5, 10 y 15 min, demostrando al cabo de 21 días que esto influyó significativamente en todas las variables evaluadas, siendo 10 min el tiempo que permitió mayor coeficiente de multiplicación, diámetro del pseudotallo y menor grado de oxidación (Basail-Pérez et al., 2011).
Al finalizar este estudio, se pudieron observar diferencias entre los SIT evaluados, entre los cuales se destacan algunas ventajas, pero también se mencionan desventajas en cuanto al uso del equipo, que pueden ser útiles para la búsqueda de mejoras. La capacidad de RITA® es menor en comparación con los otros dos sistemas evaluados, aunque su diseño permite mayor facilidad de introducción de los explantes al frasco de cultivo. Por otra parte, la malla donde se colocan los explantes tanto en RITA® como en SETIS® dificulta la recuperación del material si este presenta raíces al final del período de multiplicación. La distribución del medio de cultivo es más homogénea en RITA® y en BIT®; sin embargo, el costo de adquisición de BIT® es mucho menor. Vilchez y Albany (2014) reportan resultados similares.
Aclimatación en invernadero
Después de un mes de cultivo en los SIT, las plantas se llevaron al invernadero para su aclimatación. Es importante mencionar que el crecimiento in vitro es heterótrofo y el in vivo autótrofo. El ambiente in vitro presenta alta humedad relativa, bajo o nulo intercambio gaseoso, escasez de CO2 durante casi todo el período, producción de etileno y baja densidad fotosintética, lo que induce perturbaciones en las plantas desarrolladas bajo esas condiciones.
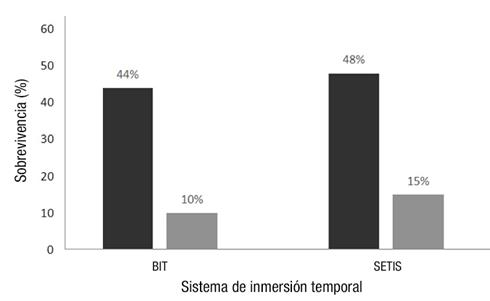
Las plantas obtenidas in vitro tienen hojas delgadas, tallos débiles, raíces débiles y poco funcionales, conexión tallo-raíz incompleta y tasa fotosintética baja (George et al., 2008). Por ello, la aclimatación es un factor importante en la posterior supervivencia de la planta, ya que es una etapa crítica dentro del proceso y es en la que se produce la mayor pérdida de plantas. Es importante iniciar el proceso de aclimatación reduciendo gradualmente la humedad relativa para permitir, además del cierre estomático, una mejor formación de cutícula y disminuir la pérdida de agua (Nava et al., 2011).
En este trabajo, la mayor mortalidad de plantas en invernadero se presentó durante la primera etapa de aclimatación, debido, en parte, a las características que presentan las plantas recién salidas del cultivo in vitro y a las condiciones del invernadero, cuya infraestructura no permite regular apropiadamente la humedad relativa, temperatura ni luminosidad. Otra de las principales limitantes durante este periodo fue el ataque por mosca blanca (Trialeurodes vaporariorum), que se controló con trampas cromáticas color amarillo y el insecticida Actara® (Tiametoxam), 2.5 mg∙L-1 cada 15 días. El contenido alto de azúcar en esta especie la hace muy atractiva para estos insectos. Una vez pasada esta primera etapa, las plantas que sobrevivieron llegaron hasta el traslado a campo. Los resultados de esta etapa obtenidos en esta investigación parecen indicar que las condiciones iniciales durante la aclimatación no fueron las más adecuadas para esta especie, y que en futuras pruebas se debe prestar atención a las condiciones dadas en el periodo inicial en invernadero.
Para ambos cultivares, sin importar el SIT utilizado, los porcentajes de sobrevivencia en invernadero fueron muy similares (Figura 7), aunque bajos por los problemas antes mencionados. Con base en los resultados obtenidos, se puede deducir que la calidad de las plantas obtenidas in vitro es buena y similar en ambos cultivares, y que el manejo de las plantas recién sembradas en el invernadero determinará el porcentaje de sobrevivencia.
Cultivo en campo
Una vez que las plantas alcanzaron una longitud de 10 a 15 cm en invernadero se llevaron a campo. Durante el cultivo en campo se presentaron algunos problemas con plagas, como la hormiga zompopa (Atta spp) y jobotos (Phyllophaga spp); sin embargo, se observó 95 % de sobrevivencia de las plantas después de 15 días de siembra. En esta etapa las plantas mostraron crecimiento vigoroso y coloración característica de la especie (Figura 8).
La producción de follaje fue alto en ambos cultivares; aunque con diferencias estadísticas significativas (P ≤ 0.05) entre ambos, siendo ‘Morita II’ el que produjo el mayor peso fresco (260.7 g), comparado con ‘Silvestre’ (214.4 g). Por el contrario, en peso seco no se presentaron diferencias estadísticamente significativas (P ≤ 0.05), produciendo ambas alrededor de 80 g de materia seca por muestra (10 plantas de la misma edad y procedencia, por triplicado) (Figura 9).
Conclusiones
Todos los sistemas de inmersión evaluados permitieron el escalamiento y, por ende, la obtención de mayor número de plantas comparado con el sistema convencional semi-sólido. Con el sistema BIT se produjo mayor brotación y longitud de brotes en el cultivar ‘Morita II’. En ‘Silvestre’ no se observó diferencia significativa en el número de brotes entre los diferentes sistemas, pero si se tuvo mayor longitud de brotes en BIT.
Es importante prestar atención a las condiciones que se den al inicio de la etapa de aclimatación en invernadero, ya que ésta es crítica para asegurar la sobrevivencia de la planta y, por tanto, mayor volumen de material para siembra en campo. Las plantas en campo produjeron mucha biomasa, confirmando no solo la calidad del material sembrado sino también la idoneidad del sitio de siembra.
Agradecimientos
A la Vicerrectoría de Investigación y Extensión del Instituto Tecnológico de Costa Rica por el apoyo financiero para el desarrollo de este proyecto. Al Centro de Productos Bióticos del Instituto Politécnico Nacional, Yautepec, Morelos, México, por facilitarnos el material ‘Morita II’ empleado en la investigación.
REFERENCIAS
Alvard, D., Cote, F., & Teisson, C. (1993). Comparison of methods of liquid medium culture for banana micropropagation: Effects of temporary immersion of explants. Plant Cell, Tissue and Organ Culture, 32(1), 55-60. doi: 10.1007/BF00040116 [ Links ]
Alvarenga-Venutolo, S., & Salazar-Aguilar, T. (2015). Micropropagación masiva de Stevia rebaudiana Bertoni en sistemas de inmersión temporal. Cultivos Tropicales, 36(3), 50-57. Retrieved from http://www.redalyc.org/pdf/1932/193242312008.pdf [ Links ]
Aragón, C., Sánchez, C., González-Olmedo, J., Escalona, M., Carvalho, L., & Amâncio, S. (2014). Comparison of plantain plantlets propagated in temporary immersion bioreactors and gelled medium during in vitro growth and acclimatization. Biologia Plantarum, 58(1), 29-38. doi: 10.1007/s10535-013-0381-6 [ Links ]
Atteh, J., Onagbesan, O., Tona, K., Buyse, J., Decuypere, E., & Geuns, J. (2011). Potential use of Stevia rebaudiana in animal feeds. Archivos de Zootecnia, 60(229), 133-136. Retrieved from http://scielo.isciii.es/pdf/azoo/v60n229/art15.pdf [ Links ]
Basail-Pérez, M., Medero-Vega, V., Otero-Gálvez, E., Torres-Delgado, M., López-Torres, J., Cabrera-Jova, M., Santos-Pino, A., Rayas-Cabrera, A., Bauta-Toledo, M., & Beovides-García, Y. (2012). Empleo de sistemas de inmersión temporal como alternativa para la multiplicación in vitro del cultivar de plátano vianda ‘INIVITPV06-30’ (Musa AAB). Biotecnología Vegetal, 12(1), 53-57. Retrieved from https://revista.ibp.co.cu/index.php/BV/article/view/150/html [ Links ]
Basail-Pérez, M., Medero-Vega, V., Otero-Gálvez, E., Torres-Delgado, M., Cabrera-Jova, M., López-Torres, J., Santos Pino A., Rayas Cabrera, A., Bauta Toledo, M., Páz Chávez, E., Beovidez García, Y., Ortega Ortiz, A. & Pérez-Martínez, J. E. (2011). Multiplicación in vitro de ‘FHIA-25’ (Musa spp., AAB) en sistemas de inmersión temporal. Revista Biotecnología Vegetal, 11(1), 27-31. Retrieved from https://revista.ibp.co.cu/index.php/BV/article/view/205 [ Links ]
Berthouly, M., & Etienne, H. (2005). Temporary immersion system: a new concept. In: Hvoslef-Eide, A. K., & Preil, W. (Eds), Liquid culture systems for in vitro plant propagation (pp. 165-195). Netherlands: Springer. Retrieved from https://www.researchgate.net/profile/Eric_Gontier/publication/235004787_Hvoslef-Eide_Walter_Preil_2005/links/0fcfd5104021fc8bd4000000.pdf [ Links ]
Cabrera-Jova, M., Gómez-Kosky, R., Rodríguez-Morales, S., López-Torres, J., Rayas-Cabrera, A., Basail-Pérez, M., Santos-Pino, A., Medero-Vega, V., & Rodríguez-Rodríguez, G. (2008). Multiplicación in vitro de segmentos nodales del clon de ñame Blanco de Guinea (Dioscoria cayenensis - D. rotundata) en sistemas de cultivo semi automatizados. Revista colombiana de Biotecnología, 10(2), 97-103. Retrieved from https://revistas.unal.edu.co/index.php/biotecnologia/article/view/9182 [ Links ]
Casaccia, J., & Álvarez, E. (2006). Recomendaciones técnicas para una producción sustentable del KA’A HE’E (Stevia rebaudiana Bertoni) en el Paraguay. Paraguay: Ministerio de Agricultura y Ganadería, Subsecretaría de Estado de Agricultura y Dirección de Investigación agrícola. Retrieved from http://www.steviaparaguaya.com.py/recomendaciones-tecnicas_kaahee.pdf [ Links ]
Castro, D., & González, J. (2002). Eucalyotus (Eucalyptus grandis Hill ex Maiden) micropropagation in a temporary immersion system. Agricultura técnica, 62(1), 68-78. Retrieved from http://www.chileanjar.cl/files/V62I1A07_es.pdf [ Links ]
Di Rienzo, J. A., Casanoves, F., Balzarini, M., Gonzalez, L., Tablada, M., & Robledo, C. W. (2017). InfoStat software estadístico. Argentina: Universidad Nacional de Córdoba. Retrieved from http://www.infostat.com.ar [ Links ]
Escalona, M., Cid, M., Lezcano, Y., Capote, I., Yánez, E., & González, J. (1999a). Propagación de la piña (Ananas comosus (L.) Merr.) en biorreactores de inmersión temporal. Efecto de la frecuencia de inmersión y el paclobutrazol (pp. 28). Ciego de Avila, Cuba: BioVeg’99. [ Links ]
Escalona, M., Lorenzo, J. C., González, B., Daquinta, M., González, J. L., Desjardins, Y., & Borroto, C. G. (1999b). Pineapple (Ananas comosus L. Merr) micropropagation in temporary immersion system. Plant Cell Reports, 18(9), 743-748. doi: 10.1007/s002990050653 [ Links ]
Espinal-de Rueda, D., Delvalle, W., Cifuentes, E., & Ramia, N. (2006). Propagación in vitro de Stevia rebaudiana B. a partir de segmentos nodales. Ceiba, 47(1-2), 11-18. doi: 10.5377/ceiba.v47i1-2.442 [ Links ]
George, E., Hall, M. A., & de Klerk, G. (2008). Plant propagation by tissue culture (pp. 29-64). Netherlands: Springer . Retrieved from http://www.springer.com/us/book/9781402050046 [ Links ]
Georgiev, V., Schumann, A., Pavlov, A., & Bley, T. (2014). Temporary immersion systems in plant biotechnology. Engineering in Life Science, 14(6), 607-621. doi: 10.10002/elsc.201300166 [ Links ]
Goettemoeller, J., & Ching, A. (1999). Seed germination inStevia rebaudiana. In: Janick, J. (Ed.), Perspectives on new crops and new uses (pp. 510-511). Alexandria, Virginia: ASHS Press. Retrieved from https://hort.purdue.edu/newcrop/proceedings1999/v4-510.html [ Links ]
Hernández, Y., & González, M. (2010). Efectos de la contaminación microbiana y oxidación fenólica en el establecimiento in vitro de frutas perennes. Cultivos Tropicales, 31(4), 15-23. Retrieved from http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0258-59362010000400015 [ Links ]
Minitab 17. (2010). Statistical Software by Minitab Inc. Retrieved from http://www.minitab.com/es-mx/products/minitab/ [ Links ]
Murashige, T., & Skoog, F. (1962). A revised medium for rapid growth and bioassay with tobacco tissue cultures. Physiol Plantarum, 15(3), 473-497. doi: 10.1111/j.1399-3054.1962.tb08052.x [ Links ]
Nava, J., Jimenez-Aparicio, A., de Jesús-Sanchez, A., Arenas-Ocampo, M. L., Ventura-Zapata, E., & Evangelista-Lozano, S. (2011). Estudio de la morfología y aclimatación de plantas de Laelia eyermaniana RCHB. f. generadas in vitro. Polibotánica, 32, 107-117. Retrieved from http://www.redalyc.org/pdf/621/62119933006.pdf [ Links ]
Orlikowska, T., Nowak, K., & Reed, B. (2017). Bacteria in the plant tissue culture environment. Plant Cell, Tissue and Organ Culture, 128(3), 487-508. doi: 10.1007/s11240-016-1144-9 [ Links ]
Preil, W. (2005). General introduction: a personal reflection on the use of liquid media for in vitro culture. In: Hvoslef-Eide, A. K., & Preil, W. (Eds), Liquid culture systems for in vitro plant propagation (pp. 1-18). Netherland: Springer. Retrieved from https://www.researchgate.net/profile/Eric_Gontier/publication/235004787_Hvoslef-Eide_Walter_Preil_2005/links/0fcfd5104021fc8bd4000000.pdf [ Links ]
Quiala, E., Cañal, M. J., Meijon, M., Rodríguez, R., Chávez, M., Valledor, L., & Barbón, R. (2012). Morphological and physiological responses of proliferating shoots of teak to temporary immersion and BA treatments. Plant Cell, Tissue and Organ Culture, 109(2), 223-234. doi: 10.1007/s11240-011-0088-3 [ Links ]
Roels, S., Noceda, C., Escalona, M., Sandoval, J., Cañal, M., Rodríguez, R., & Debergh, P. (2006). The effects of headspace renewal in a temporary immersion biorreactor on plantain (Musa AAB) shoot proliferation and quality. Plant Cell, Tissue and Organ Culture, 84(2), 138-146. doi: 10.1007/s11240-005-9013-y [ Links ]
Sánchez-Chiang, N., & Jiménez, V. M. (2010). Técnicas de conservación in vitro para el establecimiento de bancos de germoplasma en cultivos vegetales. Agronomía mesoamericana, 21(1), 193-205. Retrieved from http://www.mag.go.cr/rev_meso/v21n01_193.pdf [ Links ]
Santos-Pino, A., Cabrera-Jova, M., Gómez-Kosky, R., López-Torres, J., Rayas-Cabrera, M., Basail-Pérez, M., Medero-Vega, V., & Beovides-García, Y. (2011). Multiplicación en sistema de inmersión temporal del clon de malanga “Viequera” (Xanthosoma spp.). Revista Colombiana de Biotecnología, 13(2), 97-106. Retrieved from https://dialnet.unirioja.es/servlet/articulo?codigo=4808854 [ Links ]
Shivanna, N., Mahadev, N., Khanum, F., & Kaul, V. K. (2013). Antioxidant, anti-diabetic and renal protective properties of Stevia rebaudiana. Journal of Diabetes and Its Complications, 27(2), 103-113. doi: 10.1016/j.jdiacomp.2012.10.001 [ Links ]
Sivaram, L., & Mukundan, U. (2003). In vitro culture studies on Stevia rebaudiana. In vitro Cellular & Developmental Biology-Plant, 39(5), 520-523. doi: 10.1079/IVP2003438 [ Links ]
Steinmacher, D. A., Guerra, M. P., Saare-Surminski, K., & Lieberei, R. (2011). A temporary immersion system improves in vitro regeneration of peach palm through secondary somatic embryogenesis. Annals of Botany, 108(8), 1463-1475. doi: 10.1093/aob/mcr033 [ Links ]
Thiyagarajan, M., & Venkatachalam, P. (2012). Largescale in vitro propagation of Stevia rebaudiana (bert) for commercial application: Pharmaceutically important and antidiabetic medicinal herb. Industrial Crops and Products, 37(1), 111-117. doi: 10.1016/j.indcrop.2011.10.037 [ Links ]
Vilchez, J., & Albany, N. (2014). Multiplicación in vitro de Psidium guajava L. en sistemas de inmersión temporal. Revista Colombiana de Biotecnología, 16(2), 96-103. Retrieved from http://www.redalyc.org/html/776/77632757012/ [ Links ]
Watt, P. (2012). The status of temporary immersion system (TIS) technology for plant propagation. African Journal of Biotechnology, 11(76), 14025-14035. doi: 10.5897/AJB12.1693 [ Links ]
Ziv, M. (2005). Simple bioreactors for mass propagation of plants. Plant Cell, Tissue and Organ Culture, 81, 277-285. doi: 10.1007/1-4020-3200-5_5 [ Links ]
Recibido: 03 de Agosto de 2017; Aprobado: 17 de Octubre de 2017











 texto en
texto en