Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo. Serie horticultura
versão On-line ISSN 2007-4034versão impressa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.23 no.3 Chapingo Set./Dez. 2017
https://doi.org/10.5154/r.rchsh.2017.02.009
Articles
Neoscytalidium dimidiatum agente causal de muerte descendente en Ficus benjamina L. en México
1Universidad de Sonora, Departamento de Agricultura y Ganadería. Carretera Bahía de Kino km 21, Hermosillo, Sonora, C. P. 83340, MÉXICO.
2Universidad Politécnica de Pénjamo. Carretera Irapuato - La Piedad km 44, Pénjamo, Guanajuato, C. P. 36921, MÉXICO.
3Consejo Nacional de Ciencia y Tecnología - Instituto Politécnico Nacional, Unidad Michoacán. Justo Sierra núm. 28, Jiquilpan, Michoacán, C. P. 59510, MÉXICO.
En México, Ficus benjamina L. se usa principalmente como ornamental y ha sido ampliamente aceptado debido a su bajo costo de producción, crecimiento rápido y follaje abundante. Ficus L. es un género muy amplio que agrupa diversas especies originarias de regiones tropicales y subtropicales. El presente trabajo tuvo como objetivo identificar morfológica y molecularmente al agente causal de la “muerte descendente de ramas” en plantas de F. benjamina. Se observó muerte descendente en árboles de Ficus benjamina de zonas urbanas y jardines de Sonora durante la temporada de mayor calor (junio-septiembre) en 2014. Se obtuvieron aislados fúngicos de diferentes plantas sintomáticas. Las características morfológicas de dichos aislados fueron similares entre sí y su patogenicidad se corroboró al observar las lesiones necróticas ocasionadas por cuatro de estos aislados en plantas de F. benjamina a los 40 días después de la inoculación. Las secuencias concatenadas de la región espaciadora interna transcrita (ITS; KU141333 y KU141334), subunidad grande (LSU; MF508739 y MF508740) y ARN polimerasa subunidad II (RPB2; MF508741 y MF508742) del ADN de dos aislados representativos se analizaron filogenéticamente, mostrando que los aislados NDFB002 y NDFB003 forman un clado aparte con varias cepas de Neoscytalidium dimidiatum. Dichos aislados se reportaron previamente en el Banco de Genes del National Center for Biotechnology Information (NCBI). Hasta donde se sabe, este es el primer reporte donde N. dimidiatum se señala como agente causal de muerte descendente de ramas en plantas de F. benjamina en México.
Palabras clave: necrosis de ramas; Botryosphaeriaceae; análisis filogenético; PCR
In Mexico, Ficus benjamina L. is mainly used as an ornamental and has been widely accepted because of its low production cost, rapid growth and abundant foliage. Ficus L. is a very broad genus that groups together diverse species native to tropical and subtropical regions. The aim of this research was to morphologically and molecularly identify the causal agent of “branch dieback” in F. benjamina plants. Dieback was observed in Ficus benjamina trees in urban areas and gardens in Sonora during the hottest season (June to September) in 2014. Fungal isolates were obtained from different symptomatic plants. The morphological characteristics of these isolates were similar to each other and their pathogenicity was confirmed by observing necrotic lesions caused by four of these isolates in F. benjamina plants 40 days after inoculation. Concatenated sequences from the internal transcribed spacer region (ITS; KU141333 and KU141334), large subunit (LSU; MF508739 and MF508740) and RNA polymerase II subunit (RPB2; MF508741 and MF508742) of the DNA from two representative isolates were analyzed phylogenetically, showing that the NDFB002 and NDFB003 isolates form a separate clade with several strains of Neoscytalidium dimidiatum. These isolates were previously reported in the National Center for Biotechnology Information (NCBI) GenBank. To our knowledge, this is the first report where N. dimidiatum is designated as a causal agent of branch dieback in F. benjamina plants in Mexico.
Keywords: branch necrosis; Botryosphaeriaceae; phylogenetic analysis; PCR
Introducción
Ficus L. es un género muy amplio que agrupa numerosas especies diferentes entre sí; además, es originario de regiones tropicales y subtropicales (Serrato, Ibarra-Manrriquez, & Oyama, 2004). Muchas especies de Ficus son comunes en regiones biogeográficas diferentes y se considera uno de los géneros más diversos respecto de sus hábitats y formas de vida (Chaudhary et al., 2012). En México, Ficus benjamina L. se usa principalmente como ornamental y ha sido ampliamente aceptado debido a su bajo costo de producción, crecimiento rápido y follaje denso y lustroso (Alanís-Flores, 2005). Al igual que muchas especies vegetales, el crecimiento y desarrollo de F. benjamina es afectado por varios hongos fitopatógenos, donde predominan los ascomicetos y sus anamorfos.
Los hongos de la familia Botryosphaeriaceae (Ascomycetes) infectan plantas como Acacia karroo (Sudáfrica), Hylocereus polyrhizus (Malasia), Eucalyptus camaldulensis y Populus nigra (Iraq), Citrus paradisi (Israel), Ficus spp. (Sudán), Manihot esculenta (Brasil), Vitis vinifera (California), entre muchas otra plantas arbóreas y arbustivas en el mundo (El Atta & Aref, 2013; Hassan, Haleem, & Hassan, 2011; Jami, Slippers, Wingfield, & Gryzenhout, 2013; Machado, Pinho, Oliveira, & Pereira, 2014; Mohd, Salleh, & Zakaria, 2013; Sadowsky, Solel, & Sztejnberg, 2007; Úrbez-Torres, Leavitt, Voegel, & Gubler, 2006).
La identificación de especies de la familia Botryosphaeriaceae ha sido inconsistente y pobre por muchos años (Slippers & Wingfield, 2007). No obstante, con ayuda de herramientas moleculares, se han identificado diferencias en secuencias del ADN ribosomal, necesarias para una caracterización más confiable (Machado et al., 2014).
En 2014, durante la temporada de mayor calor (junio-septiembre), se detectaron plantas de F. bejamina con síntomas de muerte descendente de ramas en jardines particulares y avenidas en zonas públicas en Hermosillo, Sonora, México, desconociendo la causa del o los organismos asociados con dicha enfermedad. Por ello, el presente trabajo tuvo como objetivo identificar morfológica y molecularmente al agente causal de la “muerte descendente de ramas” en plantas de F. benjamina.
Materiales y métodos
Colecta y aislamiento
De jardines y zonas urbanas de Hermosillo, Sonora, se colectaron muestras de tejido con síntomas de muerte descendente de árboles de F. benjamina, se desinfestaron con hipoclorito de sodio al 1 % por 1 min, se enjuagaron tres veces con abundante agua destilada esterilizada y se colocaron en papel secante esterilizado. Los fragmentos de tejido se sembraron en medio PDA (Difco®) e incubaron a 28 °C durante tres días.
Para la identificación morfológica se realizaron montajes de tejido de cultivos de 10 días de edad y la clasificación del género y especie se realizó con las claves de Crous et al. (2006) y Phillips et al. (2013).
Pruebas de patogenicidad
Se utilizaron cuatro aislamientos de plantas de F. benjamina con síntomas de muerte descendente. Para ello, se inocularon cinco plantas de F. benjamina, de aproximadamente un año de edad, con cada uno de los aislados. Adicionalmente, se utilizaron cinco plantas como control. Para la inoculación de las plantas, se realizaron cortes superficiales en la corteza de aproximadamente 2 x 5 mm y 2 mm de profundidad con una navaja desinfestada con alcohol. En el corte realizado se colocaron trozos del medio PDA con micelio del hongo. En las plantas control se realizaron heridas similares, pero se les colocó medio de cultivo sin el hongo. Para evitar la desecación y contaminación, se cubrieron las heridas con cinta de parafilm.
Identificación molecular y análisis filogenético
El ADN extraído de los cuatro aislamientos inoculados se amplificó parcialmente con los iniciadores: ITS1 (5’-TCC GTA GGT GAA CCT GCG G-3’) / ITS4 (5’-TCC TCC GCT TAT TGA TAT GC-3’) (White, Bruns, Lee, & Taylor, 1990), RPB2-5F (5’-GAY GAY MGW GAT CAY TTY-3’) / fRPB2-7cR (5’-GGC CCA TWG CYT GCT TMC CC AT-3’) (Liu, Whelen, & Hall, 1999) y LROR (5’-ACC CGC TGA ACT TAA GC-3’) / LR5 (5’-TCC TGA GGG AAA CTT CG-3’) (Vilgalys & Hester, 1990), que amplifican las regiones ITS1-5.8S-ITS2, RPB2 y 28S, respectivamente. Los amplicones purificados se secuenciaron en ambas direcciones, usando el respectivo par de iniciadores por separado. El equipo de secuenciación utilizado fue ABI PRISM® 3700, Genetic-Analyser - Applied Biosystems. Las secuencias de dos aislados representativos de N. dimidiatum, junto con otras secuencias de la familia Botryosphaeriaceae, se alinearon utilizando Clustal W, editadas y analizadas con el método de máxima verosimilitud con el software MEGA 7 (Kumar, Stecher, & Tamura, 2016). Se analizaron un total de 1,345 posiciones. La robustez de los nodos se examinó con un análisis de bootstrap con 2,000 réplicas. Se utilizó a Aplosporella hesperidica CBS:732.79 como grupo externo.
Resultados y discusión
Aislamiento e identificación
Se aisló a Neoscytalidium dimidiatum con una frecuencia de 100 % de plantas de F. benjamina con síntomas de muerte descendente de ramas (Figura 1A), desprendimiento de corteza y cancros en el fuste del tronco; que como consecuencia provocó la emergencia de raíces adventicias. Neoscytalidium pertenece a la familia Botryosphaeriaceae, siendo un género recientemente creado (Crous et al., 2006). Los hongos de la familia Botryosphaeriaceae son organismos típicamente patógenos oportunistas, causando enfermedades solo cuando las plantas están estresadas y con distribución cosmopolita; asimismo, están comúnmente asociados con muerte descendente y cancros de plantas leñosas y arbustivas (Bush, 2015). Neoscytalidium dimidiatum presentó las siguientes características morfológicas: micelio de color verde claro a verde-olivo cuando joven (tres días) y gris-oscuro a negro cuando viejo (siete a diez días), picnidios obscuros en troncos afectados y conidias en cadena de forma elipsoides y globosas, con 0-2 septas al madurar de aproximadamente 3 a 5.5 y 6 a 9.5 µm (Figura 1B).

Figura 1 Características de Neocytalidium dimidiatum. A) Muerte descendente en plantas de F. benjamina; B) artroconidias (arriba) y crecimiento micelial en medio PDA (abajo).
Las secuencias de la región espaciadora interna transcrita (ITS; KU141333 y KU141334), subunidad grande (LSU; MF508739 y MF508740) y ARN polimerasa subunidad II (RPB2; MF508741 y MF508742) del ADN de los aislados representativos NDFB002 y NDFB003 se depositaron en el Banco de Genes del National Center for Biotechnology Information (NCBI; http://www.ncbi.nlm.nih.gov/). Dichas secuencias se compararon mediante la herramienta BLAST del NCBI, mostrando de 99 a 100 % de similitud con Neoscytalidium dimidiatum.
Pruebas de patogenicidad
Las plantas de Ficus benjamina inoculadas con los aislados fúngicos mostraron necrosis y ligero descortezamiento en la zona inoculada a los 40 días después de la inoculación (ddi) (Figura 2D, E, G y H): mientras que en las plantas control no se observaron dichos síntomas (Figura 2C y F):. Las características morfológicas de los aislados obtenidos de las plantas inoculadas coincidieron con los aislados inoculados, cumpliéndose los postulados de Koch.

Figura 2 Síntomas en Ficus benjamina a los 40 días después de la inoculación. C) y F) plantas control, sin y con corte, respectivamente; D) y G) necrosis inducida por N. dimidiatum (aislado NDFB002), sin y con corte, respectivamente; E) y H) necrosis inducida por N. dimidiatum (aislado NDFB003), sin y con corte, respectivamente.
Las enfermedades ocasionadas por Botryosphaeriaceae spp. son mayores cuando las plantas afectadas están bajo condiciones de estrés. Bajo las condiciones ambientales de Hermosillo, Sonora, de extremo calor y humedad relativa baja, las plantas de Ficus tienen mayor probabilidad de infectarse con N. dimidiatum. La mayor predisposición de las plantas a infecciones por especies de la familia Botryosphaeriaceae por efecto de condiciones ambientales específicas fue reportada por Hassan et al. (2011). Ellos expusieron plantas de eucalipto (Eucalyptus camaldulensis) y álamo (Populus nigra) a temperaturas cálidas (32 °C), muy cálidas (40 °C) y a N. dimidiatum, observando que las temperaturas extremas predispusieron a las plantas a una mayor infección por parte del hongo. De igual forma, Sadowsky et al. (2007) reportaron el efecto de las temperaturas 25, 32 y 40 °C en plantas de pomelo, indicando que las temperaturas extremas (40 °C) son un factor crucial para predisponer a las plantas a la infección por Scytalidium lignicola. En este sentido, Jami et al. (2013) y Slippers y Wingfield (2007) mencionan que varios miembros de la familia Botryosphaeriaceae son patógenos latentes que viven como endófitos en sus hospedantes asintomáticos por periodos extensos y que causan enfermedades bajo condiciones de estrés. Particularmente, N. dimidiatum se ha reportado como patógeno de plantas leñosas como nogal (Juglans regia), mango (Mangifera indica), vid (Vitis vinifera L.), Ficus carica y Ficus spp., en las cuales produce síntomas como muerte descendente, necrosis de ramas y cancros en el tallo; así como, muerte de la unión del injerto en plantas de nogal en viveros, entre otros síntomas (Al-Saadoon, Ameen, Hameed, Al-Badran, & Ali, 2012; Chen, Fichtner, Morgan, & Michailides, 2013; El Atta & Aref, 2013; Ray, Burgess, & Lanoiselet, 2010).
Análisis filogenético
Las secuencias concatenadas de las regiones ITS, RPB2 y LSU se compararon con las de aislados de hongos de especies pertenecientes a la familia Botryosphaeriaceae. El análisis multilocus indicó que los aislados de N. dimidiatum (CBS:204.33, CBS:125616 y CBS:125695) se agruparon en la misma rama filogenética que los hongos obtenidos en el presente estudio. Por el contrario, las especies de Botryosphaeria, Macrophomina, Neofusicoccum, Dothiorella, Lasiodiplodia y Diplodia se agrupan en nodos filogenéticamente diferentes (Figura 3).
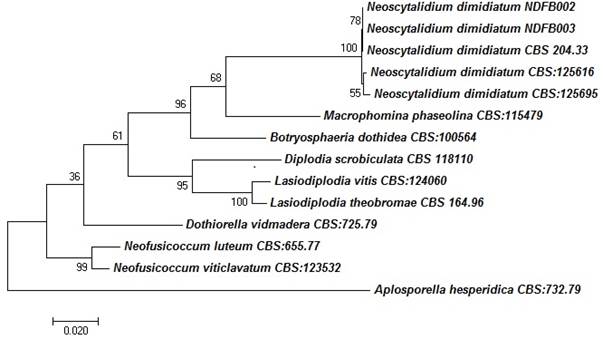
Figura 3 Árbol filogenético de especies de la familia Botryosphaeriaceae usando el método de Máxima Verosimilitud con secuencias combinadas de la región ITS, LSU y RPB2. Solo se muestran valores de bootstrap ≥ a 60 %. La longitud de las ramas es proporcional a las distancias genéticas. Todas las secuencias relacionadas se tomaron de la base de datos de la colección de cultivos CBS-KNAW del Instituto Westerdijk de Holanda.
Conclusiones
Basados en las características morfológicas y moleculares de las regiones ITS, RPB2 y LSU, se identificó a Neoscytalidium dimidiatum como agente causal de muerte descendente de ramas y cancros en plantas de Ficus benjamina en Hermosillo, Sonora. Hasta donde se sabe, este es el primer reporte donde Neoscytalidium dimidiatum se encuentra afectando plantas de Ficus benjamina en México.
References
Alanís-Flores, G. J. (2005). El arbolado urbano en el área metropolitana de Monterrey. Ciencia UANL, 8(1), 20-32. Retrieved from http://www.isahispana.com/treecare/resources/monterrey.pdf [ Links ]
Al-Saadoon, A. H., Ameen, M. K. M., Hameed, M. A., Al-Badran, A., & Ali, Z. (2012). First report of grapevine dieback caused by Lasiodiplodia theobromae and Neoscytalidium dimidiatum in Basrah, Southern Iraq. African Journal of Biotechnology, 11(95), 16165-16171. doi: 10.5897/AJB12.010 [ Links ]
Bush, A. E. (2015). Botryosphaeria canker and dieback of trees and shrubs in the landscape. USA: Virginia Tech and Virginia State University. Retrieved from https://pubs.ext.vt.edu/450/450-726/450-726_pdf.pdf [ Links ]
Chaudhary, L. B., Sudhakar, J. V., Kumar, A., Bajpai, O., Tiwari, R., & Murthy, G. V. S. (2012). Synopsis of the genus Ficus L. (Moraceae) in India. Taiwania, 57(2), 193-216. Retrieved from http://tai2.ntu.edu.tw/taiwania/pdf/tai.2012.57.193.pdf [ Links ]
Chen, S. F., Fichtner, E., Morgan, D. P., & Michailides, T. J. (2013). First report of Lasiodiplodia citricola and Neoscytalidium dimidiatum causing death of graft union of english walnut in California. Plant Disease, 97(7), 993. doi: 10.1094/PDIS-10-12-1000-PDN [ Links ]
Crous, P. W., Slippers, B., Wingfield, M. J., Rheeder, J., Marasas, W. F. O., Philips, A. J. L., & Groenewald, J. Z. (2006). Phylogenetic lineages in the Botryosphaeriaceae. Studies in Mycology, 55, 235-253. Retrieved from http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2104729/ [ Links ]
El Atta, H. A., & Aref, I. M. (2013). Pathogenic mortality of Ficus spp. International Journal of Plant, Animal and Environmental Sciences, 3(1), 204-210. Retrieved from http://ijpaes.com/admin/php/uploads/295_pdf.pdf [ Links ]
Hassan, W. A., Haleem, R. A., & Hassan, P. H. (2011). Effect of heat-stress predisposition on the development of sooty canker caused by Neoscytalidium dimidiatum (Penz.) Crous & Slippers. Acta Agrobotanica, 64(4), 207-212. doi: 10.5586/aa.2011.062 [ Links ]
Jami, F., Slippers, B., Wingfield, M. J., & Gryzenhout, M. (2013). Greater Botryosphaeriaceae diversity in healthy than associated diseased Acacia karroo tree tissues. Australasian Plant Pathology, 42(4), 421-430. doi: 10.1007/s13313-013-0209-z [ Links ]
Kumar, S., Stecher, G., & Tamura, K. (2016). MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger data sets. Molecular Biology and Evolution, 36(7), 1870-1874. doi: 10.1093/molbev/msw054 [ Links ]
Liu, Y. J, Whelen, S., & Hall, B. D. (1999). Phylogenetic relationships among ascomycetes: evidence from an RNA polymerase II subunit. Molecular Biology and Evolution, 16(12), 1799-1808. Retrieved from https://pdfs.semanticscholar.org/489f/13d5c3ea5604ba263092a691dad6d71f84a7.pdf [ Links ]
Machado, A. R., Pinho, D. B., Oliveira, S. A. S., & Pereira, O. L. (2014). New occurrences of Botryosphaeriaceae causing black root rot of cassava in Brazil. Tropical Plant Pathology, 39(6), 464-470. doi: 10.1590/S1982-56762014000600008 [ Links ]
Mohd, M. H., Salleh, B., & Zakaria, L. (2013). Identification and molecular characterization of Neoscytalidium dimidiatum causing stem canker of red-fleshed dragon fruit (Hylocereus polyrhizus) in Malaysia. Journal of Phytopathology, 161, 841-849. doi: 10.1111/jph.12146 [ Links ]
Phillips, A. J. L., Alves, A., Abdollahzadeh, J., Slippers, B., Wingfield, M. J., Groenewald, J. Z., & Crous, P. W. (2013). The Botryosphaeriaceae: genera and species known from culture. Studies in Mycology, 76, 51-167. doi: 10.3114/sim0021 [ Links ]
Ray, J. D., Burgess, T., & Lanoiselet, V. M. (2010). First record of Neoscytalidium dimidiatum and N. novaehollandiae on Mangifera indica and N. dimidiatum on Ficus carica in Australia. Australasian Plant Disease Notes, 5(1), 48-50. doi: 10.1071/DN10018 [ Links ]
Sadowsky, A., Solel, Z., & Sztejnberg, A. (2007). Effect of heat-stress predisposition on the development of Scytalidium wilt of “Star Ruby” grapefruit, caused by Scytalidium lignicola. European Journal of Plant Pathology, 117(2), 123-127. doi 10.1007/s10658-006-9076-6 [ Links ]
Serrato, A., Ibarra-Manrriquez, G., & Oyama, K. (2004). Biogeography and conservation of the genus Ficus (Moraceae) in Mexico. Journal of Biogeography, 31(3), 475-485. doi: 10.1046/j.0305-0270.2003.01039.x [ Links ]
Slippers, B., & Wingfield, M. J. (2007). Botryosphaeriaceae as endophytes and latent pathogens of woody plants: diversity, ecology and impact. Fungal Biology Reviews, 21(2), 90-106. doi: 10.1016/j.fbr.2007.06.002 [ Links ]
Úrbez-Torres, J. R., Leavitt, G. M., Voegel, T. M., & Gubler, W. D. (2006). Identification and distribution of Botryosphaeria spp. Associated with grapevine cankers in California. Plant Disease, 90(12), 1490-1503. doi: 10.1094/PD-90-1490 [ Links ]
Vilgalys, R., & Hester, M. (1990). Rapid genetic identification and mapping of enzymatically amplified ribosomal DNA from several Cryptococcus species. Journal of Bacteriology, 172(8), 4238-4246. Retrieved from http://pubmedcentralcanada.ca/pmcc/articles/PMC213247/pdf/jbacter00122-0118.pdf [ Links ]
White, T. J., Bruns, T., Lee, S., & Taylor, W. J. (1990). Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis, M. A., Gelfand, D. H., Sninsky, J. J., & White, T. J. (Eds.), PCR Protocols: A Guide to Methods and Applications (pp. 315-322). New York: Academic Press, Inc. [ Links ]
Recibido: 14 de Febrero de 2017; Aprobado: 08 de Agosto de 2017











 texto em
texto em 


