Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo. Serie horticultura
versão On-line ISSN 2007-4034versão impressa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.23 no.3 Chapingo Set./Dez. 2017
https://doi.org/10.5154/r.rchsh.2016.11.028
Articles
Infección crónica del virus de la tristeza de los cítricos en árboles de Citrus sinensis / C. aurantium en un régimen térmico restrictivo en Yucatán
1Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias - Campo Experimental Valle de México. Carretera Los Reyes-Texcoco km 13.5, Coatlinchán, Texcoco, México, C. P. 56250, MÉXICO.
2Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias - Campo Experimental Mocochá. Carretera Mérida-Motul km 25, Mocochá, Yucatán. C. P. 97454, MÉXICO.
3Colegio de Postgraduados, Departamento de Fitopatología. Carretera México-Texcoco km 36.5, Montecillo, Texcoco, México, C. P. 56230, MÉXICO.
El virus de la tristeza de los cítricos (CTV) es un patógeno presente en casi todas las áreas citrícolas; el cual, reduce la producción en plantaciones con portainjertos susceptibles, como el naranjo agrio. El objetivo de este estudio fue caracterizar temporalmente el comportamiento del CTV considerando su estructura poblacional (EP), vigor, concentración en tejidos y disponibilidad de vectores. Esto último a partir del análisis de las condiciones térmicas en Yucatán. Se muestrearon y evaluaron en vigor durante 12 años los árboles de dos huertas de naranjo dulce (C. sinensis), injertados en agrio (C. aurantium) en Yucatán. Las muestras se analizaron por inmunoimpresión, polimorfismo de conformación de cadena simple (SSCP) y amplificaciones específicas por la reacción en cadena de la polimerasa (PCR) en punto final y tiempo real. La incidencia de CTV se incrementó 40 % en cuatro años. Todas las muestras analizadas (81) fueron negativas para aislados severos; solo se identificaron aislados tipo T-30 y cambios menores en el vigor de los árboles. La EP indicó cambios con tendencia a la complejidad (11 patrones electroforéticos en seis haplotipos), coeficiente de similaridad de 0.80 y diversidad intrapoblacional de 65 %. El régimen térmico (RT) fue restrictivo durante 75 % del año para la transmisión del CTV y el desarrollo óptimo de áfidos vectores. La EP del patógeno y el RT han contribuido a que no se registren epidemias severas de CTV; por lo cual, el naranjo agrio continúa como un elemento clave en la producción citrícola de la región con el riesgo que esto implica (comercializar material propagativo que no cumple la NOM 079-FITO-2002).
Palabras clave: aislado moderado; epidemia; patrón electroforético; vigor; Toxoptera citricida
The citrus tristeza virus (CTV) is a pathogen present in almost all citrus areas. It reduces production in plantations with susceptible rootstocks, such as sour orange trees. The aim of this study was to temporally characterize the behavior of CTV considering its population structure (PS), vigor, concentration in tissues and availability of vectors, this on the basis of an analysis of the thermal conditions in Yucatán. In two sweet orange (C. sinensis) orchards in Yucatán, trees grafted onto sour orange (C. aurantium) were sampled and evaluated in terms of vigor for 12 years. Samples were analyzed by immunoprinting, single-strand conformation polymorphism (SSCP), and specific amplifications by real-time and conventional polymerase chain reaction (PCR). The incidence of CTV increased 40 % in four years. All samples analyzed (81) were negative for severe isolates; only T-30 isolates and minor changes in tree vigor were identified. The PS indicated changes with a tendency towards complexity (11 electrophoretic patterns in six haplotypes), a similarity coefficient of 0.80 and intrapopulation diversity of 65 %. The thermal regime (TR) was restrictive during 75 % of the year for CTV transmission and the optimum development of vector aphids. Pathogen PS and TR have contributed to the fact severe CTV epidemics have not been recorded; therefore, sour orange continues as a key element in the region’s citrus production despite the risk involved (commercializing propagating material that does not comply with NOM 079-FITO-2002).
Keywords: moderate isolate; epidemic; electrophoretic pattern; vigor; Toxoptera citricida
Introducción
La tristeza de los cítricos es una enfermedad que ha tenido gran impacto en todas las regiones citrícolas del mundo, debido a la mortandad de casi 100 millones de árboles injertados en naranjo agrio (Bar-Joseph, Batuman, & Roistacher, 2010). El patógeno responsable es el virus de la tristeza de los cítricos (CTV, por sus siglas en inglés), un Closterovirus de cadena sencilla de RNA en sentido positivo de 20 kb, con 12 marcos abiertos de lectura y regiones no traducibles en las terminaciones 5’ y 3’ (Karasev, 2000). La especie del CTV está conformada por una colección de secuencias homólogas que varían entre sí hasta 4 %. Dentro de la población del CTV existen aislados con variantes de secuencia o haplotipos (Ayllón et al., 2006; Rubio et al., 2001). Cada aislado puede inducir síntomas diferentes (Herrera-Isidrón, Ochoa-Sánchez, Rivera-Bustamante, & Martinez-Soriano, 2009; Weng et al., 2007), o incluso ser asintomático (Bové, Vogel, Albertini, & Bové, 1988; Rivas-Valencia et al., 2010).
El CTV es transmitido de forma semipersistente por Aphis gossypii y Toxoptera citricida, entre otros áfidos (Yokomi et al., 1994). La transmisibilidad también puede ser específica (Hermoso-de Mendoza, Ballester-Olmos, & Pina-Lorea, 1984; Roistacher & Bar-Joseph, 1987), así como la capacidad para interferir con otros aislados de distinta virulencia (Costa & Müller, 1980; van Vuuren, Collins, & da Graça, 1993). Como en otros sistemas biológicos, la abundancia de los vectores, la tasa de replicación viral y su transmisión son modificadas sensiblemente por las condiciones ambientales (Hermoso-de Mendoza et al., 1984; Raccah, Loebenstein, & Bar-Joseph, 1976). Entre los elementos climáticos más estudiados sobresalen la temperatura, humedad relativa y precipitación pluvial (Piyaratne et al., 2014; Wallin & Loonan, 1971). La temperatura ideal para el ciclo biológico de los vectores, y la replicación y transmisión del virus está entre 20 y 26 °C (Garnsey et al., 2005; Raccah et al., 1976; Yokomi & de Borde, 2005).
En México, las primeras detecciones del CTV se realizaron en Tamaulipas (1983) y Veracruz (1986) (Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación [SAGARPA], 2001). Hasta 2007, la Dirección General de Sanidad Vegetal detectó y eliminó plantas infectadas (Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria [SENASICA], 2014). Sin embargo, a pesar de la erradicación de los focos iniciales, la dispersión de la enfermedad ha continuado (Góngora-Canul et al., 2005; Rivas-Valencia et al., 2010; Ruiz-García et al., 2009; Silva-Vara et al., 2001). Actualmente, T. citricida, se encuentra en 18 estados citrícolas (SENASICA, 2014), con riesgo de provocar epidemias severas de tristeza de los cítricos. La prevalencia de aislados de CTV en Yucatán ha sido de tipo moderado (Rivas-Valencia et al., 2010); mientras que infecciones severas se han detectado en Nuevo León, Colima, Baja California, Veracruz y Tamaulipas (Herrera-Isidrón et al., 2009; Loeza-Kuk et al., 2005; Mendoza, Salazar, Alvarado, Cruz, & Barrera, 2003; Silva-Vara et al., 2001).
En Yucatán, con la llegada de T. citricida en el 2000 (Michaud & Álvarez, 2000), se pronosticó un incremento de aislados y síntomas severos de CTV como en otros países (Halbert et al., 2004; Matos et al., 2013); sin embargo, éstos no se han detectado. Se desconoce si la ausencia de síntomas graves está ligada a las condiciones climáticas locales que enmascaran a los aislados severos. En este sentido, fue necesario realizar un estudio a largo plazo para detectar los cambios en la estructura poblacional ligada a la replicación del virus, los efectos productivos en el hospedante, la supervivencia del vector, dispersión y el componente climático que ofrezcan información relevante para el manejo, control y predicción de la expresión epidémica del CTV.
Por lo anterior, el objetivo de este estudio fue caracterizar temporalmente el comportamiento del CTV, considerando su estructura poblacional (EP), vigor, concentración en tejidos y disponibilidad de vectores. Esto último a partir del análisis de las condiciones térmicas en Yucatán.
Materiales y métodos
Ubicación del área de estudio
En octubre de 2009 y noviembre de 2010 y 2014 se realizaron muestreos en dos huertas comerciales de cítricos: Cabaché 2 (20° 20’ 25.8’’ latitud norte y 89° 26’ 48.2’’ longitud oeste) y Unión 2 (20° 20’ 26.2’’ latitud norte y 89° 26’ 21’’ longitud oeste), ubicadas en Ticul, municipio de Yucatán, México; ambas huertas con incidencia de CTV desde el 2002 y con 25 años de edad.
Muestreo y detección del CTV
El muestreo realizado en Cabaché 2 fue restrictivo a 24 hileras por 24 árboles y en Unión 2 fue de 9 hileras por 24 árboles, con la finalidad de detectar nuevos positivos a CTV y actualizar el registro iniciado en 2003 (Rivas-Valencia et al., 2010). El material colectado consistió en brotes jóvenes obtenidos de los cuatro puntos cardinales del árbol a 1.50 m de altura almacenándose en refrigeración a 4 oC hasta su procesamiento en laboratorio. La detección de árboles positivos a CTV se realizó con inmunoimpresión ELISA-directa (Plant Print Diagnostics SL. y Agdia S.C.), de acuerdo con el procedimiento de Ruiz-García et al. (2009).
Caracterización molecular y estructura poblacional de CTV
Extracción de RNA
Se utilizaron 100 mg de nervadura fresca de cada muestra para la extracción de RNA total con Trizol® Reagent (Invitrogen™), según protocolo del fabricante.
Para la reacción en cadena de la polimerasa (PCR, por sus siglas en inglés), se obtuvo cDNA por reverso transcripción con hexámeros, se amplificó una parte del gen p25 que codifica a la capa proteica (CP) (273 pb; Cuadro 1) y se analizó en gel de agarosa (Kong, Rubio, Polek, & Falk, 2000). Los productos de la PCR se sometieron a polimorfismo de conformación de cadena simple (SSCP, por sus siglas en inglés), que permite detectar a la mayoría de las variantes de secuencia sin recurrir a procedimientos de clonación para separarlos, especialmente cuando existe una secuencia dominante (Iglesias et al., 2008). Se tomaron 5 µl del producto de la amplificación y se desnaturalizaron por 10 min a 99 oC en una solución que contenía 95 % formamida, 20 mM EDTA, bromofenol azul y xilen-cianol. Los fragmentos se separaron mediante electroforesis en gel de poliacrilamida al 12 % en una cámara Bio-Rad Protean II® con amortiguador TBE 1x a 200 v por 2 h 30 min a temperatura ambiente. El gel se tiñó con plata según el protocolo de Beidler, Hilliard, y Rill (1982).
Cuadro 1 Iniciadores utilizados para detección y caracterización de aislados del virus de la tristeza de los cítricos en Yucatán.

z R = A o G, K = T o G, FAM = 6-carboxyfluorescein), Cy5 = cyanine-5, TET = tetraclorofluorescein.
Prefijo pro indica sondas marcadas para la identificación de aislados en PCR tiempo real. §Citrocromo oxidasa, control interno de reacción.
Análisis de patrones electroforéticos
Para comparar las diferencias entre los patrones electroforéticos, se construyó una matriz con vectores de presencia (1) y ausencia (0) de señal de bandas de SSCP a partir del coeficiente de Nei y Li (Nei & Li, 1979). Se generó un dendrograma por el método de promedio aritmético de grupos de pares no ponderados (UPGMA, por sus siglas en inglés) usando el programa NTSYSpc ver. 2.10L y se realizó un análisis de varianza molecular con el programa GenAlEx 6.5 (Peakall & Smouse, 2012).
PCR selectiva
Adicionalmente, el cDNA de las muestras se procesó para diferenciar aislados de tipo T-385 (moderado; iniciadores PM34/RF137) y T-36 (severo; iniciadores PM35/RF137) (Cuadro 1; Ayllón et al., 2001).
El mismo cDNA obtenido se sometió a la PCR en tiempo real (qPCR) para diferenciar aislados tipo T-30 y T-36 (Cuadro 1; Ananthakrishnan, Venkataprassana, Roy, & Brlansky, 2010) y determinar la concentración relativa de los aislados presentes en la planta. El volumen de reacción final fue de 25 μL que contenía buffer PCR 1X, 2.5 mM de MgCl2, 100 nM dNTPs, 200 nM de iniciadores y sonda para T-30 (para T-36 se usaron 100 nM), 100 nM de iniciadores para citocromo oxidasa de cítricos (COX), 50 nM de sonda COX (control interno) y 1U de Taq DNA polimerasa (Invitrogen™). Las reacciones se realizaron en un termociclador SmartCycler® (Cepheid) con perfil de 90 s, 40x (94 oC, 30 s y 60 oC, 90 s).
Registro fotográfico y evaluación de vigor
El registro fotográfico digital de los árboles positivos se realizó en 2004, 2006, 2009 y 2015 (con Samsung® L200). La evaluación del vigor de los árboles se realizó con una escala diagramática que toma en cuenta el vigor de las ramas primarias y secundarias considerando densidad foliar, aspecto y coloración de hojas para relacionarla con la presencia de patógenos, con énfasis en CTV (Figura 1).
Análisis climático
Se analizó la temperatura máxima y mínima, así como la precipitación acumulada. Se generó un índice de oscilación térmica diaria e índice de días con condiciones favorables para el patosistema tristeza de los cítricos, con datos diarios de 1966 a 2014 de la estación climática convencional Dzan (Comisión Nacional del Agua - Servicio Meteorológico Nacional [CONAGUA-SMN]) localizada a 4.3 km del área de estudio. Además, se usaron datos de temperatura mínima y máxima de cada 15 min de 2014 de la estación meteorológica automatizada de Maní localizada a 5.5 km de las huertas pertenecientes al Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP).
Resultados y discusión
Muestreo y detección de árboles positivos a CTV
En 2009 y 2010, se realizaron 3,712 impresiones en Cabaché 2 y 1,728 en Unión 2 para la detección de CTV. Todos los árboles muestreados estaban injertados en naranjo agrio (Citrus aurantium L.). En Cabaché 2, se detectó un incremento de 40 % de árboles positivos (83 árboles), con respecto a lo encontrado en 2006 por Rivas-Valencia et al. (2010). En Unión 2, se detectaron siete árboles positivos que no fueron consistentes entre fechas (datos no mostrados). En 2014, se muestrearon 95 árboles, incluyendo aquellos con registro histórico negativo a CTV como controles, de los cuales 81 fueron positivos y 14 negativos (Cuadro 2). En huertas de Nuevo León con la misma combinación variedad/portainjerto, se observó una dispersión anual de 0.27 y 0.19 % (Silva-Vara et al., 2001), lo cual comparativamente es menor a lo estimado en Yucatán (10 %).
Cuadro 2 Número de árboles positivos al virus tristeza de los cítricos por inmunoimpresión y porcentaje de incidencia en dos huertas comerciales de Ticul, Yucatán, México.
| Huerta § | 2002 | 2003 | 2004 | 2006 | 2009-2010 | 2014 | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| CTV z | CTV | Y (%) | CTV | Y (%) | CTV | Y (%) | CTV | Y (%) | CTV | |
| Cabaché 2 | 9 | 11 | 4.04 | 46 | 16.91 | 49 | 18.01 | 83 | 17.62 | 81 |
| Unión 2 | 1 | 0.2 | - | - | - | - | - | 7 | 3.24 | - |
§ Huerta mixta (chicozapote, mamey, aguacate, plátano y coco) con arreglo topológico irregular.
zCTV = virus de la tristeza de los cítricos, Y = incidencia absoluta restrictiva.
Para 2014, solo se muestrearon los árboles positivos detectados en 2009 y 2010.
Caracterización molecular y estructura poblacional
Todas las muestras positivas por inmunoimpresión amplificaron parte del gen p25 de la CP del CTV (81 muestras; Figura 2A). Los aislados sometidos a la PCR selectiva fueron moderados (81). La PCR en tiempo real confirmó la prevalencia de aislados moderados de tipo T-30 y presentaron una concentración de partículas virales baja, con una media de Ct (threshold cycle) de 25.6 ± 2.94 (Cuadro 3). Esta variación es dependiente del tipo de aislado, tiempo de infección, especie de cítrico y el vigor de los árboles; además de la temperatura que limita la replicación del virus. En condiciones cálidas, el CTV reduce su tasa de replicación; sin embargo, el efecto es menor en aislados moderados (Targon et al., 2005), por lo que son capaces de superar, en la ocupación de nichos de infección, a los aislados severos.

Figura 2 A) Electroforesis en agarosa (1 %) de amplicones parciales de p25 del virus de la tristeza de los cítricos (CTV) (273 pb), B) y C) polimorfismo de conformación de cadena simple (SSCP) en poliacrilamida al 12 % con fragmentos del gen p25 del CTV de aislamientos de Cabaché 2 (2010 y 2014), Yucatán, México.Los números romanos indican el tipo de patrón electroforético.
Cuadro 3 Vigor histórico de árboles positivos al virus de la tristeza de los cítricos y concentración de copias de T-30 en Cabaché 2, Ticul, Yucatán, México.
| Árbol | Vigor | Ct z | Árbol | Vigor | Ct | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 2004 | 2006 | 2010 | 2015 | 2004 | 2006 | 2010 | 2015 | ||||
| L1-A11 | 2a | 2 | 2 | 2 | 25.95§ | L6-A4 | 1 | 1 | 1 | - | 24.90 |
| L1-A12 | 3 | 3 | 4 | 4 | 25.28 | L6-A5 | 1 | 1 | 1 | - | 25.95 |
| L1-A14 | 2 | 3 | 3 | 4 | 23.86 | L6-A17 | 1 | 1 | - | 1 | 27.50 |
| L1-A17 | 1 | 1 | 1 | 1 | 26.76 | L7-A12 | - | - | - | - | 32.91 |
| L1-A18 | 2 | 2 | 1 | * | 24.65 | L8-A3 | 2 | 2 | 2 | - | 29.66 |
| L2-A11 | 2 | 2 | 2 | * | 31.99 | L8-A4 | 2 | 2 | 2 | - | 28.27 |
| L2-A17 | 1 | 2 | 2 | 2 | 27.91 | L9-A2 | 2 | 2 | 2 | - | 28.61 |
| L3-A9 | 1 | 1 | 1 | 2 | 26.57 | L9-A3 | 2 | - | - | - | 26.56 |
| L3-A12 | 2 | 2 | 2 | 3 | 28.90 | L9-A5 | - | 2 | 2 | - | 23.56 |
| L3-A14 | 2 | 2 | 2 | 2 | 25.60 | L9-A6 | 1 | 1 | 1 | 1 | 25.99 |
| L3-A15 | 2 | 2 | 2 | 3 | 25.94 | L11-A5 | - | 1 | 1 | - | 28.44 |
| L3-A16 | 1 | 1 | 1 | 1 | 25.70 | L11-A14 | - | 1 | 1 | 1 | 22.50 |
| L4-A9 | 2 | - | - | - | 27.74 | L12-A11 | 1 | 1 | 1 | 1 | 23.23 |
| L6-A3 | 2 | 2 | 2 | - | 23.60 | L12-A14 | 1 | 1 | 1 | 1 | 20.90 |
z CT = threshold cycle.
*Solo portainjerto vivo.
§Valores < 22 concentración alta y > 25 concentración baja.
a1 = excelente, 2 = bueno, 3 = malo, 4 = muy malo y 5 = muerto.
La EP en 2009-2010 con SSCP mostró patrones electroforéticos (PE) con mayor número de bandas (12), que representan al menos seis haplotipos en un mismo árbol (Figura 2B). En 2014, se detectaron hasta 10 bandas, representadas en 11 PE con al menos cinco haplotipos (Figura 2C). Lo anterior muestra la dinámica en el patosistema con cambios temporales de la EP, pero no así de prevalencia. Rivas-Valencia et al. (2010) encontraron, en esta misma huerta en 2006, tres patrones de hasta tres bandas; es decir, una combinación de hasta dos haplotipos por aislado. Con el análisis de SSCP se determinó la existencia de secuencias dominantes tipo T-30.
El dendrograma construido a partir de la ausencia y presencia de bandas separó los aislados en cuatro grupos, con un coeficiente de similaridad de 0.80 (Figura 3). La proporción de aislados para los grupos I, II, III y IV fue de 13.6, 39.7, 13.63 y 32.95 %, respectivamente. Aislados provenientes de otra área geográfica de la península se ubicaron en el grupo IV, que indica un origen común para las dos poblaciones.
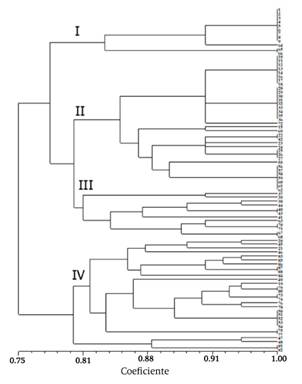
Figura 3 Dendrograma obtenido de 88 perfiles electroforéticos de aislados del virus de la tristeza de los cítricos (CTV), Yucatán, México. Se incluyeron siete aislados de un origen geográfico diferente.
El análisis de varianza mostró que dentro de las poblaciones hay mayor diversidad (65 %) que entre ellas (35 %; Cuadro 4); esto de acuerdo con el número de patrones electroforéticos (11) y de haplotipos (cinco) encontrados. Estudios previos, revelaron que la diversidad genómica dentro y entre los aislados del CTV se atribuye a cierta patogenicidad (Albiach-Martí et al., 2010; Papaylannis, Santos, Kyriakou, Kapari, & Nolasco, 2007); la cual depende de la estructura de la población del CTV presente (Kong et al., 2000).
Cuadro 4 Análisis de varianza molecular de patrones electroforéticos obtenidos de un fragmento del gen p25 (273 pb) de aislados originarios de Yucatán, México (2014).
| Fuentes de variación | GL z | Estimadores de varianza | Variación (%) | Significancia* |
|---|---|---|---|---|
| Entre poblaciones | 1 | 1.50 | 35 | 0.35 |
| Dentro de poblaciones | 86 | 2.78 | 65 | -- |
z GL = grados de libertad.
*Probabilidad de ocurrencia de valores de varianza de probabilidad estadística más extremos a los observados (P ≤ 0.05).
Evaluación de vigor de árboles con infección crónica
El registro fotográfico en 2004, 2006, 2009 y 2015 fue de 46, 49, 83 y 37, respectivamente. A lo largo de los 12 años, el vigor de los árboles infectados presentó diferentes grados de deterioro (Figura 4).

Figura 4 Vigor de árboles positivos al virus de la tristeza de los cítricos (CTV). A) 2004, B) 2009 y C) 2015. Huerta comercial de Ticul, Yucatán, México.
La interacción entre especies de cítricos y aislados con diferente severidad se ha estudiado ampliamente (Albiach-Martí et al., 2000). En este estudio, la respuesta de los árboles a la infección del CTV mostró pocos cambios, en concordancia con una infección por aislados moderados. Asimismo, los árboles con aspecto vigoroso y saludable mostraron mayor concentración relativa de CTV. La concentración de partículas virales en árboles con vigor 1 fue similar (Cuadro 3) a plantas jóvenes de C. aurantifolia confinadas en invernadero (Ct = 23); mientras que en árboles menos vigorosos, la concentración viral fue menor (Ct = 27). De manera general, la concentración viral detectada fue baja al compararse con plantas de C. aurantifolia mantenidas a 28 °C (Ananthakrishnan et al., 2010).
Caracterización regional climática
El climograma de la Figura 5A indicó que el área de estudio posee un clima tipo Aw1(w’’)(i’)g (García, 1998), que corresponde a cálido subhúmedo intermedio con sequía interestival, poca oscilación térmica y marcha anual de la temperatura tipo Ganges. Este no es un clima común en el que se desarrollan y expresan los aislados tipo severo, excepto en Florida, E.U.A. (Cuadro 5). En Tamaulipas, aún y cuando la incidencia de aislados de tipo severo fue registrada, en años posteriores no fue posible detectarlos nuevamente (Rivas-Valencia et al., 2010); lo cual indica el efecto de la temperatura en los aislados severos.
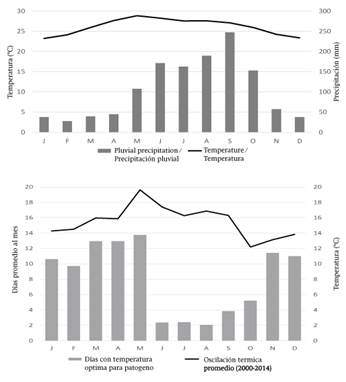
Figura 5 A) Climograma de la zona de estudio (1966-2014) y B) oscilación térmica diaria (línea) y horas apropiadas diarias (barras) para el virus de la tristeza de los cítricos (CTV).Generado con datos de la estación climatológica convencional 31009-Dzan, CONAGUA-SMN y EMA-Maní-INIFAP.
Cuadro 5 Clima y condición térmica de sitios con incidencia de aislados severos del virus de la tristeza de los cítricos.
| Sitio | Tipo de aislado de CTV z | Clima § | OT anual | OT mensual | Clasificación de la OT | Cita |
|---|---|---|---|---|---|---|
| Dzan, Yucatán, México | NS* | Aw1w’’(i’)g | 5.6 | 14.5 | ME | |
| Mante, Tamaulipas, México | S | Aw0w’’(e’) | 10.8 | 13.5 | E | Loeza-Kuk et al. (2005) |
| Cundinamarca, Bogotá, Colombia | S | Cb’(w2)(x’)w’’ig | 1.45 | 8.5 | E | Oliveros-Garay, Martínez-Salazar, Torres-Ruiz, y Acosta (2009) |
| Meta, Villavicencio, Colombia | S | Am(i)g | 2.7 | 9.4 | E | |
| Ora, Salta, Argentina | S | (A)Ca(w2)(w)w’’(e) | 11.6 | 11.3 | E | Iglesias et al. (2008) |
| Montecasero, Corrientes, Argentina | S | (A)Ca f w’’(e) | 13.5 | 10.7 | E | |
| Entre Ríos, Concordia, Argentina | S | (A)Ca(fm)w’’(e’) | 14.1 | 11.7 | E | |
| Tucuman, Alta Gracia, Argentina | S | (A)Ca(w2)(w)(e) | 13.2 | 11.6 | E | |
| Jujuy, Calilegua, Argentina | S | (A)Ca(w0)(w)(e) | 12.2 | 12.6 | E | |
| Sharon plain, Tel Aviv, Israel | S | (A)Ca s(e) | 13 | 7.8 | E | Marcus, Salomon, y Bar-Joseph (1987) |
| Seferihisar, Izmir, Turquía | S | Ca s(e’) | 18.9 | 9.2 | E | Çevik, Yardimci, y Korkmaz (2013) |
| Kastela, Split, Croacia | S | Ca s(e’) | 18 | 6.4 | E | Černi et al. (2005) |
| Immokalee, Florida, Estados Unidos | S | Aw1(x’)w’’(e) | 10.5 | 10.1 | E | Halbert et al. (2004) |
Datos obtenidos del World Meteorological Organization (WMO, 2016).
zCTV = virus de la tristeza de los cítricos, OT = oscilación térmica.
*NS = aislado no severo, S = aislado severo, I = isotermal, E = extremoso, ME = muy extremoso.
§Climas clasificados según García (1998).
En la marcha anual de la temperatura, enero presenta el promedio menor de las temperaturas mínimas mensuales (ptmm) con 15.7 °C; mientras que en junio el ptmm alcanza su máximo valor con 21.4 °C. De manera análoga, en enero se presenta el promedio menor de temperaturas máximas mensuales (PTMM) con 30.8 °C; mientras que en mayo alcanza su valor máximo con 36.8 °C. Esta variación se traduce frecuentemente en una oscilación térmica diaria (OT) muy extremosa, que en mayo alcanza 19.6 °C (Figura 5B). Estas condiciones son restrictivas durante la mitad del año para los componentes involucrados en el patosistema estudiado. Aunque Florida comparte un clima similar con Yucatán, en los sitios con expresión de aislados severos, la oscilación térmica mensual se define como extremosa (Cuadro 5).
El CTV depende de los áfidos involucrados para la transmisión; sin embargo, éstos pierden su capacidad reproductiva a 30 °C. Los valores de mayor fecundidad y tasa reproductiva neta de T. citricida, A. spiraecola y A. gossypii se registran a 20 °C (Komasaki, 1982). Toxoptera citricida presenta un comportamiento similar; a 20 °C una hembra puede generar 52 individuos, mientras que a 32 °C genera siete y la sobrevivencia se desploma a 29 % (Tsai & Wang 1999).
En Yucatán, las temperaturas favorables para el patosistema se alcanzan parcialmente de octubre a diciembre y de enero a marzo; lo cual coincide con lo reportado por Patiño-Arellano, Rodríguez-Leyva, Mora-Aguilera, Lomelí-Flores, y Díaz-Gómez (2012), donde la abundancia de las poblaciones de T. citricida, T. aurantii, A. spiraecola y A. gossypii se concentra en esos meses. Aun así, en este intervalo la OT es extremosa (10 a 14 °C), o eventualmente muy extremosa (> 14 °C; Figura 5B). Estos valores son un factor de estrés, incluso más importante que las temperaturas mínimas y máximas per se. Estudios del impacto de OT extremosas revelan un aumento en la mortalidad de otros insectos (Ma, Hoffmann, & Ma, 2015), sobre todo cuando las temperaturas máximas ambientales exceden las críticas letales para el insecto (Chanthy, Martin, Gunning, & Andrew, 2012).
En Yucatán, los meses con el mayor número de horas propicias para los áfidos y el virus (>22 <31 °C) son de noviembre a mayo, y pudiera sugerir presencia de éstos durante toda la época. Sin embargo, la OT también se incrementa desde marzo hasta septiembre con valores superiores a 16 °C. Los cítricos en la región (especialmente C. latifolia) presentan flujos de brotación elevados en febrero, mayo, agosto, diciembre y uno pequeño en noviembre (Lomas-Barrié, Loeza-Kuk, Cicero-Jurado, Sanchez-Borja, & Arredondo-Bernal, 2015). Es decir, existe alimento suficiente y nichos de colonización para los áfidos, pero no son capaces de aprovechar las brotaciones por factores climáticos.
El régimen térmico de la región también modifica la transmisión del virus, que se maximiza a 22 ± 2 °C (60.8 %) y reduce a 31 °C (12.2 %) (Bar-Joseph & Loebenstein, 1973; Raccah et al., 1976).
En este estudio se muestra que la estructura poblacional del CTV está compuesta por aislados moderados del tipo T-30. Esta prevalencia permite la convivencia del virus con los árboles infectados, aún con la presencia de T. citricida, lo cual no ha ocurrido en otras áreas productoras (Matos et al., 2013). Sin embargo, lo anterior no exime que la estructura pueda ser modificada por aislados severos como T-36 o VT, como en otras áreas de producción (da Graça & van Vuuren, 2010; Roistacher, da Graça, & Müller, 2010). En República Dominicana, en 10 años los aislados tipo T-30 fueron desplazados por T-36 y VT, introducidos por el intercambio de material propagativo infectado (Matos et al., 2013). En Yucatán, el uso de naranjo agrio como portainjerto es un factor de riesgo en dos sentidos: 1) por su susceptibilidad a CTV y 2) por el origen y calidad desconocidos del material propagativo empleado, que en ocasiones no cumplen con la NOM-079-FITO-2002 (SAGARPA 2002).
Conclusiones
En los arboles de las huertas estudiadas se identificaron cambios en la estructura poblacional del patógeno; sin embargo, no se encontraron síntomas ni aislados severos de CTV, ni tampoco un detrimento importante en el vigor de los árboles positivos. No obstante, la dispersión del CTV se incrementó 40 % en cuatro años. Entre las variables climáticas, la oscilación térmica diaria y el número de horas propicias para el patosistema, operan en detrimento de este y reducen su impacto, haciendo de esto un régimen térmico restrictivo. Estas condiciones han permitido que el portainjerto de naranjo agrio persista entre la preferencia de los productores. Sin embargo, es necesario proveer de alternativas de portainjertos, debido al riesgo que existe en la comercialización de material propagativo que no cumple con la normatividad.
References
Albiach-Martí, M. R., Mawassi, M., Godwa, S., Satyanarayana, T., Hilf, M. E., Shanker, S.,… Dawson, W. O. (2000). Sequences of citrus tristeza virus separated in time and space are essentially identical. Journal of Virology, 74(15), 6856-6865. doi: 10.1128/JVI.74.15.6856-6865.2000 [ Links ]
Albiach-Martí, M. R., Robertson, C., Gowda, S., Tatineni, S., Belliure, B., Garnsey, S. M., Folimonova, S. Y., Moreno, P., & Dawson, W. O. (2010). The pathogenicity determinant of Citrus tristeza virus causing the seedling yellows syndrome maps at the 30-terminal region of the viral genome. Molecular Plant Pathology, 11(1), 55-67. doi: 10.1111/j.1364-3703.2009.00572.x [ Links ]
Ananthakrishnan, G., Venkataprassana, T., Roy, A., & Brlansky, R. H. (2010). Characterization of the mixture of genotypes of a citrus tristeza virus isolate by reverse transcription-quantitative real-time PCR. Journal of Virological Methods, 164(1-2), 75-82. doi: 10.1016/j.jviromet.2009.12.001 [ Links ]
Ayllón, M. A., López, C., Navas-Castillo, J., Garnsey, S. M., Guerri, R., Flores, R., & Moreno, P. (2001). Polymorphism of the 5’ terminal region of citrus tristeza virus (CTV) RNA: Incidence of three sequences types in isolates of different origin and pathogenicity. Archives of Virology, 146(1), 27-40. doi: 10.1007/s007050170188 [ Links ]
Ayllón, M. A., Rubio, L., Sentandreu, V., Moya, A., Guerri, J., & Moreno, P. (2006). Variations in two gene sequences of Citrus tristeza virus after host passage. Virus Genes, 32(2), 119-128. doi: 10.1007/s11262-005-6866-4 [ Links ]
Bar-Joseph, M., & Loebenstein, G. (1973). Effects of strain, source plant, and temperature on the transmissibility of citrus tristeza virus by the melon aphid. Phytopathology, 63, 716-720. [ Links ]
Bar-Joseph, M., Batuman, O., & Roistacher, C. N. (2010). The history of Citrus tristeza virus-revisited. In: Karasev, A. V., & Hilf, M. E. (Eds.), Citrus Tristeza Virus complex and tristeza diseases (pp. 3-26). St. Paul, MN, USA: APS Press. [ Links ]
Beidler, L. L., Hilliard, P. R., & Rill, R. L. (1982). Ultrasensitive staining of nucleic acids with silver. Analytical Biochemical, 126(2), 374-380. doi: 10.1016/0003-2697(82)90530-9 [ Links ]
Bové, C., Vogel, R., Albertini, D., & Bové, J. M. (1988). Discovery a strain of tristeza virus (K) inducing no symptoms in Mexican lime. In: Timmer, L. W., Garnsey, S. M., & Navarro, L. (Eds.), Procceedings10 th IOCV Conference (pp. 14-16). Riverside, CA, USA: International Organization of Citrus Virologists and University of California. Retrieved from http://iocv.org/proceedings/ten/10th014_016.pdf [ Links ]
Chanthy, P., Martin, R. J., Gunning, R. V., & Andrew, N. R. (2012). The effects of thermal acclimation on lethal temperatures and critical thermal limits in the green vegetable bug, Nezara viridula (L.) (Hemiptera: Pentatomidae). Frontiers in Physiology, 3, 1-8. doi: 10.3389/fphys.2012.00465 [ Links ]
Çevik, B., Yardimci, N., & Korkmaz, S. (2013). The first identified citrus tristeza virus isolate of Turkey contains a mixture of mild and severe strains. Plant Pathology Journal, 29(1), 31-41. doi: 10.5423/PPJ.OA.09.2012.0141 [ Links ]
Černi, S., Škorić, D., Krajačić, M., Gatin, Ž., Santos, C., Martins, V., & Nolasco, G. (2005). Occurrence of stem-pitting strains of citrus tristeza virus in Croatia. Plant Disease, 89(3), 342. doi: 10.1094/PD-89-0342B [ Links ]
Costa, A. S., & Müller, G. W. (1980). Tristeza control by cross protection: a U.S.-Brazil cooperative success. Plant Disease, 64(6), 538-541. Retrieved from https://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web&cd=2&cad=rja&uact=8&ved=0ahUKEwjXqbCGlbTVAhWM6SYKHZhrAnoQFggzMAE&url=https%3A%2F%2Fwww.apsnet.org%2Fpublications%2FPlantDisease%2FBackIssues%2FDocuments%2F1980Articles%2FPlantDisease64n06_538.PDF&usg=AFQjCNFHPYQS7ihpHpRy8QGQInx4k9E9Lw [ Links ]
Da Graça, J. V., & van Vauuren, S. P. (2010). Mananging Citrus tristeza virus losses using crop protection. In: Karasev, A. V., & Hilf, M. E. (Eds.), Citrus tristeza virus complex and tristeza diseases (pp. 247-260). St. Paul, MN, USA: APS Press . [ Links ]
García, E. (1998). Modificaciones al sistema de clasificación climática de Köppen. México: Instituto de Geografía - Universidad Nacional Autónoma de México. Retrieved from http://www.igeograf.unam.mx/sigg/utilidades/docs/pdfs/publicaciones/geo_siglo21/serie_lib/modific_al_sis.pdf [ Links ]
Garnsey, S. M., Civerolo, E. M., Gumpf, D. J., Paul, C., Hilf, M. E., Lee, R. F., Brlansky, R. H., & Yokomi, R. K. & Hartung, J. S. (2005). Biological characterization of an international collection of Citrus tristeza virus (CTV) isolates. In: Timmer, L. W., Garnsey, S. M., & Navarro, L. (Eds.), Sixteenth IOCV Conference(pp. 75-93). Riverside, CA, USA: International Organization of Citrus Virologists and University of California . Retrieved from https://www.researchgate.net/publication/267793201_Biological_Characterization_of_an_International_Collection_of_Citrus_tristeza_virus_CTV_Isolates. [ Links ]
Góngora-Canul, C., Mora-Aguilera, G., Ruiz-García, N., Rivas-Valencia, P., Loeza-Kuk, E., Ochoa-Martínez, D. L., & Álvarez-Ramos, R. (2005). Epidemiology of Citrus tristeza virus in Mexico: Spatial Patterns, and Sampling. In: Hilf, M. E., Duran-Vila, A., & Rocha-Peña, M. A. (Eds.), Proceedings of the sixteenth conference of the International Organization of Citrus Virologists (pp. 495). Riverside, CA, USA: International Organization of Citrus Virologists and University of California . Retrieved from http://iocv.org/proceedings/sixteen/i-xx%20IOCV%2016.pdf [ Links ]
Halbert, S. E., Genc, H., Cevik, B., Brown, L. G., Rosales, I. M., Manjunath, K. L., …Niblett, C. L. (2004). Distribution and characterization of Citrus tristeza virus in south Florida following establishment of Toxoptera citricida. Plant Disease, 88(9), 935-941. doi: 10.1094/PDIS.2004.88.9.935 [ Links ]
Hermoso-de Mendoza, A., Ballester-Olmos, J. F., & Pina-Lorea, J. A. (1984). Transmission of citrus tristeza virus by aphids (Homoptera, Aphididae) in Spain. In: Garnsey, S. M., Timmer, L. W., & Dodds, J. A. (Eds.), Proceedings 9th IOCV Conference(pp. 23-27). Riverside, CA, USA: International Organization of Citrus Virologists and University of California . Retrieved from http://iocv.org/proceedings/nine/9th023_027.pdf [ Links ]
Herrera-Isidrón, L., Ochoa-Sánchez, J. C., Rivera-Bustamante, R., & Martínez-Soriano, J. P.(2009). Sequence diversity on four ORFs Citrus tristeza virus correlates with pathogenecity. Virology Journal, 6, 116. doi: 10.1186/1743-422X-6-116 [ Links ]
Iglesias, N. G., Gago-Zachert, S. P., Robledo, G., Costa, N., Plata, M. I., Vera, O., Grau, O., & Semorile, L. C. (2008). Population structure of Citrus tristeza virus from field Argentinean isolates. Virus Genes, 36(1), 199-207. doi: 10.1007/s11262-007-0169-x [ Links ]
Karasev, A. V. (2000). Genetic diversity and evolution of closteroviruses. Annual Review Phytopathology, 38, 293-324. doi: 10.1146/annurev.phyto.38.1.293 [ Links ]
Komasaki, S. (1982). Effects of constant temperatures on population growth of three aphid species, Toxoptera citricidus (Kirkaldy), Aphis citricola van der Goot and Aphis gossypii Glover (Homoptera: Aphididae) on citrus. Applied Entomology and Zoology, 17(1), 75-81. doi: 10.1303/aez.17.75 [ Links ]
Kong, P., Rubio, l., Polek, M., & Falk, B. W. (2000). Population structure and genetic diversity within California citrus tristeza virus (CTV) isolates. Virus Genes, 21(3), 139-145. doi: 10.1023/A:1008198311398 [ Links ]
Loeza-Kuk, E., Palacios-Torres, E. C., Ochoa-Martínez, D. L., Mora-Aguilera, G., Gutiérrez-Espinosa, M. A., Febres, V. J., Moore, G. A., & Alvarez-Ramos, R.(2005). Molecular characterization of some isolates of Citrus Tristeza Closterovirus from Veracruz and Tamaulipas. In: Hilf, M. E., Duran-Vila, A., & Rocha-Peña, M. A. (Eds.), Proceedings sixteenh IOCV Conference (pp. 407-411). Riverside, CA, USA: International Organization of Citrus Virologists and University of California . Retrieved from https://www.researchgate.net/publication/267417106_Molecular_Characterization_of_Citrus_tristeza_virus_Isolates_from_Veracruz_and_Tamaulipas_States_Mexico [ Links ]
Lomas-Barrié, C., Loeza-Kuk, E., Cicero-Jurado, L., Sanchez-Borja, M., & Arredondo-Bernal, H. (2015). Availability of Diaphorina citri nymphs for parasitism in regional control areas. In: Proceedings of the 69th annual meeting of the Subtropical Agriculture and Environment Society. Retrieved from http://www.subplantsci.org/wp-contents/uploads/2016/03/34-WESLACOClaudialomas-etal-arcos-Feb2015.pdf [ Links ]
Ma, G., Hoffmann, A., & Ma, C. S. (2015). Daily temperature extremes play an important role in predicting thermal effects. The Journal Experimental Biology, 218, 2289-2296. doi: 10.1242/jeb.122127 [ Links ]
Marcus, R., Salomon, R., & Bar-Joseph, M. (1987). The distribution of citrus tristeza virus in citrus groves in Israel. Journal of Applied Statistics, 14(1), 15-21. doi: 10.1080/02664768700000002 [ Links ]
Matos, L. A., Hilf, M. E., Cayetano, X. A., Feliz, A. O., Harper, S. J., & Folimonova, S. Y. (2013). Dramatic change in Citrus tristeza virus populations in the Dominican Republic. Plant Disease, 97(3), 339-345. doi: 10.1094/PDIS-05-12-0421-RE [ Links ]
Mendoza, A., Salazar, C., Alvarado, O., Cruz, M. A., & Barrera, H. (2003). Diferenciación molecular de razas severas y débiles de aislados del virus tristeza de los cítricos en México. Revista Fitotecnia Mexicana, 26(4), 223-230. Retrieved from https://www.revistafitotecniamexicana.org/documentos/26-4/2a.pdf [ Links ]
Michaud, J. P., & Alvarez-Ramos, R. (2000). First collection of brown citrus aphid (Homoptera: Aphididae) in Quintana Roo, Mexico. Florida Entomologist, 83(3), 357-358. doi: 10.1046/j.1365-2311.2000.00257.x [ Links ]
Nei, M., & Li, W. H. (1979). Mathematical model for studying genetic variation in terms of restriction endonucleases. Proceedings of the National Academy of Science, 76(10), 5269-5273. Retrieved from https://www.ncbi.nlm.nih.gov/pmc/articles/PMC413122/pdf/pnas00010-0529.pdf [ Links ]
Oliveros-Garay, O. A., Martínez-Salazar, N., Torres-Ruiz, Y., & Acosta, O. (2009). CPm gene diversity in field isolates of Citrus tristeza virus from Colombia. Archives of Virology, 154(12), 1933-1937. doi: 10.1007/s00705-009-0530-6 [ Links ]
Patiño-Arellano, S. A., Rodríguez-Leyva, E., Mora-Aguilera, G., Lomelí-Flores, R., & Díaz-Gómez, O. (2012). Composición y fluctuación de áfidos vectores del virus de la tristeza de los cítricos en la Península de Yucatán, México. Entomología Mexicana, 11, 370-374. Retrieved from: http://www.entomologia.socmexent.org/revista/entomologia/2012/EC/370-374.pdf [ Links ]
Papaylannis, L. C., Santos, C., Kyriakou, A., Kapari, T., & Nolasco, G. (2007). Molecular characterization of Citrus tristeza virus isolates from Cyprus on the basis of the coat protein gene. Journal of Plant Pathology, 89(2), 291-295. Retrieved from http://www.jstor.org/stable/41998393 [ Links ]
Peakall, R., & Smouse, P. E. (2012). GenAlEx 6.5: Genetic analysis in excel. Population genetic software for teaching and research-an update. Bioinformatics, 28(19), 2537-2539. doi: 10.1093/bioinformatics/bts460 [ Links ]
Piyaratne, M., Huiyan, Z., Zuqing, H., Xianghun, H., Yu, W., & Bailing, W. (2014). A model to analyze weather impact an aphid population dynamics: an application on swallowtail catastrophe model. European Scientific Journal, 10(18), 300-311. Retrieved from http://eujournal.org/index.php/esj/article/view/3599/3371 [ Links ]
Raccah, B., Loebenstein, G., & Bar-Joseph, M. (1976). Transmission of citrus tristeza virus by the melon aphid. Phytopathology, 66, 1102-1104. Retrieved from https://www.apsnet.org/publications/phytopathology/backissues/Documents/1976Articles/Phyto66n09_1102.PDF [ Links ]
Rivas-Valencia, P., Loeza-Kuk, E., Mora-Aguilera, G., Ruiz-García, N., Ochoa-Martínez, D. L., Gutiérrez-Espinosa, M. A., & Febres, V. (2010). Análisis espacio-temporal de aislados del Citrus tristeza virus de Yucatán y Tamaulipas. Revista Mexicana de Ciencias Agrícolas, 1(4), 493-507. Retrieved from http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2007-09342010000400004 [ Links ]
Roistacher, C. N., & Bar-Joseph, M. (1987). Transmision of Citrus tristeza virus (CTV) by Aphis gossypii and by graft inoculation to and from Passiflora spp. Phytophylactica, 19, 179-182. Retrieved from http://www.cabdirect.org/abstracts/19881107882 [ Links ]
Roistacher, C. N., da Graça, V. A., & Müller, G. W. (2010). Cross protection against Citrus tristeza virus - a review. In: Hilf, M. E., Milne, R. G., Timmer, L. W., & da Graça, J. V. (Eds.), Proceedings 17 th IOCV Conference (pp. 1-27). Riverside, CA, USA: International Organization of Citrus Virologists and University of California . Retrieved from http://iocv.org/proceedings/pr17/3.%20Roistacher.pdf [ Links ]
Rubio, L., Ayllón, M. A., Kong, P., Fernández, A., Polek, M. L., Guerri, J., Moreno, P, & Falk, B. W. (2001). Genetic variation of Citrus tristeza virus isolates from California and Spain: evidence for mixed infections and recombination. Journal of Virology, 75(17), 8054-8062. doi: 10.1128/JVI.75.17.8054-8062.2001 [ Links ]
Ruiz-García, N., Mora-Aguilera, G., Rivas-Valencia, P., Góngora-Canul, C., Loeza-Kuk, E., Ochoa-Martínez, D., Ramírez-Valverde, G., Gutiérrez-Espinosa, M. A., & Álvarez-Ramos, R. (2009). Sensibilidad de inmunoimpresión-ELISA y DAS-ELISA en el diagnostico del virus tristeza de cítricos en Tamaulipas, México. Revista Chapingo Serie Horticultura, 15(1), 41-47. doi: dx.doi.org/10.5154/r.rchsh.2009.15.006 [ Links ]
Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA). (2001). NOM-031-FITO 2000: Campaña contra el virus tristeza de los cítricos. México: Diario Oficial de la Federación. Retrieved from http://dof.gob.mx/nota_detalle.php?codigo=762092&fecha=10/08/2001 [ Links ]
Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA). (2002). NOM-079-FITO 2002: Requisitos y especificaciones fitosanitarias para la producción y movilización de material propagativo libre de virus tristeza y otras virosis asociadas a cítricos. México: Diario Oficial de la Federación. Retrieved from http://dof.gob.mx/nota_detalle.php?codigo=733575&fecha=22/05/2002 [ Links ]
Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria (SENASICA). (2014). Campaña contra plagas reglamentadas de los cítricos (Leprosis). Retrieved from: http://publico.senasica.gob.mx/includes/asp/download.asp?IdDocumento=26770&IdUrl=71706&objeto=Documento&IdObjetoBase=26770&down=true [ Links ]
Silva-Vara, S., Peña-del Río, M. A., Peña-Martínez, R., Villegas-Jiménez, N., Byerly-Murphy, K. F., & Rocha-Peña, M. A. (2001). Distribución del virus de la tristeza en tres plantaciones comerciales de cítricos del estado de Nuevo León, México. Agrociencia, 35, 441-450. Retrieved from http://www.redalyc.org/pdf/302/30235408.pdf [ Links ]
Targon, M. L. P. N., Coletta-Filho, H. D., de Souza, A. A., Cristofani, M., de Oliveira-Dorta, S., & Machado, M. A. (2005). Differentia expression of Citrus tristeza virus isolates in the host-interaction. In: Hilf, M. E., Duran-Vila, A., & Rocha-Peña, M. A. (Eds.), Proceedings 16th IOCV Conference. (pp. 493). Riverside, CA, USA: International Organization of Citrus Virologists and University of California . Retrieved from http://iocv.org/proceedings/sixteen/i-xx%20IOCV%2016.pdf [ Links ]
Tsai, J., & Wang, H. (1999). Life table study of brown citrus aphid (Homoptera: Aphididae) at different temperatures. Enviromental Entomology, 28(3), 412-419. doi: 10.1093/ee/28.3.412 [ Links ]
van Vuuren, S. P., Collins, R. P., & da Graça, J. V. (1993). Evaluation of citrus tristeza virus isolates for cross protection of grapefruit in South Africa. Plant Disease, 77(1), 24-28. doi: 10.1094/PD-77-0024 [ Links ]
Wallin, J. R., & Loonan, D. V. (1971). Low-level jet winds, aphid vectors, local weather and barley yellow dwarf virus outbreaks. Phytopathology, 61, 1068-1070. Retrieved from http://www.apsnet.org/publications/phytopathology/backissues/Documents/1971Articles/Phyto61n09_1068.PDF [ Links ]
Weng, Z., Barthelson, R., Gowda, S., Hilf, M. E., Dawson, W. O., Galbraith, D. W., & Xiong, Z. (2007). Persistent infection and promiscuous recombination of multiples genotypes of an RNA virus within a single host generate extensive diversity. Plos One, 2(9), e917. doi: 10.1371/journal.pone.0000917 [ Links ]
World Meteorological Organization (WMO). (2016). Database. Retrieved from http://worldweather.wmo.int [ Links ]
Yokomi, R. K., Lastra, R., Stoetzel, M. R., Damsteegt, V. D., Lee, R. F., Garnsey, S. M., Gottwald, T. R., Rocha-Peña, M. A., & Niblett, C. L. (1994). Establishment of the brown citrus aphid (Homoptera: Aphididae) in Central America and the Caribbean basin and transmission of Citrus tristeza virus. Journal of Economic Entomology, 87(4), 1078-1085. doi: 10.1093/jee/87.4.1078 [ Links ]
Yokomi, R. K., & de Borde, R. L. (2005). Incidence, transmissibility, and genotype analysis of Citrus tristeza virus (CTV) isolates from CTV eradicative and noneradicative districts in central California. Plant Disease, 89(8), 859-866. doi: 10.1094/PD-89-0859 [ Links ]
Recibido: 16 de Noviembre de 2016; Aprobado: 31 de Julio de 2017











 texto em
texto em 



