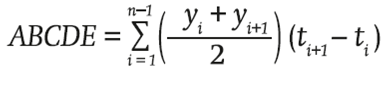Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.23 no.3 Chapingo sep./dic. 2017
https://doi.org/10.5154/r.rchsh.2017.01.004
Articles
Sensibilidad a fungicidas del Phytophthora infestans (Mont.) de Bary en Chapingo, México
1Universidad Autónoma Chapingo, Departamento de Fitotecnia. Carretera México-Texcoco km 38.5, Chapingo, México, C. P. 56230, MÉXICO.
2Colegio de Posgraduados, Instituto de Fitosanidad. Carretera México-Texcoco km 36.5, Montecillo, Texcoco, México, C. P. 56230, MÉXICO.
3Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias, Campo Agrícola Experimental Valle de México. Carretera Los Reyes-Texcoco km 13.5, Coatlinchán, Texcoco, C. P. 56250, MÉXICO.
El control químico de las enfermedades de las plantas ejerce gran presión de selección en el desarrollo de resistencia del patógeno a fungicidas. Los objetivos del presente estudio fueron cuantificar la existencia de tizón tardío en Solanum tuberosum L., detectar la presencia de variantes del oomiceto resistentes a agroquímicos y comparar los diferentes niveles de resistencia en los aislados de un ciclo a otro. Se expusieron parcelas de papa var. Fianna, susceptibles al tizón tardío (Phytophthora infestans [Mont.] de Bary), a la infección natural del patógeno para detectar la presencia de variantes del oomiceto resistentes a agroquímicos de un ciclo a otro, y bajo condiciones in vivo respecto a in vitro mediante la aplicación de medias dosis de fungicidas. La enfermedad alcanzó 100 % de infección foliar final en tratamientos con ciazofamida en 2011 y con fosetil-Al en 2012. Por otro lado, la mandipropamida permitió solamente de 21 a 22 % de infección en ambos años en campo. No obstante, 49 % de la población de P. infestans resultó susceptible, 39 % intermedia y 19 % fue resistente a este producto in vitro. Las parcelas tratadas con fosetil-Al alcanzaron de 80 a 100 % de infección en campo y 88 % in vitro. El 46 % de las poblaciones de P. infestans mostraron resistencia intermedia cuando se expusieron a dosis altas del producto y 62 % fueron resistentes a dosis bajas. Los aislados de parcelas con infección natural expuestos a ciazofamida fueron sensibles in vitro. Las inconsistencias del oomiceto en relación a la resistencia/susceptibilidad a los fungicidas bajo condiciones in vitro/in vivo, así como de un año a otro, no explican la predictibilidad del comportamiento. Estos resultados exponen la gran plasticidad genética del oomiceto en relación con su sensibilidad a los fungicidas.
Palabras clave: tizón tardío; papa; Solanum tuberosum; resistencia a fungicidas
Chemical control of plant diseases exerts high selection pressure for the development of pathogen resistance to fungicides. The objectives of this study were to quantify the existence of late blight in Solanum tuberosum L., detect the presence of variants of the oomycete resistant to agrochemicals and compare the different levels of resistance in the isolates from one cycle to another. Plots of the potato cv. Fianna, susceptible to late blight (Phytophthora infestans [Mont] de Bary), were exposed to natural infection of the pathogen to detect the presence of variants of the oomycete resistant to the agrochemicals from one cycle to another, and from in vivo with respect to in vitro conditions, by applying a half dose of fungicides. The disease reached 100 % final foliar infection in treatments with ciazofamid in 2011 and with fosetyl-Al in 2012. On the other hand, mandipropamid allowed only 21-22 % infection in both years in the field. However, 49 % of the P. infestans population was susceptible, 39 % was intermediate, and 19 % was resistant to this product in vitro. Plots treated with fosetyl-Al reached 80-100 % infection in the field, while in vitro 88 and 46 % of the P. infestans populations showed intermediate resistance when exposed to high dosages of the product, and 62 % were resistant at low dosage. Isolates from field plots with natural infection exposed to ciazofamid were all sensitive in vitro. The inconsistencies of the oomycete regarding fungicide resistance/sensitivity under in vivo/in vitro conditions, as well from one year to another, do not support behavior predictability. These results expose the great genetic plasticity of the oomycete in relation to its sensitivity to fungicides.
Key words: late blight; potato; Solanum tuberosum; fungicide resistance
Introducción
Phytophthora infestans (Mont.) de Bary es el agente causal del tizón tardío en papa (Solanum tuberosum L.), en tomate (Solanum lycopersicum L.) y otras solanáceas. El oomiceto infecta a la planta completa y dispersa rápidamente sus esporangios mediante el viento si las condiciones son propicias. Si el cultivo no está protegido con fungicidas, con diferentes modos de acción, el patógeno podría generar resistencia a algunos productos y los cultivos de papa se destruirían en cuestión de semanas (Abad & Ochoa, 1995; Díaz-de la Cruz, Lozoya-Saldaña, Sahagun-Castellanos, & Peña-Lomelí, 2014). Actualmente, la mejor medida de control sigue siendo el uso de fungicidas; sin embargo, las poblaciones de P. infestans han desarrollado resistencia a estos productos, debida al uso continuo de un solo fungicida (Damicone, 2004).
Considerando lo anterior, el metalaxil es un producto tan importante que aún está en uso. Actúa en áreas específicas del patógeno impidiendo la biosíntesis de proteínas a través de la interferencia en la síntesis de ARN ribosómico; lo cual puede ser superado por variantes del patógeno naturalmente resistentes. Este hecho fue reportado en 1981 en Europa y en 1993 en Estados Unidos, Canadá, México y Ecuador (Davidse, Looijen, Turkesnteen, & van der Wal, 1981; Drenth, Goodwin, Fry, & Davidse, 1993; Forbes et al., 1997; Marquinez, 1995; Matuszak, Fernández, Gu, Villarreal, & Fry, 1994; Power, Hamlen, & Morehart, 1995), hasta el punto en que esta resistencia se considera una variable adicional para caracterizar a P. infestans (Doster, Milgroom, & Fry, 1990; Dowley, & O’Sullivan, 1985; Kato, Mizubuti, Goodwin, & Fry, 1997; Matuszak et al., 1994; Runno & Koppel, 2006).
Recientemente, otras sustancias sistémicas han aparecido en el mercado para el control del tizón tardío, como la ciazofamida, que interfiere con la cadena respiratoria mitocondrial, y la mandipropamida, que inhibe la síntesis de celulosa de la pared celular del oomiceto, actúa sobre la proteína PiCesA3 celulosa sintetasa e interfiere en la formación de micelio y haustorios durante la fase inicial de incubación de la enfermedad (Blum et al., 2010; Cohen et al., 2007). Además, la mandipropamida modifica la biosíntesis de los fosfolípidos y provoca alteraciones en las F-actinas (Griffiths, Dancer, O’ Neill, & Harwood, 2003).
Fosetil-Al es un fungicida que actúa sobre la planta estimulando sus mecanismos de defensa, aumentando sus niveles de peroxidasas, fitoalexinas, polisacáridos y la actividad de la fenilalanina amonio liasa (Brent & Hollomon, 2007; Gisi y Cohen, 1996; Robledo-Esqueda, Lozoya-Saldaña, & Colinas-León, 2012; Serrano-Cervantes, Lozoya-Saldaña, Colinas y León, & Leyva-Mir, 2016). El modo de acción de este producto se basa en su influencia sobre la fosforilación enzimática y el metabolismo del fósforo, afectando la síntesis de diferentes compuestos que contienen este elemento esencial para el crecimiento de Phytophthora, como nicotinamida adenina dinucleótido (NAD), trifosfato de adenosina (ATP) y nucleótidos (Gómez & Reis, 2011).
Respecto al patógeno, el carácter heterotálico de P. infestans le confiere ventajas evolutivas, dado que aumenta su variabilidad genética e intercambio de los factores de virulencia. Por ende, en la escala de población, estos eventos de recombinación generan genotipos más agresivos, adaptándose a diferentes nichos ecológicos y a la presión de selección ejercida por los fungicidas (Adler et al., 2004; Erwin & Ribeiro, 1996; Goodwin, Sujkowski, & Fry, 1995; Knapova, Tenzer, Gessler, & Gisi, 2001). En México, la variabilidad y la resistencia del patógeno al metalaxil han sido reportadas en diferentes regiones agrícolas (Garay-Serrano et al., 2007, Grünwald et al., 2006; Matuszak et al., 1994), particularmente en el Valle de Toluca, México, centro de origen de P. infestans (Grünwald et al., 2006; Grünwald & Flier, 2005).
Con respecto a la susceptibilidad de los fungicidas, se generó una nueva base de datos para una población sexual del patógeno, con una amplia gama de sensibilidad al metalaxil; en tanto que para la azoxistrobina, un compuesto químico de la familia de las estrobilurinas, la resistencia estaba presente (Evenhuis, Schepers, Bus, & Stegeman, 1996; Grünwald et al., 2001, 2006). Estos estudios no incluyen el área de Chapingo, México, que es el segundo centro de diversificación genética del oomiceto después de Toluca (Goodwin, 1996) y que tiene el clima ideal para el desarrollo de la enfermedad (Díaz-de la Cruz et al., 2014), con poblaciones silvestres de oomicetos (Alarcón-Rodríguez, Lozoya-Saldaña, Valadez-Moctezuma, García-Mateos, & Colinas-León, 2013).
Por lo anterior, los objetivos del presente estudio fueron cuantificar la existencia de tizón tardío en campo abierto en dos ciclos de cultivo, detectar la presencia de variantes del oomiceto resistentes a agroquímicos y comparar los diferentes niveles de resistencia en los aislados de un ciclo a otro (in vivo primer año vs in vivo segundo año) e in vivo con respecto a in vitro en Chapingo, México.
Materiales y métodos
Colecta de aislados de P. infestans y lecturas de la infección
En verano de 2011 y 2012 se establecieron parcelas de papa cv. Fianna susceptibles al tizón tardío en la Estación Experimental de la Universidad Autónoma Chapingo, ubicada a 25 km al este del Aeropuerto Internacional de la Ciudad de México, a 2,250 msnm con un clima C(Wo)(W)b(i)g, temperatura promedio de 15 °C y estación de lluvias fiable en verano (645 mm). El diseño experimental fue de bloques al azar con cuatro hileras de 4 m de longitud y cuatro repeticiones, bajo condiciones de temporal y expuestos a infección natural por el oomiceto.
Los tratamientos consistieron en cinco aspersiones foliares semanales de medias dosis, de acuerdo con las etiquetas de metaxil, fosetil-Al, mandipropamida, propamocarb, ciazofamida o agua (control absoluto) a partir de los 45 días después de la siembra. Con la finalidad de obtener la curva de desarrollo de la enfermedad, durante el mismo período se tomaron lecturas de infección foliar de diez individuos de las hileras centrales por tratamiento, conforme a la escala de Henfling (1987). El número de lecturas de la infección tuvo una semana de compensación posterior con respecto a la aplicación de los productos. Así, la primera lectura correspondió a la segunda semana de aspersión y la quinta lectura se hizo una semana después de la quinta (y final) aplicación de los productos, esto es, a la sexta semana.
Al final de cada ciclo se realizó la comparación de medias de la lectura final, donde las hileras centrales fueron la parcela útil. El área bajo la curva de desarrollo de la enfermedad (ABCDE) se calculó conforme a Campbell y Madden (1990) y Shaner y Finney (1977), utilizando la fórmula:
donde el valor final del ABCDE es la suma de las áreas por lapsos, que resulta de multiplicar la lectura promedio de dos fechas consecutivas (valor de y) por el lapso (días, valor de t) entre lecturas.
Durante los ciclos de cultivo, se colectaron muestras de hojas y tallos con lesiones simples de tizón de cada uno de los tratamientos. Las muestras se colocaron en cámaras húmedas a temperatura ambiente (22 a 25 °C) con luz blanca durante 24 h para inducir la formación de esporangios y se añadieron sobre la lesión rodajas de papa desinfestadas. Después de 2 días, se observó crecimiento micelial impregnado en los cortes. Se retiraron las puntas del micelio utilizando una aguja de disección, luego se sembraron en medio centeno agar (Alarcón-Rodríguez et al., 2013) con oxitetraciclina y se incubaron a una temperatura constante (17 °C).
Identificación de tipos de compatibilidad
Para determinar el tipo de compatibilidad (A1 o A2), se colocaron aislados "desconocidos" en un extremo de una caja de Petri con medio centeno agar. En el otro extremo de la caja, se sembró un aislado de referencia de tipo conocido (A1 o A2, proporcionado por la Dra. Sylvia P. Fernández Pavía de la Universidad Michoacana de San Nicolás de Hidalgo) y se mantuvo a 17 °C en oscuridad. Después de una semana, se evaluaron las colonias para determinar su capacidad de desarrollar estructuras de reproducción sexual (ovogonia, anteridios y oosporas). La presencia de oosporas se interpretó como si el aislado desconocido fuese de un grupo de compatibilidad opuesto al de la confrontación; además, al enfrentar el aislado con ambos tipos de compatibilidad conocidos, o sin la confrontación, se interpretó como homotálico (H).
Resistencia a fungicidas in vitro
La evaluación in vitro de la resistencia/susceptibilidad de los aislados a los fungicidas aplicados en condiciones de campo abierto se llevó a cabo conforme a la metodología de Deahl, DeMuth, Sinden, y Rivera-Peña (1995b) y Shattock (1988). Se sembraron fragmentos de micelio del oomiceto, aislados de los dos ciclos de cultivo, en medio centeno agar selectivo adicionado con los fungicidas (0.1 y 10 mg∙L-1). El crecimiento in vitro de cada aislado se midió después de 10 días de incubación a 17 °C y el resultado se cuantificó mediante la ecuación:
Donde PC = porcentaje de crecimiento, DMC = diámetro medio de la colonia (mm), 5 = diámetro del cilindro con micelios originalmente sembrados en el centro de la caja de Petri (mm) y DCA = diámetro de crecimiento del control sin fungicidas. Para la clasificación, se adaptaron los criterios empleados por Deahl et al. (1995b) y Shattock (1988), quienes califican a los aislados con porcentaje de crecimiento igual o superior a 60 % como resistentes al metalaxil, de 10 a 60 % como intermedios e inferior a 10 % como susceptibles. La comparación por categorías se realizó en un diseño completamente al azar (Statistical Analysis System [SAS Institute], 2004).
Resultados y discusión
Aislados y curva de desarrollo de la enfermedad
El P. infestans resultó altamente sensible a los fungicidas durante el primer ciclo, y todos los aislados obtenidos fueron del tipo A1. En el segundo año, todos los aislados fueron homotálicos (Cuadro 1). El tipo de compatibilidad A1 es el más abundante en la naturaleza, pero es genéticamente limitado, por lo que tiende a conservarse clonalmente sin mucha variación (Judelson, 1996). Este tipo se esparció en todo el mundo a mediados del siglo XIX.
Cuadro 1 Número de aislados y tipo de compatibilidad por año.
| Ingrediente activo | Núm. y GC z (2011) | Núm. y GC (2012) |
|---|---|---|
| Metalaxil | 3 A1z | 13 H |
| Fosetil-Al | 3 A1 | 12 H |
| Mandipropamida | 5 A1 | 4 H |
| Ciazofamida | 7 A1 | 0 |
| Control | 5 A1 | 28 H |
| Total | 23 A1 | 57 H |
zGC: grupo de compatibilidad (A1 o H [homotálico]).
Teniendo en cuenta la ausencia de presión de selección en la zona previa a los ensayos debida a la falta de cultivos comerciales de papa, se esperaba que la población de P. infestans fuese silvestre, predominando el tipo de compatibilidad mencionada arriba y poca infección en los tratamientos con los agroquímicos, por lo que se obtuvieron pocos en 2011 (Cuadro 1). Para el año siguiente, todos fueron homotálicos, incluido el control, como evidencia de la presencia de estos tipos que aflorarían como una consecuencia de la situación del año anterior, dado que ambos ensayos se establecieron en las mismas parcelas en los dos años consecutivos.
Debido a que la población de oomicetos en el área de Chapingo es silvestre, ocasionada por la ausencia de presión de selección (fungicidas) en su ambiente natural, en el primer año la mayoría del tipo de compatibilidad A1 (muy sensible a fungicidas) se eliminó, sin detección de poblaciones homotálicas hasta entonces. Como consecuencia, en el segundo año todos los patógenos presentes en el área fueron homotálicos. Esta característica ya había sido reportada en Chapingo (Alarcón-Rodríguez et al., 2013) y en el Valle de Toluca (López-Orona et al., 2013). La naturaleza clonal de los aislados de Chapingo (todos A1 el primer año y todos homotálicos el segundo año) se confirmó posteriormente mediante la determinación de genotipos vía microsatélites (Shakya, Larsen, Cuenca-Condoy, Lozoya-Saldaña, & Grünwald, 2016).
Porcentaje de infección
Al final de los dos ciclos de crecimiento se detectó 100 % de infección en los controles no protegidos. En 2011, los tratamientos que mostraron la protección más alta fueron la mandipropamida y el metalaxil, con 22 y 39 % de infección, respectivamente; lo que se reflejó directamente en el valor del ABCDE (44 y 99, respectivamente, Figura 1 y Cuadro 2). En 2012, el tratamiento con la mayor protección fue nuevamente la mandipropamida, con cerca de 21 % de infección final (ABCDE de 24); en tanto que el de metalaxil presentó 87 % (ABCDE de 176). Con excepción de la mandipropamida, el resto de los fungicidas permitió una infección más alta durante el segundo año respecto del primero (Figura 1, Cuadro 2). Lo anterior podría deberse a la presión de selección de los productos sobre el patógeno durante el ciclo anterior. Además, en este segundo año, toda la población de P. infestans fue homotálica; lo cual sugiere que el patógeno podría mostrar variabilidad genética mayor en 2012 que en 2011.

Figura 1 Desarrollo de la infección foliar:  metalaxil,
metalaxil,  fosetil-Al,
fosetil-Al,  mandipropamida,
mandipropamida,  ciazofamida,
ciazofamida,  control. zLíneas con la misma letra no difieren estadísticamente (Tuckey, P ≤ 0.05).
control. zLíneas con la misma letra no difieren estadísticamente (Tuckey, P ≤ 0.05).
Cuadro 2 Lectura final de la infección foliar y área bajo la curva de desarrollo de la enfermedad (ABCDE).
| Tratamiento | Última lectura 2011 | ABCDE 2011 | Última lectura 2012 | ABCDE 2012 |
|---|---|---|---|---|
| Metalaxil | 39 cz | 99 | 87 bc | 176 |
| Fosetil-Al | 83.2 b | 185 | 98.2 ab | 226 |
| Mandipropamida | 22 d | 44 | 20.9 d | 24 |
| Ciazofamida | 99.5 a | 231 | 84.2 c | 219 |
| Control | 100 a | 265 | 100 a | 296 |
zMedias con la misma letra dentro de cada columna no difieren estadísticamente (Tukey, P ≤ 0.05).
En las evaluaciones in vitro, los aislados crecieron sobre agar centeno con 0.1 y 10 mg∙L-1 de los ingredientes activos. Estas dosis se definieron en función de los reportes elaborados por Deahl, DeMuth, y Fry (1995a), Locher y Lorenz (1991), Marquinez (1995), Rekanović et al. (2011), Shattock (1988) y Sozzi, Schwinn, y Gisi (1992), quienes reportaron colonias con crecimiento de 2 a 100 % con respecto a los controles.
En cuanto a los aislados expuestos a ciazofamida en campo e in vitro, todos fueron sensibles en ambos ciclos de cultivo (Figura 2). El modo de acción de este fungicida es fundamental para no desarrollar resistencia en el patógeno; esto debido a que está relacionado con la inhibición de la cadena respiratoria mitocondrial, en la reducción de la ubiquinona (Qi) y la oxidación del ubiquinol (Qo) en el citocromo b (Temperli, Roos, & Itohl, 1990), con reducción del ATP. La ciazofamida limita la movilidad de las zoosporas, así como la germinación de los esporangios y la formación de oosporas (Ziogas, Markoglow, Theodosiou, Anagnostou, & Boutopoulou, 2006).
Discusión general
La zona geográfica de Chapingo cuenta con las condiciones climáticas ideales para cultivar papa, así como para el desarrollo de tizón tardío en el verano. Sin embargo, este cultivo no se produce extensamente en la zona. Por lo tanto, se esperaría tratar con poblaciones silvestres de P. infestans, altamente sensibles a los agroquímicos, ya que no hay presión de selección del patógeno causada por fungicidas. No obstante, los resultados fueron opuestos. El mejor tratamiento en campo fue la mandipropamida, con consistencia en el control del patógeno durante ambos años, pero los estudios in vitro no mostraron los mismos resultados. Aunque todos los tratamientos resultaron sensibles al producto in vitro el primer año, las poblaciones afloraron con resistencia intermedia y alta a este producto en el laboratorio durante el segundo año.
El resto de los productos mostraron inconsistencias en las curvas de avance de la enfermedad en campo de un año a otro. El metalaxil, por ejemplo, permitió una infección de 39 % en un año y de 87 % en el otro. Además, hubo infección casi total en el tratamiento con ciazofamida el primer año y con fosetil-Al el segundo año. Esto también se reflejó en los ensayos in vitro, en los que las poblaciones expuestas a la ciazofamida fueron consistentemente las más susceptibles, sin mostrar resistencia; lo cual sería exactamente lo contrario a lo que se esperaría cuando en el campo este producto no controló a la enfermedad.
Por otra parte, el fosetil-Al falló en controlar al tizón en campo en ambos años, pero hubieron poblaciones intermedias y resistentes del oomiceto cuando se expusieron al producto in vitro. Las inconsistencias del oomiceto con respecto a la resistencia/sensibilidad a fungicidas bajo condiciones in vivo/in vitro, así como de un año a otro en campo, no explican la predictibilidad del comportamiento. Estos resultados ponen de manifiesto la gran plasticidad genética del oomiceto en relación a su sensibilidad a los fungicidas; además, cuestionan los ensayos in vitro de los productos como fungicidas potenciales a lo largo del proceso de desarrollo, ya que el control in vitro del patógeno no garantiza los mismos resultados in vivo.
Conclusiones
Se presentó severidad alta por Phytophthora infestans en ambos años en campo (in vivo), donde tres de los tratamientos presentaron curvas y valores de la enfermedad que fueron diferentes de un año a otro. Las medias dosis de los agroquímicos protegieron parcialmente al follaje, retrasando la epidemia pero permitiendo la infección y floración de cepas de P. infestans tolerantes a los productos. La resistencia in vitro del oomiceto a los fungicidas fue parcial, dependiendo de las dosis a las cuales fue expuesto, sin coincidencia de resistencia/susceptibilidad al compararse con su respuesta in vivo (campo). La inconsistencia del comportamiento de P. infestans, a estas dos condiciones (in vivo e in vitro), no permite la anticipación de las respuestas del oomiceto bajo diversas situaciones de presión de selección por parte de los agroquímicos, lo cual demuestra su plasticidad genética alta.
References
Abad, J. A., & Ochoa, C. (1995). Historical evidence on occurrence of the late blight of potato, tomato and pear melon in the Andes of South America. In: Dowlwey, L. J., Bannon, E., Cooke, R. L., Keane, T., & Sullivan, E. (Eds). Phytophthora infestans 150 (pp: 36-41). Dublin, Ireland: Boole Press Ltd. [ Links ]
Adler, N. F., Erselius, L. J., Chacón, M. G., Flier, W. G., Ordóñez, M. E., Kroon, L., & Forbes, G. A. (2004). Genetic diversity of Phytophthora infestans sensu lato in Ecuador provides new insight into the origin of this important plant pathogen. Phytopathology, 94(2), 154-162. doi: 10.1094/PHYTO.2004.94.2.154 [ Links ]
Alarcón-Rodríguez, N. M., Lozoya-Saldaña, H., Valadez-Moctezuma, E., García-Mateos, R., & Colinas-León, M. T. (2013). Genetic diversity of potato late blight, Phytophthora infestans (Mont) de Bary, at Chapingo, México. Agrociencia, 47(6) 593-607. Retrieved from http://www.scielo.org.mx/scielo.php?pid=S1405-31952013000600006&script=sci_abstract&tlng=en [ Links ]
Blum, M., Boehler, M., Randall, E., Young, V., Csukai, M., & Kraus, S. (2010). Mandipropamid targets the cellulose synthase like PiCesA3 to inhibit cell wall biosynthesis in the oomycete plant pathogen, Phytophthora infestans. Molecular Plant Pathology, 11(2), 227- 243. doi: 10.1111/j.1364-3703.2009.00604.x [ Links ]
Brent, K. J., & Hollomon, D. W. (2007). Fungicide resistance in crop pathogens: How can it be managed?. Belgium: Fungicide Resistance Action Committee. Retrieved from http://www.frac.info/docs/default-source/publications/monographs/monograph-1.pdf [ Links ]
Campbell, C. L., & Madden, L. V. (1990). Introduction to plant disease epidemiology. New York, USA: Wiley. [ Links ]
Cohen, Y., Rubin, E., Hadad, T., Gotlieb, D., Sierotzki, H., & Gisi, U. (2007). Sensitivity of Phytophthora infestans to mandipropamid and the effect of enforced selection pressure in the field. Plant Pathology, 56(5), 836-842. doi: 10.1111/j.1365-3059.2007.01625.x [ Links ]
Damicone, J. (2004). Fungicide resistance management. Oklahoma: Cooperative Oklahoma Extension Service. Retrieved from http://pods.dasnr.okstate.edu/docushare/dsweb/Get/Rendition-3508/F-7663web.pdf [ Links ]
Davidse, L., Looijen, C. D., Turkesnteen, L. J., & van der Wal, D. (1981). Occurrence of metalaxyl resistant strains of Phytophthora infestans in Dutch potato fields. Netherlands Journal of Plant Pathology, 87(2), 65-68. doi: 10.1007/BF01976658 [ Links ]
Deahl, K. L., DeMuth, S. P., & Fry, W. E. (1995a). Genetic and phenotypic diversity in populations of Phytophthora infestans in the United States of America. In: Dowlwey, L. J., Bannon, E., Cooke, R. L., Keane, T., & Sullivan, E. (Eds), Phytophthora infestans 150 (pp: 362). Dublin, Ireland: Boole Press Ltd . [ Links ]
Deahl, K. L, DeMuth, S. P., Sinden, S. L., & Rivera-Peña, A. (1995b). Identification of mating types and metalaxyl resistance in North American populations of Phytophthora infestans. American Potato Journal, 72(1), 35-49. [ Links ]
Díaz-de la Cruz, J. B., Lozoya-Saldaña, H., Sahagun-Castellanos, J., & Peña-Lomelí, A. (2014). The pathosystem Solanum tuberosum L.-Phytophthora infestans (Mont.) de Bary in Chapingo. México. Expected, observed, and simulated. American Journal of Potato Research, 91(3), 312-326. doi: 10.1007/s12230-013-9351-y [ Links ]
Doster, M. A., Milgroom, M. G., & Fry, W. E. (1990). Quantification of factors influencing potato late blight suppression and selection for metalaxyl resistance in Phytophthora infestans: A simulation approach. Phytopathology, 80, 1190-1198. doi: 10.1094/Phyto-80-1190 [ Links ]
Dowley, L. J., & O’Sullivan, E. (1985). Monitoring metalaxyl resistance in population of Phytophthora infestans. Potato Research, 28, 531-534. [ Links ]
Drenth, A., Goodwin, S. B., Fry, W. E., & Davidse, L. C. (1993). Genotypic diversity of Phytophthora infestans in the Netherlands revealed by DNA polymorphism. Phytopathology, 83(10), 1087-1092. doi: 10.1094/Phyto-83-1087 [ Links ]
Erwin, D., & Ribeiro, O. (1996). Introduction to the genus Phytophthora. In: Edwin D. and Ribeiro,O. (Eds.). Phytophthora diseases worldwide (pp. 1-7). St. Paul, Minnesota: American Phytopathological Society. [ Links ]
Evenhuis, A., Schepers, H. T., Bus, C. B., & Stegeman, W. (1996). Synergy of cymoxanil and mancozeb when used to control potato late blight. Potato Research, 39(4), 551-559. doi: 10.1007/BF02358474 [ Links ]
Forbes, G. A., Escobar, X. C., Ayala, C. C., Revelo, J., Ordoñez, M. E., Fry, B. A., Dovccett, K., & Fry, W. E. (1997). Population genetic structure of Phytophthora infestans in Ecuador. Phytopathology, 87(4), 375-380. doi: 10.1094/PHYTO.1997.87.4.375 [ Links ]
Garay-Serrano, E., Fernández-Pavía, S. P., Rodríguez-Alvarado, G., Flier, W. G., Lozoya-Saldaña, H., Rojas-Martínez, R. I., Goss, E. M., & Grünwald, N. J. (2007). First report of haplotype I-b of Phytophthora infestans (Mont) de Bary in Central Mexico. Plant disease, 91(7), 909. doi: 10.1094/PDIS-91-7-0909B [ Links ]
Gisi, U., & Cohen, Y. (1996). Resistance to phenylamide fungicides: A case study with Phytophthora infestans involving mating type and race structure. Annual Review of Phytopathology, 34, 549-572. doi: 10.1146/annurev.phyto.34.1.549 [ Links ]
Gómez, D. E., & Reis, E. M. (2011). Inductores abióticos de resistencia contra fitopatógenos. Química viva, 10, 6-17. [ Links ]
Goodwin, S. B. (1996) Origin and ecology of Phytophthora infestans. Revista Mexicana de Fitopatologia , 14, 143-147. [ Links ]
Goodwin, S. B., Sujkowski, L. S., & Fry, W. E. (1995). Rapid evolution of pathogenicity with clonal lineages of the potato late blight disease fungus. Phytopathology, 85(6), 669-76. [ Links ]
Griffiths, R. G., Dancer, J., O’ Neill, E., & Harwood, J. L. (2003). A madelamide pesticide alters lipid metabolism in Phytophthora infestans. New Phytologist, 158, 345-353. [ Links ]
Grünwald, N. J., Sturbaum, A. K., Romero, G., Garay, E., Lozoya, H., & Fry, W. E. (2006). Selection for Fungicide Resistence within a Growing Season in Field Populations of Phytophthora infestans at the center of origin. Phytopathology, 96(12), 1397-1403. doi: 10.1094/PHYTO-96-1397 [ Links ]
Grünwald, N. J., Flier, W. G., Sturbaum, A. K., Garay, E., Van Den Bosch, T. B., Smart, C. D., Matuszak, J. M., Lozoya, H., Turkensteen, L. J. & Fry, W. E. (2001). Population structure of Phytophthora infestans in the Toluca valley region of central Mexico. Phytopathology, 91(9), 882-890. doi: 10.1094/PHYTO.2001.91.9.882 [ Links ]
Grünwald, N. J., & Flier, W. G. (2005). The Biology of Phytophthora infestans at Its Center of Origin. Annual Review of Phytopathology, 43, 171-190. doi: 10.1146/annurev.phyto.43.040204.135906 [ Links ]
Henfling, J. W. (1987). Late blight of potato: Phytophthora infestans. Technical Information Bulletin 4., Lima Peru: International Potato Center. [ Links ]
Judelson, H. S. (1996). Chromosomal heteromorphism linked to the mating type locus of the oomycete Phytophthora infestans. Molecular General Genetics, 252(1-2), 155-161. [ Links ]
Kato, M., Mizubuti, E. S., Goodwin, S. B., & Fry, W. E. (1997). Sensitivity to protectant fungicides and pathogenic fitness of clonal lineages of Phytophthora infestans in the United States. Phytopathology, 87(9), 973-980. doi: 10.1094/PHYTO.1997.87.9.973. [ Links ]
Knapova, G., Tenzer, I., Gessler, C., & Gisi, U. (2001). Characterization of Phytophthora infestans from potato and tomato with molecular markers. Proceedings of the 5th Congress of the European Foundation for Plant Pathology. Biodiversity in Plant Pathology Taormina, Italy . [ Links ]
Locher, F. J., & Lorenz, G. (1991). Methods for monitoring the sensitivity of Botrytis cinerea to ditiocarboximide fungicides. EPPO Bulletin, 21(2), 341-345. doi: 10.1111/j.1365-2338.1991.tb01261.x [ Links ]
López-Orona, C. A., Martínez, A. R., Arteaga, T. T., García, H. G., Palmero, D., Ruiz, A., & Peñuelas, C. G. (2013). First report of homothallic isolates of Phytophthora infestans in commercial potato crops (Solanum tuberosum) in the Toluca Valley, Mexico. Plant Disease, 97(8), 1112. doi: 10.1094/PDIS-10-12-0962-PDN [ Links ]
Marquinez, R. (1995). Resistance of Phytophthora infestans strains to phenylamides in Spain. In: Dowley, L. J., Bannon, E., Cooke, L. R., Keane, T., & O’Sullivan, E. (Eds.), Phytophthora infestans 150 (pp 137-141). Dublin. Ireland: EAPR, Boole Press Ltd. [ Links ]
Matuszak, J. M., Fernández, J., Gu, W. K., Villarreal, M. J., & Fry, W. E. (1994). Sensivity of Phytophthora infestans population to Metalaxyl in México; distribution and dynamics. Plant Disease, 78(9), 911-916. doi: 10.1094/PD-78-0911 [ Links ]
Power, R. J., Hamlen, R. A., & Morehart, L. A. (1995). Variation in sensitivity of Phytophthora infestans field isolates to cimoxanil, chlorothalonil and metalaxyl. In: Dowley, L. J., Bannon, E., Cooke, L. R., Keane, T., & O’Sullivan, E. (Eds.), Phytophthora infestans 150 (pp 154-159). Dublin. Ireland: EAPR, Boole Press Ltd . [ Links ]
Rekanović, E., Potočnik, I., Milijašević-Marčić, S., Stepanović, M., Todorović, B., & Mihajlović, M. (2011). Toxicity of metalaxyl, azoxystrobin, dimethomorph, cymoxanil, zoxamide and mancozeb to Phytophthora infestans isolates from Serbia. Journal of Environmental Science, 47(5), 403-409. doi: 10.1080/03601234.2012.657043 [ Links ]
Robledo-Esqueda, M. N., Lozoya-Saldaña, H., & Colinas-León, M. T. (2012). Inducción de defensa en papa (Solanum tuberosum L.) contra Phytophthora infestans Mont. de Bary, por fungicidas. Interciencia, 37(9), 689-695. Retrieved from http://www.redalyc.org/html/339/33925502006/ [ Links ]
Runno, E., & Koppel, M. (2006). The question of metalaxyl resistance on late blight fungus in Estonia. Agronomy Research, 4, 341-344. Retrieved from http://agronomy.emu.ee/vol04Spec/p4S44.pdf [ Links ]
Serrano-Cervantes, R.,Lozoya-Saldaña, H.,Colinas y León,M. T. B., & Leyva-Mir, S. G. (2016). Algunas alteraciones enzimáticas en papa causadas por fungicidas. Revista Fitotecnia Mexicana, 39(1), 25-31. Retrieved from http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0187-73802016000100006 [ Links ]
Shakya, S. K., Larsen, M. M., Cuenca-Condoy, M. M., Lozoya-Saldaña, H., & Grünwald, N. J. (2016). Microsatellite genotyping reveals high genetic diversity in Phytophthora infestans from Mexico. Proceedings, American Phytopathological Society Annual Meeting, Tampa, Florida, USA. [ Links ]
Shaner, G., & Finney, R. E. (1977). The effect of nitrogen fertilization on the expression of slow mildewing resistance in Knox Wheat. Phytopathology, 67, 1051-1056. doi: 10.1094/Phyto-67-1051 [ Links ]
Shattock, R. C. (1988). Studies on the inheritance of resistance to metalaxyl in Phytophthora infestans. Plant Pathology, 37(1), 4-11. doi: 10.1111/j.1365-3059.1988.tb02188.x [ Links ]
Sozzi, D., Schwinn, F. J., & Gisi, U. (1992). Determination of the sensitivity of Phytophthora infestans to phenylamides: a leaf disease method. EPPO Bulletin, 22 (2), 306-309. doi: 10.1111/j.1365-2338.1992.tb00499.x [ Links ]
Statistical Analysis System (SAS Institute). (2004). SAS/STAT.® 9.1 Cary, NC, USA: Author. [ Links ]
Temperli, E., Roos, U. P., & Itohl, H. R. (1990). Actin and tubulin cytoskeletons in germlings of the oomycete fungus Phytophthora infestans. European Journal of Cell Biology, 53(1), 75-88. [ Links ]
Ziogas, B. N., Markoglow, A. N., Theodosiou, D. I., Anagnostou, A., & Boutopoulou, S. (2006). A high multi-drug resistance to chemically unrelated oomycete fungicides in Phytophthora infestans. European Journal of Plant Pathology, 115(3), 283-292. doi: 10.1007/s10658-006-9007-6 [ Links ]
Recibido: 19 de Enero de 2017; Aprobado: 16 de Julio de 2017











 texto en
texto en