Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo. Serie horticultura
versão On-line ISSN 2007-4034versão impressa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.22 no.2 Chapingo Mai./Ago. 2016
https://doi.org/10.5154/r.rchsh.2014.11.051
Articles
Ureasa y níquel en la fisiología de las plantas
1Universidad Autónoma de Chihuahua, Facultad de Ciencia Agrotecnológicas. Ciudad Universitaria s/n. Chihuahua, Chihuahua, C. P. 31310, MÉXICO.
2Universidad Autónoma Chapingo, Centro Regional Universitario Centro-Norte. Calle Cruz del Sur núm. 100, col. Constelación, El Orito, Zacatecas, C. P. 98085, MÉXICO.
3Universidad Autónoma de Zacatecas, Unidad Académica de Matemáticas. Calzada Solidaridad s/n, Zacatecas, Zacatecas, C. P. 98064, MÉXICO.
En la presente revisión se compila y discute la información científica actual referente a la función de la ureasa en las plantas; además, se aborda su función catalítica, distribución, influencia del pH en la hidrólisis de la urea y Ni como cofactor en su activación. Esta enzima es de vital importancia en el metabolismo nitrogenado. Para ser activada, la ureasa requiere unirse con dos átomos de níquel (Ni), y en las células vegetales participa en el metabolismo de los compuestos que contienen nitrógeno (N). La activación de la ureasa parece ser, hasta la fecha, la única función enzimática del Ni en las plantas superiores. Asimismo, se plantea la importancia del Ni en los procesos fisiológicos y bioquímicos de la planta, se incluyen las respuestas típicas frente a la presencia del Ni en el suelo y planta, y se evidencia una estrecha relación entre la ureasa y el Ni en la fisiología vegetal de algunas plantas, por lo tanto, su actividad podría ser considerada como un indicador bioquímico de deficiencia de Ni antes de que se presente la sintomatología de manera visible.
Palabras clave: micronutrimento; metaloenzima; catálisis; cofactor
This review compiles and discusses current scientific information relating to the role of urease in plants; moreover, it addresses its catalytic function, distribution, influence of pH on hydrolysis of urea and Ni as a cofactor in its activation. This enzyme is of vital importance in nitrogen metabolism. To be activated, urease requires binding with two nickel (Ni) atoms, and in plant cells it participates in the metabolism of compounds containing nitrogen (N). To date, urease activation appears to be the only enzymatic function of Ni in higher plants. The importance of Ni in the physiological and biochemical processes of plants, and the typical responses to the presence of Ni in soil and plants are discussed. Evidence of a close relationship between urease and Ni in the physiology of some plants is provided, thereby indicating that urease activity could be considered as a biochemical indicator of Ni deficiency before symptoms are visibly present.
Keywords: micronutrient; metalloenzyme; catalysis; cofactor
Introducción
La confirmación de que el Ni es un nutrimento esencial para las plantas se demostró al comprobar su función en la actividad de la ureasa. Algunos trabajos han demostrado que el Ni es un elemento móvil en la planta y se acumula en hojas y semillas de cebada (Hordeum vulgare L.) (Brown, Welch, & Cary, 1987a; Wood, Reilly, & Nyczepir, 2004a). Inclusive, los síntomas de deficiencia de Ni han sido inducidos en trigo (Triticum aestivum), avena (Avena sativa) y cebada (Hordeum vulgare), mostrando clorosis intervenal semejante a la provocada por la deficiencia de Fe, Mn, Zn y Cu (Brown, Welch, Cary, & Checkai, 1987b).
La ureasa es una enzima que se activa con la interacción de dos átomos de Ni. Una reacción catalizada por esta enzima es la hidrólisis de urea, teniendo como productos carbonato y amoníaco, seguida por una reacción espontánea de otra molécula de amoníaco y ácido carbónico. Esta enzima es importante en el metabolismo del nitrógeno; sin embargo, su actividad puede ser bloqueada o disminuida en ausencia de Ni (Wood, Reilly, & Nyczepir, 2004d). Este elemento es requerido para el metabolismo de las plantas en cantidades menores de 0.001 mg∙kg-1 de peso seco. La falta de Ni también interrumpe la asimilación del nitrógeno y el carbono durante la expansión del follaje (Bai, Reilly, & Wood, 2007b). Las manchas necróticas asociadas con la deficiencia de Ni se deben a los sitios de acumulación de urea o de los ácidos oxálico y láctico; lo que también indica que existen cambios en el metabolismo del carbono, en particular en la reducción de la respiración (Klucas, Hanus, Russell, & Evans, 1983; Wood, Reilly, & Nyczepir, 2004b).
En este contexto, el presente documento expone el estado del arte de la importancia de la ureasa y el Ni en los procesos fisiológicos y bioquímicos de las plantas, así como sus respuestas a la presencia del Ni en el suelo.
El Ni en el suelo
Los metales pesados están presentes en el suelo como consecuencia de las actividades antropogénicas o componentes naturales del mismo (Bosiacki & Wojciechowska, 2012). Se pueden encontrar diferentes metales que forman parte de los minerales, como magnesio (Mg) y níquel (Ni). El Ni se encuentra en el suelo en diversas formas, como nickelita (NiAs), garnielita y en forma de sulfuros de Fe y Ni (Wood et al., 2004a).
En la corteza terrestre existe similitud entre la distribución de Ni, Co y Fe. En los horizontes superficiales del suelo (capa arable), el Ni aparece ligado a formas orgánicas, parte de las cuales pueden encontrarse en forma de quelatos fácilmente solubles. En el suelo, los metales pesados pueden estar presentes como iones libres o disponibles, compuestos de sales metálicas solubles o compuestos insolubles o parcialmente solubilizables (óxidos, carbonatos e hidróxidos) (Bai, Reilly, & Wood, 2007a).
El Ni es de suma importancia en cuanto a su disponibilidad y potencial para lixiviarse de los perfiles del suelo hacia el agua subterránea, y difiere en cuanto a origen, ya que puede ser natural o antrópico (Polacco, Mazzafera, & Tezzoto, 2013). Este elemento es liberado al ambiente mediante actividades antropogénicas; tales como la minería, fundición, quema de combustibles fósiles, emisiones vehiculares, desechos domésticos, municipales e industriales, aplicación de fertilizantes y abonos orgánicos (Kutman, Kutman, & Cakmak, 2013).
El Ni varía en el suelo de 0.2 a 450 mg∙kg-1; sin embargo, lo más común es que los valores se encuentren entre 5 y 22 mg∙kg-1. Puede reemplazar al Zn, Fe y otros iones metálicos en algunas otras metaloenzimas de las plantas inferiores. La solubilidad del Ni se encuentra inversamente relacionada con el pH del suelo (Halstead, Finn, & Maclean, 1969; Mulrooney & Hausinger, 2003). Este elemento se usa principalmente como materia prima en las industrias metalúrgica y de galvanoplastia, como catalizador en la industria química y alimentaria, así como componente de las baterías. Las concentraciones de Ni2+ pueden llegar a 0.2 mg∙L-1 y 26,000 mg∙kg-1, en agua superficial y suelos contaminados, respectivamente (20 a 30 veces más que lo encontrado en áreas limpias).Este tipo de contaminación se ha convertido en un problema mundial (McGrath & Zhao, 2003).
Con el objetivo de reducir la contaminación de suelos con Ni, actualmente se emplean plantas ornamentales con propósitos de fitorremediación. Algunas especies de las familias Brasicaceae y Fabaceae son adecuadas para mejorar la arquitectura del paisaje y la extracción de este metal (Bosiacki & Wojciechowska, 2012).
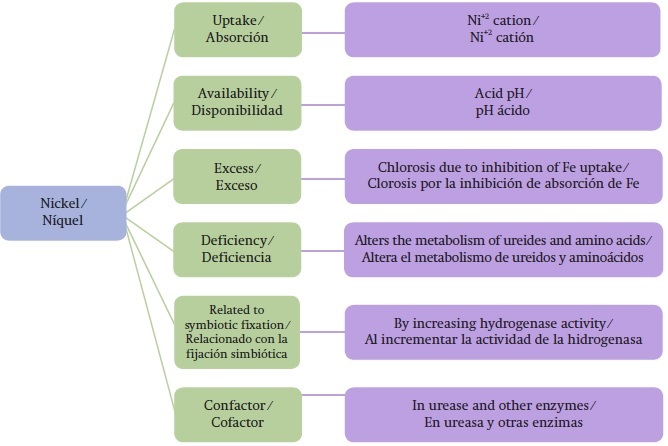
El Ni como micronutrimento esencial
Desde 2004 la Asociación Americana Oficial de Control de Nutrimentos Vegetales ha reconocido al níquel como elemento esencial en plantas, dada su relación con la enzima ureasa (Wood et al., 2004a). Aksu (2002) reporta que Chorella vulgaris requiere Ni para su crecimiento y se indica la necesidad de este elemento para el crecimiento de la cebada (Hordeum vulgare L.). A pesar de los estudios realizados y comparado con otros microelementos, poco se conoce acerca del metabolismo o la función del Ni, (Figura 1) (Contreras et al., 2006). En parte, esto es debido a que los niveles considerados requeridos para las plantas son pequeños (0.001 mg∙kg-1 de peso seco) en relación con la abundancia relativa de Ni en prácticamente todos los suelos (mayor de 5 kg∙ha-1) (Wood et al., 2004a, 2004b; Wood, Reilly, & Nyczepir, 2004c). La sintomatología en los folíolos de nogal pecanero (Carya illinoinensis [Wangenh.] K.Koch) que se deforman (conocida como “oreja de ratón”) está relacionada con la deficiencia de este elemento (Wood et al., 2004a, 2004b, 2004c). Inicialmente este desorden se atribuyó a varias causas como daños por frío, enfermedades virales o deficiencias de Mn o Cu. Los análisis foliares de hojas sanas y afectadas, revelaron que los síntomas son provocados por deficiencia de Ni o inducidos por exceso de Zn en el suelo (Figura 2) (Wood et al., 2004b).
El Ni en la fisiología de las plantas
La absorción de Ni en plantas se lleva a cabo, principalmente, por los sistemas radiculares a través de difusión pasiva y transporte activo; esto varía dependiendo de la especie vegetal, la forma y la concentración del Ni en el suelo o en la solución nutritiva. Por ejemplo, los compuestos solubles con Ni pueden ser absorbidos a través del sistema de transporte de cationes. Desde que el Cu2+ y el Zn2+ inhiben la asimilación de Ni2+ de manera competitiva, estos tres iones metálicos solubles parecen ser ingresados por el mismo sistema de transporte pasivo. La absorción de Ni por las plantas depende de las concentraciones de Ni2+, el metabolismo de la planta, la acidez del suelo o de la solución, la presencia de otros metales y la composición de la materia orgánica. Como ejemplo, la absorción de Ni2+ por Lathyrus sativus se incrementó con la disminución del pH hasta 5.0, luego disminuyó a medida que se elevó el pH a 8.0 (Walsh & Orme- Johnson, 1987; Mulrooney & Hausinger, 2003).
En Berkheya coddii la absorción de Ni2+ es inhibida por Ca2+ y Mg2+. Sin embargo, Ca2+ y Mg2+ no compiten en la afluencia de Ni2+ en raíces de cebada (Hordeum vulgare L.); en este caso con los iones Zn2+, Cu2+, Co2+, Cd2+ y Pb2+ los que inhiben al Ni2+. Entre estos Zn2+ y Cu2+ se mostraron muy competitivos, Co2+ fue ligeramente, y Cd2+ y Pb2+ parecieron no ser competitivos (Walsh & Orme-Johnson, 1987; Mulrooney & Hausinger, 2003).
La absorción de Ni2+ por Datura inoxia es favorecida con la aplicación de ácido etilendiaminotetraacético (EDTA) en la superficie del suelo. Además, pueden influir otros factores en la absorción de Ni2+, tales como la duración de la estación, el método de siembra y las propiedades geoquímicas del suelo Walsh & Orme-Johnson, 1987; Mulrooney & Hausinger, 2003)
El 50% del Ni absorbido por las plantas es retenido en las raíces; esto puede deberse a los sitios de intercambio catiónico de las paredes de las células del parénquima xilemático y a la inmovilización en las vacuolas de las raíces. Además, 80% del Ni en las raíces está presente en el cilindro vascular; mientras que menos de 20% se encuentra en el córtex. Esta distribución sugiere gran movilidad del Ni en xilema y floema.
El Ni es llevado de las raíces a los brotes y a las hojas a través de la corriente de transpiración por medio del xilema. Este elemento es suministrado a las partes meristemáticas de las plantas por retranslocación de hojas viejas a hojas nuevas, y a yemas, frutos y semillas a través del floema. Este transporte está estrechamente regulado por complejos metal-ligandos o metal- proteínas que se unen específicamente al Ni; tales como la nicotianamina (NA), histidina (His) y los ácidos orgánicos (ácido cítrico e iones malato), que pueden actuar como quelatos intracelulares, los cuales se unen al Ni en el citosol o en compartimentos subcelulares para el transporte, translocación y acumulación dentro de las plantas. Han sido evidenciados complejos Ni-NA en las raíces de varias plantas como Thlaspi caerulescens, Ni-His en Alyssum lesbiacum, Alyssum montanum y Brassica juncea, y Ni citrato en hojas de Thlaspi goesingense y Thlaspi arvense (Ghaderian, Mohtadi, Rahiminejad, & Baker, 2007).
Es notable que las formas de Ni en los exudados del xilema están estrechamente influenciadas por el pH. Este elemento es principalmente quelatado por el citrato en pH de 5.0, y por la histidina en pH de 6.5. Se ha encontrado que el Ni es distribuido preferentemente en las células de la epidermis en tallos y hojas de las hiperacumuladoras (Allyssum bertolonii, Alyssum lesbiacum y Thlaspi goesingense), probablemente en las vacuolas en lugar de en la pared celular. Sin embargo, de 67 a 73 % del Ni en las hojas se encontró en las paredes celulares de Thlaspi goesingense. El consenso es que el Ni en tallos y hojas está principalmente localizado en las vacuolas, paredes celulares y tricomas epidérmicos asociados con citrato, malato y malonato. Asimismo, las cantidades de este elemento dentro de los diferentes organelos y en el citoplasma pueden diferir sustancialmente. Aproximadamente 87 % del Ni, en las células de hojas de cuatro especies, se localizó en citoplasma y vacuolas; mientras que los cloroplastos contenían de 8 a 9.9 %, y las mitocondrias y ribosomas de 0.32 a 2.85 % (Kramer, Smith, Wenzel, Raskin, & Salt, 1997; Kutman, Kutman, & Cakmak, 2014).
Respuesta de los cultivos al Ni
Durante tres generaciones se cultivaron plantas de cebada (Hordeum vulgare L.) en sustrato nutritivo sin Ni. Las semillas germinadas presentaron concentraciones extremadamente pequeñas de este micronutrimento, y el porcentaje de germinación se redujo linealmente en relación con las concentraciones de Ni menores al nivel crítico (100 μg∙kg-1). En el frijol (Phaseolus vulgaris) y la soya (Glycine max L.), la forma de transporte del NH4+ fijado en los nódulos de la raíz son los ureidos ácido alantoico y citrulina, principalmente, los cuales se transportan vía xilema hasta las hojas, y vía floema pasan de las hojas más viejas a las más jóvenes y a las semillas en desarrollo. El metabolismo de dichos ureidos implica la formación de urea, y ésta solo puede hidrolizarse en presencia de ureasa, enzima que contiene Ni. Si el metal no se encuentra presente, la concentración de urea aumenta y se comporta como un compuesto tóxico que produce necrosis en las puntas de las hojas. Dado que la degradación de las bases púricas (adenina y guanina) ocurre vía ureidos, parece probable que todas las plantas presenten y, en consecuencia, necesiten Ni para su funcionamiento.
En este sentido, los experimentos realizados en cebada (Hordeum vulgare), aunque obligan a llegar a la tercera generación para que se obtengan semillas incapaces de germinar y con importantes anormalidades estructurales, demuestran el primer criterio de la esencialidad de un nutrimento, en este caso Ni. Asimismo, diversas bacterias presentan dependencia clara de Ni, siendo Rhizobium la más conocida. En esta especie, el Ni forma parte de la enzima hidrogenasa, responsable de la recuperación del hidrógeno implicado en el proceso de fijación de nitrógeno (Bai et al., 2007b).
En el otoño, la aplicación foliar de sulfato de Ni (NiSO4 · 6H2O) induce el transporte de Ni a los tejidos de los tallos y brotes en dormancia en cantidad suficiente para el crecimiento normal de nogal pecanero (Carya illinoinensis [Wangenh.] K. Koch). En la primavera, las hojas de las plantas tratadas son normales en forma y tamaño, y presentan 7 mg de Ni∙kg-1, mientras que las hojas con síntomas de deficiencia tienen 0.5 mg de Ni∙kg-1. Los suelos de los huertos que presentan severa deficiencia contienen de 0.4 a 1.4 kg de Ni∙ha-1 (Wood, Reilly, & Nyczepir, 2006).
Los árboles de nogal pecanero transportan N como ureidos a principios de la primavera. El estado nutricional de Ni en estos árboles afecta el metabolismo tanto de ureidos como de amidas, y la composición de la savia del xilema en primavera. En este frutal la deficiencia de Ni afecta cuantitativamente la composición de xantina en la savia, ácido alantoico, asparagina, citrulina y β-feniletilamina. El efecto observado del Ni sobre el metabolismo del nitrógeno es evidencia de que la nutrición con Ni es más importante para el manejo de este nutriente en los cultivos (Bai et al., 2007b).
Aspectos generales y distribución de la ureasa
En 1926, James B. Sumner, un profesor asistente en la Universidad de Cornell, mostró mediante rayos X que la ureasa es una proteína de forma cristalizada. Este trabajo fue la primera demostración de que una proteína pura puede funcionar como una enzima. La ureasa (EC 3.5.1.5) fue la primer enzima cristalizada, y funcionalmente pertenece a las familias amidohidrolasas y fosfotriesterasas (Todd et al., 2006).
El peso molecular de la ureasa es de 545,000 Da. Consiste en seis subunidades idénticas de 90,790 Da, organizada en una estructura bipiramidal trigonal. El sitio activo está compuesto por un dímero de Ni (II), siendo la geometría de coordinación octaédrica distorsionada. Entre otras metalhidrolasas dinucleares en la familia, las ureasas son las únicas que poseen iones de Ni (II) en el sitio activo (Kojima, Bohner, & Von-Wirén, 2006). Esta enzima contiene cuatro dominios estructurales (Figura 3). Uno de ellos presenta un centro biníquel con separación de 3.5 armstrongs entre los dos átomos de Ni.
Un residuo de lisina modificado (carbamilada) (Figura 4) proporciona un ligando con oxígeno a cada níquel; lo cual explica por qué el dióxido de carbono es imprescindible para la activación de la apoenzima (parte proteica de una holoenzima); es decir, una enzima que no puede llevar a cabo su acción catalítica desprovista de los cofactores necesarios, ya sean iones metálicos (Fe, Cu, Mg, etc.) u orgánicos, que a su vez puede ser una coenzima o un grupo prostético (Kojima et al., 2006; Alexandrova & Jorgensen, 2007).
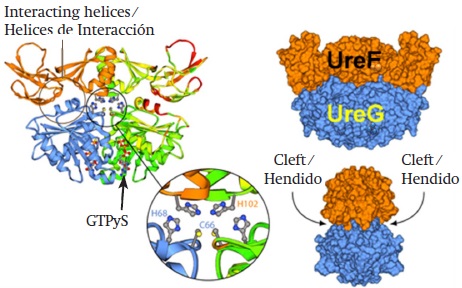
Activación de la ureasa
Como muchas otras enzimas, la ureasa no es funcional inmediatamente, sino que necesita unirse con dos átomos de níquel para ser activada. En concreto, tres proteínas accesorias denominadas UreD, UreF y UreG forman un complejo capaz de colocar el níquel en el lugar correcto en la ureasa (Figura 5). Así, una vez que el Ni está en su sitio (Figura 6), la enzima rompe la urea y produce amonio. Además, cuando se impide la formación del complejo UreD-UreF-UreG se inhibe la síntesis de ureasa activa (Lebrette et al., 2014).
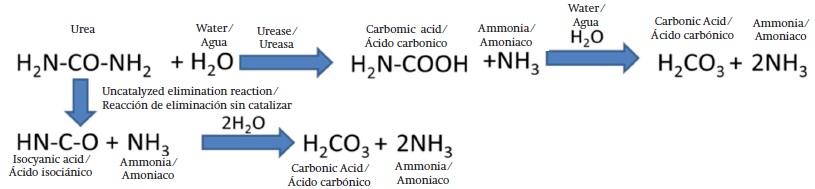
Hidrólisis de la urea
La reacción catalizada por la ureasa es la hidrólisis de urea hacia ácido carbámico; la cual se produce 1014 veces más rápido en presencia de dicha enzima, teniendo como productos el ácido carbónico y el amoníaco, seguida de una reacción espontánea de otra molécula de amoníaco y ácido carbónico (Figura 7) (Zambelli et al., 2014).
La urea puede ser aprovechada directamente por las raíces o partes áreas. Después de ser absorbida se hidroliza rápidamente por la ureasa, en las raíces (por ejemplo en soya) o después de la translocación a los brotes (por ejemplo maíz). En suelo, la hidrólisis de la urea, por lo general, se lleva a cabo antes de la absorción por raíz (Almanza, Rojas, Borda, Galindo, & Galindo, 2009).
La urea se convierte en amoníaco y después éste se transforma en amonio. Esta transformación a amonio es un proceso de hidrólisis que, dependiendo del pH del suelo, da lugar a diferentes productos. Así, a pH mayor de 6.3 la urea se hidroliza en amonio y en ion bicarbonato, pero si es menor de 6.2 se descompone en amonio, dióxido de carbono y agua (Figura 8) (Lebrette et al., 2014).
Ureasa en plantas y el Ni como cofactor
La deficiencia de Ni inhibe la acción de la ureasa, y esta condición lleva a la acumulación de urea, lo que provoca la presencia de manchas necróticas en hojas. La deficiencia de Ni interrumpe el metabolismo de los ureidos, aminoácidos y ácidos orgánicos, y debido al estrés oxidativo generado por esta deficiencia se acumulan los ácidos oxálico y láctico (Kutman et al., 2014). Las especies transportadoras de ureidos como el nogal pecanero (Carya illinoinensis [Wangenh.] K.Koch) poseen mayor requerimiento de Ni que las especies transportadoras de amidas, como las leguminosas. Así aumenta la posibilidad de que los sistemas transportadores de ureidos puedan tener enzimas que requieren Ni para su activación o para intensificar su actividad (Wood et al., 2004a). Los candidatos probables para estos sistemas son enzimas que afecten el catabolismo de ureidos.
Hasta la fecha, los efectos metabólicos de la deficiencia de Ni sólo han sido reportados para unas cuantas especies anuales. Un ejemplo de lo anterior es la cebada (Hordeum vulgare), la cual mostró alteraciones en el metabolismo de los aminoácidos, malato y varios aniones inorgánicos (SO4-, Cl-, P y NO3-) (Brown, Welch, & Madison, 1990; Bai, Liping, & Wood, 2013).
La ureasa se encuentra ligada a la fracción celulósica de la pared de células de cotiledones de diferentes variedades de cucurbitáceas, entre ellas Cucurbita ficifolia. Esta planta está estrechamente emparentada con Cucurbita spp., aunque es atípica en sus caracteres cromosómicos y bioquímicos (Vicente, Villalobos, & Hernández, 1975; Almanza et al., 2009).
El efecto de la aplicación foliar de Ni en plantas de Cucurbita ficifolia, en concentraciones de 1.0, 2.5 y 5.0 mg∙L-1 y un testigo sin aplicación de Ni, se estudió al cuantificar la incidencia de ureasa cristalina en las semillas y la observación del crecimiento y desarrollo morfológico de las plantas desde la primera aplicación hasta la fructificación. El Ni causó fitotoxicidad en todas las plantas. El crecimiento de frutos y semillas fue indirectamente proporcional a las concentraciones aplicadas. La adición de 1.0 y 2.5 mg∙L-1 de Ni fue tolerada por las plantas, pero se presentó clorosis intervenal. En 100 % de las plantas, 5.0 mg de Ni∙L-1 causaron senescencia de flores, impidiendo la fructificación. La cantidad de ureasa obtenida fue directamente proporcional a las concentraciones de Ni aplicadas. La actividad de esta enzima en su orden fue: 1.0 mg∙L-1 de Ni > testigo >mg∙L-1 de Ni. La ureasa obtenida de cada uno de los tratamientos tuvo rendimiento menor que la comercial (Almanza et al., 2009).
La ureasa en plantas
La ureasa cataliza la hidrolisis de urea para producir amonio, que puede ser utilizado en las células radiculares. Esto es posible debido a la presencia de estas enzimas en los suelos, un hecho explotado en las prácticas de fertilización de urea (Almanza et al., 2009). Es importante destacar que cantidades grandes de este compuesto pueden constituir un peligro grave para las plantas y el ambiente. El uso de inhibidores de ureasa es una opción para incrementar la eficiencia de aplicación de N superficial como urea hasta 50 %. En follaje, la urea se aplica para mejorar la absorción de fertilizantes foliares. La urea es absorbida rápidamente; sin embargo, puede ser tóxica a concentraciones de 2 % o mayores (Almanza et al., 2009).
De ser metabolizada, la urea no se acumula y puede servir como una fuente de nitrógeno. Debido a la generación de amoniaco, también se ha planteado la hipótesis de que la ureasa cumple una función de defensa donde exihibe propiedades antifúngicas e insecticida (Figura 9) (Wood, Reilly, & Nyczepir, 2004d; Bai et al., 2007b; Zambelli et al., 2014). La ureasa es especialmente abundante en las semillas de leguminosas; la harina de soya (Glycine max) contiene 0.012 % y el frijol (Canavalia ensiformis [L.] DC.) de 0.07 a 0.14 % (Wood et al., 2006).
Conclusiones
La ureasa es la enzima que cataliza la hidrólisis de la urea en dióxido de carbono y amoníaco, funcionalmente, y pertenece a la familia de amidohidrolasas y fosfotriesterasas. En las células vegetales, esta enzima participa en el metabolismo de los compuestos que contienen N. Hasta la fecha, la única función enzimática del Ni en las plantas superiores parece ser la activación de la ureasa. Si el metal no se encuentra presente, la concentración de urea aumenta y se comporta como un compuesto tóxico que produce necrosis en las puntas de las hojas. Dado que la degradación de las bases púricas (adenina y guanina) ocurre vía ureidos en las plantas, parece probable que todas las plantas, y no solo las leguminosas, requieran Ni para su funcionamiento
References
Aksu, Z. (2002). Determination of the equilibrium, kinetic and thermodynamic parameters of the batch biosorption of nickel (II) ions onto Chlorella vulgaris. Process Biochemistry, 38(1), 89-99. doi: 10.1016/S0032-9592(02)00051-1 [ Links ]
Alexandrova, A. N., & Jorgensen, W. L. (2007). Why urea eliminates ammonia rather than hydrolyzes in aqueous solution. Journal of Physical Chemistry B, 111(4), 720-730. doi: 10.1021/jp066478s [ Links ]
Almanza, M. P., Rojas, H. A., Borda, G. C., Galindo, A. R., & Galindo, D. R. (2009). Aplicación foliar de níquel en Cucurbita ficifolia Bouché para producción de ureasa (EC 3.5.1.5) cristalina. Agronomía Colombiana, 27(1), 33-40 Retrieved from http://revistas.unal.edu.co/index.php/agrocol/article/ view/11328 [ Links ]
Bai, C., Liping, L., & Wood, B. (2013). Nickel affects xylem Sap RNase and converts RNase A to a urease. Plant Biology, 13(207). doi: 10.1186/1471-2229-13-207 [ Links ]
Bai, C., Reilly, C. C., & Wood, B. W. (2007a). Nickel deficiency affects nitrogenous forms and urease activity in spring xylem sap of pecan. Journal of the American Society for Horticultural Science, 132(3), 302-309. Retrieved from http://journal.ashspublications.org/content/132/3/302.full [ Links ]
Bai, C., Reilly, C. C., & Wood, B. W. (2007b). Insights into the nutritional physiology of nickel. Acta Horticulturae, 772, 365-368. doi: 10.17660/ActaHortic.2008.772.62 [ Links ]
Bosiacki, M., & Wojciechowska, E. (2012). Phytoextraction of nickel by selected ornamental plants. Ecological Chemistry and Engineering S, 19(3), 331-345. doi: 10.2478/v10216-011-0024-9 [ Links ]
Brown, P. H., Welch, R. M., & Madison, J. T. (1990). Effect of nickel deficiency on soluble anion, amino acid, and nitrogen levels in barley. Plant Soil, 125, 19-27. doi: 10.1007/BF00010740 [ Links ]
Brown, P. H., Welch, R. M., & Cary, E. E. (1987a). Nickel: A micronutrient essential for high plants. Plant Physiology, 85(3), 801-803. doi: 10.1104/pp.85.3.801 [ Links ]
Brown, P. H., Welch, R. M., Cary, E. E., & Checkai, R. T. (1987b). Beneficial effects of nickel on plant growth. Journal of Plant Nutrition, 10(9-16), 2125-2135. doi: 10.1080/01904168709363763 [ Links ]
Contreras, R., Fontal-Rivera, B., Reyes-Malavé, M., Suárez, T., Bellandini, F., Romero, I., & Cancines, P. (2006). Algo más sobre alimentos: una visión desde la química. México: Universidad de los Andes. Retrieved from http://webdelprofesor.ula.ve/ciencias/Ricardo/pdf [ Links ]
Ghaderian, S. M., Mohtadi, A., Rahiminejad, M. R., & Baker, J. M. (2007). Nickel and other metal uptake and accumulation by species of Alyssum (Brassicaceae) from the ultramafics of Iran. Environmental Pollution, 145(1), 293-298. doi: 10.1016/j.envpol.2006.03.016 [ Links ]
Halstead, R. L., Finn, B. J., & Maclean, A. J. (1969). Extractability of nickel added to soils and its concentration in plants. Canadian Journal of Soil Science, 49, 335. Retrieved from http://pubs.aic.ca/doi/pdf/10.4141/cjss69-046 [ Links ]
Klucas, R. V., Hanus, F. J., Russell, S. A.,& Evans, H. J. (1983). Nickel: a micronutrient element for hydrogen-dependent growth of Rhizobium japonicum and for expression of urease activity in soybean leaves. Proceedings of the National Academy of Sciences, 80(8), 2253-2257. [ Links ]
Kojima, S., Bohner, A., & Von-Wirén, N. (2006). Molecular mechanisms of urea transport in plants. Journal of Membrane Biology, 212(2), 83-91. doi: 10.1007/s00232-006-0868-6 [ Links ]
Kramer, U., Smith, R. D., Wenzel, W. W., Raskin, I., & Salt, D. E. (1997). The role of metal transport and tolerance in nickel hyperaccumulation by Thlaspi goesingense Halacsy. Plant Physiology, 115(4), 1641-1650. doi: 10.1104/pp.115.4.1641 [ Links ]
Kutman, B. Y., Kutman, U. B., & Cakmak, I. (2013). Foliar nickel application alleviates detrimental effects of glyphosate on grain yield and seed quality of wheat. Journal of Agricultural and Food Chemistry, 61(35), 8364-8372. doi: 10.1021/jf402194v [ Links ]
Kutman, B. Y., Kutman, U. B., & Cakmak, I. (2014). Effects of seed nickel reserves or externally supplied nickel on the growth, nitrogen metabolites and nitrogen use efficiency of urea- or nitrate-fed soybean. Plant and Soil, 376(1-2), 261-276. doi: 10.1007/s11104-013-1983-7 [ Links ]
Lebrette, H., Brochier-Armanet, C., Zambelli, B., Reuse, H., Borezïe-Durant, E., Ciurli, S., & Cavazza, C. (2014). Promiscuous nickel import in human pathogens: structure, thermodynamics, and evolution of extracytoplasmic nickel-binding proteins. Structure, 22(10), 1421-1432. doi: 10.1016/j.str.2014.07.012 [ Links ]
McGrath, S. P., & Zhao, F. J. (2003). Phytoextraction of metals and metalloids from contaminated soils. Current Opinion in Biotechnology, 14(3), 277-282. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/12849780 [ Links ]
Mulrooney, S. B., & Hausinger, R. P. (2003). Nickel uptake and utilization by microorganisms. FEMS Microbiology Reviews, 27, 239-261. doi: 10.1016/S01686445(03)00042-1 [ Links ]
Polacco, J. C., Mazzafera, P., & Tezzoto, T. (2013). Opinion: nickel and urease in plants: still many knowledge gaps. Plant Science, 79(90), 199-200. doi: 10.1016/j.plantsci.2012.10.010 [ Links ]
Todd, C. D., Tipton, P. A., Blevins, D. G., Piedras, P., Pineda, M., & Polacco, J. C. (2006). Update on ureide degradation in legumes. Journal of Experimental Botany, 57(1), 5-12. doi: 10.1093/jxb/erj013 [ Links ]
Vicente, C., Villalobos, N., & Hernández, A. (1975). Ureasa de cucurbitáceas y su localización citológica.Anales del Instituto Botánico, 32(1), 269-277. Retrieved from http://www.rjb.csic.es/jardinbotanico/ficheros/documentos/pdf/anales/1975/Anales_32%281%29_269_277.pdf [ Links ]
Walsh, C. T., & Orme-Johnson, W. H. (1987). Nickel enzymes.Biochemistry, 26, 4901-4906. doi: 10.1021/bi00390a001 [ Links ]
Wood, B. W., Reilly, C. C., & Nyczepir, A. P. (2004a). Mouse-ear of pecan: I. Symptomology and occurrence. HortScience, 39(1), 87-94. Retrieved from http://hortsci.ashspublications.org/content/39/1/87.full.pdf+html [ Links ]
Wood, B. W., Reilly, C. C., & Nyczepir, A. P. (2004b). Mouse- ear of pecan: II. Influence of nutrient applications. HortScience, 39(1), 95-100. Retrieved from http://hortsci.ashspublications.org/content/39/1/95.full.pdf+html [ Links ]
Wood, B. W., Reilly, C. C., & Nyczepir, A. P. (2004c). Mouse-ear of pecan: a nickel deficiency. HortScience, 39(6), 1238-1242. Retrieved from http://hortsci.ashspublications.org/content/39/6/1238.full.pdf+html [ Links ]
Wood, B. W., Reilly, C. C., & Nyczepir, A. P. (2004d). Nickel deficiency is occurring in orchard trees. HortScience, 39(4), 858. Retrieved from http://hortsci.ashspublications.org/content/39/4/858.2.full.pdf+html [ Links ]
Wood, B. W., Reilly, C. C., & Nyczepir, A. P. (2006). Field deficiency of nickel in trees: symptoms and causes. Acta Horticulturae, 721, 83-87. Retrieved from http://naldc.nal.usda.gov/naldc/download.xhtml?id=23592&content=PDF [ Links ]
Zambelli, B., Berardi, A., Martin-Diaconescu, V., Mazzei, L., Musiani, F., Maroney, M. J., & Ciurli, S. (2014). Nickel binding properties of Helicobacter pylori UreF, an accessory protein in the nickel-based activation of urease. Journal of Biological Inorganic Chemistry, 19(3), 319-334. doi: 10.1007/s00775-013-1068-3 [ Links ]
Recibido: 17 de Diciembre de 2014; Aprobado: 20 de Abril de 2016











 texto em
texto em