Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.20 no.2 Chapingo may./ago. 2014
https://doi.org/10.5154/r.rchsh.2013.07.023
Componentes nutricionales y antioxidantes de dos especies de guaje (Leucaena spp.): un recurso ancestral subutilizado
Nutritional components and antioxidants of two species of guaje (Leucaena spp.): an underutilized traditional resource
Nallely Román-Cortés1; María del Rosario García-Mateos1*; Ana María Castillo-González1; Jaime Sahagún-Castellanos1; Adelina Jiménez-Arellanes2
1 Departamento de Fitotecnia, Universidad Autónoma Chapingo. km 38.5 Carretera México-Texcoco. C. P. 56230. Chapingo, Texcoco, Estado de México, México. Correo-e: rosgar08@hotmail.com (*Autor para correspondencia).
2 Unidad de Investigación Médica en Farmacología de Productos Naturales UMAE. Hospital de Pediatría, Siglo XXI IMSS. Av. Cuauhtémoc 330, col. Doctores. C. P. 06720. Delegación Cuauhtémoc, México, D. F.
Recibido: 08 de julio de 2013.
Aceptado: 05 de agosto de 2014.
Resumen
El guaje (Leucaena spp.) es una planta de vaina y semillas comestibles, un recurso ancestral subutilizado por los pueblos mesoamericanos. El valor nutricional y nutracéutico del guaje se desconoce pese a su consumo vigente en las poblaciones rurales. El objetivo de este trabajo fue evaluar el contenido de minerales, componentes nutricionales y antioxidantes para contribuir a la revalorización alimentaria del guaje rojo (L. esculenta Benth.) y verde (L. leucocephala Lam.). Los contenidos de antocianinas, flavonoides, fenoles totales, taninos y actividad antioxidante se cuantificaron, así como la composición proximal y mineral. Las semillas de guaje rojo superaron a las de guaje verde en los contenidos de N, Mg, Mn, P y Zn; en contraste, las semillas de guaje verde presentaron niveles mayores de Na y de Fe. El contenido de fibra cruda fue 10.55 y 10.07 % en guaje rojo y verde, respectivamente, mientras que el de proteína fue 33.12 % en guaje rojo y 31.7 % en el verde. El alto contenido de compuestos fenólicos fue mayor en las semillas frescas de guaje rojo (1,088.70 mg equivalentes de ácido gálico [EAG]·100 g-1 p. f.) que en las verdes (969.09 mg EAG·100 g-1 p. f.), pero las últimas presentaron mayor cantidad de taninos. La elevada actividad secuestradora de radicales libres (97.22 a 98.11 %) obtenida por el método ABTS (ácido 2,2'-azino-bis(3-etilben-zotiazolin)-6-sulfónico), puede estar asociada al contenido de compuestos fenólicos. En conclusión, las semillas de guaje podrían considerarse un alimento funcional, principalmente las de guaje rojo debido a su calidad nutricional y mayor actividad antioxidante.
Palabras clave: Flavonoides, fenoles totales, taninos, proteína, minerales.
Abstract
The guaje (Leucaena spp.), a leguminous plant with edible seeds, is a traditional resource underutilized by Mesoamerican peoples. The nutritional and nutraceutical value of the guaje is unknown despite being consumed by rural people today in mainly central and southern Mexico. The aim of this study was to assess the mineral, nutritional and antioxidant contents of the red guaje (L. esculenta Benth.) and green guaje (L. leucocephala Lam.) in order to contribute to a reevaluation of their food properties. Their anthocyanin, flavonoid, total phenol, and tannin contents, as well as their antioxidant activity and proximate and mineral composition, were quantified. Red guaje seeds outperformed green guaje ones in N, Mg, Mn, P and Zn contents; by contrast, green guaje seeds had higher Na and Fe levels. Crude fiber content was 10.55 and 10.07 % in red and green guaje, respectively, while protein content was 33.12 % and 31.7 %, respectively. The high content of phenolic compounds was greater in the fresh red guaje seeds (1,088.70 mg gallic acid equivalents [GAE]·100 g-1 FW) than in the green ones (969.09 mg GAE·100 g-1 FW), but the latter had a greater amount of tannins. The high free radical scavenging activity (97.22 to 98.11 %) obtained by the ABTS (2.2 '-azino-bis (3-ethylbenzthiazoline)-6-sulfonic acid) method may be associated with the content of phenolic compounds. In conclusion, guaje seeds could be considered as a functional food, but mainly the red guaje ones due to their nutritional quality and higher antioxidant activity.
Keywords: Flavonoids, total phenols, tannins, protein, minerals.
INTRODUCCIÓN
Una dieta elevada en alimentos de origen animal y grasas saturadas incrementa el riesgo de enfermedades cardiovasculares y de algunos tipos de cáncer (Pierart y Rozowzky, 2006), lo que ha generado el interés de promover el consumo de proteínas de origen vegetal (Pamplona-Roger, 2006; Espín et al., 2007). Las leguminosas, al igual que los cereales, frutas y hortalizas tienen componentes que promueven la salud, además del valor nutricional que poseen (Shetti et al., 2009).
En algunos países de América y África, el consumo de leguminosas, en particular de frijol (Phaseolus vulgaris L.), ha contribuido a mejorar la mala nutrición de sus habitantes (Reynoso-Camacho et al., 2006; Audu y Aremu, 2011; Duarte-Martino et al., 2012), debido al alto contenido de proteína, vitaminas, minerales y fibra, ya que son alimentos de fácil consumo para la población de bajos recursos (Duarte-Martino et al., 2012). Otra alternativa para tal situación podrían ser aquellas especies subutilizadas como Leucaena spp.; sin embargo, su potencial nutricio y nutracéutico no han sido estudiados. Diferentes especies de Leucaena se consumen desde épocas remotas en el México prehispánico (Basurto, 2011); después de más de 500 años, aún son un recurso alimentario vigente por su alto contenido en vitamina A, proteína, fibra (Zárate, 1987) y ácidos grasos (palmítico, esteárico, behénico, lignocérico, oleico y linoleico). Las especies de Leucaena se conocen comúnmente como leucaena, tantan, guaje o huaje según la especie y la región del país donde se consumen (Parrota, 1992; Martínez, 1994). Las especies se encuentran ampliamente distribuidas en el centro y sur de México, particularmente en la península de Yucatán y en el Itsmo de Tehuantepec (Zárate, 1999; Grether et al., 2006). Las semillas frescas de guaje son de suma importancia en regiones suburbanas y rurales del país, se consumen crudas o cocidas en platillos tradicionales dependiendo de su frescura o madurez y forman parte de la identidad cultural de algunas entidades (Guerrero y Oaxaca). La calidad nutricia y el contenido de nutracéuticos asociados a la actividad antioxidante de Leucaena se desconocen, pero otras leguminosas como el frijol son fuente importante de componentes nutricionales (proteínas, carbohidratos, fibra, vitaminas y algunos minerales) (Reynoso-Camacho et al., 2006; Duarte-Martino et al., 2012), por lo que han llamado la atención como un alimento funcional-nutracéutico, debido a la gran variedad de fitoquímicos (compuestos fenólicos, flavonoides, taninos y ácidos grasos insaturados).
Actualmente, el consumidor prefiere alimentos nutracéuticos o funcionales porque previenen algunas enfermedades degenerativas y mantienen la buena salud, lo que ha ocasionado gran interés de los investigadores para estudiar el contenido de fitoquímicos con actividad antioxidante en granos y leguminosas (Salinas-Moreno et al., 2012). Se han incrementado las evidencias epidemiológicas y farmacológicas de las propiedades nutracéuticas de compuestos biológicamente activos presentes en las plantas comestibles, contribuyendo a la prevención y reducción de padecimientos cardiacos, diabetes, hipertensión, Alzheimer y arterioesclerosis, entre otros de origen oxidativo (Tachakittirungrod et al., 2007; Chaturvedi et al., 2011; Kaisoon et al., 2011; Chew et al., 2011). En México existe una gran riqueza productiva y diversidad vegetal, por tanto, es recomendable ampliar las investigaciones de la calidad nutricia y nutracéutica de alimentos autóctonos que contribuyan a la conservación de la identidad cultural del país y a la generación de disponibilidad comercial de especies de cultivo rural como el guaje. Con base en lo antes señalado, el objetivo del presente estudio fue evaluar el contenido de minerales, los componentes nutricionales y antioxidantes para contribuir a la revalorización alimentaria de las especies de guaje rojo (L. esculenta Benth.) y guaje verde (L. leucocephala Lam.).
MATERIALES Y MÉTODOS
Material vegetal
Las vainas de guaje rojo y verde, sin alteraciones morfológicas y patológicas visibles, se obtuvieron en el mercado municipal de la ciudad de Iguala de la Independencia, Guerrero, México. Las semillas se desprendieron de la vaina, se lavaron en agua corriente y, posteriormente, se enjuagaron con agua destilada.
Cuantificación de minerales
Las semillas se molieron en un molino Thomas-Wiley Mill (Thomas Scientific, Swedesboro, NJ, USA). La harina se mantuvo en congelación a -20 °C, para análisis posteriores. La harina de las semillas frescas de guaje rojo (0.5 g) y verde (0.5 g) se sometió separadamente a una digestión húmeda con una mezcla diácida (H2SO4:HClO4, 4:1 v/v) y peróxido de hidrógeno. La determinación de Al, B, Ca, Cu, Fe, K, Mg, Mn, Na, P, N y Zn se realizó en un espectrofotómetro de emisión atómica de plasma por inducción acoplada (ICP-AES) VARIAN modelo Liberty II (USA). El contenido de N se determinó por el método colorimétrico mediante la digestión en micro-kjeldahl, descrito por Alcántar y Sandoval (1999).
Análisis proximal
Las semillas se secaron en una estufa a 55 °C y se molieron en molino Thomas-Wiley Mill (Thomas Scientific, Swedesboro, NJ, USA). Los porcentajes de humedad, lípidos, fibra cruda y ceniza se determinaron mediante los métodos descritos por la AOAC (1998). El contenido de ácidos grasos se calculó a partir de la siguiente fórmula:
AG = 0.8(FC)
Donde:
AG = Ácidos grasos (%)
FC = Fibra cruda (%)
El contenido de carbohidratos totales se calculó mediante la fórmula utilizada por Audu y Aremu (2011):
CT = 100 - (PC + L + C)
Donde:
CT = Carbohidratos totales (%)
PC = Proteína cruda (%)
L = Lípidos (%)
C = Cenizas (%)
Cuantificación de fitoquímicos
Preparación de extracto metanólico.
Se mezcló 1 g de semilla fresca molida con 10 mL de MeOH acuoso al 80 % (v/v). La mezcla se homogeneizó mediante agitación en un vortex, se sonicó por 15 min a temperatura ambiente, se dejó reposar durante 24 h, y posteriormente se centrifugó por 10 min a 1,409 x g, para usarse en la cuantificación de los fitoquímicos.
Cuantificación de fenoles
Se tomaron 0.5 mL de extracto metanólico y se agregaron 0.5 mL del reactivo Folin-Ciocalteu (0.2 N) y 4 mL de una solución de Na2CO3 (0.7 M). La mezcla se incubó a temperatura ambiente y en oscuridad durante 2 h. Se tomaron lecturas de la mezcla en un espectrofotómetro Genesys 10s (Thermoscientific, Florida, USA), para determinar la absorbancia a una longitud de onda de 765 nm. La concentración de fenoles se calculó a partir de una curva estándar preparada a base de ácido gálico. El contenido total de fenólicos en el extracto se expresó en mg equivalentes de ácido gálico por 100 g de peso fresco de la muestra (mg EAG·100 g-1 p. f.) según el método modificado de Waterman y Mole (1994).
Cuantificación de flavonoides
Se preparó una mezcla con 0.5 mL de extracto metanólico, 1.5 mL de etanol al 95 % (v/v), 0.1 mL de solución de AlCl3 al 10 % (p/v), 0.1 mL de solución de CH3COOK (1 M) y 2.8 mL de agua destilada. La mezcla se incubó por 30 min. Posteriormente, la absorbancia se determinó a una longitud de onda de 415 nm. Los flavonoides se cuantificaron a partir de una curva estándar a base de flavona quercetina (Chang et al., 2002). Los resultados se expresaron en mg equivalentes de quercetina por 100 g de peso fresco de la muestra (mg EQ·100 g-1 p. f.).
Cuantificación de antocianinas
Se colocaron 200 μL de extracto metanólico en dos tubos de ensayo; en el primero se adicionaron 1.8 mL de una solución amortiguadora de pH = 1.0 (HCl/KCl) y en el segundo tubo se agregaron 1.8 mL de una solución amortiguadora de pH = 4.5 (CH3COOH/CH3COONa·3H2O). La absorbancia de la mezcla de cada tubo se midió a longitudes de onda de 510 y 700 nm. La absorbancia total (At) de la muestra se calculó a partir de la siguiente ecuación:
At = [(A510 − A700) pH = 1.0] − [(A510 − A700) pH = 4.5]
La concentración de antocianinas (mg·litro-1) se calculó con la siguiente ecuación:
antocianinas = (At * PM * FD * 1000) / (ε * 1) Donde:
At = Absorbancia total.
PM = Peso molecular (449.2 g·mol-1) del estándar (cianidina-3-glucósido)
FD = Factor de dilución (1)
ε = Absortividad molar del estándar (26,900)
La concentración se expresó en mg de cianidina-3-glucósido por 100 g de peso fresco (mg antocianinas·100 g-1 p. f.), según lo descrito por Giusti y Wrolstad (2001).
Cuantificación de taninos condensados
Se pesaron 200 mg de semilla fresca molida y se agregaron 10 mL de solución del HCl en MeOH al 1 % (v/v). La mezcla se mantuvo en agitación constante durante 20 min. Se tomó un 1 mL de la mezcla filtrada y se agregaron 4 mL de una solución de HCl al 8 % en MeOH (v/v) y una solución de vainillina en MeOH al 4 % (v/v) en una proporción 1:1. La mezcla resultante se mantuvo en baño maría a 30 °C durante 20 min; finalmente, se midió la absorbancia a 500 nm. Los taninos se cuantificaron mediante una curva estándar a base de catequina (Cardador-Martínez et al., 2011). El contenido total de taninos se expresó como mg equivalentes de catequina en 100 g de peso fresco de la muestra (mg EC·100 g-1 p. f.).
Cuantificación de la capacidad inhibidora de radicales libres
Método ABTS
El radical ABTS+ se obtuvo siguiendo la metodología descrita por Re et al. (1999). Para ello, se agregaron 6.61 mg de K2S2O4 a una solución de 10 mL (7 mM) de ABTS (ácido 2,2'-azino-bis(3-etilben-zotiazolin)-6-sulfónico), para lograr una concentración 2.45 mM. La mezcla reposó a temperatura ambiente y en oscuridad durante 16 h. Posteriormente, se tomó 1 mL de la solución de ABTS+ y se agregó el volumen necesario de etanol anhidro hasta obtener en la mezcla una absorbancia de 0.7 ± 0.1 a una longitud de onda de 734 nm (máxima concentración de radical ABTS + formado). Por otra parte, se tomó 1 mL de la solución de ABTS + y se adicionaron 10 uL del extracto metanólico; la mezcla se incubó a baño maría a 30 °C en oscuridad por 7 min. Finalmente, se tomó la lectura de la absorbancia de la mezcla a una longitud de onda de 734 nm. La actividad antioxidante se cuantificó a través de una curva estándar a base de trolox (ácido 6-hidroxi-2,5,7,8-tetrametilcroman-2-carboxílico). Los resultados se expresaron en mg equivalentes de trolox por cada 100 g de peso fresco (mg ET·100 g-1 p. f.). El porcentaje de inhibición del radical libre ABTS+ se calculó con la fórmula:
Inhibición (%) = [(AI − AF) / AI * 100
Donde:
AI = Absorbancia inicial del radical libre a 734 nm.
AF = Absorbancia final de la reacción con la muestra.
Método DMPD.
El radical libre DMPD. se obtuvo acorde con la metodología descrita por Fogliano et al. (1999). Esta se basa en añadir 1 mL de solución 100 mM de DMDP (diclorhidrato de N,N-dimetil-p-fenilendiamina) a 100 mL de una solución amortiguadora (CH3COOH/C2H3O2Na·3H2O) para mantener pH de 5.25 y adicionar 200 μL de una solución 0.5 M de FeCl3·6H2O; la mezcla se agitó y se dejó reposar en oscuridad. La absorbancia se leyó a una longitud de onda de 506 nm (AI = Absorbancia inicial). Posteriormente, se tomó 1 mL de la solución del radical libre DMPD+ y se adicionaron 50 μL del extracto metanólico, preparado anteriormente. La absorbancia se leyó a una longitud de onda de 506 nm (AF = Absorbancia final) y los resultados se expresaron en mg equivalentes de ácido gálico por cada 100 g de peso fresco (mg EAG·100 g-1 p. f.). El porcentaje de inhibición se calculó empleando la fórmula: % de inhibición = [1 - (AF / AI)] * 100.
Método DPPH.
Se preparó una solución metanólica al 80 % (v/v) del radical libre DPPH. (2,2-difenil-1-picrilhidrazilo) a una concentración 100 μM. La absorbancia se midió a 515 nm (AI = Absorbancia inicial). Se tomaron 2.9 mL de esta solución y se adicionaron 100 μL del extracto metanólico; la mezcla se incubó en oscuridad a 23 °C durante 30 min. La absorbancia se midió a una longitud de onda de 506 nm (AF = Absorbancia final) y los resultados se expresaron en mg equivalentes de quercetina por cada 100 g de peso fresco (mg EQ·100 g-1 p. f.). El porcentaje de inhibición se calculó empleando la fórmula: % de inhibición = [1 - (AF / AI)] * 100 de acuerdo con lo reportado en la metodología de Kim et al. (2002).
Análisis estadístico
Los datos se sometieron a análisis de varianza (ANOVA), prueba de comparación de medias de Tukey (P ≤ 0.05) y se calculó el coeficiente de correlación de Pearson mediante el programa Statistical Analysis System (SAS, version 9.0, 2003) de acuerdo con un diseño experimental completamente al azar, donde cada muestra seleccionada se consideró como tratamiento del cual se tuvieron seis repeticiones.
RESULTADOS Y DISCUSIÓN
Contenido de minerales
En el Cuadro 1 se muestra el contenido de 12 minerales en las semillas de guaje; el contenido de siete minerales fue estadísticamente diferente (P < 0.05) entre el guaje rojo y verde. Las semillas de guaje rojo superaron a las de guaje verde en los niveles de N, Mg, Mn, P y Zn; en contraste, las semillas de guaje verde presentaron mayores concentraciones de Na y de Fe. En el Cuadro 1 también se muestran algunos contenidos minerales reportados en otras leguminosas. En dicho cuadro se puede observar que los contenidos de Ca y Na en las especies de guaje fueron superiores a los reportados para frijol, chícharo y haba seca. Por otra parte, los niveles reportados de Fe, K y Mg en haba superaron a los encontrados en el guaje rojo y verde y en chícharo. Audu y Aremu (2011) determinaron el contenido de minerales en harina de frijol rojo y encontraron que los niveles de Mg superaron a los contenidos en seis cultivares de frijol de Brasil y a los materiales de guaje aquí reportados.
Cabe señalar que las diferencias encontradas en las concentraciones de minerales en los seis cultivares de frijol de Brasil se atribuyen a factores genéticos, condiciones edafoclimáticas y al tipo de cultivo (condiciones hidropónicas) (Reynoso-Camacho et al., 2006; Duarte-Martino et al., 2012), lo cual podría explicar algunas de las diferencias entre las semillas de guaje rojo y verde del presente estudio. Con base en los resultados, el consumo de leguminosas como las semillas de guaje representa una alternativa de la ingesta de minerales a bajo costo para la población.
Análisis proximal
El contenido proximal de las semillas de guajes rojo y verde se muestra en el Cuadro 2. Las semillas de guaje rojo superaron a las de guaje verde en el contenido de lípidos; mientras que en los niveles de proteína y fibra cruda no se encontraron diferencias significativas. Sotelo (1997) hizo el análisis proximal de L. leucocephala (guaje verde) y reportó valores de humedad, lípidos y fibra superiores a los encontrados en el presente estudio, excepto los niveles de carbohidratos y de proteína cruda.
Los valores de fibra cruda encontrados en guaje rojo y verde superaron al reportado en semilla de frijol rojo (3.6 %) (Audu y Aremu, 2011) , así como a los contenidos en sorgo (2.10 %) (Giami, 1993), frijol de soya (4.28 %) y haba (5.4 %) (Apata y Ologhobo, 1994). Es importante mencionar que el consumo de fibra disminuye los niveles de colesterol y de azúcar en sangre; no obstante, el mecanismo de acción aún no está elucidado (Duarte-Martino et al., 2012).
Las semillas de guaje verde presentaron niveles mayores de carbohidratos que el guaje rojo, frijol de soya, chícharo, haba y frijol rojo (Cuadro 2). El contenido de carbohidratos en guaje rojo y verde coincide con el intervalo (55-65 % p. s.) reportado para leguminosas por Reynoso-Camacho et al. (2006). Algunas plantas de esta familia contienen niveles bajos de carbohidratos digestibles y proporción alta de carbohidratos no digestibles (CND) como almidón resistente, fibra insoluble y oligosacáridos no digestibles (Henningson et al., 2001). Los CND se asocian con una respuesta glucémica baja, niveles bajos de colesterol y decremento en los factores de riesgo de padecer cáncer de colon, lo que sugiere que el aumento en el consumo de leguminosas con niveles elevados de CND podría ayudar a reducir la incidencia de dicha enfermedad (Reynoso-Camacho et al., 2006).
El contenido de lípidos en ambas especies de guaje fue superior al reportado para frijol, chícharo, haba, excepto frijol de soya, frijol rojo y al guaje verde señalado por Sotelo (1997) (Cuadro 2). Baltes (2007) reporta 2 % de grasa en el frijol de soya. Duarte-Martino et al. (2012) consideran que el contenido de lípidos en frijol es muy bajo (0.8-2.32 %) comparado con el de otros granos.
Las semillas de las leguminosas son ricas en proteínas y aminoácidos (Reynoso-Camacho et al., 2006), aunque carecen o contienen concentraciones muy bajas de aminoácidos azufrados (Audu y Aremu, 2011; Duarte-Martino et al., 2012) y triptófano (la metionina y el triptófano son aminoácidos esenciales indispensables en la dieta humana). Los niveles de proteínas encontrados en guaje rojo y verde superan a los observados en chícharo y en haba seca (Cuadro 2), pero son similares a los reportados en seis cultivares de frijol (1535 %) cosechados en Brasil (Duarte-Martino et al., 2012). Oakes y Skov (1967) reportaron un contenido inferior de proteína (14.0-16.2 %) en ramas y vainas de Leucaena sp. usadas como forraje para vacas y cabras, también fue menor a lo encontrado por Sotelo (1997) en semillas de la especie L. leucocephala. Debido a que se desconocen las características nutritivas de las proteínas presentes en guaje, se sugiere realizar estudios posteriores de la calidad de las mismas. La variación en la calidad nutricional de la proteína en las leguminosas, en particular del frijol, depende de factores genéticos, del perfil de aminoácidos esenciales, tiempo de almacenamiento, proceso de cocinado y de sustancias anti-nutricionales (Duarte-Martino et al., 2012). La alteración de la calidad nutricional de la proteína en las semillas frescas o cocinadas de las especies de guaje se desconoce. Al respecto, Sotelo (1997) señala que, en la mayoría de los casos, el contenido de componentes nutricionales, en particular en las leguminosas silvestres, es similar en las variedades de la misma especie; la diferencia principal radica en el mayor contenido de los factores antinutricionales presentes.
La presencia de sustancias antinutricionales (taninos, lectinas, inhibidores de tripsina y ácido fítico) (Guzmán-Maldonado y Paredes-López, 1998) en leguminosas limitan la aceptabilidad de su consumo. Existen pocos reportes que señalan algunos de los beneficios biológicos de estos metabolitos en soya y lenteja (Reynoso-Camacho et al., 2006); sin embargo, la presencia y contenido de estos fitoquímicos en guaje se desconoce. La presencia de sustancias antinutricionales en leguminosas reduce el valor nutricional de la proteína, digestibilidad, biodisponibilidad de minerales y la absorción de los aminoácidos (Duarte-Martino et al., 2012). Las sustancias antinutricionales son sensibles al calor y procesamiento (Reynoso-Camacho et al., 2006; Duarte-Martino et al, 2012); algunas de ellas y sus productos de hidrólisis son benéficos a bajas concentraciones ya que favorecen la disminución de los niveles de glucosa y lípidos en la sangre. El ácido fítico, los inhibidores de proteasas, saponinas, polifenoles y lignanos están asociados con la disminución de varios tipos de cáncer (Duarte-Martino et al., 2012). Algunos beneficios biológicos se han reportado en soya y lenteja (Reynoso-Camacho et al., 2006), pero en frijol existe poca información al respecto (Reynoso-Camacho et al., 2006). Sotelo (1997) señala la presencia de inhibidores de tripsina (6.8 UIT·g-1 p.s.) y lectinas (4.0 UAH·g-1), y ausencia de saponinas en semillas de L. leucocephala. En el follaje de esta especie se ha descrito la presencia de un aminoácido tóxico (mimosina) para el ganado (Brewbaker, 1980; MacDicken, 1988), pero en las semillas se desconoce.
Contenido de fitoquímicos
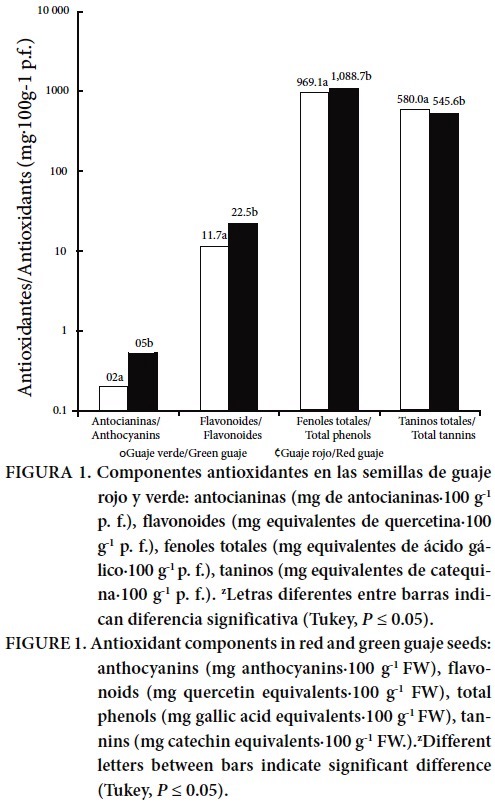
En la Figura 1 se observa que existen diferencias significativas (P ≤ 0.05) en las concentraciones de antioxidantes entre las semillas de guaje rojo y verde. Los niveles de compuestos fenólicos y flavonoides fueron superiores en guaje rojo; mientras que en guaje verde se encontró mayor contenido de taninos condensados (proantocianidinas). El mayor contenido de antocianinas en las semillas de guaje rojo en comparación con guaje verde explica la pigmentación de la testa.
Chanwitheesuk et al. (2005) analizaron semillas de guaje verde de Thailandia reportando una concentración menor de taninos (60.6 mg equivalentes de ácido tánico en 100 g-1 p. s.), como de fenoles (405.0 mg equivalentes de pirocatecol en 100 g-1 p. s.) a lo encontrado en el presente trabajo; estas diferencias podrían deberse al contenido de humedad en las muestras, a la metodología de análisis y al lugar de origen. En investigaciones de diferentes variedades de frijol cultivado en América y África (Cardador-Martínez et al., 2002; Beninger y Hostfield, 2003; De Mejía et al, 2003; Aparicio-Fernández et al., 2005; Reynoso-Camacho et al., 2006) se describe la presencia de compuestos fenólicos, flavonoides, antocianinas y taninos condensados (proantocianidinas). La presencia de antocianinas, así como el contenido de proantocianidinas, solamente se ha encontrado en la testa de frijoles negros y azul-violeta (Reynoso-Camacho et al., 2006). Los mecanismos de acción de cada fitoquímico en frijol se desconoce, pero el efecto sinérgico de estos bioactivos lo convierten en un alimento con propiedades funcionales notables (Duarte-Martino et al., 2012). Por lo anterior y con base en los contenidos fitoquímicos encontrados, las semillas de guaje rojo, principalmente, podrían considerarse también un alimento económico funcional.
Existen evidencias epidemiológicas que demuestran que la ingesta de alimentos ricos en fenólicos y flavonoides protegen al organismo de enfermedades cardiovasculares y neurodegenerativas (Cartea et al., 2011). Las antocianinas son un tipo de flavonoides presentes como pigmentos en algunos frutos, flores, hojas y en la testa de algunas semillas (Morales, 2011; Tsuda, 2012). Numerosos estudios sugieren que estos metabolitos tienen un rango amplio de propiedades promotoras de salud como antioxidantes (secuestradores de especies reactivas del oxígeno "radicales libres" producidos por el estrés oxidativo en el organismo afectando lipoproteínas, lípidos del plasma sanguíneo y otras biomoléculas) (Prior y Wu, 2006; Tsuda, 2012; Pojer et al., 2013).
Cuantificación de la capacidad inhibidora de radicales libres
En el Cuadro 3 se presenta la actividad antioxidante determinada por tres métodos, los cuales demuestran que los extractos de las semillas de ambas especies de guaje poseen porcentaje elevado de inhibición de los radicales libres (ABTS+, DMPD. y DPPH.). En los tres métodos se observaron diferencias significativas (P < 0.05) en la actividad antioxidante de las dos especies de guaje.
El coeficiente de Pearson (r = 0.5) mostró una correlación positiva entre las antocianinas (0.82), fenoles (0.93) y la actividad antioxidante (método ABTS) en las semillas de guaje rojo; en contraste, la actividad antioxidante en guaje verde se correlacionó con los contenidos de flavonoides (0.86) y los compuestos fenólicos (0.59). El alto contenido de compuestos fenólicos encontrado en las semillas de guaje podría explicar la elevada actividad antioxidante, lo cual coincide con Reynoso-Camacho et al. (2006), quienes señalan una elevada correlación del contenido de fenólicos con la actividad antioxidante en frijol.
El presente estudio podría considerarse una contribución preliminar al conocimiento de la calidad nutricia y antioxidante, aún no documentada en diferentes especies de guaje, recurso consumido ancestralmente por diferentes pueblos mesoamericanos. Actualmente, el potencial del guaje es poco reconocido; sin embargo, aún forma parte de la identidad cultural y gastronómica de algunos estados de la república mexicana.
CONCLUSIONES
Las semillas de guaje rojo (L. esculenta) presentaron mayores niveles de N, Mg, Mn, P y Zn, así como de lípidos, que las de guaje verde (L. leucocephala). Las semillas de guaje rojo y verde presentaron niveles similares de proteína y fibra cruda; las dos especies de Leucaena tienen mayor contenido de fibra cruda que los reportados en frijol, sorgo, haba y frijol de soya. Por otra parte, las concentraciones de compuestos fenólicos, antocianinas y flavonoides fueron mayores en guaje rojo, mientras que guaje verde presentó niveles mayores de taninos condensados. El alto contenido de compuestos fenólicos en las semillas de guaje de ambas especies podría explicar la elevada actividad secuestradora de radicales libres. Por lo anterior, el guaje es una especie de consumo subvalorado de alto valor nutricional y funcional. Las semillas de guaje rojo podrían considerarse un alimento funcional por su calidad nutricional y el alto contenido de componentes antioxidantes.
LITERATURA CITADA
ALCÁNTAR, G.; SANDOVAL, V. M. 1999. Manual de análisis químico de tejido vegetal. Publicación especial 10. Sociedad Mexicana de la Ciencia del Suelo, A. C. Chapingo, Estado de México, México. 156 p. [ Links ]
Association of Official Analytical Chemists (AOAC). 1998. Official Methods of Analysis, 16th ed. William, S. Ed. Published by the Association of Official Analytical Chemist. USA. [ Links ]
APARICIO-FERNÁNDEZ, X.; YOUSEF, G. G.; LOARCA-PIÑA, G.; GONZÁLEZ DE MEJÍA, E.; LILA, M. A. 2005. Characterization of polyphenolics in the seed coat of Black Jamapa bean (Phaseolus vulgaris L.). Journal of Agricultural and Food Chemistry 53(11): 4615-4622. doi: 10.1021/jf047802o. [ Links ]
APATA, D. F.; ALOGHOBO, A. D. 1994. Biochemical evaluation of some Nigerian legume seeds. Food Chemistry 49: 333-338. doi: 10.1016/j.aoas.2013.07.010. [ Links ]
AUDU, S. S.; AREMU, M. O. 2011. Effect of processing on chemical composition of red kidney bean (Phaseolus vulgaris L.) flour. Pakistán Journal of Nutrition 10(11): 1069-1075. doi: 10.3923/pjn.2011.1069.1075. [ Links ]
BALTES, W. 2007. Química de los alimentos. México, D.F. Editorial Acribia Zaragoza. 476 p. [ Links ]
BASURTO, P. F. 2011. Los quelites de México: especies de uso actual, pp. 23-45. In: Especies Vegetales, Poco Valoradas: Una Alternativa para la Seguridad Alimentaria. MERA, O. L. M.; CASTRO, L. D.; BYE, B. R. (eds.). UNAM. México, D. F. [ Links ]
BENINGER, C. W.; HOSTFIELD, G. L. 2003. Antioxidant activity of extracts, condensed tannin fractions, and pure flavonoids from Phaseolus vulgaris L. seed coat color genotypes. Journal of Agricultural and Food Chemistry 51(27): 7879-7883. doi: 10.1021/jf0304324. [ Links ]
BREWBAKER, J. L. 1980. Giant Leucaena (Koahaole) Energy Tree Farm. Honolulu, HI: Hawaii Natural Energy Institute. Hawaii. 90 p. [ Links ]
CARDADOR-MARTÍNEZ, A.; CASTAÑO-TOSTADO, E.; LOAR-CAPIÑA, G. 2002. Antimutagenic activity of natural phenolic compounds in the common bean (Phaseolus vulgaris) against aflatoxin B1. Food Additives and Contaminants 19(1): 62-69. doi: 10.1080/02652030110062110. [ Links ]
CARDADOR-MARTÍNEZ, A.; JIMÉNEZ-MARTÍNEZ, C.; SANDOVAL, G. 2011. Revalorization of cactus pear (Opuntia spp.) wastes as a source of antioxidants. Ciéncia e Tecnologia de Alimentos 31(3): 782-788. doi: 10.1590/S0101-20612011000300036. [ Links ]
CARTEA, M.E.; FRANCISCO, M.; SOENGAS, P.; VELASCO, P. 2011. Phenolic compounds in Brassica vegetables. Molecules 16: 251-80. doi: 10.3390/molecules16010251. [ Links ]
CHANG, C.; YANG, M.; WEN, H., CHERN, J. 2002. Estimation of total flavonoids content in propolis by two complementary colorimetric methods. Journal Food and Drug Analysis 10(3): 176-182. [ Links ]
CHANWITHEESUK, A.; TEERAWUTGULRAG, A.; RAKARI-YATHAM, N. 2005. Screening of antioxidant activity and antioxidant compounds of some edible plants of Thailand. Food Chemistry 92(3): 491-497. doi: 10.1016/j.food-chem.2004.07.035. [ Links ]
CHATURVEDI, S.; SHARMA, P. K.; GARG, V. K.; BANSAL, M. 2011. Role of Nutraceuticals in health promotion. International Journal of Pharm Tech Research 3(1): 442-448. http://sphinxsai.com/Vol.3No.1/pharm_jan-mar11/pdf/ JM11(PT=74)%20pp%20442-448.pdf. [ Links ]
CHEW, Y. L.; CHAN, E. W.L.; TAN, P. L.; LIM, Y. Y.; STANSLAS, J.; GOH, J. K. 2011. Assessment of phytochemical content, polyphenolic composition, antioxidant and antibacterial activities of Leguminosae medicinal plants in Peninsular Malaysia. BMC Complementary and Alternative Medicine 11(1):1-10. doi: 10.1186/1472-6882-11-12. [ Links ]
DE MEJÍA, E.; GUZMÁN-MALDONADO, S. H.; ACOSTA-GA-LLEGOS, J. A.; REYNOSO-CAMACHO,R.; RAMÍREZ-RODRIGUEZ, E.; PONS-HERNÁNDEZ, J. L.; GONZÁLEZ-CHAVIRA, M. M.; CASTELLANOS, J. Z.; NELLY, J. D. 2003. Effect of cultivar and growing location on the trypsin inhibitors, tannins and lectins of common beans (Phaseolus Vulgaris L.) grown in semiarid highlands of México. Journal of Agricultural and Food Chemistry 51(20):5962-5966. pubs.acs.org/doi/abs/10.1021/jf030046m. [ Links ]
DUARTE-MARTINO, H. C.; BIGONHA, S. M.; DE MORAIS, C. L.; DE OLIVEIRA B. R C.; BRUNORO C. N. M.; RAMÍREZ, C. L. L,; MACHADO, R. R. S. 2012. Nutritional and Bioactive Compounds of Bean: Benefits to Human Health, pp. 233-258. In: Hispanic Foods: Chemistry and Bioactive Compounds (ACS Symposium). TUNICK, M. H.; GONZÁLEZ DE MEJÍA, E. (eds.). American Chemical Society. USA. doi: 10.1021/bk-2012-1109. [ Links ]
ESPÍN, J. C.; GARCÍA-CONESA, M. T.; TOMÁS-BARBERÁN, F. A. 2007. Nutraceuticals Facts and fiction. Phytochemistry 68(22-24): 2986-3008. doi: 10.1016/j.maturitas.2013.05.006. [ Links ]
FOGLIANO, V.; VERDE, V.; RANDAZZO. G.; RITIENI, A. 1999. Method for Measuring Antioxidant Activity and its application to monitoring the antioxidant capacity of wines. Journal of Agricultural and Food Chemistry 47(3): 1035-1040. doi: 10.1021/jf980496s. [ Links ]
GIAMI, S. Y. 1993. Effect of processing on the proximate composition and functional properties of cowpea (Vigna unguiculata) flour. Food Chemistry 47(2):153-158. doi: 10.1016/0308-8146(93)90237-A. [ Links ]
GIUSTI, M.M.; WROLSTAD, R.E. 2001 Unit. F1.2.1-13, Anthocyanins. Characterization and measurement with UV-Visible spectroscopy. In: WROLSTAD, R.E. (ed.). Current Protocols in Food Anal.Chem. John Wiley & Sons: New York. USA. doi: 10.1002/0471142913.faf0102s00. [ Links ]
GRETHER, R. A.; MARTÍNEZ-BERNAL, A.; LUCKOW, M.; ZÁRATE, S. 2006. Mimosaceae. Tribu Mimoseae. In: Flora del Valle de Tehuacán-Cuicatlán. DÁVILA, A. P. D.; VILLA-SEÑOR, R. J. L.; MEDINA, L. R.; TÉLLEZ, V. O. (eds.). Fascículo 44. Instituto de Biología. Universidad Autónoma de México. México, D. F. http://www.ibiologia.unam.mx/barra/publicaciones/floras_tehuacan/F44.pdf. [ Links ]
GUTIÉRREZ, H, K. T.; MATOS, CH. R. A. 2011. Propiedades nutricionales y funcionales de la harina de habas. Revista de la Universidad Peruana Unión 1: 1-7. [ Links ]
GUZMÁN-MALDONADO, S.H.; PAREDES-LÓPEZ, O. 1998. Functional products of plants indigeneous of Latin America: amaranth, quinoa, common beans and botanicals, pp. 293-328. In: Functional Foods. Bichemical and Processing Aspects. MAZZA, G. (ed.). Thechnomic Publishing Company. Pennsylvania, USA. [ Links ]
HENNINGSON, A. M.; NYMAN, E. M.; BJORCK, I. M. 2001. Content of short-chain fatty acids in the hindgut of rats fed processed bean (Phaseolus vulgaris) flours varying in distribution and content of indigestible carbohydrates. British Journal of Nutrition 86(3): 379-89. doi: 10.1079/BJN2001423. [ Links ]
KAISOON, O.; SIRIAMORNPUN, S.; WEERAPREEYAKUL, N.; MEESO, N. 2011. Phenolic compounds and antioxidant activities of edible flowers from Thailand. Journal of Functional Foods 3(2): 88-99. doi: 10.1016/j.jff.2011.03.002. [ Links ]
KIM, D.O.; LEE, K.W.; LEE, H.J. Y LEE, C.Y. 2002. Vitamin C equivalent antioxidant capacity (VCEAC) of phenolic phytochemicals. Journal of Agricultural and Food Chemistry 50(13): 3713-3717. doi: 10.1021/jf020071c. [ Links ]
MACDICKEN, K. G. 1988. Nitrogen fixing trees for wastelands. RAPA Publication 1988/9. Bangkok: Food and Agriculture Organization of the United Nations, Regional Office for Asia and the Pacific. Bangkok, Thailandia. 104 p. [ Links ]
MARTÍNEZ, M. 1994. Catálogo de Nombres Vulgares y Científicos de Plantas Mexicanas. Fondo de Cultura Económica. México. 1247 p. [ Links ]
MENCHÚ, M. T.; MÉNDEZ, H. 2012. Tabla de Composición de Alimentos de Centroamérica/INCAP/ 2da. Edición. Guatemala. 128 p. [ Links ]
MORALES, A. R. 2011. Frutoterapia: El oro de mil colores. EDAF. Madrid, España. 314p. [ Links ]
MOREIRAS, O.; CARBAJAL, A.; CABREBRA, L.; CUADRADO, C. 2013. Tablas de Composición de Alimentos. Editorial Pirámide. España. 140 p. [ Links ]
OAKES, A.J.; SKOV, O. 1967. Yield trials of Leucaena in the U.S. Virgin Islands. Journal of Agriculture University of Puerto Rico 51: 176-181. [ Links ]
PAMPLONA-ROGER, G. D. 2006. Encyclopedia of Foods and Their Healing Power: A Guide to Food Science and Diet Therapy. Editorial Safeliz. 447 p. [ Links ]
PARROTA, J. A. 1992. Leucaena leucocephala (Lam.) de Wit, leucaena, tantan. US Departament of Agriculture, Forest Service, Southern Forest Experimental Station. New Orleans, L.A. USA. 8 p. [ Links ]
PIERART, Z. C.; ROZOWSKY, N. J. 2006. Papel de la nutrición en la prevención del cáncer gastrointestinal. Revista Chilena de Nutrición 33(1): 8-13. doi: 10.4067/S0717-75182006000100001. [ Links ]
POJER, E.; MATTIVI, F.; JOHNSON, D.; STOCKLEY, C. S.; 2013. The case for anthocyanin consumption to promote human health: a review. Comprehensive Reviews in Food Science and Food Safety 12: 483-508. doi: 0.1111/1541-4337.12024. [ Links ]
PRIOR, R. L.; WU, X. 2006. Anthocyanins: structural characteristics that result in unique metabolic patterns and biological activities. Free Radical Research. 40: 1014-1028. doi: 10.1080/10715760600758522. [ Links ]
RE, R.; PELLEGRINI, N.; PROTEGGENTE, A.; PANNALA, A.; YANG, M.; RIVE-EVANS, C. 1999. Antioxidant activity an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine 26(9/10): 1231-1237. doi: 10.1016/S0891-5849(98)00315-3. [ Links ]
REYNOSO-CAMACHO, R.; RAMOS-GOMEZ, M.; LOARCA- PINA, G. 2006. Bioactive Components in Common Beans (Phaseolus vulgaris L.), pp. 217-236. In: Advances in Agricultural and Food Biotechnology; GUEVARA-GONZÁLEZ, R.; TORRES-PACHECO, I. (eds.). Research Signpost, Trivandrum, India. [ Links ]
SALINAS-MORENO, Y.; PÉREZ-ALONSO, J. J.; VÁZQUEZ-CARRILLO, G.; ARAGÓN-CUEVAS, F.; VELÁZQUEZ-CARDELAS, G. A. 2012. Antocianinas y actividad antioxidante en maíces (Zea mays L.) de las razas chalqueño, elotes cónicos y bolita. Agrociencia 46(7): 693-706. http://www.scielo.org.mx/pdf/agro/v46n7/v46n7a5.pdf. [ Links ]
SAS Institute Inc. 2003. The SAS System for Windows Release 6.12. Cary, N. C. USA. [ Links ]
SHETTI, A.; KELUSKAR, V.; AGGARWAl, A. 2009. Antioxidants enhancing oral and general health. Journal of Indian Academy of Oral Medicine and Radiology 21(1): 1-6. doi: 10.4103/0972-1363.57770. [ Links ]
SOTELO, A. 1997. Constituents of wild food plants, pp. 89-111. In: Functionality of Food Phytochemicals. JOHNS, T.; ROMEO, J. T. (eds.). Plenum Press, New York.USA. [ Links ]
TACHAKITTIRUNGROD, S.; OKONOGI, S.; CHOWWANAPOONPOHN, S. 2007. Study on antioxidant activity of certain plants in Thailand: Mechanism of antioxidant action of guava leaf extract. Food Chemistry 103(2): 381-388. doi: 10.1016/j.foodchem. [ Links ]
TSUDA, T. 2012. Dietary anthocyaninrich plants: biochemical basis and recent progress in health benefits studies. Molecular Nutrition and Food Research 56: 159-70. doi: 10.1002/mnfr.201100526. [ Links ]
WATERMAN, P.G.; MOLE, S. 1994. Analysis of Phenolic Plant Metabolites. Methods in Ecology. Black well Scientific Publications. Oxford, UK. 238 p. [ Links ]
ZÁRATE, S. 1987. Taxonomic identity of Leucaena leucocephala (Lam.) de Wit, with a new combination. Phylologia 63(4): 304-306. [ Links ]
ZÁRATE, S. 1999. Ethnobotany and domestication process of Leucaena in México. Journal of Ethnobiology 19(1): 1-23. http://ethnobiology.org/sites/default/files/pdfs/JoE/19-1/Zarate.pdf. [ Links ]