Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.19 no.3 Chapingo sep./dic. 2013
https://doi.org/10.5154/r.rchsh.2012.12.070
Comportamiento de líneas avanzadas de tomate (Solanum lycopersicum L.) a fitopatógenos en Chapingo, México
Behavior of advanced lines of tomato (Solanum lycopersicum L.) to phytopathogens at Chapingo, Mexico
Santos Gerardo Leyva-Mir*; Carlos Manuel González-Solano; Juan Enrique Rodríguez-Pérez; Domingo Montalvo-Hernández
Universidad Autónoma Chapingo. km 38.5 Carretera México-Texcoco. Chapingo, Estado de México, MÉXICO. C. P. 56230. Correo-e: lsantos@correo.chapingo.mx (*Autor para correspondencia)
Recibido: 7 de diciembre, 2012
Aceptado: 31 de agosto, 2013
Resumen
Con el objetivo de evaluar la respuesta de 18 líneas experimentales y dos genotipos comerciales de tomate (Solanum lycopersicum L.) ante la infección natural de patógenos (Alternaria solani, Phytophthora infestans, Fusarium oxysporum, Nacobbus spp. y Meloidogyne spp.) de importancia económica, se realizó un ensayo en el campo agrícola experimental de la Universidad Autónoma Chapingo con el diseño experimental bloques completos al azar con cuatro repeticiones. Se evaluó el grado de severidad de cinco patógenos sobre las plantas de los genotipos considerados. Previo a la evaluación se identificó a cada patógeno en laboratorio por medio de la morfología de sus estructuras reproductivas. Se aplicó la prueba no paramétrica de Friedman a los datos obtenidos y posteriormente se realizó la comparación múltiple de rangos. Se detectaron fuentes de resistencia para Alternaria solani con severidad final del 35 %, en comparación con los genotipos susceptibles que fue del 80 %. En el caso de Phytopthora infestans la severidad final alcanzó 60 %, mientras que la susceptibilidad correspondió a 100 %. En el caso de Fusarium oxysporum se obtuvo un valor de 10 % de daño contra los susceptibles con 40 %. Con respecto a nematodos (Nacobbus spp. y Meloidogyne spp.), se determinó tolerancia con registros de 30 % de agallamiento y 76 % en líneas susceptibles.
Palabras clave: Resistencia, Alternaria solani, Phytophthora infestans, Fusarium oxysporum, Nacobbus spp., Meloidogyne spp.
Abstract
A test was conducted at the experimental field of Universad Autónoma Chapingo using the randomized complete block design with four replications, in order to assess the response of 18 experimental lines and two commercial genotypes (Solanum lycopersicum L.) of tomato against natural infection of pathogens (Alternaria solani, Phytophthora infestans, Fusarium oxysporum, Nacobbus spp. and Meloidogyne spp.) of economic importance. We evaluated the severity degree of five pathogens on plants of the genotypes considered. Before evaluation, each pathogen was identified in the laboratory by morphology of their reproductive structures. The Friedman nonparametric test was applied to the data obtained, and then multiple ranges were compared. Sources of resistance were found for Alternaria solani with end severity of 35 % compared to the susceptible genotype of 80 %. Phytophthora infestans end severity reached 60 %, while the susceptibility was 100 %. Fusarium oxysporum had a value of 10 % of damage against susceptible with 40 %. Tolerance with records of 30 % galling and 76 % in susceptible lines were determined with respect to nematodes (Nacobbus spp. and Meloidogyne spp.).
Key words: Resistance, Alternaria solani, Phytophthora infestans, Fusarium oxysporum, Nacobbus spp., Meloidogyne spp.
INTRODUCCIÓN
En México se siembran alrededor de 55,000 ha de tomate, que es una de las hortalizas de mayor producción con un rendimiento promedio de 41 t·ha-1. Los mayores porcentajes los aportan Sinaloa, Michoacán y Baja California. A pesar de ello, la superficie destinada a la producción decreció 27 % en la última década debido a diversos factores, entre ellos plagas y enfermedades, impulso de la agricultura protegida y precios de mercado. Esta solanácea tiene una gran influencia y derrame económico sobre otros sectores que subsisten por su producción y comercialización, a través de la generación de empleos, dado que requiere gran número de trabajadores (Anónimo, 2010).
Las enfermedades son un factor que disminuye la cantidad y calidad de la producción, y que está siempre presente en los cultivos debido principalmente al uso inadecuado de los plaguicidas, que han causado la selección de poblaciones de patógenos con resistencia y que al incrementarse provocan severos daños al cultivo. Además, en el caso de los hongos patógenos presentan una gran variación morfológica, patogénica y de adaptación a diversas condiciones climáticas, por lo cual tienen la capacidad de atacar a los cultivos en sus diferentes etapas de desarrollo (Mendoza, 1999).
Se entiende por plaga al "organismo que reduce el aprovechamiento, la calidad o el valor de algún recurso de interés para el humano". El manejo integrado de plagas (MIP) comenzó a conformarse en la década de 1970, y surgió como resultado de la necesidad de buscar opciones de control para evitar o reducir los crecientes problemas derivados del uso continuo y sistemático de los plaguicidas (contaminación ambiental, daño a otros organismos, resistencia y resurgimiento de plagas, brotes de plagas secundarias, entre otros). El MIP es una teoría, un concepto y una metodología creada para controlar insectos destructivos, malezas competitivas y organismos patógenos. Sin embargo, la aplicación de esta teoría en algunos cultivos aún se encuentra en la fase inicial (Toledo e Infante, 2008).
La presente investigación hace hincapié sobre el manejo de enfermedades de importancia económica en el cultivo de tomate, ya que dentro de las estrategias y tácticas de control en un MIP es vital incorporar genotipos con capacidad de tolerancia o resistencia a diversos patógenos, de tal modo que existan nuevas alternativas para reducir los daños causados por factores bióticos año con año. Al mismo tiempo se podrá reducir la aplicación de agroquímicos y el impacto al medio ambiente, con lo que el cultivo se convierte en una fuente de ingresos segura (Robinson, 2000).
En el año 2004 se iniciaron acciones para conformar el Proyecto de Mejoramiento Genético de Tomate para Invernadero dirigido por investigadores del Departamento de Fitotecnia de la Universidad Autónoma Chapingo (UACh), con el propósito de generar variedades de bajo costo y atender los sistemas de producción con baja capacidad de inversión en sistemas protegidos y con capacidad para competir en rendimiento. Dentro de la colección de recursos fitogenéticos que posee la UACh existen más de 100 genotipos, los cuales han sido evaluados con respecto a rendimiento y calidad de frutos (Rodríguez, 2012). Sin embargo, no ha sido evaluada su capacidad genética para soportar el ataque de diversos patógenos, lo cual le daría un valor agregado a las variedades.
Las enfermedades de importancia económica del tomate en México son los tizones temprano y tardío (Alternaria solani y Phytophthora infestans, respectivamente), las pudriciones radiculares o ahogamiento (Pythium spp., Phytophthora spp., Rhizoctonia spp., Fusarium spp.) y el ataque de nematodos agalladores (Meloidogyne spp. y Nacobbus spp.), las cuales causan pérdidas del 50 al 100 %. Los daños son muerte de la planta y frutos de baja calidad (Jones et al., 1991; Mendoza, 1999; Prado-Vera et al., 2001). Con base en lo anterior se realizó la presente investigación con el objetivo de evaluar el comportamiento de 18 líneas avanzadas de tomate cultivado a la intemperie ante la infección natural de fitopatógenos de importancia agrícola en Chapingo, México, a fin de detectar aquellos materiales que ofrecen cierto grado de tolerancia o resistencia.
MATERIALES Y MÉTODOS
El ensayo se realizó durante el ciclo primavera-verano 2011 (abril-agosto) en el lote X3 del campo agrícola experimental de la Universidad Autónoma Chapingo (UACh), ubicado a 19° 22' 00" LN y 98º 56' 44" LO, con una altitud de 2,250 msnm. El clima es templado semiseco BSKw (i'), con precipitación de 600 mm y temperatura media anual de 15.9 °C (García, 1981).
Genotipos evaluados, diseño y unidad experimental
Se evaluaron 18 líneas uniformes del proyecto de mejoramiento genético de tomate del Departamento de Fitotecnia de la UACh, las cuales poseen cualidades sobresalientes en rendimiento y calidad de fruto (Rodríguez, 2012). Éstas provienen de autofecundaciones sucesivas (F6 y F7) de cruzas entre híbridos comerciales, o directamente de los híbridos comerciales F1. Además se incluyeron 2 genotipos comerciales (Floradade y Pik Ripe) como testigos. Las características de tipo de crecimiento y forma del fruto de las líneas se indican en el Cuadro 1.
Se empleó un diseño experimental de bloques completos al azar con cuatro repeticiones. La unidad experimental consistió de un surco de 1 m de ancho por 3 m de largo, con 17 plantas distanciadas a 0.4 m. La parcela útil consistió en 10 plantas de la unidad experimental (Cochran y Cox, 1990).
Variables evaluadas asociadas a patógenos
La infección fue natural, por lo que las enfermedades aparecieron al azar. Los caracteres evaluados correspondieron al grado de severidad (Agrios, 2005) de los patógenos sobre las plantas de los genotipos considerados.
Tizones
Al inicio de la infección se colectaron muestras de material vegetal con el fin de comprobar que el patógeno en estudio era el causante de la enfermedad. En primera instancia se observaron los síntomas característicos de cada uno de los tizones: manchas con halo clorótico y anillos concéntricos, y manchas color café homogéneas (Jones et al., 1991; Romero, 1993). Las muestras de tejido vegetal infectado se colocaron en cámaras húmedas para dar condiciones de temperatura y humedad adecuadas para el desarrollo del hongo con el fin de generar el crecimiento micelial y producción de estructuras asexuales de reproducción. Posteriormente se identificó en laboratorio la morfología de sus estructuras reproductivas, mediante microscopio compuesto, de acuerdo con la propuesta de Simmons (2007), Gallegly y Hong (2008) y Ristaino (2011). Una vez identificado el patógeno causante de cada uno de los tizones, en campo se evaluó la severidad de la enfermedad en porcentaje (% SEV), con la ayuda de una escala visual de 0 a 100, correspondiente a planta sana y muerta, respectivamente, apoyado con las propuestas establecidas por James (1971) y Henfling (1987). La frecuencia de toma de datos dependió de la agresividad de la enfermedad con respecto a las condiciones ambientales. Al inicio fue de 15 días para ambos tizones y al final del ciclo se acortó a ocho días. Posteriormente, los datos de porcentaje de severidad obtenidos se introdujeron a un programa de análisis de área bajo la curva (ABCPE) (Pedroza, 1995), para determinar el efecto que genera este problema fitopatológico a lo largo del ciclo del cultivo de tomate y con ellos comparar la epidemia generada en cada una de las líneas evaluadas. Al llegar a la etapa productiva, en todas las líneas se realizó un muestreo de frutos para evaluar el daño de los tizones en este órgano, a partir de 10 frutos elegidos al azar en cada unidad experimental, y se contabilizó el número de frutos infectados.
Pudrición de raíz
Para determinar el agente causal de la enfermedad se observó la sintomatología presente en las plantas (marchitez, clorosis) desde el inicio de la infección hasta llegar a su muerte (Jones et al., 1991; Mendoza, 1999). Posteriormente se colocaron muestras de tejido infectado en cámaras húmedas en laboratorio para favorecer el incremento del patógeno y con ello observar las estructuras reproductivas del hongo en microscopio compuesto. Una vez identificado el hongo, en campo se contabilizaron plantas muertas por la enfermedad cada 15 días después del trasplante y hasta finalizar el ciclo del cultivo (Lesli y Sumemerell, 2006).
Nematodos
Al observar el tipo de agalla amorfas y en forma de rosario que forman en las raíces del tomate se determinó la presencia de nematodos agalladores en el cultivo (Cepeda, 1996; Prado-Vera et al., 2001; Manzanilla-López et al., 2002). Además, se realizó una extracción de nematodos de muestras de suelo obtenidas de la zona del experimento, mediante la técnica de tamizado de Cobb (1918), y posteriormente se hicieron preparaciones para observar al microscopio los ejemplares (Eisenback et al., 1981; Zuckerman et al., 2005). Se evaluó el porcentaje de agallamiento de cada uno de los nematodos con la escala visual de 0 a 100, diferenciando el tipo de agalla en las raíces de las plantas. Esta información se transformó de la escala propuesta por Taylor y Sasser (1978).
Análisis estadístico
Se realizaron pruebas no paramétricas de Friedman para bloques completos al azar en todos los caracteres evaluados y posteriormente se realizó la comparación múltiple de totales de rangos de acuerdo con las recomendaciones de Conover (1980) e Infante y Zárate (1990).
Manejo agronómico
La siembra se realizó el 24 de marzo del 2011. Se utilizó sustrato comercial tipo peat-moss y charolas de polipropileno de 200 cavidades, las cuales se desinfestaron previamente con agua, jabón y posteriormente con UREA al 5 %. Se depositaron de tres a cuatro semillas por cavidad, posteriormente se realizó un aclareo, dejando una planta por cavidad. La planta se mantuvo en condiciones de invernadero durante 19 días. Diariamente se realizaron dos riegos sólo con agua, y cada segundo día con solución nutritiva de Steiner al 50 % (Steiner, 1984). Se realizó una aplicación de clorotalonil (1.5 kg·ha-1) más cipermetrina (400 ml·ha-1) (Bautista et al., 2010) para asegurar el total de plántula necesaria para el experimento.
En el terreno se realizaron dos barbechos y un paso de rastra, y posteriormente se realizó el surcado a distancias de 1.8 m, todas las actividades en forma mecánica y con los implementos correspondientes a cada labor. Se colocó una cintilla por surco de calibre ocho mil, con goteros cada 20 cm y con un gasto por emisor de 1.02 litro·h-1. Se usó un acolchado de tipo reflejante en color gris-negro, de calibre 90 y de 1.20 m de ancho, el cual se instaló de forma mecánica. El plástico para acolchado tenía perforaciones de fábrica cada 40 cm entre plantas y 30 cm entre hileras.
El trasplante se realizó por la mañana a los 28 días después de la siembra, a una distancia de 0.4 m entre plantas y 0.3 m entre hileras en tresbolillo. Se aplicó la fertilización 92-28-23 (N, P y K20, respectivamente), con productos comerciales hidrosolubles: Ultrasol inicial (15-30-15), UREA (46 % de N) y Ultrasol Multipropósito (18-18-18). La nutrición se complementó con tres aplicaciones del fertilizante foliar líquido (BAYFOLAN FORTE®), para aportar elementos menores.
Se presentaron plagas defoliadoras que fueron controladas mediante tres aplicaciones de ciromazina (TRIGARD®, 50 g·ha-1) para controlar las poblaciones de gusano minador (Liriomyza spp.) y Bacillus thuringiensis subespecie kurstaki (Beretta®, 2 kg·ha-1) para controlar el gusano del cuerno (Manduca spp.) (Bautista et al., 2010). La maleza se controló con escardas y en forma manual a los 15, 30 y 45 días después del trasplante, más una aplicación de paraquat a los 70 (2 litro·ha-1), mediante aspersora de mochila con capacidad de 15 litros, previamente calibrada.
Para el buen sostén de las plantas se utilizaron tutores de madera de aproximadamente 5 cm de diámetro y de 2.5 a 3.0 m de largo. Se colocaron a distancias de 1.5 metros a lo largo del surco, y sobre ellos como base se realizó un hilado doble con rafia.
RESULTADOS Y DISCUSIÓN
Identificación de patógenos
Se identificó a cada patógeno en laboratorio mediante la observación de la sintomatología. En el caso de hongos, se complementó mediante la observación en microscopio compuesto de las estructuras de reproducción, y para nematodos se observaron los ejemplares adultos y juveniles (Eisenback et al., 1981; Jones et al., 1991; Romero, 1993; Mendoza, 1999; Zuckerman et al., 2005; Lesli y Summerell, 2006; Simmons, 2007; Gallegly y Hong, 2008).
Condiciones ambientales para la infección
Para el tizón temprano (A. solani) los primeros síntomas aparecieron a los 22 días después de trasplante (DDT) cuando la temperatura y humedad relativa eran suficientes, con valor de 23 ºC y 40 %, respectivamente. El cultivo se encontraba en estado vegetativo (Tello y Moral, 1995) y no hubo daños significativos en el área foliar. La mayor tasa de infección se dio entre los 43 y 78 DDT, cuando las plantas se encontraban a mitad del periodo de fructificación, y la temperatura era de 21 ºC y la humedad relativa subió a 70 %. Sin embargo, el patógeno no generó mayor daño a las plantas debido a que se requería temperatura óptima de 28 a 30 ºC. Estos intervalos de variación coinciden con los establecidos por Jones et al. (1991) y Romero (1993) en tomate. Entre los 22 y 64 DDT se detectaron plantas muertas por F. oxysporum, generando daños entre 10 y 37 %. La mayor pérdida de plántula se obtuvo al inicio del ciclo, decreciendo al inicio de la fructificación. Las condiciones para el desarrollo del hongo fueron adecuadas, con temperatura entre 20 y 22 ºC. Además, la humedad del suelo nunca fue menor que 50 % en el área de riego (Mendoza, 1999; Jones et al., 1991) (Cuadro 2).
Cuando la temperatura fue de 19 ºC y la humedad relativa de 70 %, inició la infección de tizón tardío (P. infestans), a los 92 DDT; el cultivo estaba en plena etapa de fructificación, la mayoría de las líneas tenían cinco racimos. A partir de esa fecha la epidemia se incrementó con gran velocidad, ya que la temperatura baja (10 a 25 ºC) y humedad relativa alta (91 a 100 %) son las favorables para el desarrollo de este patógeno. En el caso de humedad relativa, estas condiciones se presentaron en horas tempranas durante el periodo de 92 y 121 DDT. Los daños por este patógeno alcanzaron severidad de 100 %, en daño foliar y de frutos (Jones et al., 1991; Romero, 1993; Mendoza, 1999; Jaramillo, 2003).
Se observaron síntomas de infección de nematodos a partir de los 22 DDT, los cuales fueron marchitez, amarillamiento y pequeñas agallas. Para verificar su presencia, se realizó el muestreo y la evaluación del patógeno en raíz a los 75 DDT, las plantas de tomate estaban en periodo de fructificación. Sin embargo, como los daños por P. infestans alcanzaron 100 % (foliar y de fruto) era tiempo adecuado para calificar el grado de severidad y determinar la resistencia o susceptibilidad de las líneas (Cepeda, 1996; Prado-Vera, 2001).
Se observaron diferencias estadísticas (P ≤ 0.01) con la prueba no paramétrica de Friedman para el número de frutos dañados por A. solani, así como para área bajo la curva del progreso de la enfermedad y número de frutos dañados por P. infestans.
Comparación de rangos
De acuerdo con la comparación de rangos (Conover, 1980) se determinó la tolerancia o susceptibilidad a las enfermedades evaluadas. A pesar de que la prueba no paramétrica de Friedman no detectó diferencias estadísticas en todos los parámetros evaluados, se aplicó la comparación de rangos a todas las variables para observar la respuesta de los genotipos evaluados al ataque de fitopatógenos.
Tizón temprano (Alternaria solani)
En cuanto a tolerancia al tizón temprano (A. solani) las mejores líneas fueron la 60 y 10, con menor área bajo la curva del progreso de la enfermedad (ABCPE) (1215 y 1147, respectivamente), y con porcentajes de severidad de 33 y 35, respectivamete, mientras que las líneas 14 y 28 se comportaron como las susceptibles, con mayor ABCPE (1935 y 2169, respectivamente) y porcentajes de severidad de 56 y 76, respectivamente. Los genotipos comerciales Pike Ripe y Floradade no mostraron capacidades altas de tolerancia, y al igual que muchas de las líneas evaluadas obtuvieron un valor de 40 % de severidad final (Figura 1). Lo anterior indica que se cuenta con buen potencial de competencia con respecto a la resistencia a enfermedades en genotipos de tomate, ya que las líneas evaluadas mostraron tolerancias al tizón temprano similares a los genotipos comerciales.
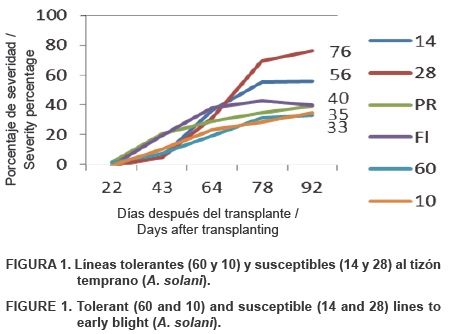
En comparación con los resultados obtenidos por Moya et al. (2009) la severidad final de las variedades de tomate (S. lycopersicum L.) seleccionadas como resistentes a A. solani alcanzaron valores menores a 25 %. González-Chávez et al. (2001), al estudiar la resistencia frente a A. solani de variedades nativas de L. esculentum var. cerasiforme, obtuvieron valores menores a 10 % de índice de infección. Sin embargo, las epidemias no pueden compararse totalmente, ya que las condiciones ambientales, el cultivar y la virulencia del patógeno fueron diferentes en el presente ensayo.
Con respecto al daño en frutos por A. solani, las líneas más tolerantes fueron 92, 77, 72, 25 y el testigo Floradade, con cero frutos infectados de una muestra de 10, es decir, 0 % de daño, en comparación con las líneas susceptibles: 60 y 43, con 40 % de daño.
A la fecha no se conocen genes específicos que codifiquen resistencia para el ataque por A. solani. Sin embargo, se tienen registros de qué cultivares silvestres poseen capacidad de tolerar el daño por este hongo, como lo es Lycopersicon esculentum var. ceraciforme (Jinsin, 1999; González-Chávez et al., 2001).
Tizón tardío ( Phytophthora infestans)
Las líneas con tolerancia media al tizón tardío (P. infestans) fueron 72, 92, 80 y 43, ya que obtuvieron valores bajos de ABCPE (< 1,100), aunque su porcentaje de severidad final promedio fue de 75. La línea 77 se considera la más tolerante debido a su bajo valor de ABCPE y al 60 % de severidad observada al final del ciclo. Las líneas 51 y 76 se consideran con susceptibilidad alta, con valores mayores de ABCPE (> 1,500) y con 100 % de severidad final (Figura 2).
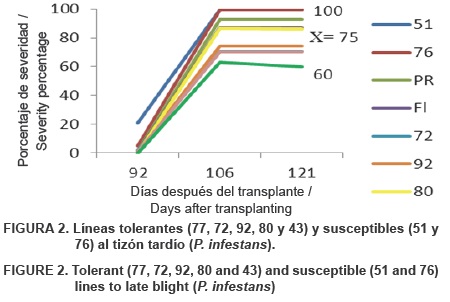
Los resultados obtenidos coinciden con el estudio realizado por Rodríguez et al. (2008), quienes obtuvieron valores de ABCPE de 0 a 1,000 en los clones de papa resistentes a P. infestans, y en los susceptibles alcanzaron un valor de 5,000. En cambio, Barquero et al. (2006) determinaron resistencia a P. infestans de la progenie de cruzas de especies silvestres de papa obteniendo valores de ABCPE entre 400 y 500. Otro estudio similar de resistencia a P. infestans, utilizando como parámetro ABCPE, fue realizado por Zúñiga et al., (2000), quienes determinaron la capacidad de tolerancia al tizón tardío al obtener valores de ABCPE entre 500 y 800. Estos resultados coinciden con los reportados en este ensayo, ya que la línea de tomate más tolerante obtuvo un valor de 900, pero no es posible comparar la capacidad de resistencia, debido a que el cultivo (Papa vs. Tomate), las condiciones ambientales (Toluca vs Texcoco) y el patógeno son diferentes. Esto se menciona porque se ha demostrado que aislamientos obtenidos de tomate son más virulentos en papa, y aislamientos obtenidos de papa no causan ningún síntoma en tomate.
Las líneas 25 y 44 demostraron resistencia en el número de frutos dañados por P. infestans, con 0 % de daños, mientras que la 82 y 52 fueron las más susceptibles al daños por tizón tardío en frutos, con tres a cinco frutos infectados de una muestra de 10. El resto de las líneas, así como Pik Ripe y Floradade (Crill et al., 1971) se comportaron con tolerancia media al daño por tizón tardío en fruto, con medias de uno a dos frutos dañados.
Se tienen avances en cuanto a la resistencia a este patógeno, pero aún no se han descubierto genes específicos. Se menciona que existen genes PR (Relacionados con la patogénesis) que se expresan al someter plantas de tomate al ataque de P. infestans, generando la producción de enzimas (PR-1) con acción antifúngica, lo que inhibe la germinación de las esporas y detiene el proceso de infección de la enfermedad. Cabe mencionar que la expresión de genes menores (Resistencia horizontal) es de gran importancia para iniciar un proceso de mejoramiento genético con respecto a protección contra patógenos (Robinson, 2000; Rivas et al., 2011).
Pudrición de raíz (Fusarium oxysporum)
Para el número de plantas muertas por F. oxysporum, la línea susceptible fue la 67 con una media de 4 (40 % de daño). Por el contrario se determina que las línea 77, 60 y el genotipo comercial Pik Ripe poseen tolerancia media al daño, con medias menores a uno (10 % de daño). El genotipo Floradade posee genes de resistencia contra F. oxysporum (Fol y For), lo cual se observó porque presentó una media de una planta muerta a partir de una muestra de 10, es decir, 10 % de daño por este patógeno evaluado (Crill et al., 1971).
Los resultados obtenidos coinciden con los reportados por Baéz-Valdez et al. (2010), quienes al evaluar el comportamiento de cuatro portainjertos de tomate frente a la infección por F. oxysporum, determinaron resistencia en plantas con ausencia de síntomas causados por este patógeno (daños = 0) y tolerancia en plantas con síntomas mínimos (con valor < 10 %). De la mima manera, los valores registrados en el presente ensayo son similares a los reportados por Mitov y Pérez (1973), quienes al determinar resistencia a F. oxysporum en variedades de tomate obtuvieron valores menores 15 % de daño en las evaluaciones realizadas. Mitidieri et al., (2005) determinaron resistencia a F. oxysporum en portainjertos de tomate al obtener daños por este patógeno menores a 13 %, después de 30 días de evaluación.
Nematodosagalladores (Nacobbus spp. y Meloidogyne spp.)
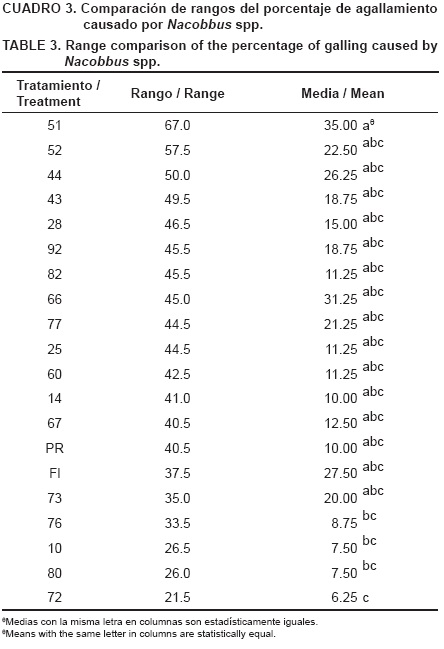
Las líneas 76, 10 y 80 mostraron tolerancia media al daño por Nacobbus spp., pues su media fue de 8 % de agallamiento en la raíz. La línea 72 fue la más tolerante, con 6.25 de porcentaje de agallamiento. Los testigos Pik Ripe y Floradade no mostraron resistencia adecuada para este nematodo, con medias de 10 y 27.5 % de agallamiento, respectivamente. Cabe aclarar que el testigo comercial Floradade se declara como resistente a nematodos. Sin embargo, en este ensayo existieron genotipos con el mismo grado de resistencia a Nacobbus spp. (P ≤ 0.05), incluso con valores numéricos de 12 a 35 % de agallamiento (Cuadro 3).
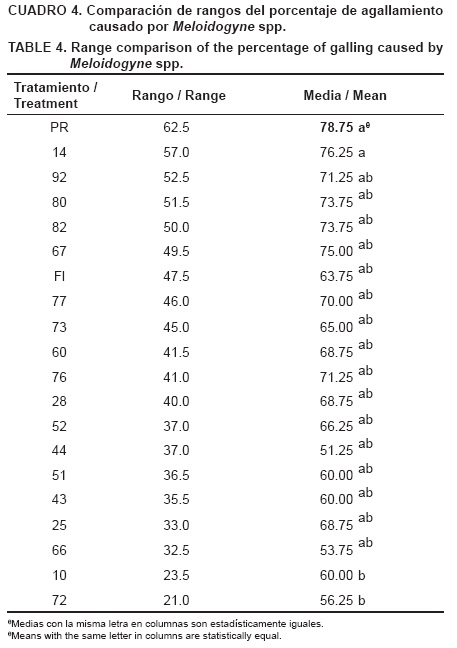
El genotipo Pik Ripe y la línea 14 mostraron alta susceptibilidad al daño por Meloidogyne spp., con medias de 78.75 y 76.25 % de agallamiento de la raíz, respectivamente. Las líneas con baja tolerancia al daño por dicho nematodo fueron la 72 y 10 con agallamiento de 56 y 60 %, respectivamente. El resto de las líneas, al igual que el genotipo Floradade, no mostraron diferencias (Cuadro 4).
La expresión del gen "Mi" genera la capacidad de resistencia en muchos híbridos conocidos en el mercado. Existe la probabilidad de que por lo menos uno de los materiales evaluados posea este gen enmascarado, y que al someterlo a un proceso de hibridación se exprese en el producto de la F1 (Rodríguez y Rodríguez, 1991).
Al analizar el daño total por nematodos (Nacobbus spp. y Meloidogyne spp.) se determinó que la línea 51 fue la más susceptible con 95 % de agallamiento de la raíz, mientras que las líneas 72 y 10 mostraron tolerancia media al daño por estos nematodos, con 62.5 y 67.5 % de agallamiento, respectivamente. Los testigos Pik Ripe y Floradade no mostraron resistencia alguna al daño por nematodos, a pesar de que Floradade fue registrado con tolerancia a nematodos. Esto es similar a lo reportado por Rodríguez y Rodríguez (1991), ya que al evaluar seis variedades de tomate determinaron resistencia a M. incognita con valores de 40 % de agallamiento en las raíces. En otro caso, al estudiar la respuesta de resistencia de cuatro patrones (portainjertos) de tomate frente a siete poblaciones de Meloidogyne, Cortada et al. (2010) determinaron resistencia de los mismos por el porcentaje de agallamiento registrado, que fue menor a 20 %. Como se puede observar, estos valores no coinciden con los obtenidos en el ensayo (60 a 70 %).
CONCLUSIONES
Las fuentes de tolerancia detectadas fueron seleccionadas en condiciones óptimas de desarrollo de patógenos.
Para tizón temprano (Alternaria solani), las líneas 52, 76, 73, 44, 92, 77, 72 y 25 poseen capacidad de tolerar el daño foliar y de fruto causado por este hongo.
Las líneas 77, 80, 43, 92, 72, 25 y 44 pueden heredar tolerancia al tizón tardío ( Phytophthora infestans).
La línea 60 puede conferir capacidad de tolerar el ataque por Fusarium oxysporum.
Respecto al daño por nematodos, las líneas 72, 80, 76 y 10 son fuentes de tolerancia al daño por Nacobbus spp., en tanto que para Meloidogyne spp. las fuentes de tolerancia son las líneas 72 y 10.
LITERATURA CITADA
AGRIOS, G. N. 2005. Planth Pathology. Fifth edition. Elsevier Academic Press. California, USA. 903 p. http://es.scribd.com/doc/57849124/Agrios-Plant-Pathology-5Th-Ed [ Links ]
ANÓNIMO. 2010. Producción Nacional de Jitomate. Sistema de Información Agroalimentaria y Pesquera. http://www.siap.gob.mx (Consulta: 25/07/2011). [ Links ]
BAÉZ-VALDEZ, E. P.; CARRILLO-FASIO, J. A.; BAÉZ-SAÑUDO, M. A.; GARCÍA-ESTRADA, R. S.; VALDEZ,-TORRES, J. B; CONTRERAS-MARTÍNEZ, R. 2010. Uso de portainjertos resistentes para el control de la fusariosis (Fusarium oxysporum f. sp. lycopersici Snyder & Hansen) del tomate (Lycopersicon esculentum Mill.) en condiciones de malla sombra. Revista Mexicana de Fitopatología 28(2): 11-122. http://www.redalyc.org/pdf/612/61218468004.pdf [ Links ]
BARQUERO, M.; GÓMEZ, L.; BRENES, A. 2006. Resistencia al tizón tardío ( Phytophthora infestans) en clones promisorios de papa en Costa Rica. Agronomía Costarricense 29(3): 31-45. http://www.revistas.ucr.ac.cr/index.php/agrocost/article/download/6779/6466 [ Links ]
BAUTISTA M., N.; CHAVARÍN, P. C.; VALENZUELA, E. F. 2010. Jitomate: Tecnología para su Producción en Invernadero. Colegio de Postgraduados. Montecillos, México. 241 p. [ Links ]
CEPEDA, S. M. 1996. Nematología Agrícola. Trillas. D. F., México. 305 p. [ Links ]
COCHRAN, W. G.; COX, G. M. 1990. Diseños Experimentales. Trillas. D. F., México. 661 p. [ Links ]
CONOVER, W. J. 1980. Practical Nonparametric Statistics. John Wiley & Sons. California, USA. 493 p. [ Links ]
CORTADA, L.; SORRIBAS, C. J.; ORNAT, C.; ANDRÉS, M. F.; VERDEJO-LUCAS, S. 2010. Patrones de tomate resistentes a Meloidogyne: variabilidad de la respuesta de resistencia en función de la población del nematodo. Horticultura Global 288: 40-45. http://www.horticom.com/revistasonline/horticultura/rhg288/40_45.pdf [ Links ]
COBB, N. A. 1918. Estimating the Nematode Population of the Soil. Agricultural Technical Circular 1. United States Department of Agriculture. USA. 48 p. [ Links ]
CRILL, P.; STROBEL, J. W.; BURGIS, D. S. 1971. Florida MH-1, Florida's first machine harvest fresh market tomato. University of Florida. Gainesville, Florida, USA. 12 p. [ Links ]
EISENBACK, J. D.; HIRSCHMANN, H.; SASSER, J. N.; TRIANTAPHYLLOU, A. C. 1981. A Guide to the Four Most Common Species of Root-Knot Nematodes (Meloidogyne species) with a Pictorial Key. Departments of Plant Pathology and Genetics North Carolina State University-The United States Agency for International Development. Raleigh, North Carolina, USA. 48 p. http://pdf.usaid.gov/pdf_docs/pnaaq221.pdf [ Links ]
GALLEGLY, M. E.; HONG, C. 2008. Phytophthora: identifying species by morphology and DNA fingerprints. American Phytopathological Society Press. Saint Paul, Minnesota, USA. 158 p. [ Links ]
GARCÍA, M. E. 1981. Modificaciones del Sistema de Clasificación Climática de Köppen: para adaptarlo a las condiciones de la República Mexicana. 3ª Edición. Universidad Nacional Autónoma de México. D. F., México. 264 p. [ Links ]
GONZÁLEZ-CHÁVEZ, M.; DÍAZ, N.; FUNDORA, Z.; ARMAS, D.; SOTO, J. A. 2001. Caracterización de la resistencia a Alternaria solani en cultivares nativos de tomate (Lycopersicon esculentum var. ceraciforme). Revista Protección Vegetal 16(2-3): 116-119. http://ftp.censa.edu.cu/revistas_censa/rpv/v16n2-3/pag116-119.pdf [ Links ]
HENFLING, J. W. 1987. Late Blight of Potato ( Phytophthora infestans). Technical Information Bulletin 4. International Potato Center. Lima, Perú. 25 p. http://pdf.usaid.gov/pdf_docs/PNAAY345.pdf [ Links ]
INFANTE G., S.; ZÁRATE L., G. P. 1990. Métodos Estadísticos: Un Enfoque Interdisciplinario. Trillas. D. F., México. 643 p. [ Links ]
JARAMILLO V., S. 2003. Monografía sobre Phytophthora infestans (Mont) de Bary. Universidad Nacional de Colombia. Medellín, Colombia. 120 p. [ Links ]
JONES, J. B.; JONES, J. P.;STALL, R. E.; ZITTER, T. A. 1991. Compendium of Tomato Diseases. American Phytopathological Society Press. Saint Paul, Minnesota, USA. 73 p. [ Links ]
JAMES, C. 1971. A Manual of Assessment Keys for Plant Diseases. American Phytopathological Society. California, USA. 90 p. [ Links ]
JINSIN, Y. 1999. Evaluation of Cherry Tomato Inbred Lines for Multiple Disease Resistance. Asian Regional Center. China. [ Links ]
LESLIE, J. F.; SUMMERELL, B. A. 2006. The Fusarium Laboratory Manual. Blackwell Publishing. Ames, Iowa, USA. 388 p. [ Links ]
MANZANILLA-LÓPEZ, R. H.; COSTILLA, M. A.; DOUCET, M.; FRANCO, J.; INSERRA, R. N.; LEHMAN, P. S.; PRADO-VERA, C.; SOUZA, R. M.; EVANS, K. 2002. The genus Nacobbus Thorne & Allen, 1944. (Nematoda: Pratylenchidae): systematics, distribution, biology and management. Nematropica 32(2): 149-227. http://journals.fcla.edu/nematropica/article/view/69655/67315 [ Links ]
MENDOZA Z. C. 1999. Diagnóstico de Enfermedades Fungosas. Universidad Autónoma Chapingo. Chapingo, México.168 p. [ Links ]
MITOV, N.; PÉREZ, M. 1973. Resistencia de variedades de tomate al Fusarium oxysporum f. lycopersici (Sacc.) Snyder y Hansen. Agricultura 6(2): 52-61. [ Links ]
MITIDIERI, M. S.; BRAMBILLA, M. V.; PIRIS, M.; PIRIS, E.; MALDONADO, L. 2005. El Uso de Portainjertos Resistentes en Cultivo de Tomate Bajo Cubierta: Resultados Sobre la Sanidad y el Rendimiento del Cultivo. Instituto Nacional de Tecnología Agropecuaria. Buenos Aires, Argentina. 8 p. http://www.biblioteca.org.ar/libros/210791.pdf [ Links ]
MOYA, C.; ARZUAGA, J.; AMAT, I.; SANTIESTEBAN, L.; ÁLVAREZ, M.; PLANA, D.; DUEÑAS, F.; FLORIDO, M.; HERNÁNDEZ, J.; FONSECA, E. 2009. Evaluación y selección participativa de nuevas líneas y variedades de tomate (Solanum lycopersicum L.) en la región oriental de Cuba. Cultivos Tropicales 30(2): 66-72. http://ediciones.inca.edu.cu/anteriores/pdf/2009/2/CT30211.pdf [ Links ]
PEDROZA S., A. 1995. Epidemiología Agrícola: Principios y Aplicaciones. Universidad Autónoma Chapingo. Bermejillo, Durango, México. 104 p. [ Links ]
PRADO-VERA, I. C.; TOVAR-SOTO, A.; HERNÁNDEZ, J. A. 2001. Distribución de especies y razas de Meloidogyne en México. Revista Mexicana de Fitopatología 19(1): 32-39.http://socmexfito.org/images/stories/revista_smf/2001/001/61219105.pdf [ Links ]
RISTAINO, J. B. 2011. Key for Identification of Common Phytophthora Species. CD-Rom format. American Phytopathological Society. [ Links ]
RIVAS, F.; PROAÑO, K.; JIMÉNEZ, P.; LEÓN-REYES, A. 2011. Análisis de la expresión del gen PR-1, mediante la técnica de PCR en tiempo real (RT-PCR), en tomate (Solanum lycopersicum L.) infectado con Phytophthora infestans. Revista Digital VI Congreso Ciencia y Tecnología ESPE 2011, Ciencias de la vida 5. Sangolqui, Ecuador. pp. 1-11. http://www.espe.edu.ec/portal/files/sitio_congreso_2011/papers/V5.pdf [ Links ]
ROBINSON, R. A. 2000. El Retorno de la Resistencia: Fitomejoramiento de los Cultivos Para Reducir la Dependencia de Plaguicidas. Traducido al español por ROMERO R., F. Colegio de Posgraduados. Montecillos, México. 292 p. http://www.redsemillas.info/wp-content/uploads/2008/12/dosier-fitomejoramiento.pdf [ Links ]
RODRÍGUEZ, D.; ALCALÁ, M. D.; ESCALONA, F. 2008. Selección inicial de clones de papa por resistencia a la candelilla tardía y rendimiento. Bioagro 20(1): 29-35. http://www.ucla.edu.ve/bioagro/Rev20%281%29/4.%20Selecci%C3%B3n%20inicial%20de%20clones.pdf [ Links ]
RODRÍGUEZ, J. M.; RODRÍGUEZ, R. 1991. Resistencia de cultivares de tomate con el gen "Mi" ante poblaciones de Meloidogyne spp. (Nematoda: Tylenchidae) en Gran Canaria (Islas Canarias). Boletín de Sanidad Vegetal Plagas 17: 529-535. http://www.magrama.gob.es/ministerio/pags/biblioteca/revistas/pdf_plagas%2FBSVP-17-04-529-535.pdf [ Links ]
RODRÍGUEZ, M. L. M. 2012. Rendimiento, Aptitud Combinatoria y Heterosis Intervarietal en Líneas Experimentales de Tomate. Universidad Autónoma Chapingo. Chapingo, México. 95 p. [ Links ]
ROMERO C., S. 1993. Hongos Fitopatógenos. Universidad Autónoma Chapingo. Chapingo, México. 347 p. [ Links ]
SIMMONS, E. G. 2007. Alternaria: an identification manual. CBS Fungal Biodiversity Centre. Netherlands. 775 p. [ Links ]
STEINER, A.A. 1984. The universal nutrient solution. In: Proceedings 6th International Congress on Soilles Culture. Wageningen, The Netherlands. 633-650 p. [ Links ]
TAYLOR, A. L.; SASSER, J. N. 1978. Biology, Identification and Control of Root-Knot Nematodes. (Meloidogyne species). North Carolina State University Graphics. Raleigh, North Carolina, USA. 111 p. http://pdf.usaid.gov/pdf_docs/pnaak809.pdf [ Links ]
TELLO M., J. C.; MORAL V., J. 1995. Enfermedades no víricas del tomate, pp. 523-564. In: El Cultivo del Tomate. NUEZ, F. (ed.). Mundi-Prensa. Madrid, España. [ Links ]
TOLEDO A., J.; INFANTE M., F. 2008. Manejo Integrado de Plagas. Trillas. D. F., México. 327 p. [ Links ]
ZUCKERMAN, B. M.; MAI, W. F.; KRUSBERG, L. R.; MARBAN, N. M. 2005. Fitonematología Práctica: Ejercicios de Laboratorio. Universidad Autónoma Chapingo. Chapingo, México. 234 p. [ Links ]
ZÚÑIGA L., L. N.; MOLINA G., J. D.; CADENA H., M. A.; RIVERA P., A. 2000. Resistencia al tizón tardío de la papa ( Phytophthora infestans) en cruzamientos de cultivares y clones de papa (Solanum tuberosum L.). Revista Mexicana de Fitopatología 18(1):1-9. http://www.redalyc.org/articulo.oa?id=61218101 [ Links ]














