Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Chapingo. Serie horticultura
On-line version ISSN 2007-4034Print version ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.19 n.2 Chapingo May./Aug. 2013
https://doi.org/10.5154/r.rchsh.2012.10.059
Etiología y control de la necrosis de flores y pudrición de frutos de pepino en Morelos, México
Etiology and control of flower necrosis and fruit rot in cucumber in Morelos, Mexico
Tania Núñez-Rios1; Santos Gerardo Leyva-Mir2*; Juan Enrique Rodríguez-Pérez1; Luis Antonio Mariscal-Amaro3
1 Universidad Autónoma Chapingo, Departamento de Fitotecnia. km 38.5 Carretera México-Texcoco. Chapingo, Estado de México, MÉXICO. C. P. 56230.
2 Universidad Autónoma Chapingo, Departamento de Parasitología Agrícola. km 38.5 Carretera México-Texcoco. Chapingo, Estado de México, MÉXICO. C. P. 56230. Correo-e: lsantos@correo.chapingo.mx (*Autor para correspondencia).
3 Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias, Campo Experimental Bajío. km 6.5 Carretera Celaya-San Miguel de Allende. Celaya, Guanajuato, MÉXICO. C. P. 38110.
Recibido: 27 de octubre, 2012.
Aceptado: 26 de junio, 2013.
Resumen
Durante muestreos realizados en 2010, se observaron síntomas severos de necrosis de flores, tizón de hojas y pudrición de frutos en parcelas de pepino de Totolapan, Morelos, México. La incidencia de la enfermedad fluctuó entre 40 y 50 %. Se aislaron colonias fungosas a partir de hojas, flores y frutos sintomáticos colectados en diferentes sitios. Las características morfológicas de las colonias, conidios y esclerocios de los aislados fungosos fueron similares a Botrytis cinerea. Un aislado representativo de B. cinerea se seleccionó para análisis molecular mediante la amplificación de la región ITS. La patogenicidad del aislado se verificó mediante la inoculación de una suspensión conidial sobre 10 plántulas y 10 frutos de pepino. Cinco plántulas y frutos asperjados con agua destilada estéril sirvieron como control. Las plántulas y frutos control permanecieron sanos, mientras que los frutos inoculados con la suspensión de conidios desarrollaron lesiones grises a los cinco días después de la inoculación. B. cinerea se reaisló consistentemente a partir de hojas y frutos con lesiones. Con base en el aislamiento, identificación morfológica y molecular, así como pruebas de patogenicidad, se determinó a B. cinerea como el agente causal de la necrosis de flores, tizón de hojas y pudrición de frutos de pepino en Totolapan, Morelos, México. Adicionalmente, se evaluó la eficacia de cuatro fungicidas y del agente de biocontrol T. harzianum contra B. cinerea en plantas de pepino en invernadero. Los fungicidas clorotalonil y thiabendazol mostraron los más altos porcentajes de control. Los tratamientos químicos y la cepa de T. harzianum no redujeron significativamente la infección causada por B. cinerea.
Palabras clave: Cucumis sativus, Botrytis cinerea, Botryotinia fuckeliana, Trichoderma harzianum, fungicidas.
Abstract
During field surveys conducted in 2010, severe symptoms of leaf blight, flower necrosis and fruit rot were observed in cucumber fields in Totolapan, Morelos, Mexico. Disease incidence ranged between 40 and 50 %. Fungal colonies were isolated from symptomatic cucumber leaves, flowers and fruits collected from different fields. Morphological characteristics of the colonies, conidia, and sclerotia of these fungal isolates were similar to Botrytis cinerea. A representative isolate of B. cinerea was selected for molecular analysis by amplification of the ITS region. Pathogenicity of the representative isolate was tested by inoculation of a conidial suspension on 10 cucumber seedlings and 10 fruits. Five seedlings and fruits inoculated with sterile distilled water served as controls. Control seedlings and fruits remained healthy, but grey lesions on inoculated leaves and fruits were observed five days after inoculation. B. cinerea was consistently re-isolated from leaves and fruits with lesions. On the basis of the isolation, morphological and molecular identification, and pathogenicity tests, B. cinerea was determined to be the causal agent of leaf blight, flower necrosis and fruit rot in cucumber in Totolapan, Morelos, Mexico. Additionally, the efficacy of four fungicides and the bio-control agent T. harzianum against B. cinerea in cucumber plants was evaluated in a greenhouse test. The fungicides chlorothalonil and thiabendazole showed the highest percent control, but the chemical treatments and the strain of T. harzianum did not significantly reduce the symptoms caused by B. cinerea.
Keywords: Cucumis sativus, Botrytis cinerea, Botryotinia fuckeliana, Trichoderma harzianum, fungicides.
INTRODUCCIÓN
El pepino (Cucumis sativus L.) es una hortaliza de fruto que se consume en fresco. En el 2011, la superficie sembrada en México en sistemas de riego y temporal fue de 16,534 ha, de las que se obtuvo una producción total de 425,433 t de fruta. Los estados con mayor volumen de producción fueron Michoacán, Sinaloa y Sonora. El estado de Morelos fue el quinto productor de este cultivo con una superficie sembrada de 1,397 ha y una producción de 24,596 t (Anónimo, 2012).
Botrytis cinerea (teleomorfo: Botryotinia fuckeliana) es un hongo fitopatógeno con habito necrotrófico que ataca alrededor de 200 cultivos a nivel mundial, principalmente en regiones templadas y subtropicales. Este patógeno es responsable de inducir una amplia variedad de síntomas, los cuales no pueden ser generalizados a través de los órganos y tejidos vegetales. Los síntomas típicos sobre hojas y frutos es una pudrición suave, acompañada de colapso del parénquima, y seguida por un rápido desarrollo de masas grises de conidios. En pepinos, calabacitas y fresas, la infección por B. cinerea comienza sobre flores senescentes y avanza como una pudrición suave que se dispersa y afecta el desarrollo de frutos adyacentes (Williamson et al., 2007).
Este hongo patógeno es difícil de controlar debido a que presenta una gran variedad de modos de ataque, diversos hospedantes como fuente de inóculo, y puede sobrevivir como micelio, conidios y esclerocios en residuos de cultivos. Por estas razones, el uso de una simple medida de control no es suficiente, y se requiere de un conocimiento detallado sobre la interacción patógeno-hospedante, del microambiente en el cual se desarrolla el hongo y de sus competidores microbianos localizados en el hospedante (Williamson et al., 2007).
Durante las últimas dos décadas, el método más efectivo para el control de B. cinerea ha sido el uso de fungicidas benzimidazoles, dicarboxamidas y multi-sitio. Sin embargo, esta estrategia de control es costosa, no garantiza el control de las enfermedades y existe riesgo de que los hongos generen resistencia (Lee et al., 2006; Koike et al., 2007).
Otra alternativa que se ha investigado extensivamente para el control de B. cinerea es la aplicación de agentes de biocontrol. Los organismos que han mostrado mayor potencial son Trichoderma harzianum, Clonostachys rosea, Ulocladium oudemansii, Bacillus subtilis, Pseudomonas syringae, y Candida oleophila (Elad y Steward, 2007). Trichoderma harzianum es un agente de biocontrol eficiente que se usa contra patógenos bajo condiciones comerciales (Elad et al., 1993; Dik y Elad, 1999; Howell, 2003). Algunos mecanismos que se han reportado como responsables del control de patógenos mediante el uso de Trichoderma spp. son competencia por espacio y nutrientes, micoparasitismo, producción de compuestos inhibitorios o antibióticos, supresión de la esporulación y resistencia inducida (Dubos y Bulit, 1981; Belanger et al., 1995; Zimand et al., 1996).
En la zona productora de pepino a campo abierto de Totolapan, Morelos, México, se han observado síntomas severos de necrosis de flores, tizón de hojas y pudrición de frutos de pepino. Por lo anterior, los objetivos de este estudio fueron identificar al agente causal de los síntomas de necrosis, tizón y pudrición, mediante la combinación de análisis morfológicos, moleculares y patogénicos, y evaluar la efectividad de productos químicos y biológicos para el control de esta enfermedad.
MATERIALES Y MÉTODOS
Recolección de muestras
Durante el ciclo de producción 2010, se recolectaron un total de 100 flores necrosadas, 50 hojas con síntoma de tizón y 50 frutos con pudrición gris oscuro en parcelas comerciales de pepino en Totolapan, Morelos, México, localizado a 18° 59' LN y 98° 54' LO. Las muestras se colocaron en bolsas de papel y se trasladaron al Laboratorio de Micología Agrícola de la Universidad Autónoma Chapingo para su adecuado procesamiento.
Aislamiento y purificación
Se realizaron cortes de tejido vegetal (hojas, flores y frutos) de 1 cm2 a partir de la zona de transición entre el tejido enfermo y sano. Los fragmentos de tejido se desinfestaron con hipoclorito de sodio al 3 % por 5 min, se enjuagaron con agua destilada estéril tres veces y se transfirieron a cajas Petri con medio de cultivo papa-dextrosa-agar (PDA) al 2 %. Las cajas se incubaron a 24 °C bajo condiciones de luz negra continua. Las colonias fungosas más frecuentes se transfirieron a cajas Petri con PDA fresco y se incubaron hasta la formación de estructuras de reproducción (conidios y conidióforos). La obtención de cultivos monoconidiales se realizó de acuerdo a la metodología descrita por Crous et al. (2009).
Prueba de patogenicidad
Un aislado monoconidial del hongo que presentó la mayor frecuencia se inoculó en 10 plántulas y 10 frutos de pepino variedad Poinset 76. La inoculación en las plántulas se realizó 15 días después de la siembra cuando éstas presentaban la primera hoja verdadera. Los frutos de pepino se desinfestaron previamente en una solución de hipoclorito de sodio al 1 % por 3 min. El inóculo del hongo se ajustó a una concentración de 1 × 106 conidios·ml-1 usando una cámara de Neubahuer para el conteo de esporas. Se agregaron 2 ml del surfactante Tween 20® por litro de agua destilada estéril. La suspensión se aplicó con un aspersor manual sobre hojas y frutos de pepino, hasta punto de escurrimiento. Cinco plántulas y cinco frutos, que sirvieron como control, se asperjaron únicamente con agua destilada estéril. Todas las plántulas y frutos de pepino se colocaron en cámara húmeda durante siete días a 22 ± 2 °C y con 100 % de humedad relativa. Una vez que las plántulas y frutos inoculados presentaron la misma sintomatología que los tejidos colectados inicialmente, se obtuvieron reaislados del organismo inoculado siguiendo la metodología mencionada anteriormente. La prueba de patogenicidad se realizó dos veces.
Identificación morfológica
Las características de las colonias crecidas en PDA se registraron cada 48 h. Además, se realizaron preparaciones con glicerol a partir de las estructuras de reproducción asexual (conidióforos y conidios). Las preparaciones se analizaron en microscopia de luz a 400 X, en donde se registró el tamaño, septación, forma y color de 20 conidióforos y 100 conidios. La identificación a nivel de género se realizó comparando las estructuras morfológicas del hongo con las claves de Barnett y Hunter (2006), y para especie se utilizaron las descripciones especializadas de Ellis (1971) y Crous et al. (2009).
Extracción, amplificación y secuenciación de ADN
A partir de colonias fungosas crecidas en PDA, se extrajo el DNA genómico con el kit DNAeasy (Qiagen®), de acuerdo al protocolo recomendado por el manufacturero. Una vez extraído el DNA, se verificó su calidad por electroforesis en gel de agarosa (Ultrapure, Invitrogen®) al 1.5 %. Mediante PCR, y se amplificaron las regiones ITS1 e ITS2 usando los iniciadores universales ITS5 (5'-GGAAGTAAAAGTCGTAACAAGG-3') e ITS4 (5'-TCCTCCGCTTATTGATATGC-3') (White et al., 1990). Para cada reacción de PCR se utilizó un volumen final de 25 µl de la mezcla compuesta por amortiguador de DNA polimerasa Taq (Buffer) 1X, MgCl2 a 0.13 mM, dNTP's a 16 µM, marcador molecular a 20 pmoles, Taq-DNA polimerasa a 0.4 U. A la mezcla de reacción se le adicionaron 5 µl de DNA del hongo (80 ng/µl) y se colocó en un termociclador CT 2400 ICA (Perkin-Elmer®). El programa del termociclador presentó las siguientes características: desnaturalización inicial a 95 °C por 1 min; 30 ciclos a 95 °C por 1 min, alineación a 50 °C por 30 s, extensión a 72 °C por 2 min, y extensión final a 72 °C por 10 min. El fragmento amplificado se purificó con el Kit Wisard PCR Clean up System (Quiagen®). Los productos de PCR se secuenciaron en el laboratorio MacroGen en Corea. Las secuencias ITS obtenidas en este estudio se compararon con secuencias de organismos referencia con mayor similitud, por medio de una búsqueda en la base de datos BLAST del National Center for Biotechnology Information.
Prueba de control
Para el experimento en invernadero, se utilizaron plantas de pepino variedad Sol verde cultivadas en macetas. Se evaluaron cuatro fungicidas comerciales (benomilo, iprodione, clorotalonil y thiabendazol, a una dosis de 2 g·litro-1), y el agente de control biológico Trichoderma harzianum, a una concentración de 1 × 108 conidios·ml-1), un testigo inoculado (1 × 108 conidios·ml-1), y otro sin inocular, con 10 repeticiones de cada uno, bajo un diseño experimental de bloques completos al azar, en donde la unidad experimental fue una maceta. La cepa de T. harzianum se obtuvo de la colección de cepas del Laboratorio de Micología Agrícola de la Universidad Autónoma Chapingo. Los tratamientos se asperjaron sobre hojas, flores y frutos de pepino recién formados hasta el punto de escurrimiento. Dichas aplicaciones se realizaron durante la etapa de floración-fructificación con una mochila manual de 15 litros y boquilla de cono hueco. La suspensión conidios de T. harzianum se preparó a partir de colonias de 30 días de edad. Se ajustó la concentración a 1 × 108 conidios·ml-1 con ayuda de la cámara de Neubauer. Veinticuatro horas después, se realizó la inoculación del patógeno sobre las plantas, siguiendo el procedimiento mencionado anteriormente en las pruebas de patogenicidad, y las plantas se mantuvieron en una cámara bioclimática a 24 °C y con humedad relativa de 100 % durante 48 h. Se evaluó el número de brotes, flores y frutos enfermos, con la escala de daño: 1= ausencia de enfermedad; 2= 25 % de enfermedad; 3= 50 % de enfermedad, 4= 75 % de enfermedad y 5= planta muerta. Además se determinaron el porcentaje de infección y porcentaje de efectividad.
Análisis estadístico
Con los valores de la escala de daño se calculó la media ponderada de la severidad (Bautista y Díaz, 2001):

Donde:
I = porcentaje de infección de plantas inoculadas
ni = número de plantas de la categoría i
vi = valor en la escala de daño de la categoría i
CM = categoría de mayor valor numérico de la escala de daño
N = número del total de plantas muestreadas
Con el valor del porcentaje de infección se calculó la fórmula de Abbott (Bautista y Díaz, 2001):
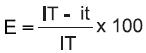
Donde:
E = porcentaje de efectividad del tratamiento
IT = porcentaje de infección del testigo inoculado
it = porcentaje de infección del tratamiento
Se realizó un análisis de varianza y comparación de medias con la prueba de Tukey (P ≤ 0.05), usando el paquete de análisis estadístico SAS 9.0 (Statistical Analysis System®).
RESULTADOS Y DISCUSIÓN
Hongos aislados
De flores necróticas, se obtuvieron un total de 200 aislados, los cuales correspondieron a los hongos Botrytis sp. (88 %), Alternaria sp. (10 %) y Aspergillus sp. (2 %). A partir de hojas con síntomas de tizón, se aisló a Botrytis sp. (79 %) y Alternaria sp. (21 %). De frutos con pudrición se obtuvieron un total de 100 aislados fungosos, los cuales se identificaron como Botrytis sp. (74 %), Aspergillus sp. (15 %), Fusarium sp. (6 %) y Cladosporium sp. (5 %).
Prueba de patogenicidad
Cinco días después de la inoculación (ddi) con la suspensión de conidios de Botrytis sp., todas las plántulas presentaron puntuaciones de color gris pardo a marrón oscuro en el tejido foliar. El hongo invadió el tejido y provocó lesiones necróticas (Figura 1A) que disminuyeron el área fotosintética (Figura 1B), lo que resultó en plántulas débiles y raquíticas (Figura 1C), y en los casos más severos causó la muerte de las plántulas al invadir el meristemo apical e inducir marchitez del tejido vegetal (Figura 1D). Por otra parte, todos los frutos inoculados con la suspensión conidial mostraron síntomas de pudrición gris oscura a los 6 ddi, además de una abundante esporulación del hongo. Las plántulas y frutos control permanecieron libres de la enfermedad. A partir de las plántulas y frutos sintomáticos, se re-aisló a Botrytis sp.
Identificación morfológica
Las colonias de Botrytis sp. exhibieron crecimiento micelial concéntrico, de consistencia afelpada y color blanco (Figura 2A). Después de 15 días, el micelio se tornó color gris. Los aislados más viejos formaron una gran cantidad de esclerocios negros de forma irregular, con un diámetro de 2-3 mm. En microscopía de luz, se observaron conidióforos largos originados irregularmente, septados, pigmentados, con pared lisa, ramificados apicalmente y con racimos de conidios (Figura 2B). Los conidios fueron unicelulares, ovoides, lisos, color café pálido y de 8-15 x 6-9 μm. Todas las características morfológicas observadas correspondieron con las descripciones de Ellis (1971) y Crous et al. (2009) para el caso de Botrytis cinerea.
Identificación molecular
Las dos secuencias de la región ITS obtenidas mostraron 99 % de similaridad con la secuencia de Botryotinia fuckeliana (Anamorfo: Botrytis cinerea) con número de acceso en el Genbank EU128649. Lo anterior confirmó los resultados obtenidos en la identificación morfológica.
Los resultados de la identificación morfológica y molecular, así como a las pruebas de patogenicidad, determinaron que B. cinerea fue el agente causal de los síntomas de necrosis de flores, tizón de hojas y pudrición de frutos de pepino colectados en campos de Totolapan, Morelos, México. Todos los síntomas observados en las plantas enfermas de este estudio correspondieron con lo indicado por Dik y Elad (1999) y Segarra et al. (2007), quienes reportaron a B. cinerea como el agente inductor de necrosis y pudrición gris en hojas, flores, tallos y frutos de pepino, tanto en condiciones de invernadero como a campo abierto.
Efectividad de tratamientos
Con base en la escala de daño utilizada, se determinaron los porcentajes de infección de la enfermedad en plantas inoculadas y el porcentaje de efectividad de los tratamientos (Cuadro 1). El tratamiento de plántulas inoculadas presentó 64 % de infección, mientras que los tratamientos a base de los fungicidas clorotalonil, thiabendazol y benomilo presentaron la mayor efectividad. Sin embargo, con estos tratamientos se obtuvieron infecciones superiores a 43 %.
El fungicida multi-sitio clorotalonil resultó ser el tratamiento más efectivo dentro de la gama de fungicidas evaluados, lo cual se debió a que es un compuesto altamente toxico sobre conidios de Botrytis spp., tal y como lo reportaron Slawecki et al. (2002) y Tremblay et al. (2003).
Existen varios reportes en donde señalaron a los fungicidas benzimidazoles como altamente efectivos en el control de infecciones causadas por B. cinerea (Delp, 1995). Sin embargo, los resultados de este estudio mostraron que los fungicidas benomilo y thiabendazol exhibieron una efectividad similar a la del fungicida multi-sitio clorotalonil. Posiblemente, estos resultados son atribuidos al fenómeno de resistencia a fungicidas que presenta B. cinerea, principalmente con los grupos químicos que incluyen a los benzimidazoles (benomilo y thiabendazol), dicarboximidas (iprodione) y fenilcarbamatos (Elad et al., 2008).
De acuerdo con Marsh (1977) se consideran buenos fungicidas aquellos que presentan efectividades superiores al 90 %, por lo que los fungicidas utilizados en este estudio no entran dentro de este rango, ya que obtuvieron efectividades menores al 31 %. Otra causa probable por la que no se obtuvieron efectividades aceptables en el control de infecciones causadas por B. cinerea, puede ser que en este estudio únicamente se realizó una aplicación de cada fungicida, en contraste con diferentes estudios de efectividad en los que realizaron al menos dos aplicaciones de cada fungicida sistémico, además de la aspersión de fungicidas multi-sitio en una frecuencia hasta de cuatro aplicaciones por ciclo, tal y como lo mencionaron Yildiz et al. (2007).
Aunque Dik y Elad (1999) y Lee et al. (2006) reportaron un progreso considerable en el biocontrol de Botrytis spp. mediante el uso de Trichoderma spp. bajo condiciones de campo. Existe una severa inconsistencia en la efectividad de los organismos de biocontrol, debido principalmente a la alta complejidad de las interacciones entre planta, patógeno, ambiente, y agente de biocontrol (Elad y Steward, 2007). Otras razones que condicionan la efectividad de T. harzianum se explican por los rangos restringidos de temperatura o humedad del agente de biocontrol para obtener un máximo de acción microbiana, además de que estos agentes son influenciados por fluctuaciones en poblaciones naturales de los microorganismos del filoplano que responden a cambios en los exudados de la planta y en el ambiente (Williamson et al., 2007). Lo anterior puede explicar la baja efectividad que presentó en este estudio el tratamiento con T. harzianum.
En este estudio, la infección general por B. cinerea se incrementó progresivamente: el mayor valor se presentó a los 19 ddi con 60 % de daño en la planta y 22 % de efectividad, tal y como se observa en el Cuadro 2.

La interacción de los tratamientos y ddi para la variable infección mostró tres tipos de comportamiento: el primero para el testigo inoculado, con los porcentajes de infección más altos; el segundo para los tratamientos de T. harzianum e iprodione, y por último el grupo de los fungicidas clorotalonil, benomilo, thiabendazol (Figura 3).
Cabe mencionar que al hacer la aplicación de los tratamientos preventivamente antes de la inoculación, el valor más bajo de infección se presentó a los 5 ddi y el intervalo de seguridad se mantuvo hasta los 8 ddi. Este periodo reducido de seguridad se atribuye a la agresividad con que B. cinerea infecta a las plantas de pepino. Estos resultados evidencian la necesidad de evaluar una mejor estrategia de manejo de este hongo fitopatógeno, ya que aun cuando se realizó la aplicación preventiva de los tratamientos, no se logró un control efectivo. Además, los principales fungicidas empleados para el control de B. cinerea presentan mediano y alto riesgo de inducir resistencia en el hongo. Por otro lado, T. harzianum no fue efectivo contra el hongo y requiere estudios posteriores. Se hace notoria la exploración de nuevas alternativas de manejo de B. cinerea, mismas que consideren alternar varios grupos químicos de fungicidas en conjunto con el control biológico y cultural.
CONCLUSIONES
La identificación morfológica, molecular y pruebas de patogenicidad confirmaron que Botrytis cinerea es el agente causal de los síntomas de necrosis de flores, tizón de hojas y pudrición de frutos de pepino en Totolapan, Morelos, México.
Los fungicidas clorotalonil, tiabendazol y benomilo presentaron las más altas efectividades en el control de B. cinerea en plantas de pepino, con 30, 29 y 28 %, respectivamente, mientras que el agente de biocontrol T. harzianum exhibió una efectividad del 14 %, lo que indica que ninguno de los tratamientos evaluados en este estudio mostraron una efectividad aceptable en el control de los síntomas causados por B. cinerea.
LITERATURA CITADA
ANÓNIMO. 2012. Cierre de la producción agrícola por estado. Servicio de Información Agroalimentaria y Pesquera. SAGARPA. http://www.siap.sagarpa.gob.mx (21 de Octubre de 2012). [ Links ]
BARNETT, H. L.; HUNTER, B. B. 2006. Illustrated genera of imperfect fungi. Fourth edition. Burgess publishing company. New York, USA. 241 p. [ Links ]
BAUTISTA, M. N.; DÍAZ, G. O. 2001. Bases para realizar estudios de efectividad biológica de plaguicidas. Colegio de Postgraduados. Montecillo, Texcoco, Estado de México, México. 148 p. [ Links ]
BELANGER, R. R.; DUFOUR, N.; CARON, J.; BENHAMOU, N. 1995. Chronological events associated with the antagonistic properties of Trichoderma harzianum against Botrytis cinerea: Indirect evidence for sequential role of antibiosis and parasitism. Biocontrol Science and Technology 5(1): 41-54. doi: 10.1080/09583159550040006 [ Links ]
CROUS, P. W.; VERKLEY, G. J. M.; GROENEWALD, J. Z.; SAMSON, R. A. 2009. Fungal Biodiversity. CBS-KNAW. Utrecht, The Netherlands. 269 p. [ Links ]
DELP, C. J. 1995. Benzimidazole and related fungicides, pp. 291-303. In: Lyr, H. (ed.) Modern Selective Fungicides. Gustav Fisher Verlag, Jena, Germany. [ Links ]
DIK, A. J.; ELAD, Y. 1999. Comparison of antagonists of Botrytis cinerea in greenhouse-grown cucumber and tomato under different climatic conditions. European Journal of Plant Pathology 105(2): 123–137. doi: 10.1023/A:1008778213278 [ Links ]
DUBOS, B.; BULIT, J. 1981. Filamentous fungi as biocontrol agents on aerial plant surfaces, pp. 353-356 In: Microbial Ecology of the Phylloplane. J. P. Blackman (ed). Academic Press. London, United Kingdom. [ Links ]
ELAD, Y.; ZIMAND, G.; ZAQS, Y.; ZURIEL, S.; CHET, I. 1993. Use of Trichoderma harzianum in combination or alternation with fungicides to control cucumber grey mold (Botrytis cinerea) under commercial greenhouse conditions. Plant Pathology 42(3): 324-332. doi: 10.1111/j.1365-3059.1993.tb01508.x [ Links ]
ELAD, Y.; STEWART, A. 2007. Microbial control of Botrytis spp., pp. 223–241. In: Botrytis: Biology, Pathology and Control. ELAD, Y.; WILLIAMSON, B.; TUDZYNSKI, P.; DELEN, N. (eds.). Springers. Dordrecht, The Netherlands. doi: 10.1007/978-1-4020-2626-3_13 [ Links ]
ELAD, Y.; SHPIALTER, L.; KOROLEV, N.; MAMIEV, M.; RAV, D. D.; DORI I.; GANOT, I.; SHMUEL, D.; MATAN, E.; MESSIKA, Y. 2008. Integrated chemical and cultural control for grey mold (Botrytis cinerea) management in Lisianthus. Modern Fungicides and Antifungal Compounds V. 15th International Reinhardsbrunn Symposium. Friedrichroda, Germany. pp. 211-218. http://dpg.phytomedizin.org/fileadmin/daten/04_Verlag/02_SP/05_Reinhard/0294-sp-2008-Reinh-4.pdf [ Links ]
ELLIS, M. B. 1971. Dematiaceous Hyphomycetes. Commonwealth Mycological Institute. Kew, Surrey, United Kingdom. 608 p. [ Links ]
HOWELL, C. R. 2003. Mechanisms employed by Trichoderma species in the biological control of plant diseases: the history and evolution of current concepts. Plant Disease 87(1): 4-10. doi: 10.1094/PDIS.2003.87.1.4 [ Links ]
KOIKE, S.T.; GLADDERS, P.; PAULUS, A. O. 2007. Vegetable Diseases: a Color Handbook. Third Edition. Academic Press. London, England. 448 p. [ Links ]
LEE, S. K.; SHON, H. B.; KIM, G. G.; CHUNG, Y. R. 2006. Enhancement of biological control of Botrytis cinerea on cucumber by foliar sprays and bed potting mixes of Trichoderma harzianum YC459 and its application on tomato in the greenhouse. Plant Pathology Journal 22(3): 283-288. http://ppj.dev.riceblast.snu.ac.kr:82/folder.php?a=down&id=43451 [ Links ]
MARSH, R. W. 1977. Systemic fungicides. Second Edition. Longman Inc. New York, USA. 401 p. [ Links ]
SEGARRA, G.; CASANOVA, E.; BORRERO, C.; AVILÉS, M.; TRILLAS, I. 2007. The suppressive effects of composts used as growth media against Botrytis cinerea in cucumber plants. European Journal of Plant Pathology 117(4): 393-402. doi: 10.1007/s10658-007-9108-x [ Links ]
SLAWECKI, R. A.; RYAN, E. P.; YOUNG, D. H. 2002. Novel fungitoxic assays for inhibition of germination associated adhesion of Botrytis cinerea and Puccinia recondita spores. Applied and Environmental Microbiology 68(2): 597-601. doi: 10.1128/AEM.68.2.597-601.2002 [ Links ]
TREMBLAY, D. M.; TALBOT, B. G.; CARISSE, O. 2003. Sensitivity of Botrytis squamosa to different classes of fungicides. Plant Disease 87(5): 573-578. doi: 10.1094/PDIS.2003.87.5.573 [ Links ]
WHITE, T. J.; BRUNS, T.; LEE, S.; TAYLOR, J. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics, pp. 315-322. In: PCR protocols: A Guide to Methods and Applications. Innis, M.; Gelfand, D.; Shinsky, J. J.; White, T. J. (eds). Academic Press. New York, United States of America. http://nature.berkeley.edu/brunslab/papers/white1990.pdf [ Links ]
WILLIAMSON, B.; TUDZYNSKI, B.; TUDZYNSKI, P.; VAN-KAN, J. A. L. 2007. Botrytis cinerea: the cause of grey mould disease. Molecular Plant Pathology 8(5): 561–580. doi: 10.1111/j.1364-3703.2007.00417.x [ Links ]
YILDIZ, F.; YILDIZ, M.; DELEN, N.; COSKUNTUNA, A.; KINAY, P.; TÜRKÜSAY, H. 2007. The effects of biological and chemical treatment on gray mold disease in tomatoes grown under greenhouse conditions. Turkish Journal of Agriculture and Forestry 31(5): 319-325. http://journals.tubitak.gov.tr/agriculture/issues/tar-07-31-5/tar-31-5-6-0611-3.pdf [ Links ]
ZIMAND, G.; ELAD, Y.; CHET, I. 1996. Effect of Trichoderma harzianum on Botrytis cinerea pathogenicity. Phytopathology 86(11): 1255-1260. http://www.apsnet.org/publications/phytopathology/backissues/Documents/1996Articles/Phyto86n11_1255.pdf [ Links ]














