Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.19 no.1 Chapingo ene./abr. 2013
https://doi.org/10.5154/r.rchsh.2010.06.121
Etiología y respuesta de variedades de crisantemo a la pudrición del tallo en el Estado de México
Etiology and response of chrysanthemum cultivars to stem rot in the State of Mexico
R. Solano-Baez; Santos Gerardo Leyva-Mir*; Bertha Tlapal-Bolaños; L. A. Mariscal-Amaro
Departamento de Parasitología Agrícola. Universidad Autónoma Chapingo. km 38.5 Carretera México-Texcoco. Chapingo, Estado de México. México. C. P. 56230. *Autor para correspondencia: lsantos@correo.chapingo.mx.
Recibido: 22 de junio, 2010
Aceptado: 9 de febrero, 2013
Resumen
El crisantemo (Dendranthema x grandiflorum Ramat.) es una de las flores cultivadas más importantes a nivel mundial. Las enfermedades fungosas constituyen la mayor causa de pérdidas económicas durante la producción de esta ornamental bajo condiciones de invernadero y cielo abierto. Los objetivos de este estudio fueron identificar al agente causal de la pudrición seca del tallo del crisantemo y evaluar la respuesta a la infección en seis variedades de crisantemo producidas en invernaderos de Texcoco, Estado de México. Con base en el análisis morfológico, molecular y patogénico, se identificó a Fusarium solani Appel & Wollenweber (Teleomorfo: Haemanectria haematococca Samuels & Nirenberg.) como el agente causal de la enfermedad. Para evaluar la respuesta de variedades de crisantemo a la infección por F. solani, se inocularon plántulas de crisantemo con una suspensión conidial de 1 x 106 esporas·ml−1. La severidad de la enfermedad se evaluó de acuerdo a una escala 0-6 a los 15 días después de la inoculación. Los resultados indicaron que las seis variedades evaluadas mostraron ser susceptibles a la infección. 'Polar', 'Leonora', 'Indianápolis' y 'Codorniz' se comportaron como las variedades más susceptibles, mientras que 'Puma' y 'Spider' exhibieron cierta tolerancia.
Palabras clave: Dendranthema x grandiflorum, Fusarium solani, Haemanectria haematococca, patogenicidad.
Abstract
Chrysanthemum (Dendranthema x grandiflorum Ramat.) is one of the most important flowers grown in the world. Fungal diseases are the largest cause of economic losses during the production of this ornamental under greenhouse and field conditions. The aims of this study were: to identify the causal agent of chrysanthemum stem rot and to evaluate the response to infection of six chrysanthemum cultivars produced in greenhouses in Texcoco, State of Mexico. The causal agent of this disease was identified as Fusarium solani Appel & Wollenweber. (Teleomorph: Haemanectria haematococca Samuels & Nirenberg.) based on morphological, molecular and pathogenic characterization. In order to evaluate the response of chrysanthemum cultivars to infection by F. solani, plantlets were inoculated with a conidial suspension of 1 x 106 spores·ml−1. Disease severity was assessed on a 0-6 scale at 15 days after inoculation. The results indicated that all six tested cultivars were susceptible to infection. 'Polar', 'Eleonora', 'Indianapolis' and 'Quail' were the most susceptible cultivars, whereas 'Puma' and 'Spider' were relatively tolerant.
Keywords: Dendranthema x grandiflorum, Fusarium solani, Haemanectria haematococca, pathogenicity.
INTRODUCCIÓN
En México, la siembra de flor de corte es actualmente de 10,164.5 ha, de las cuales 2,479 ha se destinan para el cultivo de crisantemo (Dendranthema x grandiflorum Ramat.), tanto en invernadero como en campo, lo que ubica a éste en segundo lugar en superficie cultivada después de la gladiola. El valor de la producción del crisantemo en el 2011 fue de $ 988,566,000.00 (Anónimo, 2012).
Diversos factores afectan la producción de crisantemo, pero son las enfermedades fungosas las que más disminuyen el rendimiento y calidad de la planta en cualquier etapa de producción. Aunque se sabe que bajo condiciones de invernadero se pueden controlar las condiciones de humedad relativa, temperatura, cantidad y calidad de luz, el ataque de patógenos es inminente (Flores-Ruvalcaba et al., 2005).
Las enfermedades fungosas que se presentan con mayor frecuencia durante la producción del crisantemo a nivel mundial son pudrición de raíz por Pythium spp., pudrición negra de la raíz por Thielaviopsis basicola, pudrición de tallo por Fusarium oxysporum f. sp. Chrysanthemi, pudrición blanca del tallo por Sclerotinia sclerotiorum, marchitez por Rhizoctonia solani, Verticillium dahlie y V. albo-atrum, moho gris por Botrytis cinérea, tizón por Didymella ligulicola (Anamorfo: Phoma chrysanthemi), mancha foliar por Septoria chrysanthemi, roya blanca por Puccinia horiana, roya café por Puccinia chrysanthemi y cenicilla por Golovinomyces cichoracearum (Horst y Nelson, 1997; Gleason et al., 2009).
En recorridos realizados durante el 2006 y 2007 en invernaderos comerciales de la zona productora de crisantemo en la región de Texcoco, Estado de México, se encontraron plantas de crisantemo de la variedad 'Leonora' con síntomas severos de amarillamiento, necrosis y pudrición seca del tallo. Por lo anterior, los objetivos de este estudio fueron identificar al agente causal de la pudrición seca del tallo de crisantemo en Texcoco, Estado de México y evaluar la respuesta a la enfermedad en seis de las principales variedades de crisantemo que se siembran en dicha región.
MATERIALES Y MÉTODOS
Colecta de material vegetal enfermo
Durante el periodo de julio 2006 - febrero 2007, se realizaron muestreos en diferentes invernaderos del municipio de Texcoco, Estado de México, con la finalidad de colectar plantas de crisantemo cv. 'Leonora', con síntomas de amarillamiento, necrosis foliar y pudrición seca en el tercio superior y medio del tallo. Un total de 50 plantas sintomáticas se transportaron en bolsas de papel al laboratorio de Micología Agrícola de la Universidad Autónoma Chapingo para su procesamiento.
Aislamiento y purificación
Para aislar al agente causal, se cortaron cinco piezas de tallo a partir de la zona de transición entre tejido sano y enfermo de cada una de las muestras. Las piezas se desinfestaron por inmersión en una solución de hipoclorito de sodio al 3 % durante 5 min, se enjuagaron dos veces con agua destilada estéril por 3 min, se colocaron en papel secante estéril y se transfirieron a cajas Petri con medio de cultivo papa-dextrosa-agar (PDA). Las cajas se incubaron a 25 °C y se revisaron cada 24 h. Las colonias predominantes se transfirieron a nuevas cajas con PDA y con medio hojas de clavel-agar (CLA), con el propósito de incrementar los crecimientos que se presentaron. Se realizó la purificación de los aislamientos mediante la técnica de cultivos monospóricos en medio PDA descrita por Leslie y Summerell (2006).
Identificación cultural y morfológica
Las características culturales del aislamiento predominante se registraron a partir de colonias cultivadas en medio PDA en cajas Petri y en medio pulpa de papa-agar (PPA) en tubos de ensayo, en donde se consideró el tipo de crecimiento, pigmentación en el medio de cultivo, así como la formación y coloración de esporodoquios. Los aislamientos se transfirieron a cajas de Petri con PDA y otras con CLA, con la finalidad de inducir la formación de estructuras de reproducción (conidios) y resistencia (clamidosporas). Las estructuras morfológicas se analizaron en un microscopio compuesto, en donde se registró la medida de 100 repeticiones de cada estructura (macroconidios, microconidios, fiálides y clamidosporas). La identificación de los géneros de los hongos aislados se realizó con las claves taxonómicas de Barnett y Hunter (2006), mientras que la identificación a nivel de especie se llevó a cabo con las descripciones de Toussound y Nelson (1976), Nelson et al. (1983) y Leslie y Summerell (2006). La identificación a nivel de especie únicamente se realizó para el caso del hongo con antecedentes de patogenicidad sobre plantas de crisantemo.
Prueba de patogenicidad
La prueba de patogenicidad se llevó a cabo con un aislamiento de Fusarium sp., que fue la especie fungosa encontrada con mayor frecuencia y la cual es reportada en literatura como la de mayor potencial patogénico. Un aislamiento monospórico se inoculó en 100 plántulas de crisantemo de la variedad 'Leonora', las cuales se cultivaron en macetas. El inoculo constó de una suspensión de conidios a una concentración de 1 X 106 esporas·ml−1, en la cual se introdujeron las raíces de las plántulas de crisantemo durante 30 min. Pasado el tiempo, las plántulas se incorporaron a macetas y se regaron hasta obtener la saturación del suelo. Diez plántulas, que sirvieron como control, únicamente se regaron con agua destilada estéril. Todas las plántulas se incubaron en una cámara bioclimática a 95 % de humedad relativa y 18 °C durante cuatro días. Posteriormente, las macetas se colocaron en un invernadero a 25 ± 2 °C. El avance de la expresión de síntomas se registró cada 48 h.
Caracterización molecular
Para confirmar la identificación morfológica del hongo usado en pruebas de patogenicidad, dicho aislamiento se cultivó en medio papa-dextrosa (PD) bajo agitación constante a 25 °C durante seis días. Mediante la técnica de extracción CTAB (Young-Mi et al., 2000), se extrajo el ADN genómico total a partir del micelio desarrollado en medio PD. La amplificación de las regiones ITS (Internal Transcribed Spacer) se realizó usando los iniciadores universales ITS4 (5'-TCCTCCGCTTATTGATATGC-3') e ITS5 (5'-GGAAGTAAAAGTCGTAACAAGG-3'), de acuerdo al protocolo propuesto por White et al. (1990) y Young-Mi et al. (2000).
Los productos de PCR se analizaron por electroforesis en un gel de agarosa al 1.2 %, y se observaron en un fotodocumentador (Bio-Imaging Systems Mini Bis Pro®, USA). La cámara de electroforesis se mantuvo a 80 V por 60 min a temperatura de 20 ± 2 °C.
Los productos de PCR se purificaron con el kit Wizard SV Gel (PCR Clean-up System®, USA). Los fragmentos obtenidos se secuenciaron en un secuenciador Genetic Analyzer 3100 (Aplied Biosystem®, USA). La secuencia obtenida se depositó en la base de datos del NCBI (National Center for Biotechnology Information) bajo el número de acceso EU109673. Esta secuencia se alineó con las secuencias disponibles en la base de datos del NCBI y se comparó con el programa Clustal W.
Reacción de variedades
Para evaluar la respuesta a la infección por el hongo en variedades de crisantemo, se utilizaron 120 plántulas de cada una de las siguientes variedades: 'Leonora', 'Indianápolis', 'Puma', 'Codorniz', 'Polar' y 'Spider'. Se estableció un diseño experimental completamente al azar y cada tratamiento presentó seis repeticiones, en donde cada unidad experimental constó de 20 plantas inoculadas. El testigo lo representaron 20 plantas sin inocular (inmersión de raíces en agua destilada estéril). La inoculación se realizó tal y como se describió anteriormente en la prueba de patogenicidad. La evaluación de la severidad se realizó 15 días posteriores a la inoculación, con el uso de una escala visual, en donde 1) planta asintomática = 0 %; 2) hojas verdes con inicio de marchitez y amarillamiento = 20 %; 3) hojas inferiores marchitas = 40 %; 4) tercio medio inferior de la planta amarillento, y con necrosis y marchitez en hojas = 60 %; 5) partes amarillentas, necrosis en hojas y tallo, además de presentar marchitez en su mayoría = 80 %; y 6) planta muerta = 100 %.
Análisis estadístico
Una vez concluida la evaluación de las variedades, la severidad de la enfermedad se calculó con la siguiente fórmula:
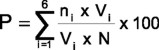
Donde
P= porciento de severidad,
ni = número de plantas de la categoría i,
Vi = valor numérico de la categoría i,
N= Tamaño de muestra.
El experimento completo se realizó dos veces. Los datos obtenidos en cada uno de los experimentos se sometieron a un análisis de varianza (ANOVA) y comparación de medias con la prueba de Tukey (P < 0.05), usando el programa estadístico SAS, versión 9.1.3 (Anónimo, 2003).
RESULTADOS Y DISCUSIÓN
Síntomas en material colectado
Las plantas colectadas en los invernaderos presentaron hojas amarillentas, curvadas y con necrosis (Figura 1A), además de tallos con rayado horizontal morado. En casos avanzados se observaron tallos curvados con pudrición seca interna (Figura 1B). Los síntomas de pudrición seca del tallo descritos anteriormente coinciden con los síntomas reportados por Armstrong et al. (1970) para el caso de F. oxysporum f. sp. chrysanthemi en plantas de crisantemo. Asimismo, concuerdan con los síntomas descritos por Engelhard y Woltz (1971), y García-Velasco et al. (2003), quienes además mencionaron que la presencia de necrosis en el tallo ocasiona la muerte de la planta.
Frecuencia de hongos aislados
Un total de 200 aislamientos de hongos se obtuvieron a partir de tejidos sembrados en medio de cultivo PDA. La frecuencia de cada uno de los géneros de hongos aislados se muestra en la Figura 2. Fusarium sp. presentó la mayor frecuencia (57 %), seguido por Alternaria sp., Cladosporium sp., Epicoccum sp., Nigrospora sp. y Aspergillus sp. Sin embargo, estos últimos géneros se descartaron, debido a que estos hongos exhiben principalmente hábitos saprofíticos (Barnett y Hunter, 2006), por lo que únicamente se trabajó con Fusarium sp.
Identificación cultural y morfológica
El crecimiento micelial en tubos con medio de cultivo PPA mostró coloraciones verdosas y naranja en el centro (Figura 1C), acordes con lo reportado por Nelson et al. (1983), Li et al. (2000), y Leslie y Summerell (2006), mientras que los medios de cultivo PDA y CLA mostraron ser útiles para la producción de estructuras de reproducción del hongo. Sin embargo, el mejor crecimiento micelial y la mayor esporulación se obtuvieron a los 18 días posteriores a la siembra en medio PDA, que coincide con lo mencionado por Leslie y Summerell (2006). Las colonias en PDA presentaron color blanco-crema, con un halo amarillo y en la parte del centro una coloración verdosa (Figura 1D). Los esporodoquios se produjeron en abundancia y exhibieron coloración crema, azul y verde, tal y como lo indicó Nelson et al. (1983).
En microscopía de luz se observaron las siguientes características:
-Macroconidios rectos a ligeramente curvos, de 50 x 5.5 µm, con las terminaciones redondeadas, con 3-6 septos, la célula apical obtusa-redondea, mientras que la célula basal mostró diferentes formas (rectas, cilíndricas y redondeadas) (Figura 1E).
-Microconidios ovales-elipsoides, con o sin septo, de 9.5-11.5 x 3-4 µm (Figura 1F), formados alrededor de falsa cabezas o sobre monofiálides relativamente largas.
-Conidióforos ramificados en monofiálides; fiálides de 52-78 x 2.6-2.9 µm.
-Clamiodosporas generalmente formadas en 2-4 semanas, globosas–ovales, intercalares o terminales, de 10 x 9 µm, con pared lisa o rugosa (Figura 1G).
Todas las características observadas coincidieron con las descritas por Toussound y Nelson (1976), Nelson et al. (1983), y Leslie y Summerell (2006) para el caso de Fusarium solani (Teleomorfo: Haemanectria haematococca).
Hasta la fecha, todos los reportes de pudrición de tallo, marchitez y necrosis foliar en plantas de crisantemo habían reportado a Fusarium oxysporum como el agente causal de la enfermedad. Sin embargo, los aislamientos identificados en este estudio no presentaron los caracteres representativos de F. oxysporum.
Muchos investigadores confunden a F. solani con F. oxysporum. Esta confusión refleja la superposición en algunos aspectos de la morfología y nichos ecológicos. Según Leslie y Summerell (2006), F. solani y F. oxysporum pueden ser diferenciados mediante la examinación de las fiálides donde se desarrollan los microconidios. Las monofiálides largas que llevan microconidios de F. solani son bastante diferentes de las monofiálides relativamente cortas de F. oxysporum. Otra diferencia marcada es que los microconidios de F. solani tienden a ser más anchos, ovales y con paredes más gruesas que los microconidios de F. oxysporum. Además, F. solani presenta microconidios con hasta dos septos, mientras que los de F. oxysporum generalmente son sin septos.
Prueba de patogenicidad
El 100 % de las plántulas inoculadas con el aislamiento de F. solani desarrollaron síntomas de la enfermedad a los 15 días después de la inoculación, mientras que, las plantas control permanecieron libres de la enfermedad. El tiempo de aparición de síntomas coincidió con lo mencionado por Strider (1985), Hung-Chang et al. (1992), García-Velasco et al. (2003) y Garibaldi et al. (2009) para el caso de variedades de crisantemo inoculadas con F. oxysporum.
A partir de plantas inoculadas sintomáticas, se volvió a aislar a F. solani. Dichos aislamientos presentaron las mismas características morfológicas que los aislamientos inoculados, con lo que se completaron los Postulados de Koch y se confirmó que F. solani es el agente inductor de la enfermedad.
Caracterización molecular
El aislamiento usado en este trabajo mostró fuerte amplificación de ADN en la PCR, utilizando los iniciadores antes mencionados, lo que resultó en un producto de 600 pb, que coinciden con lo mencionado por Li et al. (2000) y Young-Mi et al. (2000). La secuencia obtenida en este estudio (No. de acceso del Genbank EU109673) mostró un 99 % de similitud con la secuencia JQ277276 de Fusarium solani depositada en la base de datos del NCBI.
La secuencia de la región ITS confirmó el resultado de la identificación morfológica y cultural, lo que indicó que F. solani es el agente inductor de la pudrición de tallos y marchitez de plantas de crisantemo en invernaderos de la región de Texcoco. Este resultado difiere con lo reportado por Armstrong et al. (1970), Hung-Chang et al. (1992), Gar-cía-Velasco et al. (2003) y Garibaldi et al. (2009), quienes únicamente señalaron a F. oxysporum f. sp. chrysanthemi como el responsable de causar los síntomas mencionados.
Reacción de variedades
Las seis variedades de crisantemo evaluadas en este estudio mostraron ser susceptibles a Fusarium solani, debido a que presentaron síntomas característicos de la enfermedad como amarillamiento, marchitez, necrosis en hojas y en tallo. Sin embargo, el análisis de varianza mostró diferencias significativas en el porcentaje de severidad entre variedades (Cuadro 1). Las variedades 'Polar', 'Leonora', 'Indianápolis' y 'Codorniz' mostraron porcentajes de severidad mayores a 70 %, por lo que se consideraron como altamente susceptibles al patógeno. En casos de infecciones severas, se observó muerte de plantas. La variedad 'Polar' exhibió el mayor número de plantas con esta característica. Lo anterior coincide con los estudios realizados por García-Velasco et al. (2003), quienes indicaron que la variedad 'Polar' es altamente susceptible al ataque por Fusarium oxysporum en invernaderos del Estado de México.
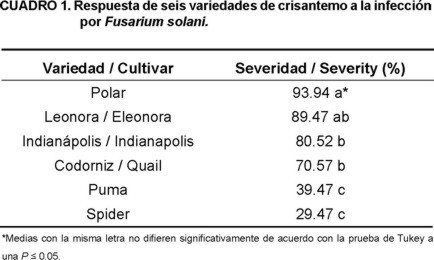
Por otra parte, las variedades 'Puma' y 'Spider' se comportaron como las más tolerantes a la infección por Fusarium solani, al presentar los más bajos porcentajes de severidad. Según Strider (1985), Gardiner et al. (1989) y Garibaldi et al. (2009), el método de control más eficiente para Fusarium spp. en plantas de crisantemo es el uso de variedades tolerantes y resistentes. Este estudio confirmó que en México existen variedades de crisantemo que presentan tolerancia a la infección por F. solani. Sin embargo, se sugiere llevar acabo futuros trabajos con el uso de una gama más amplia de genotipos de crisantemo, con la finalidad de encontrar fuentes de resistencia para este patógeno.
CONCLUSIONES
Mediante caracterización morfológica, molecular y patogénica, se determinó que Fusarium solani es el organismo causal de la pudrición seca del tallo del crisantemo en invernaderos de Texcoco, Estado de México.
Las variedades 'Polar', 'Leonora', 'Indianápolis' y 'Codorniz' mostraron ser altamente susceptibles a la infección por Fusarium solani, mientras que, las variedades 'Puma' y 'Spider' fueron tolerantes a la infección por el patógeno.
LITERATURA CITADA
ANÓNIMO. 2003. Statistical Analysis System Version 9.1.3. SAS Institute Inc., Cary. N.C., USA. [ Links ]
ANÓNIMO. 2012. Cierre de la producción agrícola por cultivo. Sistema de Información Agroalimentaria y Pesquera. http://www.siap.gob.mx/index. [ Links ]
ARMSTRONG, G. M.; ARMSTRONG, J. K.; LITTRELL, R. H. 1970. Wilt of chrysanthemum caused by Fusarium oxysporum f. sp. chysanthemi, forma specialis nov. Phytopathology 60: 496-498. doi: 10.1094/Phyto-60-496 [ Links ]
BARNETT, H. L.; HUNTER, B. B. 2006. Illustrated Genera of Imperfect Fungi. Fourth Edition. St. Paul, Minnesota. 241 p. [ Links ]
ENGELHARD, A. W.; WOLTZ, S. S. 1971. Fusarium wilt of chrysanthemum: symptomatology and cultivar reactions. Florida Agricultural Experiment Stations Journal 4153: 351-354. http://www.fshs.org/Proceedings/Password%20Protected/1971%20Vol.%2084/351-354%20%28ENGELHARD%29.pdf [ Links ]
FLORES-RUVALCABA, J. S.; BECERRIL-ROMÁN, A. E.; GON-ZÁLEZ-HERNÁNDEZ, V. A.; TIJERINA-CHÁVEZ, L.; VÁS-QUEZ-ROJAS, T. 2005. Crecimiento vegetativo y floral del crisantemo Dendratema x gradiflorum (Ramat) Kitamura en respuesta a la presión osmótica de la solución nutritiva. Revista Chapingo Serie Horticultura 11(2): 241-249. http://www.chapingo.mx/revistas/horticultura/contenido.php?file=f5f2f3f1e7d9a5b68117e8b03ec24a56&ext=pdf [ Links ]
GARCÍA-VELASCO, R.; OCHOA-MARTÍNEZ, D.; ZAVALETA-MEJÍA, E.; MORA-AGUILERA, G.; GAYTÁN-ACUÑA, E. A. 2003. Etiología de la marchitez del crisantemo (Dendrathema grandiflora Tzevelec) cv. Polaris. Revista Mexicana de Fitopatología 21: 75-78. http://www.sociedadmexicanadefitopatologia.org/archives/61221112.pdf [ Links ]
GARDINER, D. C.; HORST, R. K.; NELSON, P. E. 1989. Influence of night temperature on disease development in Fusarium wilt of chrysantemum. Plant Disease 73: 34-37. http://www.apsnet.org/publications/PlantDisease/BackIssues/Documents/1989Articles/PlantDisease73n01_34.pdf [ Links ]
GARIBALDI, A.; BERTETTI, D.; GULINNO, M. L. 2009. Susceptibility of chrysanthemum and paris daisy varieties to several isolates of Fusarium oxysporum f. sp. chrysanthemi. Commun. Agric. Appl. Biot. Sci. 47(3): 657-657. http://pubget.com/paper/20222547/Susceptibility_of_chrysanthemum_and_Paris_daisy_varieties_to_several_isolates_of_Fusarium_oxysporum_f__sp__chrysanthemi [ Links ]
GLEASON, M. L.; DAUGHTREY, M. L.; CHASE, A. R.; MOORMAN, G. W.; MUELLER, D. S. 2009. Diseases of Herbaceous Perennials. American Phytopathological Society. St. Paul, Minnesota, USA. 281 p. [ Links ]
HORST, R. K.; NELSON, P. E. 1997. Compendium of Chrysantemum Diseases. American Phytopathological Society. St. Paul, Minnesota, USA. 62 p. [ Links ]
HUNG-CHANG, H.; PHILLIPPE, L. M.; MARSHALL, H. H.; COLLICUTT, L. M.; NEISH, G. A. 1992. Wilt of hard Chrysanthemum caused by a new race of Fusarium oxysporum f. sp. chrysanthemi. Plant Pathology Bulletin 1: 57-61. [ Links ]
LESLIE, J. F.; SUMMERELL, B. A. 2006. The Fusarium Laboratory Manual. Blackwell Publishing. Iowa, USA. 388 p. [ Links ]
LI, S.; TAM, Y. K.; HARTMAN, G. L. 2000. Molecular differentiation of Fusarium solani f. sp. glycines from other F. solani based on mitochondrial small subunit rDNA sequences. Phythopatology 90: 491-497. doi: 10.1094/PHYTO.2000.90.5.491 [ Links ]
NELSON, P. E; TOUSSOUN, T. A.; MARASAS, W. F. 1983. Fusarium Species: An Illustrated Manual for Identification. The Pennsylvania State University Press. Pennsylvania, USA. 193 p. [ Links ]
STRIDER, D. L. 1985. Fusarium wilt of chrysanthemum: cultivar susceptibility and chemical control. Plant Disease 69: 564-568. doi: 10.1094/PD-69-564 [ Links ]
TOUSSOUND, T. A.; NELSON, E. P. 1976. Fusarium: A Pictorial Guide to the Identification of Fusarium species according to the taxonomic system of Snyder and Hansen. Second Edition. The Pennsylvania State University Press. Pennsylvania, USA. 45 p. [ Links ]
WHITE, T. J.; LEE, B. S.; TAYLOR, J. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. pp. 315-322. In: Innis, M.A., D. A. Gelfand, J. J. Sninsky, and T. J. White (eds). PCR Protocols: A Guide to Methods and Applications, Academic Press, CA, USA. [ Links ]
YOUNG-MI, L.; YONG-KEEL, C.; BYUNG-RE, M. 2000. Molecular characterization of Fusarium solani and its formae speciales based on sequences analysis of the internal transcribed spacer (ITS) region ribosomal DNA. Mycobiology 28(2): 82-88. http://www.mycobiology.or.kr/Synapse/Data/PDFData/0184MB/mb-28-82.pdf [ Links ]














