Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.18 no.3 Chapingo sep./dic. 2012
https://doi.org/10.5154/r.rchsh.2011.04.016
Actividad biológica in vitro del extracto de Capsicum chinense Jacq contra Bemisia tabaci Genn
The in vitro biological activity of Capsicum chinense Jacq extract against Bemisia tabaci Genn
Luis Enrique Castillo–Sánchez1*; Juan José Jiménez–Osornio2; María América Delgado–Herrera3
1 Instituto Tecnológico de Tizimín. km 3.5 Carretera final aeropuerto Cupul a Tizimín. Tizimín, Yucatán, MÉXICO.Correo–e: hymenopteralecs@hotmail.com (*Autor para correspondencia).
2 Departamento de Manejo y Conservación de Recursos Naturales Tropicales, Campus de Ciencias Biológicas y Agropecuarias, Universidad Autónoma de Yucatán. A. P. 4–116 Col. Itzimná, Mérida, Yucatán, MÉXICO. C. P. 97100.
3 Laboratorio de Química Aplicada, Facultad de Química, Universidad Autónoma de Yucatán. Mérida, Yucatán, MÉXICO. C. P. 97150.
Recibido: 25 de abril, 2011.
Aceptado: 14 de agosto, 2012.
Resumen
En los últimos 30 años, los extractos de plantas se han utilizado contra diversas especies de insectos fitófagos y han cobrado importancia como alternativas para el control de insectos plaga porque no afectan el ambiente y son amigables con enemigos naturales de insectos fitófagos. En este estudio se evaluó el efecto insecticida y repelente del extracto de chile habanero (Capsicum chinense) sobre adultos de Bemisia tabaci. Se realizaron bioensayos de repelencia y mortalidad en frascos de 150 ml de volumen con diversas concentraciones de los capsaicinoides extraídos del chile habanero variedad criolla naranja. El diseño experimental fue completamente al azar en arreglo factorial 8 x 7 (factor tiempo y factor concentraciones de extractos) en el bioensayo de mortalidad, y en el bioensayo de repelencia el arreglo factorial fue de 8 x 8 (factor tiempo y factor concentraciones de extractos) con cuatro repeticiones para cada tratamiento. Las concentraciones del 30 y 40 % de extracto tuvieron mayor efecto de mortalidad con respecto a los demás. En cuanto a la repelencia, las concentraciones > 30 % de extracto presentan mayor repelencia con respecto a las demás concentraciones. En cuanto al factor tiempo, los resultados indican que C. chinense presenta efecto repelente desde la primera hora de exposición hacia B. tabaci.
Palabras clave adicionales: Bioensayos, chile habanero, insecticida orgánico, repelencia.
Abstract
Over the last 30 years, plant extracts have been used against several phytophagous insect species, gaining importance as alternatives for pest control, because they do not affect the environment and are friendly to phytophagous insects' natural enemies. In the present work, the insecticidal and repellent effects of C. chinense extract against B. tabaci adults were appraised. Repellency and mortality bioassays were performed using a flask (150 mm) with different concentrations of capsaicinoids extracted from habanero peppers (Capsicum chinense), local orange variety. A random experimental design was used with an 8 X 7 factorial arrangement for the mortality bioassay, and an 8 x 8 factorial arrangement for the repellency effect, with four replications per treatment. Concentrations of 30 and 40 % of the extract showed a higher mortality effect than others. Concerning the repellency, treatments >30 % of extract showed a higher repellency compared to other treatments. The results showed that C. chinense has a repellent effect during the first hour of exposure against B. tabaci.
Additional keywords: Bioassays, habanero pepper, organic insecticide, repellency.
INTRODUCCIÓN
La plaga de mayor importancia económica del cultivo de chile habanero (Capsicum chinense Jacq.) es la mosca blanca (Bemisia tabaci Genn.) (Soria et al., 2003). Ocasiona pérdidas de producción que pueden alcanzar hasta el 90 % (Ruiz y Medina, 2001). Además de causar daños directos por su alimentación, dicha especie actúa como vector de virus (Bielza et al., 2000). De acuerdo con el paquete tecnológico para el chile habanero presentado por Soria et al. (2003), se recomienda la aplicación de insecticidas sintéticos del grupo de los carbamatos, organofosforados y neonicotinoides para el control de insectos plaga. Sin embargo, estos insecticidas causan problemas de contaminación ambiental, peligro de intoxicación en personas, riesgo de residuos tóxicos al consumidor, desarrollo de resistencia en los insectos plaga y muerte en enemigos naturales de plagas (lannacone y Lamas, 2003; Viglianco et al., 2006). Adicionalmente, B. tabaci posee alto potencial reproductivo, con elevada fecundidad y ciclo de vida corto, por lo cual es muy difícil controlarla en áreas de cultivos hortícolas (Bethke et al., 1991).
Para atender esta problemática, se considera necesaria la búsqueda de alternativas de control, con menos riesgos para el ambiente, la salud humana y de mayor eficacia contra los insectos–plaga. Tal es el caso de sustancias derivadas del metabolismo secundario de las plantas (Hernández–Lauzardo et al., 2007; Salvadores et al., 2007).
En las últimas tres décadas, los extractos de plantas han sido usados contra diversas especies de insectos fitófagos (Clemente et al., 2003), porque no afectan el ambiente y son menos dañinos con los enemigos naturales de insectos plaga (Iannacone y Lamas, 2003; Aggarwal y Brar, 2006). Se ha encontrado que los insectos no crean resistencia a los extractos de plantas debido a que son una mezcla de metabolitos secundarios (Valladares et al., 2003).
Alrededor de 2000 especies vegetales tienen potencial de manejo para el control de insectos plaga. Las familias que destacan son Euphorbiaceae, Asteraceae, Labiatae, Fabaceae, Compositae y Solanaceae (Jermy, 1990). En general, los metabolitos secundarios se pueden clasificar en insecticidas, aquellos que causan la muerte de los insectos, y los insectistáticos, que se refieren a la inhibición del desarrollo y comportamiento de los insectos. Por ejemplo, los repelentes, que ahuyentan a los insectos de sus plantas hospederas (Celis et al., 2008).
En la revisión de Castillo et al. (2010), se presentan los compuestos y la actividad biológica de varias especies de tres familias: Annonaceae, Solanaceae y Meliaceae. En especial, en la familia Solanaceae se han obtenido extractos (polvos, acuosos y pastas) que poseen efecto insecticida y repelente sobre diversas especies de insectos (Pascual–Villalobos, 1998; Mareggiani, 2001).
Las especies del género Capsicum sintetizan capsai–cinoides, de los cuales, la capsaicina y la dihidrocapsaicina son responsables hasta del 90 % de la pungencia en los chiles (López, 2003; Cázares et al., 2005). En los últimos años se ha demostrado que los capsaicinoides presentan actividad biológica contra insectos, como el efecto tóxico sobre Myzus persicae (Sulzer) (Edelson et al., 2002) y efecto antialimentario sobre Earias insulana (Boisduval) (Weissenberg et al., 1986). Actualmente, en los Estados Unidos de América, existen patentes de insecticidas y agentes de control que contienen capsaicinoides (Eich, 2008). Además, se han introducido como repelentes para el manejo de plagas en la agricultura y se utilizan como sinergistas con insecticidas sintéticos (Liu y Lin, 2003).
Los capsaicinoides se sintetizan y acumulan en el tejido de la placenta adyacente a las semillas (Ben Chaim et al., 2006), y su contenido depende del genotipo, la madurez del fruto y de las condiciones de cultivo (Zewdie y Bosland, 2000).
En este trabajo se evaluó, bajo condiciones in vitro, la actividad biológica del extracto de capsaicinoides del fruto del chile habanero variedad criolla naranja, en plántulas de la misma especie, contra la mosca blanca, con la finalidad de determinar su actividad insecticida y repelente.
MATERIALES Y MÉTODOS
Colecta de insectos
Los adultos de B. tabaci utilizados en los bioensayos se obtuvieron del cultivo de chile habanero variedad criolla naranja establecido en bolsas negras, en el invernadero del Campus de Ciencias Biológicas y Agropecuarias (CCBA), de la Universidad Autónoma de Yucatán (UADY). A cada bolsa se le agregó composta con proporción 3:1 de tierra roja y estiércol de borrego; después del trasplante, no se utilizó ningún fertilizante químico y se aplicó por única vez un acaricida (Ingrediente activo, abamectina; dosis, 50–70 cm3·hl), para controlar la presencia de ácaros rojos (Tetranychus urticae Koch).
Dos semanas después del trasplante, se infestó la plantación con adultos de mosca blanca colectados en plantaciones de chile habanero, cercanas a la localidad de X'matkuil. Mes y medio después de la infestación, se inició la colecta de adultos de moscas para realizar los bioensayos. Se colectaron 320 adultos de mosca blanca cuando se realizó el bioensayo de repelencia, y para el bioensayo de mortalidad se utilizaron 280 adultos. Estos insectos se colectaron el día que fue evaluada cada actividad biológica.
Material vegetativo
Los experimentos fueron realizados con extractos obtenidos de frutos de chile habanero colectados semanalmente en plantas cultivadas en condiciones de invernadero. La colecta de frutos de chile habanero se realizó cuando éstos alcanzaron la madurez fisiológica. El muestreo fue sistemático (cinco de oros) recolectando 1 kg de chile habanero que fue suficiente para realizar la investigación (Morón y Terrón, 1988). Las muestras colectadas se depositaron en bolsas de papel estraza previamente etiquetadas con los datos de muestreo (fecha, hora, sitio de colecta).
Obtención de los capsaicinoides para análisis de HPLC
En el laboratorio, los frutos se lavaron con una solución 1:1 de agua destilada y Extran® (producto de limpieza para laboratorios) para eliminar cualquier materia extraña que estuviera presente. Posteriormente, los frutos enteros de chile habanero se secaron en una liofilizadora a –40 °C, por un lapso de 24 horas.
Una vez secos, los frutos (850 g) se molieron con una picadora marca Moulinex, modelo DPA137, procurando que el tamaño de la partícula fuera homogénea, utilizando un tamiz con el número de malla de 2 mm de abertura. Finalmente, la muestra molida (790 g) se almacenó en frascos de plástico previamente etiquetados con los datos del muestreo, y fue conservada en refrigeración (4±1 °C).
Para extraer los capsaicinoides se siguió el método descrito por Collins et al. (1995). Se pesó 1 g de la muestra molida y se colocó en un matraz volumétrico de 50 ml. Posteriormente, se añadieron 10 ml de acetonitrilo, se selló el matraz con papel parafilm para evitar la evaporación del acetonitrilo, y se colocó en baño María modelo LAB LINE a 70 °C, durante cuatro horas, con agitación constante. Transcurrido ese tiempo la muestra se dejó enfriar a temperatura ambiente y se filtró el sobrenadante con papel Whatman No. 1 de 125 mm de diámetro. Se realizó un segundo filtrado utilizando filtros millipore de 0.45 µm de poro y 25 mm de diámetro. El filtrado final se aforó a 10 ml con acetonitrilo, después fue colocado en un vial ámbar y se almacenó en refrigeración hasta su análisis. La extracción se realizó por duplicado
Cuantificación de los capsaicinoides en HPLC
El extracto fue diluido preparando una solución de extracto–acetonitrilo a una relación 1:10 en un volumen de 1 ml. La dilución se realizó por duplicado. Posteriormente se cuantificaron los capsaicinoides en un equipo de HPLC Perkin–Elmer serie 200 a partir de las condiciones establecidas por Collins et al. (1995). Se utilizó una columna fase reversa C18 y como fase móvil se empleó metanol–agua con una relación de 73:27. El tiempo de corrida fue de nueve minutos (min) a un flujo de 1.6 ml·min–1. Se inyectaron 20 µl de la muestra y la longitud de onda empleada para el análisis fue de 280 nm. Debido a la sensibilidad del equipo se realizó una sola inyección del extracto. Posteriormente, se preparó una curva de calibración empleando un estándar de Capsaicina (CAP) y Dihidrocapsaicina (DHC) 65:35, respectivamente, marca SIGMA. Las concentraciones de la curva fueron 10, 20, 30, 50, 60 y 100 ppm.
Obtención del extracto para realizar los bioensayos
El extracto utilizado en los bioensayos se obtuvo por medio de etanol. Para realizar la extracción etanólica, se pesaron 100 g de la muestra molida, siguiendo la metodología propuesta por Woisky y Salatino (1998), con algunas modificaciones (incremento de rpm y mayor tiempo de extracción). Los 100 g de muestra molida se depositaron en un frasco de vidrio color ámbar, al cual se añadieron 266 ml de etanol grado reactivo y se mantuvo en agitación constante con un agitador LAB LINE (1200 rpm), por una semana, a temperatura ambiente (25–28 °C). Durante ese periodo se filtró el sobrenadante cada 48 horas y se le añadió la misma cantidad de etanol (266 ml). Una vez transcurrida la semana, los filtrados fueron concentrados mediante un rotavapor marca Büchi, a 45–50 °C, hasta eliminar el etanol y obtener finalmente el extracto de chile habanero. La extracción para los bioensayos se realizó por triplicado.
Preparación de las concentraciones a evaluar
Las concentraciones de la extracción etanólica de C. chinense se prepararon de acuerdo con una relación peso/ volumen (p/v) para ser utilizadas en los bioensayos. De tal manera que para preparar la concentración al 10 % se utilizaron 2 g del extracto y se aforó a 20 ml con diclorometano, el cual fue utilizado como disolvente.
Bioensayos de mortalidad y repelencia
Se prepararon cinco soluciones a diferentes concentraciones (5, 10, 20, 30 y 40 %) para evaluar el bioensayo de mortalidad y seis soluciones (5, 10, 20, 30, 40 y 50 %) para el bioensayo de repelencia, más los dos testigos (agua destilada y diclorometano).
En ambos bioensayos se utilizaron grupos de 10 adultos de mosca blanca, mismos que se depositaron en un frasco de plástico de 150 ml, a una temperatura de 25±2 °C. Las tapas de los frascos fueron perforadas. Se depositó un pedazo de tela tricot como base del frasco, en la cual se colocó el papel filtro Whatman no. 1. Sobre el papel Whatman se aplicaron 0.3 ml de la solución evaluada de acuerdo con el tratamiento. El papel filtro se dejó reposar a temperatura ambiente 30 minutos antes de transferirlo a los frascos que contenían los insectos. A cada frasco por tratamiento se le agregó una hoja de chile habanero, como alimento para los insectos.
En los bioensayos de repelencia, para cada repetición de los tratamientos, se unieron dos frascos de 150 ml por medio de un tubo de plástico transparente de 4 cm de longitud y 6 mm de diámetro. Los frascos fueron enumerados como número 1 y 2. En el número 1 se colocaron los insectos y se le añadió una hoja con la concentración del extracto del chile habanero a evaluar. En el frasco número 2 solamente se añadió una hoja sin extracto, esto fue con el objetivo de observar la repelencia del extracto hacia los insectos.
En los bioensayos de mortalidad, antes de realizar los análisis estadísticos, se ajustaron los valores (datos) según la fórmula de Abbott corregida (Carreras et al., 2009):

mt= es la mortalidad en el tratamiento y
mta= es la mortalidad en el tratamiento testigo.
En los bioensayos de repelencia se determinó el índice de repelencia con la fórmula utilizada por Salvadores et al. (2007):

G= es el porcentaje de insectos en el tratamiento y
P= es el porcentaje de insectos en el testigo
El índice de repelencia, se clasifica como neutro si el índice es igual a uno, atrayente si es mayor a uno y repelente si es menor a uno.
Diseño experimental para los bioensayos
El diseño experimental fue completamente aleatorio en arreglo factorial ocho por siete en el bioensayo de mortalidad; mientras que el bioensayo de repelencia tuvo un arreglo factorial ocho por ocho, con cuatro repeticiones para cada tratamiento.
En ambos bioensayos, el factor A fue el tiempo de evaluación, con ocho niveles (A1= 1 h, A2= 2 h, A3= 3 h, A4= 4 h, A5= 5 h, A6= 6 h, A7= 7 h, A8= 8 h). El factor B fueron las concentraciones y los testigos, con siete niveles para el bioensayo de mortalidad (B1= 5 %, B2= 10 %, B3= 20 % B4= 30 %, B5= 40 %, B6= Control y B7= Diclorometano). En el bioensayo de repelencia, el factor B estuvo conformado de ocho niveles (B1= 5 %, B2= 10 %, B3= 20 % B4= 30 %, B5= 40 %, B6=50 % B7= Control y B8= Diclorometano).
Para analizar los resultados de mortalidad y repelencia se empleó un análisis de varianza multivariado con base en permutaciones (Anderson, 2001), para determinar diferencias entre cada factor, así como la posible interacción entre ambos factores. Los datos se transformaron para reducir la diferencia de escalas entre ellas (lnx+1). Se utilizó la medida de disimilitud de Bray–Curtis para la prueba estadística y se calcularon todos los valores de P con 9999 permutaciones con α = 0.05. Se seleccionó el análisis PERMANOVA, porque los datos obtenidos en los bioensayos no cumplían con el supuesto de normalidad y de homogeneidad de varianzas.
Para detectar los niveles que fueron diferentes en cada uno de los factores (concentraciones y tiempo), se utilizaron intervalos de confianza de Bonferroni al 95 % para los bioensayos de mortalidad, y para los bioensayos de repelencia se graficó el error estándar. Además se realizó el análisis Probit para determinar la concentración letal para matar al 50 % de los individuos (CL50) y el tiempo letal necesario para observar la mortalidad del 50 % de los individuos (TL50) (López–Pérez et al., 2007). Para el análisis multivariado se utilizó el software PERMANOVA (Anderson, 2005). El análisis de Bonferroni y el análisis Probit se obtuvieron por medio del software STATGRAPHICS Plus 5.1.
RESULTADOS
Rendimiento del extracto etanólico y análisis de HPLC
En 100 g de muestra molida de chile habanero que se utilizó para la extracción etanólica, se obtuvo un total de 21.98 ±1 g de extracto, por lo tanto se logró 22 % de rendimiento en el extracto de C. chinense. En el análisis de cromatografía líquida de alta resolución (HPLC) se identificó la concentración total de capsaicinoides del fruto entero liofilizado (FEL). También se obtuvo la concentración total de la capsaicina y la dihidrocapsaina. Para ello, se utilizó un estándar de Capsaicina (CAP) y Dihidrocapsaicina (DHC) 65:35 respectivamente, marca SIGMA. Los resultados generados se presentan en el Cuadro 1. Posteriormente los resultados se analizaron de acuerdo con los dos factores (concentración del extracto y tiempo) en ambos tipos de bioensayos (mortalidad y repelencia).
Bioensayos de mortalidad
Los bioensayos de mortalidad para el factor concentraciones (PERMANOVA, F= 3.6, g.l.= 6, P < 0.05) y el factor tiempo (PERMANOVA, F= 10.2, g.l.= 7, P < 0.05) mostraron diferencia significativa; sin embargo, la interacción entre ambos factores no mostraron diferencia a un nivel de confianza del 95 % (PERMANOVA, F= 0.6, g.l.= 42, P > 0.05). Todas las concentraciones evaluadas causaron mortalidad de B. tabaci.
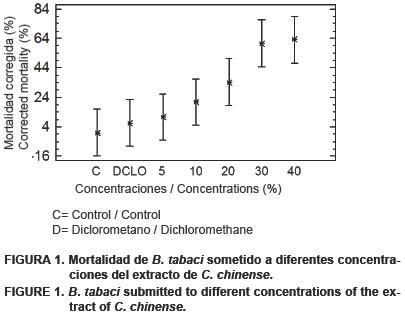
En la Figura 1 se observa que existen dos grupos diferenciados de concentraciones, destacando las concentraciones que poseen 30 y 40 % de extracto de C. chinense, ya que mataron más del 50 % de los individuos de B. tabaci. La concentración letal media (CL50) del extracto de C. chinense por medio del análisis Probit (Figura 2) fue de 29.40 % (I.C. 95 %= 25.28–35.07) (P < 0.01, R2= 85.06, x2= 39.64). En la Figura 3, se muestra que las tres últimas horas presentan mortalidad significativa sobre B. tabaci.


Se realizó un análisis Probit, para obtener el tiempo letal medio (TL50) de la concentración (30 %) que causó mayor mortalidad y para determinar el tiempo necesario para matar al 50 % de la población de B. tabaci (Figura 4). El resultado fue de 7.31 horas (I.C. 95 %= 7.12–7.53) (P < 0.01, R2= 97.87, x2= 665.48).

Bioensayos de repelencia
En los bioensayos de repelencia se obtuvieron diferencias significativas a un nivel de confianza del 95 % para el factor concentraciones (PERMANOVA, F= 3.1, g.l.= 6, P < 0.05) y el factor tiempo (PERMANOVA, F= 5.9, g.l.= 7, P < 0.05), así como la interacción entre ambos factores (PERMANOVA, F= 2.6, g.l.= 42, P < 0.05).
El índice de repelencia (I. R.) mostró que todos los tratamientos con extracto presentaron efecto repelente, siendo las concentraciones de 40 y 50 % las de mayor efecto, en cambio el menor efecto repelente lo presenta el tratamiento testigo cuyo valor es 1.0 (Cuadro 2, Figura 5).


En los bioensayos de repelencia, a partir de la hora uno se observa el efecto de repelencia (50 %) con respecto a las horas siguientes (Figura 6).

DISCUSIÓN
Bioensayos de mortalidad y repelencia para el factor concentración de extracto
En los bioensayos de mortalidad, las concentraciones con 30 y 40 % del extracto del fruto de C. chinense presentaron diferencias significativas con respecto al resto de las concentraciones evaluadas. Esto concuerda con lo reportado por Lagunes (1994). Solamente dos concentraciones (30 y 40 %) se pueden considerar como prometedoras al mostrar una mortalidad superior al 40 %. Las concentraciones restantes presentaron menos del 35 % de mortalidad (Figura 1). Estos resultados se pueden comparar con lo reportado con otras especies del género Capsicum. Por ejemplo, C. frutescens (Gakuru y Foua, 1996) extraído con éter de petróleo y C. annuum (Madhumathy et al., 2007) extraído con etanol, los cuales también poseen efecto insecticida mayor del 40 % sobre Callosobruchus maculatus (Fabricius) y Culex quinquefasciatus (Say), respectivamente, aunque con concentraciones del extracto menores al 2 %. Lo anterior, también concuerda con las investigaciones realizados por Bouchelta et al. (2005) quienes encontraron que los alcaloides de C. frutescens afectan la supervivencia de los adultos de B. tabaci de 35 a 59 %. Por su parte, Choi et al. (2003) señalan que los adultos de Trialeurodes vaporarorium (Westwood) son más sensibles a los capsaicinoides que las ninfas.
El análisis Probit para la medición de la concentración letal media (CL50) de C. chinense arrojó que es necesario 29.40 % p/v del extracto para matar al 50 % de la población de B. tabaci (Figura 2). Se podría considerar que esta concentración es elevada para ser utilizada de manera práctica por los agricultores. Sin embargo, de acuerdo con el tiempo letal medio (TL50) obtenido del extracto (7.31 h) (Figura 4), existe la posibilidad de utilizarse, debido al efecto rápido que posee, aunque sería recomendable que se evaluara en condiciones de campo para establecer una dosis exacta y ser considerada como una alternativa real para el control de B. tabaci.
En los bioensayos de repelencia, los resultados indican que todas las concentraciones del extracto de C. chinense poseen efecto repelente sobre B. tabaci, con más del 50 % sobre los individuos evaluados. Todas las concentraciones con extracto mostraron diferencias significativas con respecto a los tratamientos control (Figura 5). Destacan las concentraciones del 40 y 50 % por su mayor efecto repelente (IR= 0.11), contrario a la concentración del 5 % que obtuvo un valor más cercano al 1.0 (IR= 0.64) (Cuadro 2). Los datos que se generaron son similares con los obtenidos por Procopio et al. (2003) y Salvadores et al. (2007), quienes evaluaron a C. frutescens y C. annuum sobre Sitophilus zeamais (Motschulsky). En el primer caso repelieron menos del 50 % de los individuos evaluados y en el segundo caso se reportó un índice de repelencia de (IR= 0.57). Si bien los resultados obtenidos por Procopio et al. (2003) y Salvadores et al. (2007) no son iguales o coincidentes totalmente con los resultados registrados en la presente investigación, debido a que las especies de Capsicum se ensayaron en S. zeamais y que las plantas fueron utilizadas en forma de polvos y no de extracto acuoso, los resultados obtenidos permiten reafirmar el hecho que entre las tres especies de Capsicum mencionadas existe un claro efecto repelente.
Bioensayos de mortalidad y repelencia para el factor tiempo
En los bioensayos de mortalidad, se observó que las tres últimas horas (Figura 3) presentan mayor efecto letal sobre B. tabaco. Por el contrario, para los bioensayos de repelencia, la primera hora presentó mayor efecto del extracto (Figura 6) sobre el tiempo total (ocho horas) a la cual estuvieron expuestos los insectos. Estos resultados sugieren que los extractos de C. chinense poseen mejor efectividad en corto tiempo como repelentes y no como insecticidas. Un aspecto relevante en los bioensayos de repelencia fue que en los tratamientos evaluados, más del 60 % de los adultos de mosca blanca fueron repelidos durante la primera hora, lo cual confirma el potente efecto que posee el extracto.
Este estudio reafirma el potencial que poseen los capsaicinoides como insecticidas botánicos (repelente o insecticida) y son un indicador de que pueden ser utilizados en el control de plagas. Esto puede ser importante al momento de tomar decisiones sobre el manejo de B. tabaci.
Interacción entre los factores evaluados
La interacción de los factores concentración del extracto y tiempo sobre la variable mortalidad no mostró diferencia significativa debido, muy probablemente, a que la mortalidad fue muy similar en los diferentes tiempos y entre las diferentes concentraciones a las cuales fueron evaluados. En general, se observó que la mortalidad fue muy baja para todos los tratamientos, lo cual explica este resultado. Contrariamente, en la evaluación de la interacción de estos factores sobre la variable repelencia si se observó significancia estadística, por lo que se confirma su buen desempeño, como muestran los resultados desde la primera hora y a partir de la concentración del 20 %.
CONCLUSIONES
De acuerdo con el análisis Probit, la concentración necesaria para eliminar a la mitad de la población de B. tabaci es de 29. 4 % de p/v del extracto de capsaicinoides.
El tiempo necesario para eliminar a la mitad de la población de B. tabaci, de acuerdo con las concentraciones evaluadas, es de 7.3 horas. El extracto etanólico de C. chinense muestra resultados prometedores, principalmente como repelente durante la primera hora de exposición contra B. tabaci desde la concentración de 5 %.
AGRADECIMIENTOS
Al CONACYT por el apoyo otorgado al M.C. Luis Enrique Castillo Sánchez para realizar estudios de Doctorado en la Universidad Autónoma de Yucatán; al Departamento de Manejo y Conservación de Recursos Naturales Tropicales de la UADY por el apoyo económico a esta investigación, a través del Proyecto FMVZ–2008–0012 denominado "Evaluación de metabolitos secundarios vegetales para el control de la mosca blanca (Bemisia tabaci Genn.) y el picudo del chile (Anthonomus eugenii Cano)"; a los doctores Hugo Delfín González, Humberto Esquivel Mimenza y Luis Ramírez y Avilés, por sus comentarios y sugerencias realizadas a este trabajo. Un especial agradecimiento a los QFB Ernesto Cutz y María José Góngora Alamilla por dedicar parte de su tiempo en esta investigación.
LITERATURA CITADA
AGGARWAL, N.; BRAR, D. 2006. Effects of different neem preparations in comparison to synthetic insecticides on the whitefly parasitoid Encarsia sophia (Hymenoptera: Aphelinidae) and the predator Chrysoperla carnea (Neuroptera: Chrysopidae) on cotton under laboratory conditions. Journal of Pest Science 79: 201–207. doi: 10.1007/s10340–006–0134–9 [ Links ]
ANDERSON, M. 2001. A new method of non–parametric multivariate analysis of variance. Austral Ecology 26: 32–46. doi:10.1111/j.1442–9993.2001.01070.pp.x [ Links ]
ANDERSON, M. 2005. PERMANOVA: a FORTRAN computer program for permutational multivariate analysis of variance. Department of Statistics, University of Auckland, New Zealand. 24 p. [ Links ]
BEN–CHAIM, A.; BOROVSKY, Y.; FALISE, M.; MAZOUREK, M.; KANG, B.; PARAN, I.; JAHN. M. 2006. QTL Analysis for capsaicinoid content in Capsicum. Theoretical and Applied Genetics 113: 1481–1490. doi:10.1007/s00122–006–0395–y [ Links ]
BETHKE, J.; PAINE, T.; NUESSLY, G. 1991. Comparative biology, morphometrics and development of two populations of Bemisia tabaci (Homoptera: Aleyrodidae) on cotton and poinsettia. Annals of the Entomological Society of America 84: 407–411 [ Links ]
BIELZA, P.; CONESA, E.; LACASA, A.; CONTRERAS, J. 2000.Modificación del método de las placas adhesivas amarillas para bioensayos de insecticidas en Bemisia tabaci (Gennadius) (Homoptera: Aleyrodidae). Boletín de Sanidad Vegetal Plagas 26: 731–738. [ Links ]
BOUCHELTA, A.; BOUGHDAD, A.; BLENZAR, A. 2005. Effets biocides des alcaloides, des saponines et des flavonoides extraits de Capsicum frutescens L. (Solanaceae) sur Bemisia tabaci (Gennadius) (Homoptera: Aleyrodidae). Biotechnology, Agronomy, Society and Environment 9: 259–269. [ Links ]
CARRERAS, SOLÍS, B.; RODRÍGUEZ, D.; PIEDRAS, F. 2009. Evaluación de cepas nativas de Bacillus thuringiensis Berliner para el control de Heliothis virescens Fabricius en el cultivo del tabaco en Cuba. Fitosanidad 13(4): 277–280. [ Links ]
CASTILLO, L.; JIMÉNEZ, J.; DELGADO, M. 2010. Secondary Metabolites of the Annonaceae, Solanaceae y Meliaceae families used as biological control of insects. Tropical and Subtropical Agroecosystems 12: 445–462. [ Links ]
CÁZARES, S.; RAMÍREZ, P.; CASTILLO, F.; SOTO, R.; RODRÍGUEZ, M.; CHÁVEZ, J. 2005. Capsaicinoides y preferencia de uso en diferentes morfotipos de chile (Capsicum annumm L.) del centro–oriente de Yucatán. Agrociencia 39: 627–638. [ Links ]
CELIS, A.; MENDOZA, C.; PACHÓN, M.; CARDONA, J.; DELGADO, W.; CUCA, L. 2008. Extractos vegetales utilizados como biocontroladores con énfasis en la familia Piperácea. Una Revisión. Agronomía Colombiana 26: 97–106. [ Links ]
CHOI, W.; LEE, E.; CHOI, B.; PARK, H.; AHN Y. 2003. Toxicity of plant essential oils to Trialeurodes vaporariorum (Homoptera: Aleyrodidae). Journal of Economic Entomology 96: 1479–1484. doi: http://dx.doi.org/10.1603/0022-0493-96.5.1479 [ Links ]
CLEMENTE, S.; MAREGGIANI, G.; BROUSSALIS, A.; MARTINO, V.; FERRARO, G. 2003. Insecticidal effects of Lamia–ceae species against stored products insects. Boletín de Sanidad Vegetal Plagas 29: 1–8. [ Links ]
COLLINS, M.; WASMUND, L.; BOSLAND, P. 1995. Improved method for quantifying capsaicinoids in Capsicum using high–performance liquid chromatography. Hortscience 30: 137–139. [ Links ]
EDELSON, J.; DUTIE, J.; ROBERTS, W. 2002. Toxicity of biorational insecticides activity against the green peach aphid, Myzus persicae (Sulzer). Pest Management Science 58: 255–260. doi:10.1007/BF00979617 [ Links ]
EICH, E. 2008. Solanaceae and Convolvulaceae: Secondary Metabolites. Springer–Verlag Berlin Heidelberg. Germany. 637 p. [ Links ]
GAKURU, S.; FOUA, K. 1996. Effet d'extraits de plantes sur la bruche du niebe (Callosobruchus maculatus Frab.) et le charancon du riz (Sitophilus oryzae L.). Cahiers Agricultures 5: 39–42. [ Links ]
HERNÁNDEZ–LAUZARDO, A.; BAUTISTA–BAÑOS, S.; VELÁZQUEZ–DEL VALLE, M. 2007. Prospectiva de extractos vegetales para controlar enfermedades postcosecha hortofrutícolas. Revista Fitotecnia Mexicana 2: 119–123. [ Links ]
IANNACONE, J.; LAMAS, G. 2003. Efectos toxicológicos de molle (Schinus molle) y lantana (Lantana camara) sobre Chrysoperla externa (Neuroptera: Chrysopidae), Trichogramma pintoi (Hymenoptera: Trichogrammatidae) y Copidosoma koehleri (Hymenoptera: Encyrtidae) en el Perú. Agricultura Técnica 63: 347–360. [ Links ]
JERMY, T. 1990. Prospects of antifeedant approach to pest control. A critical review. Journal of Chemical Ecology 16: 3151–3166. doi:10.1007/BF00979617 [ Links ]
LAGUNES, A. 1994. Extractos, polvos vegetales y minerales para el combate de plagas del maíz y del frijol en la agricultura de subsistencia. Memoria. Colegio de Postgraduados, USAID, CONACYT, BORUCONSA. Montecillo, Texcoco, México. 31 p. [ Links ]
LIU, X.; LIN, Y. 2003. Biological activity of capsaicin and its joint action with other pesticides. Chinese Journal of Pesticide Science 5:94–96. doi:cnki:ISSN:1008–7303.0.2003–02–013 [ Links ]
LÓPEZ, G. 2003. Chilli: La especia del Nuevo Mundo. Ciencias 69: 66–75. [ Links ]
LÓPEZ–PÉREZ, E.; RODRÍGUEZ, C.; ORTEGA, L.; GARZA, R. 2007. Actividad biológica de la raíz de Senecio salignus contra Zabrotes subfasciatus en frijol almacenado. Agrociencia 41(1): 95–102. [ Links ]
MADHUMATHY, A.; AIVAZI, A.; VIJAYAN, V. 2007. Larvicidal efficacy of Capsicum annum against Anopheles stephensi and Culex quinquefasciatus. Journal of Vector Borne Diseases 44: 223–226. [ Links ]
MAREGGIANI, G. 2001. Manejo de insectos plaga mediante sustancias semiquímicas de origen vegetal. Manejo Integrado de Plagas 60: 22–30. [ Links ]
MORÓN, M.; TERRÓN, R. 1988. Entomología práctica: una guía para el estudio de los insectos con importancia agropecuaria, médica, forestal y ecológica de México. Instituto de Ecología, A. C. México. 504 p. [ Links ]
PASCUAL–VILLALOBOS, M. 1998. Repelencia, inhibición del crecimiento y toxicidad de extractos vegetales en larvas de Tribolium castaneum Herbst. (Coleoptera: Tenebrionidae). Boletín de Sanidad Vegetal Plagas 24: 143–154. [ Links ]
PROCOPIO, S.; VENDRAMIM, J.; RIBEIRO, J.; DOS SANTOS, J. 2003. Bioatividade de diversos pós de origem vegetal em relacao a Sitophilus zeamais Mots. (Coleoptera: Curculionidae). Ciencia e Agrotecnología Lavras 27: 1231–1236. [ Links ]
RUIZ, J.; MEDINA, J. 2001. Avances en el manejo integrado de Bemisia tabaci en tomate y chile en Oaxaca, México. Manejo Integrado de Plagas 59: 34–40. [ Links ]
SALVADORES, Y.; SILVA, G.; TAPIA, M.; HEPP, R. 2007. Polvos de especias aromáticas para el control del gorgojo del maíz, Sitophilus zeamais Motschulsky, en trigo almacenado. Agricultura Técnica 67: 147–154. [ Links ]
SORIA, M.; TUN, J.; TREJO, A.; TERÁN, R. 2003. Tecnología para la producción de hortalizas a cielo abierto en la península de Yucatán. 3a edición. Centro de Investigaciones y Graduados Agropecuarios. Instituto Tecnológico Agropecuario No. 2. SEP. Conkal, Yucatán, México. 430 p. [ Links ]
VALLADARES, G.; GARBIN, L.; DEFAGO, M.; CARPINELLA, C.; PALACIOS, S. 2003. Actividad antialimentaria e insecticida de un extracto de hojas senescentes de Melia azedarach (Meliaceae). Revista de la Sociedad Entomológica Argentina 62: 53–61. [ Links ]
VIGLIANCO, A.; NOVO, R.; CRAGNOLINI, C.; NASSETTA, M. 2006. Actividad biológica de extractos crudos de Larrea divaricata Cav. y Capparis atamisquea Kuntze sobre Sitophilus oryzae (L.). Agriscientia 23: 83–89. [ Links ]
WEISSENBERG, M.; KLEIN, M.; MEISNER, J.; ASCHER, K. 1986. Larval growth inhibition of the spiny bollworm, Earias insulana, by some steroidal secondary plant compounds. Entomologia Experimentalis et Applicata 42: 213–217. doi: 10.1007/BF00629306 [ Links ]
WOISKY, R.; SALATINO, A. 1998. Analysis of propolis: some parameters and procedures for chemical quality control. Journal of Apicultural Research 37: 99–105. [ Links ]
ZEWDIE, Y.; BOSLAND, P. 2000. Evaluation of genotype, environment, and genotype–by–environment interaction for capsaicinoids in Capsicum annuum L. Euphytica 111: 185–190. doi:10.1023/A:1003837314929 [ Links ]














