Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.18 no.1 Chapingo ene./abr. 2012
Propiedades entomotóxicas de los extractos vegetales de Azaradichta indica, Piper auritum y Petiveria alliacea para el control de Spodoptera exigua Hübner
Entomotoxic properties of plant extracts of Azadirachta indica, Piper auritum and Petiveria alliacea for the control of Spodoptera exigua Hübner
Erika Delgado Barreto1; Ma. del Rosario García–Mateos1,2*; Ma. del Carmen Ybarra–Moncada3; César Luna–Morales1; Ma. Teresa Martínez–Damián1
1 Instituto de Horticultura. Departamento de Fitotecnia. Universidad Autónoma Chapingo, Carretera México–Texcoco km 38.5. C. P. 56230, Chapingo, Estado México. MÉXICO.
2 Departamento de Preparatoria Agrícola, Universidad Autónoma Chapingo, Carretera México–Texcoco km 38.5. C. P. 56230, Chapingo, Estado de México. MÉXICO. Correo–e: rosgar08@hotmail.com (*Autor para correspondencia).
3 Departamento de Ingeniería Agroindustrial, Universidad Autónoma Chapingo, Carretera México–Texcoco km 38.5. C. P. 56230, Chapingo, Estado de México. MÉXICO.
Recibido: 27 de mayo, 2011.
Aceptado: 17 de enero, 2012.
Resumen
El propósito de este trabajo fue evaluar el efecto antialimentario y la toxicidad de los extractos de Azadirachta indica, Piper auritum y Petiveria alliacea en larvas de Spodoptera exigua en condiciones de laboratorio y en un cultivo orgánico de tomate uva var. Santa a campo abierto. El trabajo se realizó con los extractos hexánico y metanólico de semillas de A. indica y hojas de P. auritum y de P. alliacea aplicados en diferentes concentraciones en larvas 4to estadío de S. exigua. Las variables que se evaluaron fueron Indice de disuasión alimentaria (FDI), índice de supresión alimentaria (FSI), Porcentaje de mortalidad y CL50. El mayor efecto disuasivo alimentario se encontró en el extracto metanólico de Azadirachta indica, seguido por el de P. auritum, y el menor efecto en el extracto de P. alliacea. Los porcentajes de mortalidad para A. indica, P. auritum y P. alliacea fueron 38.88, 28.8 y 21.22 %, respectivamente; la misma tendencia que en condiciones de laboratorio, se encontró en campo. La CL50 mostró que el extracto metanólico de A. indica fue el más tóxico (4.03 ppm), y le siguió en efectividad el de P. auritum (42.08 ppm). En campo, la CL50 de los extractos metanólico de A. indica, P. auritum y P. alliaceae fueron 9.61, 21.21 y 104.1 ppm, respectivamente.
Palabras clave: Azadirachta indica, disuasión alimentaria, extractos, Piper auritum, Petiveria alliacea, toxicidad.
Abstract
The purpose of this study was to evaluate the antifeedant effect and toxicity of Azadirachta indica, Piper auritum and Petiveria alliacea extracts on Spodoptera exigua larvae under laboratory conditions and in an open–field crop of organically–grown grape tomatoes var. Santa. The work was carried out with hexane and methanol extracts of A. indica seeds and P. auritum and P. alliacea leaves applied in different concentrations against 4th–stage S. exigua larvae. The variables evaluated were feeding deterrence index (FDI), feeding suppression index (FSI), mortality rate and LC50. The strongest feeding deterrent effect was found in the methanol extract of Azadirachta indica, followed in descending order by that of P. auritum and P. alliacea. The mortality rates for A. indica, P. auritum and P. alliacea were 38.88, 28.8 and 21.22 %, respectively, under laboratory conditions; the same trend was found in the field. The LC50 showed that the methanol extract of A. indica was the most potent (4.03 ppm), followed in effectiveness by that of P. auritum (42.08 ppm). In the field, the LC50 of the methanol extracts of A. indica, P. auritum and P. alliaceae were 9.61, 21.21 and 104.1 ppm, respectively.
Keywords: Azadirachta indica, feeding deterrence, extracts, Piper auritum, Petiveria alliacea, toxicity.
INTRODUCCIÓN
El uso indiscriminado de insecticidas sintéticos para evitar las pérdidas económicas en la producción de algunos cultivos por el ataque de insectos plaga ha provocado la contaminación del planeta (Zapata et al., 2009), así como, un aumento de la resistencia de las plagas (Lagunes y Villanueva, 1999); tal es el caso de Spodoptera spp. (Meagher et al., 2008). El gusano soldado (Spodoptera exigua Hübner) es una plaga que afecta a aproximadamente 130 cultivos hortícolas de 30 familias diferentes (Merkx–Jacques et al., 2008; Saeed et al., 2009), entre ellos el tomate (Liburd et al., 2000), lo que repercute en considerables daños económicos (Merkx–Jacques et al., 2008).
Una alternativa para el control de plagas, sin afectar al medio ambiente y evitar el desarrollo de la resistencia, puede ser el uso de extractos vegetales biodegradables (Regnault–Roger et al., 2004). Recientemente, el estudio de la actividad insecticida de los extractos vegetales y fitoquímicos se ha intensificado debido a la demanda de alimentos orgánicos (De Souza et al., 2009) y a las exigencias actuales de la defensa fitosanitaria de los productos hortícolas (Regnault–Roger et al., 2004).
La actividad tóxica y la eficacia de extractosvegetales en las plagas han contribuido a la identificación de metabolitos secundarios con actividad insecticida. Los diversos efectos biológicos de fitoquímicos han llevado a reevaluar sus diferentes funciones en las plantas, especialmente en el contexto de las interacciones ecológicas y en el desarrollo de mecanismos de defensa contra insectos (Wink, 2003). Sin embargo, muchos metabolitos secundarios, como insecticidas o disuasorios alimentarios, aún se encuentran en estudio (Ulrichs et al., 2008).
Algunos ingredientes activos se han identificado en las familias Meliaceae, Rutaceae, Asteraceae, Labiatae y Piperaceae (Regnault–Roger et al., 2004; Ulrichs et al., 2008; De Souza et al., 2009), Annonaceae, Cannellaceae, Labiateae, Meliaceae, Mimosaceae, Rutaceae,Sapindaceae, Solanaceae (Zabel et al., 2002; González Coloma et al., 2005; Ybarra et al., 2005; Isman et al., 2006), Fabaceae (García–Mateos et al., 2004).
Por ejemplo, Petiveria alliacea L. (Phytolaccaceae) llamada comúnmente ajillo o hierba del zorrillo por su olor característico, debido a la presencia de compuestos de azufre (De Souza et al., 1990), es endémica de México, de las islas del Caribe, de Centroamérica y de Sudamérica. Es una de las plantas medicinales más usadas en América Latina; se encuentra descrita su actividad insecticida, acaricida y bactericida (Benavides et al., 2001). Scott et al. (2008), señalan que el género Piper, representado por 700 especies, en particular P. auritum Kunth (Piperaceae), conocida como hoja santa o acuyo, es una especie aromática originaria de México y distribuida hasta Colombia; tiene propiedades insecticidas, repelentes y antialimentarias por la presencia de aceites esenciales (metabolitos volátiles) y las conocidas piperamidas (Olivero–Verbel et al., 2009). Azadiractina es el principal ingrediente activo de Azadirachta indica (A. Juss., Meliaceae), y sus derivados, del tipo limonoide, son responsables de diversas propiedades fisiológicas (inhibidor de crecimiento, repelente, actividad insecticida y antialimentaria) en diferentes familias de insectos (Pavela et al., 2009).
El estudio de la actividad antialimentaria y/o insecticida de extractos vegetales en diversas especies del género Spodoptera se encuentra documentado (Ulrichs et al., 2008; De Souza et al., 2009). Sin embargo, no se ha estudiado en S. exigua la actividad insecticida de las especies de Azadirachta indica, Piper auritum y Petiveria alliacea. En el presente estudio se evaluaron el efecto tóxico y la actividad antialimentaria de los extractos hexánico y metanólico de A. indica, P. auritum y P. alliacea en larvas de 4to estadio de S. exigua en laboratorio y en un cultivo orgánico de tomate uva var. Santa a campo abierto, con la finalidad de encontrar una alternativa para el control de la plaga que afecta el rendimiento de este cultivo orgánico, sin contaminar el medio ambiente.
MATERIALES Y MÉTODOS
Recolecta del material vegetal
Las hojas de P. auritum fueron recolectadas al azar de varios ejemplares en el mes de febrero de 2010 en el municipio de Actopan, Veracruz. México, situado a 19° 30' LN y 96° 37' LO a 311 m de altitud, con un clima tropical cálido Awo(w)(i")gw", donde la temperatura varía de 21.1 a 27.3 °C y hay una precipitación media anual de 860.1 mm (García, 1988). Las semillas de A. indica (neem) fueron recolectadas en el mes de marzo del mismo año en el poblado La Brecha, municipio de Guasave, Sinaloa, México, situado a 25° 22' LN y 108° 25' LO a una altitud de 15 m, donde el clima es seco, muy cálido y cálido BS(h'), la temperatura varía de 18.5 a 29.9 °C y su precipitación media anual es de 392.8 mm (García, 1988). Las hojas de P. alliacea fueron recolectadas en el mes de junio de 2009 en el municipio de Rodríguez Clara, Veracruz, México, situado a 17° 59' LN y 03° 43' LO a una altitud de 16 m, con un clima cálido subhúmedo con lluvias en verano Aw2(w)(i")w", la temperatura promedio varía de 21.5 a 27.8 °C, y hay una precipitación media anual de 1,500 mm (García, 1988).
Preparación de extractos vegetales
La hoja seca y molida (500 g) de P. alliacea y P. auritum separadamente se maceró en hexano (2 x 1000 ml) durante 24 h (rendimiento: 0.40 y 0.19 %, respectivamente). El mismo procedimiento se siguió para preparar el extracto hexánico con 400 g de semilla seca y molida de A. indica (rendimiento: 10.20 %). Posteriormente, cada extracto se filtró y se concentró a presión reducida en un rotaevaporador Büchi para eliminar el disolvente. Para la preparación del extracto metanólico, se colocó separadamente el material vegetal seco y molido de cada especie en un equipo soxhlet por 48 h. La eliminación del disolvente se realizó a vacío. Los rendimientos obtenidos de los extractos de A. indica, P. auritum y P. alliacea fueron 4.91, 0.83 y 4.64 %, respectivamente. Las concentraciones (1, 5, y 10 %) para las pruebas en laboratorio (actividad antialimentaria, % de mortalidad y CL50) y 5, 10 y 15 % para las evaluaciones (% de mortalidad y CL50) en campo se prepararon a partir de los extractos orgánicos.
Cría de Spodoptera exigua
Las poblaciones de larvas y huevos colectados en cultivos de maíz y algodón del campo experimental del CIMMYT, campus Estado de México, en 1997, se establecieron bajo condiciones ambientales controladas (26 ± 2 °C de temperatura, 65 ± 5 % de HR y fotoperiodo de 16:8 h [luz:oscuridad]). Para las pruebas antialimentarias y de toxicidad en laboratorio y en campo se usó una población de larvas del 4to estadío de S. exigua.
Actividad antialimentaria
Pruebas con posibilidades de elección de alimento. En una caja Petri (unidad experimental:UE) de 9 cm de diámetro se colocó una base de papel filtro húmedo con agua destilada y en la superficie se ubicaron dos discos foliares de lechuga de 3 cm de diámetro, previamente pesados. Uno de los discos fue asperjado por ambos lados de la hoja (haz y envés) con 600 µl de cada concentración por extracto, y el segundo disco fue rociado con la misma cantidad de agua destilada.
Sobre los discos foliares se colocaron dos larvas de S. exigua, previamente pesadas y en abstinencia de alimento por 5 h. Las cajas Petri fueron cubiertas por una malla de tela organza, se mantuvieron a una temperatura de 24 ± 2°C, 63 ± 5 % de HR y un fotoperiodo de 16:8 h (luz:oscuridad). Después de 72 h, las larvas se retiraron de los discos foliares y se pesaron para obtener su peso final. Se realizaron cinco repeticiones por tratamiento, incluyendo el testigo.
Las variables a evaluar fueron: índice de disuasión alimentaria (FDI) = 100 [(C–T) / (C+T)]; donde: T = Peso de disco tratado con extracto, C = Peso de disco sin extracto. índice de supresión alimentaria (FSI) = 100 [(Cv–(C+T) / Cv]; donde: T = Peso de disco tratado con extracto, Cv = Variable control (peso de disco sin extracto), C = Peso de disco del tratamiento control (Zapata et al., 2009).
Evaluación de toxicidad en laboratorio
Pruebas sin posibilidades de elección de alimento.Para la adaptación de las larvas durante 24 h, se colocaron tres larvas de 4to estadío de S. exigua en tres discos foliares (3 cm de diámetro) de lechuga sin extracto por cada caja Petri de cristal (9 cm diámetro). Después del tiempo de adaptación de las larvas, se registró el peso de cada una. Posteriormente, en cada caja Petri se colocaron tres larvas sobre tres nuevos discos foliares de lechuga (3 cm de diámetro), cada uno previamente rociado por ambos lados (haz y envés) con 800 µl de extracto por concentración (1, 5 y 10 %). Se realizaron cinco repeticiones por concentración de cada extracto, incluyendo el testigo.
Las lecturas del número de larvas vivas y muertas se hicieron cada 24 h durante cinco días. Las condiciones del bioensayo fueron: temperatura ambiente promedio de 19 ± 2 °C, 60 ± 5 % de HR y fotoperiodo de 16:8 h (luz:oscuridad). Las variables que se evaluaron fueron: porcentaje de mortalidad y concentración letal media (CL50) para los extractos hexánico y metanólico de cada especie.
Evaluación de toxicidad en campo
El establecimiento del cultivo de tomate uva var. Santa (Solanum lycopersicum Mill) se llevó a cabo bajo sistema de producción a campo abierto en el Rancho Los Hoyos, ubicado en el km. 91 de la carretera internacional Obregón–Guaymas, 7.6 km al norte, municipio de Empalme, Sonora, México, ubicado a 27° 55' LN y 110° 48' LO. La zona de cultivo presenta un clima seco muy cálido del tipo BW (rf) w (e), una temperatura media máxima de 18 a 34 °C, con una precipitación anual de 320 mm. Los tipos de suelos identificados en el área del cultivo son: litosol, regosol y yermosol.
Manejo del cultivo
La siembra de las semillas de tomate se inició en charolas de polietileno; se utilizó como sustrato peat moss marca TBK y vermiculita (2:1). A los 35 días de la siembra, las plántulas fueron trasplantadas a campo abierto. La mezcla de fertilizante que se aplicó fue 0.4 – 0 – 5 (N, P, K), disolviendo 78 kg de nitrato de sodio y 288 kg de sulfato de potasio en 3,000 L de agua. El fertirriego se realizó cada tercer día. En cada surco se sembraron las plantas de tomate uva con una separación de 55 cm entre plantas y la distancia entre surcos fue de 1.2 m, obteniéndose una densidad de cuatro plantas por m2.
Infestación del cultivo
Se seleccionaron aleatoriamente 30 plantas (unidades experimentales) de una altura de 45 a 50 cm en la etapa fenológica de ramificación de tomate uva, después de cuatro semanas del trasplante. Se colocaron 15 larvas (4to. estadío) por planta durante 24 h para su adaptación. Las plantas se aislaron mediante jaulas entomológicas elaboradas con tela de organza blanca de 70 cm de largo por 50 cm de diámetro, sujetas por las estacas del tutoreo y el amarre de la planta. Después de 24 h de la infestación se realizaron tres aplicaciones cada 30 min únicamente por la mañana con la aspersión de 35 ml por cada concentración de los extractos metanólicos de P.alliacea, P. auritum y A. indica. Las condiciones de la prueba biológica fueron: temperatura ambiente promedio de 26 ± 2 °C, 55 ± 5 % de HR y fotoperiodo de 12:12 h (luz:oscuridad). Las lecturas del número de larvas vivas y muertas se realizaron tres horas después de la aplicación para cuantificar el descenso de la población. A las plantas seleccionadas se les asignaron los tratamientos de acuerdo con un diseño completamente al azar. Se realizaron tres repeticiones por concentración de cada extracto; el control fue agua + Tween 20 al 0.1 % v/v. Las variables que se evaluaron fueron: porcentaje de mortalidad y concentración letal media (CL50) para el extracto metanólico de cada especie.
Análisis fitoquímico
Con la finalidad de asociar el efecto tóxico con el tipo de metabolito secundario (alcaloides, fenólicos y terpenoides) presente en cada extracto, se realizó un análisis fitoquímico de los extractos hexánico y metanólico de cada especie. La identificación se realizó por cromatografía en capa fina aplicando 1 µl de cada extracto en cromatoplacas de gel de sílice 60 F254 (Merck). Para la detección de flavonoides se empleó como eluyente una mezcla de butanol: ácido acético: agua en una proporción de 40:10:50 % v/v; los agentes cromogénicos fueron 2–aminoethildifenilborinato y polietilenglicol 4000; los componentes se visualizaron a una longitud de onda de 365 nm. Para la detección de alcaloides se usó como eluyente metanol:diclorometano (8:2 % v/v), y el agente cromogénico fue el reactivo de Dragendorff. Para la identificación de terpenoides se utilizó una mezcla de tolueno:acetato de etilo (93:7 % v/v); el agente cromogénico empleado fue vainillina al 1 % en etanol y ácido sulfúrico al 10 % en etanol (Wagner y Bladt, 1996).
Análisis estadístico
Se realizó un Análisis de Varianza (ANOVA) y de comparación de medias LSD Fisher (P<0.05) mediante el programa Statistical Analysis System (SAS) versión 9.0. Las tasas de mortalidad fueron corregidas mediante la fórmula de Abbott (Abbott, 1925), y después fueron analizadas mediante el análisis Probit (Finney, 1971). El Análisis estadístico Probit permitió calcular la Concentración Letal Media (CL50).
RESULTADOS Y DISCUSIÓN
Actividad antialimentaria
Los resultados de la actividad antialimentaria en S. exigua que ocasionaron los extractos de A. indica, P. auritum y P. alliacea se muestran en el Cuadro 1. No se encontraron diferencias significativas de la disuasión del extracto hexánico (P<0.608) entre las tres especies vegetales (Cuadro 1). Tampoco se encontró variación estadística del peso final del alimento en relación con el testigo (Cuadro 1), lo que permitió inferir que hubo consumo del alimento, con excepción de la concentración menor (1 %) del extracto hexánico de P. alliaceae. Asimismo, el peso final de S. exigua a las 48 h fue significativamente igual en los tratamientos del extracto hexánico de P. alliacea con el testigo; solamente en aquellas que fueron alimentadas con A. indica y P. auritum hubo diferencias con menor peso (Cuadro 1).
Las sustancias antialimentarias se clasifican como repelentes (repelen al insecto sin establecer contacto), supresivas (suprimen la ingesta después del contacto) y disuasivas (disuaden al insecto de ingerirlas después de haberlas degustado) (Sengonca et al., 2006). Con base en estas definiciones y de acuerdo al comportamiento de las larvas, la FSI fue significativamente menor en las larvas tratadas con el extracto hexánico de A. indica que con los extractos de P. auritum y P. alliacea.
El extracto metanólico de las tres especies ocasionó un efecto de disuasión positivo en comparación con el extracto hexánico. Se observaron diferencias estadísticas en el FDI (P<0.265) entre los extractos metanólicos de las tres especies (Cuadro 1). El mayor efecto disuasivo de la alimentacion en larvas de S. exigua se encontró en la concentración más alta (10 %) del extracto de A. indica , y el menor efecto en la concentración más baja de A. indica (1 %) y en la mayor (10 %) de P. alliacea. Rossetti et al. (2008) describen un elevado efecto diasuasivo del extracto del fruto de M. azeradach en Spodoptera eridania a las concentraciones de 2 y 10 % y moderado en la concentracion intermedia (5 %). Los mecanismos químicos de la actividad antialimentaria en insectos plaga aún son poco claros (Harmatha y Nawrot, 2002) para explicar estos resultados. En el Cuadro 1 se presentan las variaciones de los pesos del alimento (DPD) y de la larva (DPL) para cada tratamiento del extracto metanólico. Estadísticamente, los resultados muestran que no hubo consumo de alimento en la mayoría de los tratamientos; solamente las larvas que lo consumieron fueron las del control.
Es importante señalar que no hubo diferencia estadística del FSI en la mayoría de los tratamientos del extracto metanólico de las tres especies; solamente el tratamiento del extracto metanólico de A. indica ocasionó mayor supresión desde la concentración más baja que un efecto antialimentario en comparación con los extractos de P. alliacea y P. auritum, lo que permitió inferir un efecto tóxico en la especie. Al respecto, Regnault–Roger et al. (2004) mencionan que la mayor parte de los metabolitos con actividad antialimentaria en insectos plaga provocan otras propiedades biológicas (e. g. actividad insecticida, alteraciones hormonales).
Toxicidad en laboratorio y en campo
El porcentaje de mortalidad que se observó en larvas de S. exigua 4to estadío al ser tratadas con el extracto hexánico en condiciones de laboratorio, mostró diferencias estadísticas significativas (P<0.0003) en las tres especies. El mayor efecto se manifestó en las concentraciones más altas (10 %) de A. indica, P. auritum y P. alliacea en relación con el control (Figura 1).
El extracto metanólico resultó ser más tóxico que el hexánico. La concentración más alta (10 %) del extracto metanólico de A. indica ocasionó el mayor porcentaje de mortalidad; en P. auritum se encontró un efecto de mortalidad intermedio en relación a las dos especies (Figura 2). Se encuentra ampliamente documentado que A. indica produce efectos múltiples tanto antialimentarios como tóxicos (Batabyal et al., 2009), lo cual es congruente con los resultados encontrados en el presente estudio; sin embargo, para las especies P. auritum y P. alliacea no se encontraron descritos los efectos tóxicos en S. exigua.
Debido a que el extracto hexánico de las tres especies ocasionó baja toxicidad (Figura 1), únicamente se evaluó en campo el extracto metanólico; éste ocasionó un efecto tóxico menor en campo (Figura 3) que en condiciones de laboratorio (Figura 2) a pesar de la aplicación de concentraciones más elevadas, lo cual coincide con lo reportado por García–Mateos et al. (2007). Nuevamente el extracto metanólico de A. indica fue el que ocasionó mayor porcentaje de mortalidad en larvas de S. exigua, en campo, en segundo lugar P. auritum, y finalmente P. alliacea (Figura 3). Lewis y Van Endmen (1986) señalan que los ensayos realizados con insectos en campo pueden confirmar los resultados obtenidos en el laboratorio, aunque estos últimos no pueden ser extrapolados a los realizados en campo o invernadero debido a diversos factores como la alteración de las sustancias por factores ambientales, así como a la adaptación del insecto al uso de sustratos artificiales en el laboratorio. Sin embargo, Regnault–Roger et al. (2004) mencionan que la composición de los extractos crudos es temporalmente estable; esto representa una ventaja para el control de insectos plagas.
En el Cuadro 2 se muestra la CL50 obtenida en laboratorio y en campo. Los extractos hexánico y metanólico de A. indica fueron los más tóxicos; le siguieron en efectividad los extractos de P. auritum para matar a la mitad de la población de S. exigua. En campo, el extracto metanólico ocasionó un efecto tóxico menor al que se encontró en el laboratorio.
El análisis de comparación de medias mostró baja mortalidad en S. exigua por el extracto hexánico (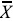 = 21.48b) comparada con el extracto metanólico (
= 21.48b) comparada con el extracto metanólico (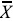 = 37.77a), debido posiblemente a: 1) la naturaleza menos polar (lipofílica), 2) la diferente composición química de los extractos hexánico y metanólico; 3) los diferentes metabolitos de cada especie, y 4) la concentración de los diferentes componentes del extracto.
= 37.77a), debido posiblemente a: 1) la naturaleza menos polar (lipofílica), 2) la diferente composición química de los extractos hexánico y metanólico; 3) los diferentes metabolitos de cada especie, y 4) la concentración de los diferentes componentes del extracto.
El análisis fitoquímico permitió detectar cualitativamente la presencia de varios terpenoides en el extracto metanólico de A. indica (Cuadro 3); azadiractina es el triterpenoide predominante en la especie y el que confiere las propiedades insecticidas (Pavela et al., 2009). En P. auritum se detectaron terpenoides en el extracto hexánico debido a la presencia de aceites volátiles, lo que explica la moderada toxicidad; en el extracto metanólico se identificaron flavonoides y alcaloides, como lo reportan en P. auritum Harmatha y Nawrot (2002), Castañeda et al. (2007) y Olivero–Verbel et al. (2009); pero Scott et al. (2008) asocian la actividad insecticida a la presencia de piperamidas, lo que explica la toxicidad detectada en este estudio. Por otro lado, se menciona la presencia de alcaloides, flavonoides y terpenoides en P. alliacea (Bezerra et al., 2005); en el presente estudio sólo se observaron evidencias de flavonoides y alcaloides, pero las propiedades insecticidas descritas se deben a la presencia de compuestos derivados de azufre, metabolitos no estudiados en el presente estudio (Kubec et al., 2002; 2003).
Regnault–Roger et al. (2004) señalan que la mortalidad de insectos plaga depende directamente de la concentración del extracto y del tiempo de exposición; pero la mezcla de compuestos en un extracto puede presentar una potenciación. De Souza et al. (2009) mencionan que la presencia de varios metabolitos en un extracto causan un efecto sinérgico, lo que incrementa la actividad y disminuye problemas de resistencia. Por lo tanto, la toxicidad de un extracto será mayor a la de un metabolito aislado, como lo señalan García–Mateos et al. (2004); esto permitió inferir que las diferencias del efecto tóxico que se observaron en las especies A. indica, P. auritum y P. alliacea se deben a la diferente naturaleza química de metabolitos presentes en cada extracto; pero no debe descartarse el estudio de estas especies para extraer otros principios activos con disolventes de otra polaridad.
En el presente estudio se encontró que son marcadas las diferencias que existen entre las variaciones de toxicidad por especie y por el tipo de extracto. De Souza et al. (2009) evaluaron extractos de diferente polaridad de varias especies de Asteraceae en larvas de Spodoptera frugiperda, donde encontraron una variación de la mortalidad de 8.7 a 87.0 %. También se observó que existe una respuesta diferencial del insecto receptor a la diferente polaridad y composición química de los extractos. Cabe mencionar que estos son los primeros estudios que se realizan con P. auritum y P. alliacea en larvas de S. exigua en condiciones de laboratorio y en campo. Evaluar la eficiencia de los extractos de plantas no estudiadas en larvas de S. exigua, permite contribuir a la búsqueda de insecticidas naturales, sobre todo en aquellas especies vegetales que han sido poco estudiadas o aquellas que se encuentran a punto de extinción (Regnault–Roger et al., 2004).
CONCLUSIONES
El extracto metanólico fue más tóxico (porcentaje de mortalidad y CL50) que el extracto hexánico de las especies A. indica, P. auritum y P. alliacea. El extracto metanólico de A. indica causó el porcentaje de mortalidad mayor en S. exigua que P. auritum, y el menor efecto se encontró en el extracto de P. alliacea. No se encontraron diferencias significativas del FDI del extracto hexánico de las tres especies vegetales. El extracto metanólico de las tres especies ocasionó un efecto de disuasión positivo en comparación con el extracto hexánico. En condiciones de laboratorio se encontró un efecto tóxico de los extractos mayor en S. exigua que en un cultivo de tomate uva var. Santa infestado con la plaga a campo abierto.
AGRADECIMIENTOS
Los autores agradecen la donación de las larvas de Spodoptera exigua por el doctor George Mahuku, del insectario del Centro Internacional de Mejoramiento de Maíz y Trigo (CIMMYT), campus Estado de México, México.
LITERATURA CITADA
ABBOTT, W. S. 1925. A method of computing the effectiveness of an insecticide. Journal of Economic Entomology 18: 265–267. [ Links ]
BATABYAL, L.; SHARMA, P.; MOHAN, L.; MAURYA, P.; SRIVAS–TAVA, C. 2009. Relative toxicity of neem fruit, bitter gourd, and castor seed extracts against the larvae of filarial vector, Culex quinquefasciatus (Say). Parasitology Research 105: 1205–1210. [ Links ]
BENAVIDES, P. J. C.; YOUNG, M. C. M.; GIESBRECHT, A. M. 2001. Antifungal polysulphides from Petiveria alliaceae L. Phytochemistry Reviews 57: 743–747. [ Links ]
BEZERRA, G. P.; DA SILVA, O. M. M.; ALVES, N. C. R. ; COELHO, N. E.; VASCONCELOS, C. L. M.; FRANCA, F. M. M.; BARRO, V. G. S.; FLORENCO, D. S. F. C. 2005. Study of anti–nociceptive effect of isolated fractions from Petiveria allicea L. (tipi) in mice. Biological Pharmaceutical Bulletin 28: 41–46. [ Links ]
CASTAÑEDA, M. L.; MUÑOZ, A.; MARTÍNEZ, J. R.; STANSHENKO, E. E. 2007. Estudio de la composición química y la actividad biológica de los aceites esenciales de diez plantas aromáticas colombianas. Scientia et Technica 33: 165–166. [ Links ]
DE SOUZA, J. R.; DEMUER, A. J.; PINHEIRO, J. A. 1990. Dibenzyl trisulphide and trans–N–methyl–α–methoxyproline from Petiveria alliaceae. Phytochemistry Reviews 29: 3653–3655. [ Links ]
DE SOUZA, T. W.; CRUZ, I.; PETACCI, F.; DE SOUSA, F. S.; COLA, Z. J.; SERRÃO, J. E. 2009. Potential use of Asteraceae extracts to control Spodoptera frugiperda (Lepidoptera: Noctuidae) and selectivity to their parasitoids Tricho–gramma pretiosum (Hymenoptera: Trichogrammatidae) and Telenomus remus (Hymenoptera: Scelionidae). Industrial Crops and Products 30: 384–388. [ Links ]
FINNEY, D. J. 1971. Probit Analysis. 3rd. ed. Cambridge University Press. London. 318 p. [ Links ]
GARCÍA, E. 1988. Modificaciones al Sistema de Clasificación Climática de Köppen. Offset Larios, S. A. México. 217 p. [ Links ]
GARCÍA–MATEOS, R.; PÉREZ PACHECO, R.; RODRÍGUEZ HERNÁNDEZ, C.; SOTO–HERNÁNDEZ, M. 2004. Toxicity of Erythrina americana in mosquito Culex quinquefasciatus. Revista Fitotecnia Mexicana 27: 297–303. [ Links ]
GARCÍA–MATEOS, M. R.; ELIZALDE SÁNCHEZ, E.; ESPINOSA–ROBLES, P.; ÁLVAREZ–SÁNCHEZ, M. E. 2007. Toxicity of Petiveria alliacea L. on white fly (Trialeurodes vaporariorum West.) in laboratory and greenhouse. Interciencia 32: 121–125. [ Links ]
GONZÁLEZ–COLOMA, A.; GUARDANO, A.; INGÉS, C.; MARTÍNEZ DÍAZ., R.; CORTÉZ, D. 2002. Selective action of acetogenin mitochondrial complex I Inhibitors. Zeitschrift für Naturforschung 57: 1023–1034. [ Links ]
HARMATHA, J.; NAWROT, J. 2002. Insect feeding deterrent activity of lignans and related phenylpropanoids with a methylenedioxyphenyl (piperonyl) structure moiety. Entomologia Experimentalis et Applicata 104: 51–60. [ Links ]
ISMAN, M. B. 2006. The role of botanical insecticides, deterrents and repellents in modern agriculture and increasingly regulated world. Annual Review Entomology 51: 51–66. [ Links ]
KUBEC, R.; KIM, S.; MUSAH, R. A. 2002. S–Substituted cysteine derivatives and thiosulfinate formation in Petiveria alliacea–part II. Phytochemistry Reviews 61: 675–680. [ Links ]
KUBEC, R.; KIM, S.; MUSAH, R. A. 2003. The lachrymatory principle of Petiveria alliacea. Phytochemistry Reviews 63: 37–40. [ Links ]
LAGUNES, T. A.; VILLANUEVA, J. J. 1999. Toxicología y Manejo de Insecticidas. Colegio de Postgraduados. Montecillo, Estado de México. México. 264 p. [ Links ]
LEWIS A. C.; VAN EMDEN, H. F. 1986. Assays for insect feeding, pp. 95–19. In: Insect–Plant Interactions. MILLER, J. R. ; MILLER, T. A. (eds.). Springer–Verlag. New York. [ Links ]
LIBURD, O. E.; FUNDERBURK, J. E.; OLSON, S. M. 2000. Effect of biological and chemical insecticides on Spodoptera species (Lep., Noctuidae) and marketable yields of tomatoes. Journal of Applied Entomology 124: 19–25. [ Links ]
MEAGHER, R. L.; BRAMBILA, J.; HUNG, E. 2008. Monitoring for exotic Spodoptera species (Lepidoptera: Noctuidae) in Florida. Florida Entomologist 91: 517–522. [ Links ]
MERKX–JACQUES, M.; DESPLAND, E.; BEDE, J. C. 2008. Nutrient utilization by caterpillars of the generalist beet armyworn, Spodptera exigua. Physiological Entomology 33: 51–61. [ Links ]
OLIVERO–VERBEL, J.; GŸETTE–FERNANDEZ, J.; STASHENKO, E. 2009. Acute toxicity against Artemia franciscana or essential oils isolated from plants of the genus Lippia and Piper collected in Colombia. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas 5: 419–427. [ Links ]
PAVELA, R.; KAZDA. J.; HERDA. G. 2009. Effectiveness of neem (Azadirachta indica) insecticides against Brassica pod midge (Dasineura brassicae Winn). Journal of Pest Science 82: 235–240. [ Links ]
REED, E.; MAJUMDAR, S. K. 1998. Differential cytotoxic effects of azadirachtin of Spodoptera frugiperda and mouse cultured cells. Entomologia Experimentalis et Applicata 89: 221–221. [ Links ]
REGNAULT–ROGER, C.; PHILOGENE, B. J.; VINCENT, C. 2004. Biopesticidas de Origen Vegetal. Ediciones Mundi–Prensa. Madrid, España. 337 p. [ Links ]
RIZWAN–UL–HAQ, M.; BO HU, Q.; YING HU, M.; SHEN LIN, Q.; LI ZHANG, W. 2009. Biological impact of harmaline, ricine, and their combined effects with Bacillus thuringiensis on Spodoptera exigua (Lepidoptera:Noctuidae). Journal Pesticide Science 82: 327–334. [ Links ]
ROSSETTI, M. R.; DEFAGÓ, M. T., CARPINELLA, M. C.; PALACIOS, S. M.; VALLADARES, G. 2008. Actividad biológica de extractos de Meüa azedarach sobre larvas de Spodoptera eridania (Lepidoptera: Noctuidae). Revista Sociedad Entomológica Argentina 67: 115–125. [ Links ]
SAEED, S.; SAYYED, A. H.; AHMAD, I. 2009. Effect of host plants on life–history traits of Spodoptera exigua (Lepidoptera: Noctuidae). Journal Pest Science 83: 165–172. [ Links ]
SCOTT, I. M.; JENSEN, H. R.; PHILOGÉNE, B. J.; ARNASON, J. T. 2008. A review of Piper spp. (Piperaceae) phytochemistry, insecticidal activity and mode of action. Phytochemistry Reviews 7: 65–75. [ Links ]
SENGONCA, C.; LIU, B.; ZHU, Y. J. 2006. Insecticidal activity and antifeedant effect of a new type biocide GCSC–BtA against Plutella sylostella L. (Lep., Plutellidae). Journal Pesticide Science 79: 3–8. [ Links ]
ULRICHS, C.; MEWIS, I.; ADHIKARY, S. 2008. Antifeedant activity and toxicity of leaf extracts from Porteresia coarctata Takeoka and their effects on the physiology of Spodoptera litura (F). Journal of Pesticide Science 81: 79–84. [ Links ]
WAGNER, H.; BLADT, S. 1996. Plant Drug Analysis: A Thin Layer Chromatography Atlas. 2d. Ed. Springer Verlag. New York. 384 p. [ Links ]
WINK, M. 2003. Evolution of secondary metabolites from an ecological and molecular phylogenetic perspective. Phytoche–mistry Reviews 64: 3–19. [ Links ]
YBARRA, M. I.; POPICH, S.; BOKORSKY, S. A.; ASAKAWA, Y.; BARDON, A. 2005. Manoyl oxide diterpenoides from Grindelia scorzonerifolia. Journal Natural Products 68: 554–558. [ Links ]
ZABEL, A.; MANOJLOVIC, B.; RAJKOVIC, S.; STANKOVIC, S.; KOSTIC, M. 2002. Effect of neem of extract of Lymantria dispar L. (Lepidoptera: Lymantriidae) and Leptinotarsa decemlineata Say (Coleoptera:Chrysomelidae). Journal Pesticide Science 75: 19–25. [ Links ]
ZAPATA, N.; BUDIA, F.; VIÑUELA, E.; MEDINA, P. 2009. Anti–feedant and growth inhibitory effects of extracts and drimanes of Drimys winteri sterm bark against Spodoptera littoralis (Lep., Noctuidae). Industrial Crops and Products 30: 119–125. [ Links ]














