Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Chapingo. Serie horticultura
On-line version ISSN 2007-4034Print version ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.18 n.1 Chapingo Jan./Apr. 2012
Fuentes de atracción y preferencia de oviposición de Conotrachelus crataegi Walsh (Coleoptera: Curculionidae) en Crataegus spp. (Rosaceae: Maloideae)
Sources of odor attractive to Conotrachelus crataegi Walsh (Coleoptera: Curculionidae) and its preference to oviposit on Crataegus spp. (Rosaceae: Maloideae)
Manolo Muñiz–Merino1*; J. Cibrián–Tovar1; Raúl Nieto–Ángel2
1 Fitosanidad, Entomología y Acarología, Colegio de Postgraduados Campus Montecillo. km 36.5 Carretera México–Texcoco. Montecillo, Texcoco, Estado de México, C.P. 56230. MÉXICO. Correo electrónico: manolo@colpos.mx (*Autor para correspondencia).
2 Instituto de Horticultura, Departamento de Fitotecnia, Universidad Autónoma Chapingo. km 38.5 Carretera México–Texcoco. Chapingo, Estado de México, C.P. 56230. MÉXICO.
Recibido: 24 de noviembre, 2010.
Aceptado: 30 de noviembre, 2011.
Resumen
El tejocote, Crataegus spp., se cultiva en siete entidades de la República mexicana. Su fruto es afectado por Conotrachelus crataegi, insecto que barrena la pulpa y hueso, ocasionando daños y pérdida de calidad. En este trabajo se evaluaron diferentes partes del hospedero, machos y hembras del curculiónido, y combinaciones de ambos, como fuentes de atracción de adultos. También se estudió la preferencia de las hembras para ovipositar en frutos de ocho accesiones de cinco especies de tejocote. Los resultados de pruebas realizadas en olfatómetros de doble vía indicaron que la mejor fuente de atracción de adultos de ambos sexos fue el fruto (P<0.0001), por lo que sus compuestos volátiles podrían ser utilizados para identificar atrayentes de C. crataegi. La preferencia para oviposición estuvo relacionada directamente con el tamaño de fruto e inversamente con su grado de madurez. Los frutos inmaduros, de tamaño mediano y grande, principalmente de la especie Crataegus mexicana, presentaron las cantidades más altas de oviposturas.
Palabras clave: Atrayentes, oviposturas, picudo del membrillo, tejocote.
Abstract
The hawthorn, Crataegus spp., is grown in seven states in Mexico. Its fruit is affected by Conotrachelus crataegi, an insect that bores into its flesh and stones, causing damage and loss of quality. In this research, we evaluated different parts of the host, male and female quince curculios, and combinations thereof, as potential sources of attraction for adults. We also studied female oviposition preference in eight fruit accessions from five hawthorn species. Results of bioassays in two–way olfactometers indicated that the fruits were the best adult attractant source (P<0.0001), so we believe that attractive volatiles released from them should be tested as source material to identify potential attractant compounds for C. crataegi. Oviposition preference was directly related to fruit size, but inversely related to fruit maturity status. Medium and large–sized immature fruits, mainly belonging to the species Crataegus mexicana, were the most oviposited.
Keywords: Attractants, egg depositions, quince curculio, hawthorn.
INTRODUCCIÓN
El género Crataegus, conocido como tejocote, tiene una amplia variabilidad genética, con 140 especies en todo el mundo (Phipps et al., 2003). Nueve de ellas son endémicas de México (Phipps, 1997) y 13 se distribuyen en al menos 20 de sus entidades (Núñez–Colín et al., 2008a), aunque es probable que existan más (Núñez–Colín et al., 2004). Tal variabilidad confiere al tejocote un gran potencial para diversos usos, entre ellos industrial, alimenticio, hortícola, ecológico, pecuario, ornamental y medicinal (Nieto–Ángel, 2007; Nieto–Ángel et al., 2009), sobresaliendo por su alto contenido de pectina de excelente calidad (Aguirre–Mandujano et al., 2010; Franco–Mora et al., 2010).
Actualmente, el tejocote Crataegus spp. se cultiva a nivel comercial, semicomercial y de traspatio en siete entidades de la República mexicana (Anónimo, 2009). Sin embargo, el rendimiento y calidad de sus frutos son afectados por un curculiónido conocido como barrenador del hueso, cuyas larvas se alimentan de la pulpa y semillas. El Comité Estatal de Sanidad Vegetal de Puebla (Anónimo, 2004), lo señala como una de las principales plagas del tejocote. El insecto se identificó como Conotrachelus crataegi, mediante las claves de Schoof (1942) y Kissinger (1964).
A C. crataegi se le denomina picudo del membrillo, en los Estados Unidos de América, y tiene dos hospederos principales: tejocote y membrillo (Cydonia oblonga Mill.). También se desarrolla en pera (Pyrus communis L.) (Maier, 1990; Beers et al., 2003; Douglas y Cowles, 2011), durazno (Prunus persica L. Batsch) (Slingerland, 1898) y manzana (Malus domestica Borkh. y Malus sp.) (Maier, 1980 y 1990).
Inverna como larva en el suelo, a una profundidad de 5.0–7.7 cm (Douglas y Cowles, 2011). La pupa (10–20 días) se presenta en la primavera. Los adultos emergen entre mayo y julio, después de permanecer 10 o más días en el suelo. Una semana después de emerger, comienzan a copular (Slingerland, 1898); no se conoce su comportamiento de precortejo y de cortejo. Ovipositan entre junio y agosto, en los frutos, colocando los huevecillos individualmente en pequeños agujeros hechos con sus partes bucales. Una vez que éstos eclosionan, 7 a 10 días después, las larvas barrenan el fruto, consumiendo hasta la mitad de la pulpa antes de abandonarlo, entre agosto y octubre, para introducirse en el suelo (Wellhouse, 1922; Hill, 1987; Douglas y Cowles, 2011).
La prevención del ataque del barrenador del hueso a plantas cultivadas y silvestres, requiere un monitoreo oportuno y efectivo de sus poblaciones. El muestreo tradicional de curculiónidos del género Conotrachelus, entre ellos C. crataegi, consiste en sacudir las ramas y capturar a los adultos en una manta que se coloca bajo la copa del árbol (Maier, 1980; González et al., 2002). Este procedimiento resulta impráctico, porque daña los árboles y ocasiona la caída de fruta (Lafleur y Hill, 1987. Una alternativa es la colocación de trampas cebadas con semioquímicos, método que ha funcionado para el monitoreo y control de diversos insectos de importancia agrícola (Metcalf y Metcalf, 1992; García y Osorio, 2000; Osorio–Osorio et al., 2003).
Los semioquímicos son percibidos y discriminados mediante neuronas receptoras de olores, localizadas en sénsulos antenales, capaces de reconocer estructuras moleculares individuales (Bruce y Pickett, 2011). No se conocen en detalle los tipos de estructuras sensoriales y su función en C. crataegi, pero posiblemente son similares a las de C. nenuphar, el cual tiene ocho tipos de sensilas [en forma de cabello (I–VI), de clavija (VII) y campaniforme (VIII)], cuya probable función es la quimiorrecepción (I, II, IV), termorrecepción (I), mecanorrecepción (III, VI), degustación (V) y propiorrecepción (VIII) (Alm y Hall, 1986).
Los compuestos volátiles liberados por el tejocote servirían como atrayentes en el monitoreo y/o control del insecto. Similarmente, el conocimiento de la preferencia de los adultos para oviposición, en relación con la fenología del fruto, sería de utilidad para su manejo integrado. Por lo anterior, la presente investigación se realizó con los objetivos de: 1) evaluar la atracción de los adultos hacia fuentes de olores de su hospedero y de insectos coespecíficos, y 2) cuantificar la frecuencia de oviposición del picudo en frutos de ocho accesiones de Crataegus spp.
MATERIALES Y MÉTODOS
Lugar y periodo de estudio
La investigación se llevó a cabo en las instalaciones del Colegio de Postgraduados, campus Montecillo, localizado en el municipio de Texcoco, Estado de México, México. La identificación del insecto y determinación de características distintivas de cada sexo se realizó en agosto de 2006, y las pruebas de atracción y de oviposición, durante junio–agosto de 2007.
Colecta del material biológico
Los insectos para las pruebas se colectaron en árboles de tejocote localizados en los municipios de Tlalancaleca y San Salvador el Verde, estado de Puebla, 20–35 días antes de su uso, y se mantuvieron en jaulas de acrílico hexagonales (9 L de capacidad) en una cámara de cría, en el Laboratorio de Ecología Química del Colegio de Postgraduados; cada tercer día se les proporcionaron frutos frescos de tejocote y agua destilada. La cámara permaneció a una temperatura de 24 ± 1 °C, humedad relativa de 70 ± 10 % y fotoperiodo de 14:10 h (luz: oscuridad).
Los insectos que se emplearon en el experimento de atracción se separaron por sexo al día siguiente de su colecta y se dejaron sin alimento por 30 h, previo a su uso. Las hembras destinadas a pruebas de oviposición se dejaron junto con los machos durante 10–15 días, después de lo cual se consideró que habían copulado ya que los adultos se aparean una semana después de que emergen del suelo, y enseguida las hembras inician la oviposición (Slingerland, 1898). Cada insecto se utilizó tres veces como máximo, debido a su limitada disponibilidad.
Separación de sexos
Según Schoof (1942), los adultos de C. crataegi se pueden separar por sexo con base en la diferencia de longitud del pico, más largo en hembras. Sin embargo, tal característica es muy variable, por lo que se buscaron otros rasgos morfológicos externos distintivos (Figura 1). Éstos se definieron observando en un microscopio la morfología externa de hembras y machos (separados durante la cópula), cuyo sexo se corroboró al extraer su genitalia. Se determinó que los machos presentan una franja de pubescencia blanca, claramente definida, en el margen anterior del pronoto, con apariencia de V o U invertida (con los brazos dirigidos hacia la parte posterior del pronoto). Sus élitros, al igual que la región esternal del tórax, abdomen y fémures, también tienen pubescencia blanca abundante, la cual contrasta con la de color café. Por el contrario, la pubescencia de las hembras es café, uniforme en todo el cuerpo; la franja anterior del pronoto en forma de V o U es menos perceptible, ya que tiene poca pubescencia blanca; la región ventral del tórax y segmentos abdominales es de color café a café rojizo. Las hembras son más robustas que los machos, pero éstos se mueven con mayor rapidez y agilidad.
Las características descritas, junto con la que señala Schoof (1942), se utilizaron para separar a los insectos por sexo, previo a la realización de las pruebas de atracción. La pubescencia mantuvo las coloraciones mencionadas durante el tiempo que los insectos se usaron en los experimentos.
Material vegetal
El material vegetal se obtuvo de árboles de ocho accesiones de un Banco de Germoplasma de tejocote ex situ e in vivo, libre de picudo, localizado en el Campo Agrícola Experimental de la Universidad Autónoma Chapingo (19° 29' de latitud Norte, 98° 53' de longitud Oeste y altitud de 2,240 m), en Texcoco, Estado de México, México. Las accesiones pertenecen a cinco especies de Crataegus (Cuadro 1) identificadas por Núñez–Colín et al. (2008). En el presente estudio, se clasificaron por su época de maduración de frutos como: tempranas (septiembre–octubre), intermedias (octubre–noviembre) y tardías (noviembre–diciembre). Mayor información sobre las mismas se encuentra en Nieto–Ángel, (2007) y Núñez–Colín etal. (2008).
Pruebas de atracción
Se evaluó la atracción de adultos del picudo hacia ocho fuentes de olores y un testigo sin estímulo (Cuadro 2). Todas las partes vegetales se cortaron de las ramas apicales de la zona media de los árboles (accesión 11), justo antes de la realización de cada prueba. Observaciones previas realizadas en laboratorio y campo, indicaron que los adultos son más activos durante el crepúsculo y las primeras horas de la noche, entre las 20:00 y las 23:00 h, por lo que las pruebas de atracción se establecieron a esa hora.
Las pruebas se realizaron en olfatómetros de doble vía (previamente descritos por Calyecac–Cortero et al., 2006) colocados en posición invertida, los cuales constan de un matraz central de 4 L y dos laterales de 150 ml. En uno de los matraces laterales (matraz tratamiento) se colocó la fuente de olor (25 g de ramas o frutos, 6 g de hojas y/o 15 adultos del sexo correspondiente), mientras que el otro (matraz blanco) se dejó vacío; en el tratamiento testigo, ambos permanecieron vacíos. La posición de los matraces se alternó en cada repetición. Cuando la fuente de olor correspondió a insectos, éstos se colocaron en bolsas de tul, para evitar que se movieran hacia el matraz central. Los olfatómetros se lavaron con jabón libre de fosfatos, agua destilada, alcohol etílico al 96 % y acetona, antes de las pruebas.
En cada repetición se liberaron 15 adultos hembras o machos en el matraz central, cubriendo enseguida la boca del mismo con tela de tul; no se conoció con certeza el estatus sexual de los insectos debido a que se colectaron como adultos. Mediante bombas de pecera se impulsó aire (flujo de 300 ml·min–1) hacia cada matraz lateral, a través de mangueras de plástico; en el punto de entrada de aire a cada matraz, se colocó un cartucho con adsorbente Tenax®, como filtro. El cuarto se mantuvo iluminado con una lámpara de 10 W, cuya intensidad se redujo a una quinta parte de su capacidad con un regulador automático, para simular la luminosidad crepuscular prevaleciente durante las horas de mayor actividad de los adultos. Los olfatómetros se dejaron en las condiciones descritas entre las 20:00 y las 7:00 h del día siguiente, lapso durante el cual se mantuvo en funcionamiento un extractor de aire para evacuar los volátiles del cuarto. Después de este tiempo, se contaron los insectos que eligieron el matraz tratamiento o el blanco; se consideró como elección cuando entraron completamente en alguno de los matraces.
El experimento se estableció en un diseño completamente al azar con dos factores (fuente de atracción y sexo de los adultos a responder) y cuatro repeticiones. Cada repetición se realizó en seis días consecutivos, aleatorizando tres tratamientos por día, de manera que el experimento se completó en un mes. Se registró el porcentaje neto de insectos atraídos hacia cada fuente de olor [(Núm. de insectos que eligieron el matraz tratamiento – Núm. de insectos que eligieron el matraz blanco) x 100 x 15–1], como variable respuesta. Los análisis estadísticos se realizaron con el programa estadístico SAS®, versión 9.1 (SAS Institute Inc., 2004). Los datos se sometieron a un análisis de varianza y comparación de medias múltiple del factor que resultó significativo (P<0.05), previa comprobación de normalidad y homogeneidad de varianzas mediante las pruebas de Shapiro–Wilk y de Bartlett, respectivamente.
Oviposición
Se evaluó la preferencia de hembras adultas para ovipositar en frutos de ocho accesiones de tejocote (66, 83, 86, 48, 11, 12, 6 y 42) provenientes del Banco de Germoplasma, mencionado anteriormente. Los frutos destinados a la evaluación se clasificaron en cuatro clases de tamaño según su diámetro ecuatorial (Cuadro 3).
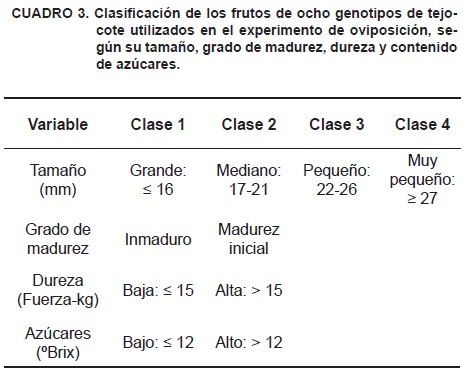
Se colocó un fruto de cada accesión y clase de tamaño (20 frutos en total) dentro de una jaula cilíndrica de malla de alambre, cubierta con tul, en la cual se liberaron 20 hembras de C. crataegi previamente apareadas. Las jaulas con los insectos se mantuvieron durante 40 h (de las 17:00 h del día del establecimiento a las 9:00 h del tercer día) en una cámara de cría a 24 ± 1 °C de temperatura, 80 ± 10 % de humedad relativa y fotoperiodo de 14:10 h (luz: oscuridad). En ese lapso, una hembra oviposita aproximadamente 3.6 huevecillos (Slingerland, 1898), cantidad que se consideró apropiada para una variable ordinal. Transcurrido el tiempo señalado, los frutos se examinaron con un microscopio estereoscópico y se registró el número de huevos presentes en cada uno. Las hembras de C. crataegi depositan un huevo por orificio de ovipostura y no colocan un tapón en el mismo (Slingerland, 1898; Schoof, 1942), lo que generalmente permite observar el huevo sin disección del fruto; por lo anterior, el conteo se realizó con el fruto intacto o raspando superficialmente la pulpa (en los orificios de ovipostura) con una navaja. Adicionalmente, se seleccionaron al azar cuatro repeticiones del experimento; a cada fruto se le midió la resistencia a la penetración y el contenido de azúcares, con un penetrómetro Compact Gauge 200 N® (MECMESIN CE) y un refractómetro Atago 100®, respectivamente. Con dichas mediciones, se formaron las clases de dureza y contenido de azúcares del Cuadro 3.
El experimento se estableció en un diseño completamente al azar con 10 repeticiones. Los datos se analizaron mediante el método de Conover e Iman (1981): el número de huevos por fruto se transformó a rangos y éstos se sometieron a un análisis de varianza. Se realizaron comparaciones de medias de los rangos entre tratamientos y entre clases de las variables: accesión y especie de tejocote, época de maduración, grado de madurez, dureza y contenido de azúcares. Se ejecutó un análisis de correlación de Pearson entre los rangos del número de huevos, diámetro, resistencia a la penetración y contenido de azúcares de los frutos de las cuatro repeticiones seleccionadas.
RESULTADOS Y DISCUSIÓN
Fuentes de atracción
El análisis de varianza mostró efectos significativos de la fuente de volátiles (P<0.0001, GL=8, F=13.03) en el porcentaje de adultos de C. crataegi atraídos. El factor sexo (P=0.7448, GL=1, F=0.07) y la interacción entre sexo y fuente de volátiles (P=0.6989, GL=8, F=0.69), no afectaron a la variable respuesta.
El fruto, tanto solo e intacto, como con hembras, machos u orificios, atrajo la mayor cantidad de insectos de ambos sexos (Cuadro 4); sin embargo, ninguna de las combinaciones superó el nivel de atracción del fruto solo. Los porcentajes de insectos atraídos hacia hojas, ramas, hembras y machos, fueron iguales a los del testigo.
Durante el experimento, hubo tres posibles estímulos sobre C. crataegi: los volátiles liberados por alguna parte del hospedero, compuestos producidos por hembras o machos adultos coespecíficos y la combinación de olores de los insectos con los del fruto de tejocote. Hembras y machos fueron igualmente atraídos hacia cada fuente de olores, como lo mostró el análisis de varianza, lo que sugiere un factor estimulante común para ambos sexos.
De las tres partes del hospedero evaluadas, únicamente los frutos atrajeron más adultos que el testigo, lo cual se explica porque los adultos de C. crataegi se alimentan y ovipositan en ellos (Slingerland, 1898; Douglas y Cowles, 2011). Durante la colecta de insectos para el presente estudio, también se les localizó con mayor frecuencia en los frutos y, en menor proporción, sobre las hojas o ramitas cercanas a éstos. Por lo tanto, es posible que la atracción de C. crataegi hacia los frutos esté relacionada con la búsqueda de alimento o de un lugar de reposo, y, en el caso de las hembras, de un sitio para oviposición. Dado que los insectos se dejaron sin alimento durante 30 h antes de las pruebas, la búsqueda de alimento es la opción más probable.
No existió evidencia de atracción de C. crataegi hacia machos o hembras de su misma especie, pues los porcentajes de adultos (de ambos sexos) que respondieron a estos estímulos, no superaron a los del testigo (Cuadro 4). En muchos casos, el efecto de los semioquímicos aumenta al conjuntar volátiles del insecto con los de su hospedero, como ocurre con la mayoría de las feromonas de agregación en especies de la familia Curculionidae (Landolt, 1997). Sin embargo, la combinación de hembras o machos de C. crataegi con los frutos de tejocote, no aumentó los niveles de atracción de insectos o frutos por separado (Cuadro 4). No obstante, no se descarta la posibilidad de que C. crataegi produzca un compuesto feromonal, ya que el estatus sexual y la edad de los insectos no se pudieron controlar, lo que quizás influyó en los resultados. Por ejemplo, las hembras apareadas del brúquido Callosobruchus subinnotatus (Pic) (Shu et al., 1998), y probablemente también las del picudo del ciruelo Conotrachelus nenuphar (Herbst) (Leskey y Prokopy, 2001), liberan menos feromona que las vírgenes; en contraste, las del picudo del algodonero Anthonomus grandis Boheman, producen más feromona a medida que aumenta su edad (Spurgeon, 2003).
Los resultados del experimento indican que los adultos de C. crataegi son estimulados por compuestos volátiles liberados por los tejocotes, de igual manera que otras especies de curculiónidos, como el picudo del ciruelo (Butkewich et al., 1987; Leskey y Prokopy, 2000 y 2001) y el picudo del nogal, Curculio Caryae (Horn) (Collins et al., 1991), que son atraídos por los olores de sus frutos hospederos. Por lo tanto, es posible que los volátiles de los frutos del tejocote sirvan para identificar compuestos atrayentes de adultos de C. crataegi, que podrían utilizarse en el monitoreo de este insecto.
Preferencia para oviposición
De acuerdo con el análisis de varianza, hubo efectos significativos de la accesión (P<0.0001, GL=7, F=20.82) y especie de Crataegus (P<0.0001, GL=4, F=34.61), así como de la época de maduración (P<0.0001, GL=2, F=49.92), grado de madurez (P<0.0001, GL=1, F=21.06), dureza (P<0.0001, GL=1, F=135.89) y contenido de azúcares de los frutos (P<0.0001, GL=1, F=22.64), sobre el número de huevecillos por fruto, ovipositados por C. crataegi.
La influencia de la accesión (Acc) fue notoria en frutos medianos y grandes, en los que las Acc's 86, 48 y 11 (de Crataegus mexicana) exhibieron el mayor número de oviposturas, y la Acc 66, el más bajo (Cuadro 5). En todas las Acc's, la cantidad de oviposturas aumentó en proporción directa con el tamaño del fruto, a excepción de la Acc 66, en la que disminuyó, y las Acc's 6 y 42, representadas en una sola clase (sus frutos son de ese tamaño aun en su máximo desarrollo). Los frutos medianos y grandes de la accesión 66 iniciaban su maduración al momento de la evaluación, lo cual indica que la oviposición de C. crataegi, en ellos, decreció conforme maduraron; la mayor frecuencia de oviposturas en frutos inmaduros, con respecto a los que se encontraban en madurez inicial (Cuadro 6), y la correlación negativa entre el número de huevos y el contenido de azúcares (Cuadro 7), apoyan esta afirmación.
La especie más ovipositada fue Crataegus mexicana, independientemente del diámetro del fruto. Las otras especies tuvieron igual cantidad de oviposturas en todos los tamaños (Cuadro 5).
Los frutos medianos y grandes de las Acc's intermedias tuvieron más oviposturas que los de las Acc's tempranas, posiblemente debido a que corresponden a C. mexicana (la especie más ovipositada por C. crataegi (Cuadro 5); en frutos de menor tamaño, los niveles de oviposición no difirieron entre las temporadas. Del mismo modo, la frecuencia de oviposición del picudo del ciruelo Conotrachelus nenuphar varía con la época de maduración de los frutos de arándano (Polavarapu et al., 2004).
El número de oviposturas varió en proporción inversa al contenido de azúcares (Cuadros 6 y 7), lo que confirma la preferencia del picudo por frutos inmaduros, posiblemente porque aseguran la supervivencia de su progenie.
En todas las variables, las diferencias en la preferencia de oviposición del picudo se presentaron solamente en frutos medianos y grandes, lo que puede atribuirse a la especie de tejocote, y al tamaño y grado de madurez del fruto. El análisis de correlación reafirma la influencia de los dos últimos factores (Cuadro 7).
Es un hecho que, en frutos inmaduros, el tamaño del fruto define la frecuencia de oviposición del picudo. Por el contrario, en aquellos en proceso de maduración, el grado de madurez parece ser el factor más importante. Así, los resultados sugieren que la especie de tejocote, y el tamaño y grado de madurez del fruto, son los principales factores que determinan la preferencia de oviposición de C. crataegi en Crataegus spp. Sin embargo, es necesario dilucidar si la alta correlación entre la resistencia a la penetración y la cantidad de oviposturas, se debe a la influencia del tamaño y grado de madurez del fruto o a un efecto independiente de su dureza.
Las diferencias en la cantidad de oviposturas entre clases de tamaño, pueden estar relacionadas con la disponibilidad de superficie en el fruto o con la existencia de algún semioquímico. Por ejemplo, varias especies de tefrítidos (Nufio y Papaj, 2004; Arredondo y Díaz–Fleischer, 2006; Edmunds et al., 2010) y algunos curculiónidos, como el picudo del chile Anthonomus eugenii (Addesso et al., 2007), depositan feromonas de marcaje que disuaden o disminuyen la oviposición subsecuente. En otros casos, las heridas de alimentación u oviposición en el fruto inducen la producción de compuestos que atraen a otras hembras (Butkewich et al., 1987), lo que podría favorecer la colocación de un número más alto de huevos en frutos grandes, aun cuando ya estén ovipositados, por contar con mayor superficie libre.
El grado de madurez del fruto afecta de manera diferente la preferencia de oviposición del picudo del tejocote y de la mosca de la manzana Rhagoletis pomonella. Tanto C. crataegi (Maier, 1980) como R. pomonella (White y Elson–Harris, 1992) tienen como hospedero original a Crataegus, y las larvas de ambas especies se desarrollan en el interior de sus frutos. Sin embargo, el principal factor que determina la susceptibilidad del tejocote a la oviposición por R. pomonella es la disminución drástica de la firmeza del fruto, que ocurre cuando éste inicia su maduración (Messina y Jones, 1990). En contraste, el número de oviposturas de C. crataegi fue más alto en frutos inmaduros, de mayor dureza.
La preferencia de C. crataegi por C. mexicana podría deberse a una coadaptación del insecto, ya que ésta es una de las especies más antiguas de Crataegus (Phipps, 1984) y sus frutos son los más grandes en el género (Phipps et al., 2003). Lo anterior representa una desventaja de las accesiones de C. mexicana, principal fuente de material superior para mejoramiento genético del tejocote (Nieto–Ángel et al., 1997; NÚÑEZ–Colín et al., 2004). Puesto que el inicio de la maduración propicia una disminución en los niveles de oviposición del picudo, la precocidad es una característica agronómica esencial, que se debe considerar en los programas de mejoramiento del tejocote.
CONCLUSIONES
El presente estudio permitió determinar que la mejor fuente de atracción de adultos de Conotrachelus crataegi fue el fruto del tejocote, por lo que podría utilizarse para identificar volátiles atrayentes de este insecto.
Asimismo, se encontró que el tamaño y grado de madurez del fruto de tejocote fueron los principales factores que determinaron el nivel de oviposición del picudo, y que las frecuencias de oviposición más altas ocurrieron en frutos inmaduros, de tamaño mediano y grande, de la especie Crataegus mexicana.
LITERATURA CITADA
ADESSO, K. M.; McAUSLANE, H. J.; STANSLY, P. A.; SCHUSTER, D. J. 2007. Host marking by female pepper weevils, Anthonomus eugenii. Entomología Experimentalis et Applicata 125: 269–276. [ Links ]
AGUIRRE–MANDUJANO, E.; NIETO–ÁNGEL, R.; HERNÁNDEZ–RODRÍGUEZ, L.; SÁNCHEZ–GUZMÁN, M.; PÉREZ–ALONSO, C.; CUEVAS–BERNARDINO, J.C. 2010. Caracterización de pectinas de tejocote (Crataegus spp). Universidad Autónoma Chapingo. Chapingo, Estado de México, México. 69 p. [ Links ]
ALM, S. R.; HALL, F. R. 1986. Antennal sensory structures of Conotrachelus nenuphar (Coleoptera: Curculionidae). Annals of the Entomological Society of America 79: 324–333. [ Links ]
ANÓNIMO, 2004. El Cultivo del Tejocote en Puebla. OPF–RE–01 edición 001. Comité Estatal de Sanidad Vegetal de Puebla (CESAVEP). Puebla, México. 25 p. [ Links ]
ANÓNIMO, 2009. Anuario Estadístico de la Producción Agrícola. Sistema de Información y Estadística Agrícola y Pesquera (SIAP), Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA). México. En línea: http://www.siap.gob.mx/aagricola_siap/icultivo/index.jsp [ Links ]
ARREDONDO, J.; DÍAZ–FLEISCHER, F. 2006. Oviposition deterrents for the mediterranean fruit fly, Ceratitis capitata (Diptera: Tephritidae) from fly faeces extracts. Bulletin of Entomological Research 96: 35–42. [ Links ]
BEERS, E. H.; KLAUS, M. W.; HEBHARD, A.; COCKFIELD, F.; ZACK, R.; O'BRIEN, C. W. 2003. Weevils attacking fruit trees in Washington. Proceedings of the 77th Annual Western Orchard Pest and Disease Management Conference. Washington State University. Pullman, Whashington, USA. 35 p. [ Links ]
BRUCE, T. J. A.; PICKETT, J. A. 2011. Perception of plant volatile blends by herbivorous insects–finding the right mix. Phyto–chemistry 72: 1605–1611. [ Links ]
BUTKEWICH, S.; PROKOPY, R. J.; GREEN, T. A. 1987. Discrimination of occupied host fruit by plum curculio females (Coleoptera: Curculionidae). Journal of Chemical Ecology 13(8): 1833–1841. [ Links ]
CALYECAC–CORTERO, H. G; CIBRIÁN–TOVAR, J.; LÓPEZ–COLLADO, J.; GARCÍA–VELAZCO, R. 2006. Emisores de los volátiles de atracción de Trichobaris championi Barber. Agrociencia 40 (5): 655–663. [ Links ]
COLLINS, J. K.; MULDER, F. G.; GRANTHAM, R. A.; REID, W. R.; SMITH, M. W.; EIKENBARY, R. D. 1991. Assessing feeding preference of pecan weevil (Coleoptera: Curculionidae) adults using a hardee olfactometer. Journal of the Kansas Entomological Society 70(3): 181–188. [ Links ]
CONOVER, W. J.; IMAN, R. L. 1981. Rank transformations as a bridge between parametric and nonparametric statistics. The American Statistician 35(3): 124–133. [ Links ]
DOUGLAS, S. M.; COWLES, R. S. 2011. Plant pest handbook, a guide to insects, diseases and other disorders affecting plants. Pear (Pyrus). Quince (Cydonia) The Connecticut Agricultural Experiment Station. Connecticut, USA. En línea: http://www.ct.gov/caes/cwp/view.asp?a=2826&q=378182&caesNav=| [ Links ]
EDMUNDS, A. J.; ALUJA, M.; DÍAZ–FLEISCHER, F.; PATRIAN, B.; HAGMANN, L. 2010. Host marking pheromone (HPM) in the Mexican fruit fly Anastrepha ludens. Chimia (Aarau) 64(1–2): 37–42. [ Links ]
FRANCO–MORA, O.; AGUIRRE–ORTEGA, S.; MORALES–ROSALES, E. J.; GONZÁLEZ–HUERTA, A.; GUTIÉRREZ–RODRÍGUEZ, F. 2010. Caracterización morfológica y bioquímica de frutos de tejocote (Crataegus mexicana DC.) de Lerma y Ocoyoacac, México. CIENCIA Ergo Sum 17(1) 61–66. [ Links ]
GARCÍA, R. M. J.; OSORIO, R. O. 2000. El uso de semioquímicos en el control de plagas de hortalizas. In: Temas Selectos en Fitosanidad y Producción de Hortalizas, pp. 76–82. Bautista, M. N.; Suárez–V, A. D.; Morales–G, O. (eds.) Instituto de Fitosanidad, Colegio de Postgraduados. Estado de México, México. [ Links ]
GONZÁLEZ–GAONA, E.; PADILLA–RAMÍREZ, J. S.; REYES–MURO, L.; PERALES–DE LA CRUZ, M. A.; ESQUIVEL–VILLAGRANA, F. 2002. Guayaba, su Cultivo en México. Libro técnico No. 1. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), Campo Experimental Pabellón. Aguascalientes, México. 182 p. [ Links ]
HILL, D. S. 1987. Agricultural insect pests of temperate regions and their control. Cambrigde University Press. New York, USA. p. 566. [ Links ]
KISSINGER, D. G. 1964. Curculionidae of America North of Mexico, a Key to the Genera. Taxonomic Publications. South Lancaster, Massachusetts, USA. 143 p. [ Links ]
LAFLEUR, G.; HILL, S. B. 1987. Spring migration, within–orchard dispersal, and apple–tree preference of plum curculio (Coleoptera: Curculionidae) in Southern Quebec. Journal of Economic Entomology 80(6): 1173–1187. [ Links ]
LANDOLT, P. J. 1997. Sex attractant and aggregation pheromones of male phytophagous insects. American Entomologist 43: 12–21. [ Links ]
LESKEY, T. C.; PROKOPY, R. J. 2000. Sources of apple odor attractive to adult plum curculios. Journal of Chemical Ecology 26(3): 639–653. [ Links ]
LESKEY, T. C.; PROKOPY, R. J. 2001. Adult plum curculio (Coleoptera: Curculionidae) attraction to fruit and conspecific odors. Ann. Entomol. Soc. Am. 94(2): 275–288. [ Links ]
MAIER, C. 1980. Quince curculio, Conotrachelus crataegi Walsh (Coleoptera: Curculionidae), developing in apple, a new host, in southern New England. Proceedings of the Entomological Society of Washington 82(1): 59.62. [ Links ]
MAIER, C. T. 1990. Native and exotic rosaceous hosts of apple, plum and quince curculio larvae (Coleoptera: Curculionidae) in Northeastern United States. Journal of Economic Entomology 83:1326–1332. [ Links ]
MESSINA, F. J.; JONES, V. P. 1990. Relationship between fruit phenology and infestation by the apple maggot (Diptera: Tephritidae) in Utah. Annals of the Entomological Society of America 83(4): 742–752. [ Links ]
METCALF, R. L.; METCALF, E. R. 1992. Plant Kairomones in Insect Ecology and Control. Chapman & Hall Inc. New York, USA. 177 p. [ Links ]
NIETO–ÁNGEL, R. 2007. Colección, conservación y caracterización del tejocote (Crataegus spp.). En: Frutales nativos, un recurso fitogenético de México. Nieto–Angel, R. (Ed.). Universidad Autónoma Chapingo. Chapingo, Estado de México, México. pp. 25–118. [ Links ]
NIETO–ÁNGEL, R.; ORTÍZ, J.; GONZÁLEZ–ANDRÉS, F; BORYS, M. W. 1997. Endocarp morphology as an aid for discriminating wild and cultivated Mexican hawthorns (Crataegus mexicana Moc & Sessé). Fruits 52: 317–324. [ Links ]
NIETO–ÁNGEL, R.; PÉREZ–ORTEGA, S. A.; NÚÑEZ–COLÍN, C. A.; MARTÍNEZ–SOLÍS, J.; GONZÁLEZ–ANDRÉ, F. 2009. Seed and endocarp traits as markers of the biodiversity of regional sources of germplasm of tejocote (Crataegus spp.) from Central and Southern Mexico. Scientia Horticulturae 121: 166–170. [ Links ]
NUFIO, C. R.; PAPAJ, D. R. 2004. Host–marking behaviour as a quantitative signal of competition in the walnut fly Rhagoletis juglandis. Ecological Entomology 29(3): 336–344. [ Links ]
NÚÑEZ–COLÍN, C. A; NIETO–ÁNGEL, R.; BARRIENTOS–PRIEGO, A. F.; SAHAGÚN–CASTELLANOS, J.; SEGURA, S.; GONZÁLEZ–ANDRÉS, F. 2008. Variability of three regional sources of germoplasm of tejocote (Crataegus spp.) from central and southern Mexico. Genetic Resources and Crop Evolution 55: 1159–1165. [ Links ]
NÚÑEZ–COLÍN, C. A; NIETO–ÁNGEL, R.; BARRIENTOS–PRIEGO, A. F.; SEGURA, S.; SAHAGÚN–CASTELLANOS, J.; GONZÁLEZ–ANDRÉS, F. 2008a. Distribución y caracterización ecoclimática del género Crataegus (Rosaceae subfam. Maloidea) en México. Revista Chapingo serie Horticultura 14: 177–184. [ Links ]
NÚÑEZ–COLÍN, C. A.; PÉREZ–ORTEGA, S. A.; SEGURA, S.; NIETO–ÁNGEL, R.; BARRIENTOS–PRIEGO, A. F. 2004. Variabilidad morfológica del tejocote (Crataegus spp.) en México. Proceedings of the Interamerican Society for Tropical Horticulture 48: 144–148. [ Links ]
OSORIO–OSORIO, R.; CIBRIÁN–TOVAR, J.; LÓPEZ–COLLADO, J.; CORTÉZ–MADRIGAL, H.; CIBRIÁN–TOVAR, D. 2003. Exploración de factores para incrementar la eficiencia de captura de Rhynchophorus palmarum (Coleoptera: Dryophthoridae). Folia Entomologica Mexicana 42(1): 27–36. [ Links ]
PHIPPS, J. B. 1984. Problems of hybridity in the cladistics of Crataegus (Rosaceae). In: Plant Biosystematics. Grant, W. F. (ed.). Acad. Press Can. Toronto, Canadá. pp. 417–438. [ Links ]
PHIPPS, J. B. 1997. Monograph of Northern Mexican Crataegus (Rosaceae, subfam. Maloideae). SIDA Botanical Miscellany 15: 1–94. [ Links ]
PHIPPS, J. B.; O'KENNON, R. J.; LANCE, R. W. 2003. Hawthorns and Medlars. Royal Horticultural Society Plant Collector Guide. Timber Press. Portland, USA. 139 p. [ Links ]
POLAVARAPU, S.; KYRYCZENKO–ROTH, V.; BARRY, J. D. 2004. Phenology and infestation patterns of plum curculio (Coleoptera: Curculionidae) on four highbush blueberry cultivars. Journal of Economic Entomology 97(6): 1899–1905. [ Links ]
SAS Institute Inc. 2004. SAS/STAT® 9.1 User's Guide. Cary, NC: SAS Institute Inc. North Carolina, USA. 5136 p. [ Links ]
SCHOOF, H. F. 1942. The Genus Conotrachelus Dejean (Coleoptera: Curculionidae) in the North Central United States. Contribution from the Entomological Laboratories of the University of Illinois No. 223. The University of Illinois Press Urbana. Illinois, USA. 170 p. [ Links ]
SHU, S.; MBATA, G. N.; RAMASWAMY, S. B. 1998. Female sex pheromone in Callosobruchus subinnotatus (Coleoptera; Bruchidae): production and male response. Annals of the Entomological Society of America 91: 840–844. [ Links ]
SLINGERLAND, M. V. 1898. The quince curculio. Bulletin 148. Cornell University Agricultural Station, Ithaca, N. Y. New York, USA. pp. 693–715. [ Links ]
SPURGEON, D. W. 2003. Age dependence of pheromone production by the boll weevil (Coleoptera: Curculionidae). Environmental Entomology 32(1): 31–38. [ Links ]
WELLHOUSE, W. H. 1922. The Insect Fauna of the Genus Crataegus. Doctor of Philosophy Thesis. Reimpreso de: Cornell University Agricultural Station Memoir 56, Ithaca, N. Y. New York, USA. pp. 1045–1136. [ Links ]
WHITE, I. M.; M. M. ELSON–HARRIS. 1992. Fruit Flies of Economic Significance: their Identification and Bionomics. CAB International and The Australian Centre for International Agricultural Research (ACIAR). Redwood Press LTD. Melkshan, UK. 624 p. [ Links ]














