Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.17 spe 1 Chapingo ene. 2011
Efecto del ácido salicílico sobre biomasa, actividad fotosintética, contenido nutricional y productividad del chile jalapeño
Effect of salicylic acid on biomass, photosynthetic activity, nutriment content and productivity of jalapeño pepper
Esteban Sánchez–Chávez1*; Ricardo Barrera–Tovar2; Ezequiel Muñoz–Márquez1; Damaris Leopoldina Ojeda–Barrios2; Álvaro Anchondo–Nájera3
1 Centro de Investigación en Alimentación y Desarrollo, A.C. Av. 4ta. Sur 3820,Fracc. Vencedores del Desierto. C. P. 33089. Cd. Delicias, Chihuahua. MÉXICO. Tel. (639) 4748400. Correo–e: esteban@ciad.mx (*Autor para correspondencia)
2 Facultad de Ciencias Agrotecnológicas de la Universidad Autónoma de Chihuahua. Campus Universitario I. C. P. 31310. Chihuahua, Chihuahua, MÉXICO.
3 Facultad de Ciencias Agrícolas y Forestales de la Universidad Autónoma de Chihuahua. km 2.5 Carretera Delicias–Rosales. C. P. 33000. Cd. Delicias, Chihuahua. MÉXICO.
Recibido: 10 de octubre, 2010.
Aceptado: 25 de febrero, 2011.
Resumen
El uso de biorreguladores del crecimiento es una práctica para mejorar el rendimiento y calidad de los cultivos. Actualmente se ha considerado al ácido salicílico un biorregulador del crecimiento de las plantas. El objetivo del presente trabajo fue estudiar el efecto de las diferentes dosis de ácido salicílico (AS) sobre la acumulación de biomasa, concentración de pigmentos, actividad fotosintética, contenido nutricional y productividad del chile jalapeño (Capsicum annuum L.) cv. Chichimeca. El AS fue aplicado a la solución nutritiva en dosis crecientes: 0.025 mM, 0.05 mM, 0.1 mM, 0.2 mM, 0.4 mM y 0.8 mM, más un control (sin aplicación de AS). Los resultados indican que la aplicación de AS a las plantas de chile jalapeño cv. Chichimeca aumentaron significativamente la producción de biomasa foliar, en raíz y total, principalmente en las dosis de 0.1 y 0.2 mM. Por otro lado, los tratamientos de 0.1 y 0.2 mM de AS tuvieron un efecto positivo en la producción de frutos. Asimismo, la actividad fotosintética presentó un comportamiento similar a la acumulación de biomasa y producción de frutos por planta, sobresaliendo los tratamientos 0.1 y 0.2 mM de AS con la máxima actividad fotosintética. En relación al análisis nutricional, se observó que a una mayor acumulación de biomasa y producción por planta se presentó una menor acumulación de nutrientes, debido probablemente al efecto de dilución. Se concluye que los tratamientos con 0.1 y 0.2 mM de AS cumplen un papel de biorregulador del crecimiento en chile jalapeño.
Palabras clave: Capsicum annuum, biorregulador, fotosíntesis.
Abstract
The use of bioregulators is a common horticultural practice to improve crop yield and quality. Currently, salicylic acid (SA) is considered a plant growth bioregulator. The objective of the present work was to study the effect of different dosages of SA on biomass accumulation, pigment concentration, photosynthetic activity, nutrient content and productivity of jalapeño pepper (Capsicum annuum L. cv. Chichimeca). Salicylic acid was applied to the nutrient solution at incremental dosages: 0.025 mM, 0.05 mM, 0.1 mM, 0.2 mM, 0.4 mM and 0.8 mM, plus a control without SA. Our results indicate that SA applied to jalapeño pepper plants significantly augmented the production of leaf, root and total biomass, mainly at dosages of 0.1 and 0.2 mM. Treatments with 0.1 and 0.2 mM of SA also increased jalapeño pepper fruit yield per plant. In addition, photosynthetic activity exhibited a trend similar to that of biomass accumulation and yield per plant; plants treated with 0.1 and 0.2 mM of SA showed maximum photosynthetic activity. With regard to nutrient content, it was observed that at higher biomass accumulation and yield per plant there was a smaller nutrient accumulation, due perhaps to the dilution effect. We conclude that treatments with 0,1 and 0,2 mM of SA play a role of biorregulador of the growth in jalapeño pepper.
Key words : Capsicum annuum, biorregulators, photosynthesis.
INTRODUCCIÓN
El chile se ubica entre las ocho hortalizas más cultivadas en el mundo con una producción de alrededor de 27 millones de toneladas (FAOSTAT, 2008), debido a la gran diversidad de usos, los cuales pueden ser: alimenticios, medicinales, industriales y ornamentales. En México esta hortaliza crece a un ritmo de 9.5 a 12 % anual y se siembran entre 140 mil y 170 mil hectareas que producen alrededor de 1.8 millones de toneladas con un valor estimado de 7,404 millones de pesos (SIAP–SAGARPA, 2009). Sin embargo, en los últimos años el incremento en la producción ha sido muy discreto, por lo que en la actualidad se están llevando a cabo numerosas investigaciones para tratar de aumentar la producción de esta hortaliza.
El uso de biorreguladores del crecimiento es una práctica para mejorar el rendimiento y la calidad de los cultivos (Latimer, 1992). Estos compuestos pueden promover el enraizamiento, la floración, el amarre y crecimiento de frutos, la abscisión de hojas y frutos, la senescencia, la regulación de algunos procesos metabólicos y la resistencia de las plantas a estrés por temperatura y agua (Nickell, 1988).
Actualmente, se ha considerado al AS como un biorregulador del crecimiento de las plantas (Larqué–Saavedra y Martín Mex, 2007; Najafian et al., 2009). Entre los efectos que causa el AS en el desarrollo de los vegetales se tiene: inhibición de la germinación o del crecimiento de raíz y coleoptilo, inducción de la floración e inhibición de la misma (Saxena y Rashid, 1980), provoca cierre de estomas y reducción de la transpiración (Larqué–Saavedra, 1978), mantiene turgentes los estomas y pulvinolos (Saeedi et al., 1984) y altera la permeabilidad de los tilacoides (Raskin, 1992).
Hay pocos estudios que indican los efectos de los biorreguladores para mejorar los rendimientos de chile. Nickell (1982) encontró que una anti–auxina (ácido toluiftalámico) extendió el periodo de producción en invernadero de algunas especies vegetales, como tomate, papa y chile, promoviendo el amarre de frutos y el desarrollo del mismo.
Berkowitz y Rabin (1988) reportan que aplicaciones de ácido abscísico a plántulas de chile Bell inmediatamente antes del trasplante, reducen el "shock" del trasplante e incrementan su rendimiento. Csizinszky (1990) reportó que la aplicación de una mezcla de reguladores del crecimiento y nutrientes incrementó el rendimiento y disponibilidad de nutrientes en frutos de chile. Hartz et al. (1995), quienes trataron semillas y hojas de chile con DCPTA (2–(3,4 diclorofenoxi) trietilamina), encontraron que éste no fue efectivo en incrementar el crecimiento vegetativo, el rendimiento y la calidad de frutos. Elsayed (1995) aplicó diversas dosis de Biozyme (Ácido giberélico, Ácido indol acético y Zeatinas) a diferentes cultivares de chile, y encontró que 2 ml de Biozyme por litro de agua incrementaron la altura y peso de las plantas de chile cv. Belmont. Belakbir et al. (1998) encontraron que el Biozyme a la concentración de 20 ppm aplicado en la etapa de floración produjo un incremento significativo en el rendimiento total del chile, pero alrededor del 40 % del fruto fue no comerciable, mientras que el tratamiento con ácido naftaleneacético (ANA) a la concentración de 15 ppm produjo el máximo rendimiento comercial de frutos.
López–Tejeda et al. (1998) aplicaron diferentes dosis de AS al trigo en la etapa de fecundación, y cinco días después encontraron que para la variedad Altar C84 la dosis de 0.01 mM presentó los mejores resultados con incrementos de 900 kg ha–1 en relación al testigo, y en Oasis F86 y Ópata M85 la dosis de 0.1 mM fue la mejor con aumentos de 500 kg ha–1 de diferencia. Por otro lado, Yildirim et al. (2008) aplicaron al follaje AS en melón bajo estrés por salinidad, y encontraron que el AS atenuó el efecto del estrés por salinidad, resultando las aplicaciones foliares de AS en una mayor biomasa foliar y en raíz en relación con las plantas que estaban sujetas al estrés por salinidad, lo cual indica que los tratamientos de AS podrían ayudar a aliviar los efectos negativos de la salinidad sobre el crecimiento del melón.
En general, existe escasa literatura disponible sobre este tema, por lo que el objetivo del presente trabajo fue analizar la influencia que tiene la aplicación de diferentes dosis de AS sobre la acumulación de biomasa en raíz y foliar, actividad fotosintética, contenido nutricional foliar y productividad en el chile jalapeño (Capsicum annuum L.) cv. Chichimeca.
MATERIALES Y MÉTODOS
Manejo del cultivo y diseño experimental
Las semillas de chile jalapeño (Capsicum annuum L.) cv. Chichimeca fueron germinadas en charolas (tamaño de celda 3 x 3 x 10 cm) rellenas con mezcla de peat–mos y vermiculita, y posteriormente se mantuvieron bajo condiciones de invernadero por un periodo de ocho semanas; el 15 de abril de 2009 las plántulas fueron trasplantadas y crecieron en una cámara de cultivo bajo condiciones ambientales controladas en Chihuahua, México, donde el cultivo finalizó en septiembre de 2009. La cámara de cultivo mantuvo las siguientes condiciones ambientales: humedad relativa entre 60 y 80 %, intensidad luminosa: 350 μmol·m–2·s–1, temperatura de 26/20 °C luz/ obscuridad y un fotoperiodo de 16 horas.
En este estudio se utilizó un diseño experimental completamente al azar con siete tratamientos de AS en las dosis de: 0.025 mM, 0.05 mM, 0.1 mM, 0.2 mM, 0.4 mM y 0.8 mM de AS más un control (sin aplicación de AS). Cada tratamiento fue repetido seis veces en macetas individuales. Los tratamientos de AS fueron aplicados en la solución nutritiva cada 15 días a partir del trasplante y hasta la madurez fisiológica de la planta. Las plantas tratadas recibieron una solución nutritiva completa de Hoagland (pH 6.0–6.1) en cada riego y estuvo compuesta de la siguiente forma: 2 mM de KNO3, 4 mM de Ca2NO3·4H2O, 3 mM de K2SO4, 2 mM de CaCl2·2H2O, 2 mM de NaH2PO4·2H2O, 1.5 mM de MgSO4, 5 μM de Fe–EDDHA, 2 μM de MnSO4·H2O, 1 μM de ZnSO4·7H2O, 0.25 μM de CuSO4·5H2O, 0.1 μM de (NH4)6Mo7O2·4H2O y 5 μM de H3BO3. La solución nutritiva fue renovada cada tres días.
Las plantas completas fueron muestreadas en la etapa fenológica de desarrollo completo y madurez del fruto. Las raíces y hojas fueron lavadas tres veces con agua destilada y detergente no iónico al 1 % (Wolf, 1982). Se tomaron hojas extendidas de características homogéneas de la altura media de las plantas y de la parte media del brote cuando las plantas tuvieron un desarrollo completo del fruto. El material vegetal fue utilizado para la determinación del análisis nutricional foliar de los siguientes elementos químicos: N, P, K, Ca, Mg, Mn, Fe, Cu y Zn.
Análisis vegetal
Biomasa en raíz y foliar. La producción de biomasa radical y foliar se obtuvo como un promedio de cada órgano estudiado, con base en materia seca (g).
Producción de frutos por planta. El rendimiento de la planta fue expresado como la media del peso del total de frutos por planta con base en materia seca (g).
Determinación de la actividad fotosintética. La actividad fotosintética de las hojas fue medida cuando la planta alcanzó su madurez fisiológica; para esto se utilizó un medidor portátil LI–COR 6400 (Centritto et al., 2003; Kocal et al., 2008). En cada planta se seleccionó una hoja sana y madura de color verde homogéneo, sin daño por plagas, enfermedad, ni daños mecánicos. Como fuente de luz (350 μmol·m2·s–1 de fotones) fueron utilizadas lámparas de alta intensidad de descarga de vapor de sodio y lámparas fluorescentes como fuente de iluminación. Las mismas usadas para el crecimiento del cultivo experimental. Se utilizó una concentración de 400 jimol por mol de CO2 en la celda de referencia, en tanto que la celda de muestra se mantuvo en alrededor de 380 μmol por ml de CO2. El déficit de presión de vapor del aire de la cámara de muestra fue generalmente menor de 1.5 y la temperatura de bloque que alojó a la hoja fue de 25°C. La actividad fotosintética se expresó como jimol de CO2 m2·s–1.
Determinación del contenido nutricional foliar.
Para la determinación del contenido nutricional se efectuó la metodología implementada en el Laboratorio de Análisis de Suelo, Agua y Planta de la Facultad de Ciencias Agrotecnológicas de la Universidad Autónoma de Chihuahua, mediante las metodologías desarrolladas por Lachica (1973) en la Estación Experimental del Zaidin del Consejo Superior de Investigaciones Científicas de Granada, España.
Análisis estadístico
Todos los datos fueron sometidos a análisis de varianza. Para la diferencia entre medias de los tratamientos se utilizó la prueba de LSD a 95 % (SAS, 1987).
RESULTADOS Y DISCUSIÓN
El ácido salicílico (AS) desempeña un papel importante en regular el crecimiento de las plantas (Fariduddin et al., 2003; Larqué–Saavedra y Martín–Mex, 2007; Najafian et al., 2009). En el presente experimento, las plantas de los tratamientos de 0.1 y 0.2 mM de AS presentaron la máxima producción de biomasa en raíz y foliar, con incrementos de 43 y 36% respectivamente, en relación al tratamiento de 0.05 mM de AS donde se presentaron los valores mínimos (P < 0.01; Figura 1). Sin embargo, en relación a las plantas del testigo, con 0.1 y 0.2 mM de AS, se tuvieron incrementos de 13 y 17 %, respectivamente (Figura 1). Por lo que se puede decir que el AS a las concentraciones indicadas en este trabajo tiene un efecto positivo en mejorar e incrementar la biomasa en raíz, foliar y total en el chile jalapeño cv. Chichimeca.

Actualmente, se ha estudiado el efecto del AS como un biorregulador del crecimiento de las plantas (Larqué–Saavedra et al., 2008). Los mismos autores mencionan que el AS tiene un efecto sobre el aumento en el porte de las plantas y en el área foliar. Se propone que esto se debe al efecto positivo del AS en mejorar la longitud y densidad de raíces. Gutiérrez–Coronado et al. (1998) reportan que el AS influye positivamente sobre el desarrollo en raíz en plantas de soya.
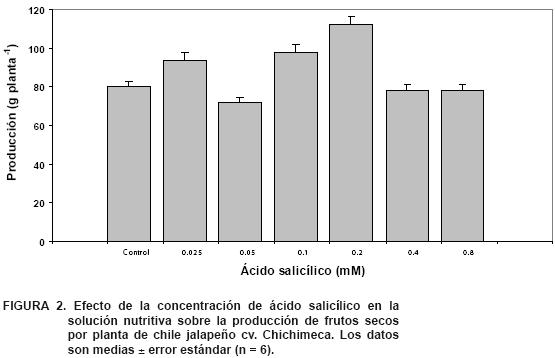
El uso de biorreguladores del crecimiento es una práctica para mejorar el rendimiento y calidad de los cultivos (Latimer, 1992). En el presente trabajo se encontraron diferencias significativas en la producción de frutos (P < 0.01; Figura 2), presentando las dosis de 0.1 y 0.2 mM de AS la mayor producción con incrementos de 34 y 36, % respectivamente, en relación con los menores valores encontrados en el tratamiento de 0.05 mM de AS. Es importante destacar que los tratamientos de 0.1 y 0.2 mM de AS tuvieron un incremento de 17 y 28 %, respectivamente, en relación con el control. De igual manera, López–Tejeda et al. (1998) aplicaron diferentes dosis de AS al trigo en la etapa de fecundación, y cinco días después encontraron que para la variedad Altar C84 la dosis de 0.01 mM presentó los mejores resultados con incrementos de 900 kg·ha–1 en relación al testigo, y en Oasis F86 y Ópata M85 la dosis de 0.1 mM fue la mejor con aumentos de 500 kg·ha–1 de diferencia. Por otro lado, Fariduddin et al. (2003) aplicaron AS en mostaza, de 30 días de germinada, en dosis de 0.1 y 0.01 mM de AS, y obtuvieron que a los 60 días el número de vainas y la producción de semilla aumentó 8.4 y 14 %, respectivamente, en comparación a las plantas del testigo. Larqué–Saavedra y Martín–Mex (2007) mencionan que el AS induce un aumento del rendimiento, sin afectar la calidad de los frutos.
La actividad fotosintética es un proceso fisiológico vital de las plantas que está estrechamente relacionado con la producción agronómica (Azcon–Bieto y Talón, 2001). En este trabajo, la actividad fotosintética presentó un comportamiento muy similar a la producción de biomasa y producción por planta (P< 0.01; Figura 3), sobresaliendo los tratamientos de 0.1 y 0.2 de AS con una máxima actividad fotosintética e incrementos de 59 y 54 %, respectivamente, en relación con el valor mínimo encontrado en el tratamiento de 0.8 mM de AS, el cual fue el más bajo. Asimismo, los tratamientos con 0.1 y 0.2 mM de AS fueron mayores en la actividad fotosintética en comparación con el control, con incrementos de 26 y 17 % (Figura 3).
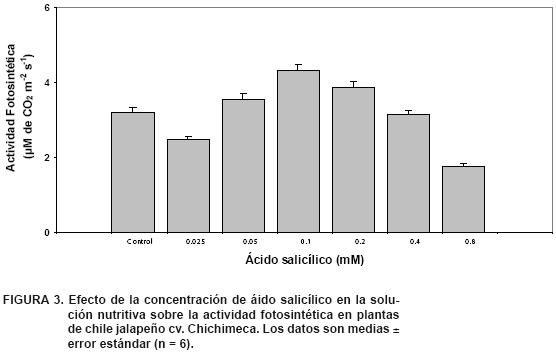
De acuerdo con los resultados obtenidos en este experimento, la concentración de 0.8 mM de AS la actividad fotosintética. Pancheva et al. (1996) encontraron que al aplicar AS en plantas de cebada a dosis de 100 μM a 1 mM de AS se obtuvo la máxima tasa de fotosíntesis. No obstante, Popova et al. (2003) mencionan que la aplicación de 500 μM de AS a plantas de cebada durante 24 horas en la oscuridad seguida de seis horas a la exposición de luz, no causó disminución de la fotosíntesis.
El análisis nutricional foliar es el método más adecuado para diagnosticar el estado nutricional del cultivo y evaluar la disponibilidad de reservas de la planta (Legaz et al., 1995). En esta investigación se encontraron diferencias significativas en el contenido nutricional foliar por efecto de la aplicación de AS, tanto en macronutrientes como en micronutrientes (P < 0.01; Cuadros 1 y 2). En términos generales, se observó que a una mayor acumulación de biomasa y producción de frutos por planta se presentó una menor acumulación de nutrientes. Esto también podría explicarse por el efecto de dilución de nutrientes; es decir, a mayor acumulación de biomasa y producción, se observó una disminución de la concentración de nutrientes minerales (Cuadros 1 y 2).
CONCLUSIONES
La aplicación de ácido salicílico a las plantas de chile jalapeño cv. Chichimeca provocó un aumento significativo en la producción de biomasa foliar, en raíz y de frutos, principalmente en las dosis de 0.1 y 0.2 mM. Asimismo, la actividad fotosintética presentó un comportamiento similar a la acumulación de biomasa, sobresaliendo los tratamientos con 0.1 y 0.2 mM de ácido salicílico con la máxima actividad fotosintética. En relación con el análisis nutricional, se observó que a una mayor producción de biomasa se presentó una menor concentración de nutrientes, debido probablemente al efecto de dilución. Finalmente, podemos concluir que los tratamientos de 0.1 y 0.2 mM de AS desempeñan un papel de biorregulador del crecimiento en chile jalapeño.
AGRADECIMIENTOS
Este trabajo fue financiado por Fondo de Conacyt para apoyo a tesis de licenciatura y tutoría con número de proyecto SNI–Estudiantes–104589, y con el cual se tituló el estudiante de licenciatura Ricardo Barrera Tovar.
LITERATURA CITADA
AZCÓN–BIETO, J.; TALÓN, M. 2001. Fundamentos de Fisiología Vegetal. Editorial McGraw–Hill Interamericana. Primera Edición. Madrid, España. 522 p. [ Links ]
BELAKBIR, A.; RUIZ, J. M.; ROMERO L. 1998. Yield and fruit quality of pepper (Capsicum annum L.) in response to bioregulators. HortScience 33: 85–87. [ Links ]
BERKOWITZ, G. A.; RABIN, J. 1988. Antitranspirant associated abscisic acid effects on the water relations and yield of transplanted bell peppers. Plant Physiol. 86: 329–331. [ Links ]
CENTRITTO, M.; LORETO, F.; CHARTZOULAKIS, K. 2003. The use of low [CO2] to estimate diffusional and non–diffusional limitations of photosynthetic capacity of sal–stressed olive saplings. Plan, Cell and Environment 26: 585–594. [ Links ]
CSIZINSZKY, A. A. 1990. Response of two bell pepper (Capsicum annuum L.) cultivars to foliar and soil applied biostimulants. Soil Crop Sci. Soc. Fla. Proc. 49: 199–203. [ Links ]
ELSAYED, S. F. 1995. Response of 3 sweet pepper cultivars to biozyme under heated plastic house conditions. Scientia Hort. 61: 285–290. [ Links ]
FAOSTAT. 2008. Datos estadísticos sobre producción mundial de alimentos. http://faostat.fao.org/site/339/default.aspx. Fecha de consulta en línea; 21 de enero de 2011. [ Links ]
FARIDUDDIN, Q.; HAYAT, S.; AHMAD, A. 2003. Salicylic acid influences net photosynthetic rate, carboxylation efficiency, nitrate reductase activity, and seed yield in Brassica juncea. Phtosynthetica 41: 281–284. [ Links ]
GUTIÉRREZ–CORONADO, M. A.; TREJO–LÓPEZ, C.; LARQUÉ–SAAVEDRA, A. 1998. Effects of salicylic acid on the growth of roots and shoots in soybeans. Plant Physiol. Biochem. 36: 563–565. [ Links ]
HARTZ, T. K.; KIES, L. J.; BAAMEUR, A.; MAY D. M. 1995. DCPTA ineffective as a production aid on field–grown tomato and pepper. HortScience 30: 78–79. [ Links ]
KOCAL, N.; SONNEWALD, U.; SONNEWALD, S. 2008. Cell wall–bound invertase limits sucrose export and is involved in sympton development and inhibition of photosynthesis during compatible interaction between tomato and Xanthomonas campestris pv vesicatoria. Plant Physiol. 148: 1523–1536. [ Links ]
LACHICA, M.; AGUILAR, A.; YÁNEZ J. 1973. Análisis foliar: métodos utilizados en la Estación Experimental del Zaidin. Anal. Edaf. Agrob. 32: 1033–1047. [ Links ]
LARQUÉ–SAAVEDRA, A. 1978. The antitranspirant effect of acetylsalicyc acid on Phaseolus vulgaris. Physiol. Plant. 43: 126–128. [ Links ]
LARQUÉ–SAAVEDRA, A.; MARTIN–MEX, R. 2007. Effects of salicylic acid on the bioproductivity of plants. pp: 15–23. In: Salicylic Acid: A Plant Hormone. Hayet, S. and Ahmad, A. (eds). Springer Netherlands. [ Links ]
LATIMER, J. G. 1992. Drought, paclobutrazol, abscisic acid, and gibberellic acid as alternatives to daminozide in tomato transplant production. J. Amer. Soc. Hort. Sci. 117: 243–247. [ Links ]
LEGAZ, F.; SERNA, M. D.; PRIMO–MILLO, E. 1995. Mobilization of the reserve N in citrus. Plant and Soil 173: 205–210 [ Links ]
LÓPEZ–TEJEDA, R.; CAMACHO–RODRÍGUEZ, V.; GUTIÉRREZ–CORONADO, M. A. 1998. Aplicación de ácido salicílico para incrementar el rendimiento agronómico en tres variedades de trigo. Terra Latinoamericana 16: 43–48. [ Links ]
NAJAFIAN, S.; KHOSHKHUI, M.; TAVALLALI, V.; SAHARKHIZ, M. J. 2009. Effect of salicylic acid and salinity in thyme (Thymus vulgaris L.): Investigation on changes in gas exchange, water relations, and membrane stabilization and biomass accumulation. Australian J. Basic Applied Sciences 3: 2620–2626. [ Links ]
NICKELL, L. G. 1982. Plant Growth Regulators. Agricultural Uses. Springer–Verlag, Berlin–Heidelberg. 210 p. [ Links ]
NICKELL, L. G. 1988. Plant growth regulator use in cane and sugar production. Update. Sugar J. 50: 7–11. [ Links ]
PANCHEVA, T. V.; POPOVA, L. P. ; UZUNOVA, A. N. 1996. Effects of salicylic acid on growth and photosynthesis in barley plants. J. Plant Physiol. 149: 57–63. [ Links ]
POPOVA, L.; ANANIEVA, E.; HRISTOVA, V.; CHRISTOV, K.; GEORGIEVA, K.; ALEXIEVA, V.; STOINOVA, Z. 2003. Salicylic acid–and methyl jasmonate–induced protection on photosynthesis to paraquat oxidative stress. Bulg. J. Plant Physiol. 21: 133–152. [ Links ]
RASKIN, I. 1992. Role of salicylic acid in plants. Annu. Rev. Plant Physiol. Plant Mol. Biol. 43: 439–463. [ Links ]
SAEEDI, S.; GAILLOCHET, J.; BONMORT, J.; ROBLIN, G. 1984. Effect of salicylic and acetyl salicylic acids on the scotonastic and photonastic leaflet movements of Cassia fasciculata. Plant Physiol. 76: 851–853. [ Links ]
SIAP–SAGARPA. 2009. Servicio de Información Agroalimentaria y Pesquera, Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. Producción Agrícola Cíclicos y Perennes 2009. http://www.siap.gob.mx. Fecha de consulta en línea: 21 de enero de 2011. [ Links ]
SAS. 1987. SAS/STAT Guide for Personal Computers. Version 6; Statistical Analysis System Institute, Inc.: Cary, NC. pp: 1028–1056. [ Links ]
SAXENA, P. K.; RASHID, A. 1980. Differentiation of bud–cells on the protonema of the moss Anoectanquium fhomsonii. Effect of aspirin and salicylic acid. Z. Pflanzenphysiology 99: 187–189. [ Links ]
WOLF, B. 1982. A comprehensive system of leaf analysis and its use for diagnosis crop nutrients status. Comm. Soil Sci. Plant Anal. 13: 1035–1059. [ Links ]
YILDIRIM, E.; TURAN, M.; GUVENC, I. 2008. Effect of foliar salicylic acid applications on growth, chlorophyll, and mineral content of cucumber grown under salt stress. J. Plant Nutr. 31: 593–612. [ Links ]














