Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo. Serie horticultura
versão On-line ISSN 2007-4034versão impressa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.17 no.3 Chapingo Set./Dez. 2011
Cultivo in vitro de pitayo (Stenocereus stellatus [Pfeiffer] Riccobono)
In vitro culture of pitayo (Stenocereus stellatus [Pfeiffer] Riccobono)
Ylvi María Martínez Villegas1; María Andrade Rodríguez1*; Ángel Villegas Monter2; Irán Alia Tejacal1; Oscar Gabriel Villegas Torres1; Víctor López Martínez
1 Facultad de Ciencias Agropecuarias, Universidad Autónoma del Estado de Morelos. Av. Universidad Núm. 1001. C. P. 62209. Chamilpa, Cuernavaca, Morelos. MÉXICO.
2 Programa de Fruticultura, Colegio de Postgraduados Campus Montecillo. km 36.5 Carretera México–Texcoco. C. P. 56230, Montecillo, Estado de México. Correo–e: andradem65@hotmail.com (*Autor para correspondencia).
Recibido: 24 de marzo, 2011.
Aceptado: 8 de septiembre, 2011.
Resumen
El pitayo (Stenocereus stellatus) es una cactácea nativa de México, apreciada por sus frutos, los cuales tienen características organolépticas únicas. Su propagación es por esquejes tomados de plantas adultas, generalmente silvestres, causando deforestación de zonas naturales. El objetivo fue definir el tipo y la dosis de citocininas así como la concentración de sacarosa que permita obtener mayor número de plantas de pitayo in vitro. Se usaron semillas de frutos maduros de las cuales se obtuvieron plántulas para iniciar el incremento de plantas. Para la multiplicación de brotes se utilizaron plántulas de 2 a 3 cm de altura divididas en secciones de 1 cm, el medio fue MS con 3 % de sacarosa; se evaluaron tres citocininas (kinetina, 6–benciladenina, y 2–isopentiladenina) en cinco concentraciones (2.2, 4.4, 8.8, 17.6 y 35.2 µM). Para el crecimiento de brotes se usó medio MS con sacarosa (1, 2, 3, 4 y 5 %). En la aclimatación se evaluó el efecto de la concentración de sacarosa usada para el crecimiento de los brotes in vitro. Se observó que la concentración de 17.6 µM de 6–benciladenina ocasionó formación de brotes en todos los explantes, los cuales tuvieron ocho brotes por explante. Los brotes desarrollaron la mayor altura cuando fueron cultivados en 3 y 4 % de sacarosa. En aclimatación sobrevivieron más del 92 % de las plantas trasplantadas a sustrato.
Palabras clave: Cactaceae, citocininas, cultivo de tejidos, multiplicación de plantas, pitaya.
Abstract
The pitayo (Stenocereus stellatus) is a cactus native to Mexico that is prized for its fruits, which have unique organoleptic characteristics. It is propagated by cuttings taken from mature, usually wild plants, causing deforestation of natural areas. The objective of this study was to identify the optimum ctyokinin type and dose, plus sucrose concentration, to obtain a greater number of pitayo plants in vitro. Seeds from ripe fruits were used to obtain seedlings to initiate plant growth. For shoot multiplication, seedlings measuring 2 to 3 cm in height and divided into 1–cm sections were used. MS medium with 3 % sucrose was used. Three cytokinins (kinetin, 6–benzyladenine, and 2–isopentenyladenine) at five concentrations (2.2, 4.4, 8.8, 17.6 and 35.2 µM) were evaluated. For shoot growth, MS medium with sucrose (1, 2, 3, 4 and 5 %) was used. In plant acclimatization, the effect of the sucrose concentration used for in vitro shoot growth was assessed. It was found that the concentration of 17.6 µM 6–benzyladenine caused shoot formation in all explants, with eight shoots per explant. The shoots achieved the greatest height when grown in 3 and 4 % sucrose. Over 92 % of the plants transplanted to substrate survived acclimatization.
Key words: Cactaceae, cytokinins, tissue culture, plant multiplication, pitayo.
INTRODUCCIÓN
El pitayo (Stenocereus stellatus) es una especie nativa de México (Bravo–Hollis, 1978); muestra amplia variación morfológica y tiene usos múltiples, principalmente para consumo de fruto, además del aprovechamiento de los tallos para cercas vivas, control de erosión y como combustible (Luna y Aguirre, 2001; Luna et al., 2001). Los frutos generalmente son consumidos como fruta de mesa o para elaborar agua fresca, helado, gelatina, mermelada y licores (Martínez–Cárdenas et al., 2007). La presencia de fenoles en el fruto y su alta actividad antioxidante hacen de este fruto una fuente importante de productos antioxidantes para el humano (Beltrán–Orozco et al., 2009). Esquivel (2004) indica que la cáscara de la pitaya puede ser fuente de colorantes naturales.
La propagación del pitayo se realiza por métodos asexuales, mediante esquejes tomados de plantas adultas, las cuales deben tener las características deseadas por el productor y estar libres de plagas y enfermedades; por lo general, los esquejes son tomados de plantas madres silvestres, causando deforestación de zonas naturales (Mercado y Granados, 2002). Las diversas especies de pitayo se encuentran en forma silvestre desde el norte hasta el sur de México. En la región de la Mixteca Baja, en los estados de Puebla y Oaxaca, se encuentran tres especies de pitayo; la principal es S. griseus ("pitaya de mayo"), seguida por S. stellatus ("pitaya agria") y S. pruinosus ("cuapetla") (Bravo–Hollis, 1978). En forma cultivada se le localiza en dos grandes regiones; la principal se ubica en el centro del país en los estados de Querétaro, Guanajuato, Michoacán y Jalisco; la segunda región productora está en la Mixteca Baja, en los estados de Oaxaca y Puebla (Corrales–García et al., 2003). Godínez–Álvarez et al. (2008) y Álvarez–Aguirre y Montaña (1997) identificaron, bajo condiciones naturales, que las plantas de pitayo se reproducen en forma asexual, probablemente debido a la baja germinación de las semillas. Con fines de cultivo comercial se recomienda utilizar tallos de 0.5 m de longitud, que surgen del eje principal, a los cuales se les corta la parte apical y son plantados en posición vertical (López et al., 2000).
Respecto al cultivo in vitro de plantas cactáceas, Ault y Blackmon (1987) propagaron in vitro Ferocactus acanthodes usando explantes apicales provenientes de semillas germinadas in vitro; la proliferación de los brotes axilares ocurrió en el medio Murashige y Skoog (1962) suplementado con 46.5 µM de kinetina y 5.4 µM de ANA.
Martínez–Vázquez y Rubluo (1989) lograron el establecimiento in vitro de Mammillaria san–angelensis mediante la germinación de semillas; las plántulas obtenidas se disectaron para usarse como explantes, y la brotación se obtuvo con 1.0 mg·L–1 de BA y 0.01 mg·L–1 de ANA. Por su parte, Infante (1992) germinó semillas de Mediocactus coccineus en medio MS en condiciones asépticas para su utilización como inóculo, y obtuvo brotes de la parte apical de las plántulas con el uso de 4.4 µM de BA y 0.27 µM de ANA.
Martínez–Cárdenas et al. (2007) sembraron pitayo de mayo in vitro, y a partir de epicótilos cultivados en medio Murashige y Skoog (1962), sólo o con ANA, AIA, ANA–BA o AIA–BA (0.1 mg·L–1), obtuvieron de dos a cuatro brotes por epicótilo al usar las dos auxinas en combinación con BA. Las plantas generadas en medio con AIA y AIA–BA tuvieron la mejor sobrevivencia y crecimiento en condiciones de suelo en cámara de crecimiento (30 °C y 16 h luz), pero al pasarlas a invernadero todas murieron.
Los productores de pitayo enfrentan dos problemas: el primero es la dificultad de encontrar material vegetativo de la especie con la calidad deseada (libre de plagas y enfermedades y con las características que requiere el productor); el segundo es reunir la cantidad de material vegetativo necesario para establecer la huerta (Mercado y Granados, 2002). Estos problemas podrían solucionarse en parte con la utilización de protocolos de cultivo in vitro, ya que con la multiplicación del pitayo mediante esta técnica se tiene la posibilidad de hacer la propagación masiva de la especie con fines comerciales y así cubrir la demanda que existe por parte de los productores al ofrecer plantas, esquejes y material vegetativo de alta calidad y libre de plagas y enfermedades. Con base en lo anterior, el objetivo fue definir el tipo y la dosis de citocininas así como la concentración de sacarosa que permita obtener mayor número de plantas de pitayo in vitro.
MATERIALES Y MÉTODOS
La investigación se realizó en las instalaciones del Laboratorio de Biotecnología Vegetal del Centro de Investigación en Biotecnología de la Universidad Autónoma del Estado de Morelos, en Cuernavaca, Morelos, y en el Laboratorio de Cultivo in vitro de la Especialidad de Fruticultura en el Colegio de Postgraduados, en Montecillo, Estado de México.
Material vegetal
Se colectaron y utilizaron frutos maduros de Stenocereus stellatus, provenientes de plantas seleccionadas por no presentar problemas fitosanitarios y por tener características de calidad del fruto deseables por el consumidor (color rojo intenso, dulzura de 17° Brix, baja acidez, etc.). Las semillas fueron extraídas de la siguiente manera: se cortaron los frutos por la mitad, y con una cuchara se extrajo la pulpa con las semillas; ésta se colocó en un colador de malla fina y se puso bajo el chorro de agua de la llave; se realizaron varios lavados hasta eliminar la pulpa por completo (Figuras 1a, 1b, 1c). Las semillas limpias se colocaron sobre papel estraza para su secado a temperatura ambiente; una vez secas, se colocaron en frascos de vidrio con tapa para su uso posterior.
Establecimiento del cultivo aséptico
Para la desinfestación de las semillas se realizó sólo un tratamiento que consistió en aplicar hipoclorito de sodio en tres concentraciones secuenciadas, adicionando cinco gotas (0.5 mL) de Tween 20 por cada 100 mL de solución desinfestante: la primera concentración de NaOCl fue 1.2 %, en la cual las semillas estuvieron sumergidas durante cinco minutos y posteriormente la solución se eliminó dejando sólo las semillas; la segunda concentración fue 0.6 %, aplicada durante 10 minutos; la tercera concentración fue 0.3 % aplicada por cinco minutos; posteriormente se efectuaron cinco enjuagues con agua destilada estéril; lo anterior se hizo para asegurar la asepsia de todas las semillas; finalmente se procedió a la siembra.
El medio de cultivo utilizado fue el MS (Murashige y Skoog, 1962), suplementado con 100 mg·L–1 de mio–inositol, 0.4 mg·L–1 de tiamina–HCl, 2 % de sacarosa y 0.65 % de agar; el pH se ajustó a 5.7. Se sirvieron volúmenes de 20 ml de medio en cada frasco de cultivo. La esterilización del medio fue durante 20 minutos a 120 °C y 15 lb·pulg–2 de presión. En la campana de flujo laminar se sembraron 20 semillas por frasco, los cuales fueron colocados en un cuarto de incubación, donde permanecieron durante ocho semanas. En esta fase no se hizo evaluación de tratamientos, ya que sólo se usó un método de desinfestación.
Las plántulas obtenidas fueron usadas para tomar los explantes. Se efectuaron tres experimentos: multiplicación de brotes, crecimiento de brotes y aclimatación, mismos que se describen a continuación.
Multiplicación de brotes
El medio de cultivo empleado fue el de Murashige y Skoog (1962), suplementado con 100 mg·L–1 de mio–inositol, 0.4 mg·L–1 de tiamina–HCl, 2.2 µM de ácido 3–indolbutírico y 3 % de sacarosa; se usó 0.7 % de agar. Se probó el efecto de los tratamientos, los cuales se formaron con las combinaciones de tres tipos de citocinina: kinetina (Kn), 6–benciladenina (BA), y 2–isopentiladenina (2–iP), las tres de la marca Sigma®, con cinco concentraciones (2.2, 4.4, 8.8, 17.6 y 35.2 µM). El pH se ajustó a 5.7 y se sirvieron volúmenes de 20 ml en cada frasco de cultivo; el medio fue esterilizado durante 20 minutos a 120 °C y 15 lb·pulg–2 de presión.
Como explantes se utilizaron plántulas de 2 a 3 cm de altura (Figura 1d); se sacaron del frasco de cultivo y se les eliminó la raíz y el ápice del brote; se hicieron cortes transversales para obtener secciones de 1 cm de largo, mismas que fueron cortadas longitudinalmente, obteniendo secciones de medio tallo (Figuras 1e y 1f); de cada plántula se obtuvieron de cuatro a seis explantes que fueron establecidos en los frascos de cultivo. Los frascos con los explantes fueron colocados en un cuarto de incubación, en donde permanecieron durante ocho semanas. Las condiciones de incubación fueron las siguientes: temperatura de 25 ± 2 °C, con un fotoperiodo de 16 h luz con intensidad luminosa de 29 µE·m–2·s–1.
El experimento fue conducido en un diseño experimental completamente al azar para estudiar 15 tratamientos, obtenidos de la combinación de tres tipos de citocinina (Kn, BA y 2–iP) y cinco concentraciones de cada una de ellas (2.2, 4.4, 8.8, 17.6 y 35.2 µM): se establecieron tres repeticiones por tratamiento y cuatro explantes por unidad experimental.
Se evaluaron las variables días a inicio de brotación (se contaron los días transcurridos desde el establecimiento del experimento hasta la aparición de brotes). A las ocho semanas de iniciado el experimento, en cada unidad experimental se registró: número de explantes con brotes, se calculó el porcentaje de explantes que formaron brotes dividiendo explantes con brotes entre explantes totales multiplicado por 100; número de brotes por explante, se contó el número de brotes formados en cada explante; tamaño de brotes, se midió con papel milimétrico el cual fue colocado debajo de una caja de petri esterilizada.
Los datos obtenidos en porcentaje fueron transformados mediante la fórmula: Y=arcoseno √x/100. Con los datos se hicieron análisis de varianza y pruebas de comparación de medias por el método de Tukey (P<0.05), con el programa estadístico SAS (SAS, 1998).
Crecimiento de brotes
El medio de cultivo utilizado fue el de Murashige y Skoog (1962), suplementado con 100 mg·L–1 de mio–inositol, 0.4 mg·L–1 de tiamina–HCl, 0.01 mg·L–1 de BA y cinco concentraciones de sacarosa (1, 2, 3, 4 y 5 %). Se usó 0.7 % de agar como agente gelificante; el pH se ajustó a 5.7. Se sirvieron volúmenes de 20 mL por frasco de cultivo y el medio se esterilizó durante 20 minutos a 120 °C y 15 lb·pulg–2 de presión.
Los brotes generados en cada uno de los explantes del experimento referido anteriormente, se cortaron desde la base y fueron establecidos en el medio de cultivo para promover su crecimiento. Se colocaron cuatro brotes por frasco de cultivo, posteriormente fueron colocados en un cuarto de incubación, donde permanecieron durante ocho semanas. Las condiciones de incubación fueron 25 ± 2 °C de temperatura, fotoperiodo de 16 h luz con intensidad luminosa de 29 µE·m–2·s–1.
Se usó un diseño experimental completamente al azar para estudiar cinco tratamientos de sacarosa (1, 2, 3, 4 y 5 %); se establecieron 10 repeticiones por tratamiento; la unidad experimental fue un frasco con cuatro brotes cada uno.
Ocho semanas después del establecimiento del experimento se evaluó la altura y el diámetro de los brotes, usando un vernier digital. Se hicieron análisis de varianza y prueba de comparación de medias (Tukey, P<0.05), con el programa estadístico SAS (SAS, 1998).
Aclimatación
Todas las plantas obtenidas del experimento anterior se sacaron de los frascos de cultivo, se lavaron con agua de la llave hasta eliminar por completo el medio de cultivo en las raíces y se establecieron en charolas de 200 cavidades que contenían una mezcla de sustrato preparado a base de tepojal (sustrato de origen mineral) y peat–moss (1:1), mojado a capacidad de campo.
El trasplante se hizo considerando el tratamiento de sacarosa en el cual estuvieron en el experimento anterior. Las plantas se cubrieron con domo transparente durante una semana para favorecer su aclimatación, ya que el domo permite que se genere un ambiente de humedad relativa alta; transcurrido este tiempo, se retiró el domo y se aplicó riego. Los riegos posteriores se aplicaron una vez por semana o bien cada vez que el sustrato se encontraba con un 65 % de humedad aprovechable. Una semana después de retirar el domo, se regó con fertilizante (peter's 20–20–20), aplicando 1 g por litro de agua.
Se usó un diseño experimental completamente al azar para estudiar el efecto de cinco tratamientos de sacarosa (1, 2, 3, 4 y 5 %) usados en el experimento anterior para promover el crecimiento de las plantas. Se tuvieron 10 repeticiones por tratamiento; la unidad experimental consistió de cuatro plantas cada una.
Cuatro semanas después de iniciado el experimento, se evaluó el porcentaje de sobrevivencia, variable que fue transformada mediante la fórmula: Y=arcoseno √x/100, para proceder a hacer el análisis de varianza y prueba de comparación de medias por el método de (Tukey P<0.05), con el programa estadístico SAS (SAS, 1998).
RESULTADOS Y DISCUSIÓN
Establecimiento del cultivo aséptico
La asepsia de las semillas fue de 80 %; la germinación ocurrió entre los 8 y 12 días después de la siembra, obteniendo 24 % de germinación. El bajo porcentaje de germinación obtenido podría explicarse por la acción de algún mecanismo de latencia, pues no se había eliminado el mucílago que protege a las semillas, en el cual muy probablemente existen inhibidores de la germinación. En estudios anteriores, se ha observado que la eliminación del mucílago de las semillas permite obtener germinación del 100 % (datos no publicados).
Multiplicación de brotes
En la mayoría de los explantes, la brotación se apreció como pequeñas protuberancias en las areolas presentes en las secciones de tallos; los brotes comenzaron a observarse a partir de los 11 días del establecimiento del experimento.
El inicio de brotación fue afectado de manera significativa por los tratamientos aplicados para la multiplicación de brotes (P<0.05), de tal manera que los explantes cultivados en el medio con 2.2 µM de BA, 2.2, 17.6 y 35.2 µM de 2–iP tardaron más tiempo en iniciar la formación de brotes (16 y 18 días) en comparación con aquéllos que fueron cultivados en el medio con 4.4, 8.8, 17.6 µM de BA y 8.8 µM de 2–iP que tardaron 11 y 12 días en mostrar brotación (Cuadro 1). Después de cuatro semanas, los explantes cultivados en los diferentes tratamientos hormonales mostraron clara diferenciación de brotes, algunos de los cuales ya mostraban presencia de espinas (Figura 1g).
Con respecto a los explantes con brotes, no hubo efecto de los tratamientos hormonales. Todos los explantes (100 %) formaron brotes en diez de los quince tratamientos, dentro de los cuales estuvieron los cinco medios que contenían BA. Aunque sin diferencias estadísticas, los medios de cultivo que indujeron menos brotación en los explantes fueron aquéllos suplementados con 2.2 y 4.4 µM de kinetina y 2.2 µM de 2–iP (Cuadro 1).
En cuanto a brotes por explante, el efecto de los tratamientos con citocininas fue significativo (P<0.05). Los medios de cultivo en los que se registró mayor número de brotes (5.2 a 8) fueron los que contenían 17.6 y 35.2 µM de BA, así como el 17.6 µM de 2–iP. En contraste, la menor cantidad de brotes por explante se obtuvo cuando fueron cultivados en cualquiera de las concentraciones de Kn, 2.2, 4.4 µM de BA, 2.2, 4.4 y 8.8 µM de 2–iP. Los resultados de brotes por explante concuerdan con lo obtenido por Martínez–Vázquez y Rubluo (1989), Infante (1992) y Mohamed–Yansseen (1995), quienes obtuvieron los porcentajes mayores de formación de brotes al utilizar BA y 2–iP en combinación con bajos niveles de auxinas para diferentes especies de cactáceas. A diferencia de lo obtenido en esta investigación, Ault y Blackmon (1987), Ortiz–Montiel y Alcántara (1997) reportan los mejores porcentajes de brotación al utilizar kinetina para Ferocactus acanthodes y Lophophora williamsii, respectivamente.
Clayton et al. (1990) mencionan que la utilización de citocininas para la propagación de cactáceas ha sido ampliamente manejada a diferentes rangos de concentración, así como en varias combinaciones, y que la respuesta morfogenética depende de factores biológicos (especie, tipo y tamaño de explante, edad del explante, nivel de concentración endógena de la hormona, forma de vida, etc.) y de factores ambientales (composición del medio de cultivo, número de subcultivos, tipo y concentración de regulador de crecimiento, tiempo y condiciones de incubación). De igual forma, Chávez et al. (2001) señalan que los niveles de citocinina y auxina requeridos deben ser probados experimentalmente para cada especie; a este respecto, George y Sherrington (1984) señalan que en la etapa de multiplicación se suelen utilizar combinaciones de citocininas y auxinas, aunque en algunos casos puede ser mejor el uso de citocininas solas.
Con relación a la altura de los brotes, se observó efecto significativo (P<0.05) de los tratamientos con citocininas. Los brotes más altos (5.5 mm) se obtuvieron con 4.4 µM de 2–iP; en contraste, los brotes más pequeños correspondieron a los formados en el medio de cultivo con 8.8 y 35.2 µM de Kn, mismos que fueron estadísticamente iguales a los de 35.2 µM de BA, 2.2 y 35.2 µM de 2–iP (Cuadro 1). Es probable que los resultados obtenidos hayan sido afectados por la estrecha relación que existe entre el número de brotes generados y la altura de éstos, ya que si un explante origina menor número de brotes es casi seguro que éstos serán de mejor calidad (mayor altura, diámetro y consistencia) en comparación con un explante que utiliza más cantidad de energía y nutrientes en formar mayor cantidad de brotes, aunque éstos sean de tamaño menor; esto fue lo que ocurrió cuando se usaron 4.4 µM de 2–iP, ya que se obtuvo la mayor altura, pero sólo se generaron 1.5 brotes por explante.
Crecimiento de brotes
La altura de los brotes fue afectada de manera significativa (P<0.05) por la concentración de sacarosa. Las plantas cultivadas en el medio con 3 % de sacarosa mostraron altura mayor, seguidas por aquellas cultivadas con 4 % del carbohidrato (Figura 1h); las concentraciones que originaron menor crecimiento de brotes fueron sacarosa al 5 y 2 % (Cuadro 2).
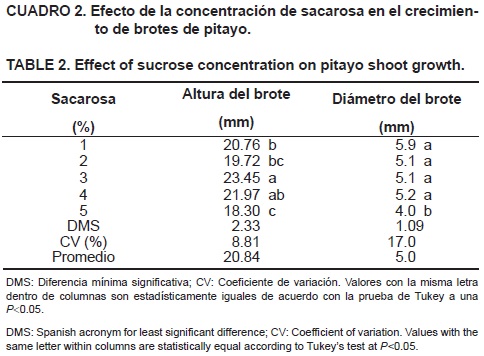
En cuanto al diámetro de los brotes, los valores más altos fueron de 4.9 a 5.9 mm obtenidos con 1, 2, 3, y 4 % de sacarosa; el medio suplementado con sacarosa al 5 % mostró los brotes con menor diámetro (Cuadro 2). Esta respuesta puede ser explicada por el efecto inductor de este carbohidrato a bajas concentraciones, lo que resulta en un potencial osmótico menos negativo en el medio, estimulando la división y el alargamiento celular por mayor absorción de agua y nutrientes del medio de cultivo; aunque con el aumento de la concentración de sacarosa en el medio de cultivo se produce mayor acumulación de masa seca en los brotes formados (Múgica y Mogollón, 2004).
Otro aspecto que es importante mencionar es que al momento de realizar el trasplante a suelo, las plantas provenientes del medio con 5 % de sacarosa presentaron tejido flácido y de color verde oscuro (signos de estrés hídrico) en contraste con las demás plantas que presentaban consistencia firme y color verde claro. Esto puede ser atribuido al potencial osmótico del medio de cultivo, ya que la concentración elevada de sacarosa hizo que el medio se volviera hiperosmótico, lo que provocó que los brotes no pudieran absorber más agua y nutrientes del medio, por lo que los brotes fueron más pequeños. Los resultados obtenidos concuerdan con lo reportado por Sánchez–Morán y Pérez– Molphe–Balch (2007), quienes promovieron el crecimiento de brotes de Browningia candelaria al cultivarlos en medio MS (1962) con 30 g·L–1 de sacarosa y 2 g·L–1de carbón activado durante 30 a 40 días; sin embargo, no reportan cuánto crecieron los brotes.
Aclimatación
Las plantas trasplantadas respondieron exitosamente al proceso de aclimatación (Figura 1i); se observó mayor porcentaje de sobrevivencia y mejor crecimiento cuando las plantas provenían de medio de cultivo con 1 a 3 % de sacarosa (Cuadro 3); en cambio cuando provenían del medio con 4 y 5 % se tuvieron pérdidas de 7.5 y 10 %, respectivamente. En general, se tuvieron buenos porcentajes de sobrevivencia, similares a los obtenidos por Sánchez–Morán y Pérez– Molphe–Balch (2007), quienes obtuvieron 86 % de aclimatación de plantas de Browningia candelaria.

CONCLUSIONES
Con base en las condiciones de investigación, factores y niveles de estudio, se concluye que el mayor número de brotes se obtuvo con 17.6 µM de 6–benciladenina; el crecimiento de los brotes fue mejor al usar 3 y 4 % de sacarosa en el medio de cultivo, mientras que la aclimatación fue mejor cuando las plantas provenían de cultivo con 1 a 3 % de sacarosa.
AGRADECIMIENTOS
El segundo autor agradece el apoyo del SNI (34643) y de PROMEP por el financiamiento brindado a través del Cuerpo Académico Producción Agrícola UAEMOR–CA–74.
LITERATURA CITADA
ÁLVAREZ–AGUIRRE, M. G.; MONTAÑA, C. 1997. Germinación y supervivencia de cinco especies de cactáceas del Valle de Tehuacán: implicaciones para su conservación. Acta Botánica Mexicana 40: 43–58. [ Links ]
AULT, J. R.; BLACKMON, W. J. 1987. In vitro propagation of Ferocactus acanthodes (Cactaceae). HortScience 22: 126–127. [ Links ]
BELTRÁN–OROZCO, M. C.; OLIVA–COBA, T. G.; GALLARDO–VELÁZQUEZ, T.; OSORIO–REVILLA, G. 2009. Ascorbic acid, phenolic content and antioxidant capacity of red, cherry, yellow and White type of Pitaya cactus fruit (Stenocereus stellatus Riccobono). Agrociencia 43: 153–162. [ Links ]
BRAVO–HOLLIS, H. 1978. Las Cactáceas de México. Vol. 1. Universidad Nacional Autónoma de México. México, D.F. 743 p. [ Links ]
CLAYTON, P.; HUBSTENBERGER, J.; PHILLIPS, G. 1990. Micropropagation of members of the Cactaceae subtribe Cactinae. Journal American Society Horticultural Science 115: 337–343. [ Links ]
CHÁVEZ, V.; MATA, M.; MOEBIUS, K.; MONROY, A. 2001. Micropropagation of Turbinicarpus laui Glass et Foster, an endemic and endangered species. In vitro Cell Developmental Biology Plant 37: 400–404. [ Links ]
CORRALES–GARCÍA, J.; FLORES, V. C. A.; GÓMEZ, C. M. A.; MERÁZ, A. M. R.; RODRÍGUEZ, C. A.; SCHWENTESIUS, R. R. 2003. Pitayas y Pitahayas, producción, postcosecha, industrialización y comercialización. CIESTAAM. Universidad Autónoma Chapingo. México. 173. [ Links ]
ESQUIVEL, P. 2004. Los frutos de las cactáceas y su potencial como materia prima. Agronomía Mesoamericana 15: 215–219. [ Links ]
GEORGE, E.; SHERRINGTON, P. 1984. Plant propagation by tissue culture. Handbook and directory of comercial laboratorios. Eastern Press. Inglaterra. 709 p. [ Links ]
GODÍNEZ–ÁLVAREZ, H.; JIMÉNEZ, M.; MENDOZA, M.; PÉREZ, F.; ROLDÁN, P.; RÍOS–CASANOVA, L.; LIRA, R. 2008. Densidad, estructura poblacional, reproducción y supervivencia de cuatro especies de plantas útiles en el Valle de Tehuacán, México. Revista Mexicana de Biodiversidad 79: 393–403. [ Links ]
INFANTE, R. 1992. In vitro axillary shoot proliferation and somatic embryogenesis of yellow pitaya Mediocactus coccineus (Sal–Dyck). Plant Cell Tissue and Organ Culture 31: 155–159. [ Links ]
LÓPEZ, G. R.; DÍAZ, P. J. C.; FLORES, M. G. 2000. Vegetative propagation of three species of cacti: pitaya (Stenocereus griseus), tunillo (Stenocereus stellatus) and jiotilla (Escontria chiotilla). Agrociencia 34: 363–364. [ Links ]
LUNA, M. C.; AGUIRRE, J. R. R. 2001. Clasificación tradicional, aprovechamiento y distribución ecológica de la pitaya mixteca en México. Interciencia 26: 18–24. [ Links ]
LUNA, M. C. del; AGUIRRE, J. R. R.; PEÑA, V. C. B. 2001. Cultivares tradicionales de Stenocereus pruinosus y Stenocereus stellatus (Cactaceae). Anales del Instituto de Biología 72: 131–155. [ Links ]
MARTÍNEZ–VÁZQUEZ, O.; RUBLUO, A.1989. In vitro mass propagation of the near extinct Mammillaria San–angelensis. Journal Horticultural Science 61: 99–105. [ Links ]
MARTÍNEZ–CÁRDENAS, M. L.; VICENTE–SOLANO, R.; MARTÍNEZ–HERRERA, A.; CARMONA, A.; VARELA, H. G. 2007. Survival and growth on soil of micropropagate pitaya de mayo plants. Acta Horticulturae 748: 237–239. [ Links ]
MERCADO, B. A.; GRANADOS, S. D. 2002. La pitaya, biología, ecología, fisiología, sistemática y etnobotánica. Universidad Autónoma Chapingo. México. 194 p. [ Links ]
MOHAMED–YANSEEN, Y. 1995. Micropropagation of pitaya (Hylocereus undatus Britt. Et Rose). HortScience 29: 559. [ Links ]
MÚJICA, H.; MOGOLLÓN, N. 2004. Bulbificación in vitro del ajo (Allium sativum L.) con adición de citocininas y sacarosa en el medio de cultivo. Bioagro 16: 55–60. [ Links ]
MURASHIGE, T.; SKOOG, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum15: 473–497. [ Links ]
ORTÍZ–MONTIEL, J. C.; ALCÁNTARA, R. 1997. Propagación in vitro de peyote (Lophophora williamsii (Lemaire) Coulter). Cactáceas y Suculentas Mexicanas XLII: 3–6. [ Links ]
SÁNCHEZ–MORÁN, M. R.; PEREZ–MOPHE–BALCH, E. 2007. Propagación in vitro de Browningia candelaria (Cactaceae) usando metatopolina. Boletín de la Sociedad Latinoamericana y del Caribe de Cactáceas y otras Suculentas 4: 16–18. [ Links ]
SAS. 1998. SAS User's guide: Statistics. Version 6.12. SAS Institute, Cary, N.C. 1 848 p. [ Links ]














