Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Chapingo. Serie horticultura
On-line version ISSN 2007-4034Print version ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.17 n.2 Chapingo May./Aug. 2011
Control biológico y químico contra Fusarium stilboides en pimiento morrón (Capsicum annuum L.) en poscosecha
Postharvest biological and chemical control of Fusarium stilboides on bell pepper (Capsicum annuum L.)
Rocío Aurora Sandoval–Chávez1; Ramón Álvar Martínez–Peniche1*; Monserrat Hernández–Iturriaga1; Eduardo Fernández–Escartín1; Sofía Arvizu–Medrano1; Lourdes Soto–Muñoz2
1 División de Estudios de Posgrado, Facultad de Química, Universidad Autónoma de Querétaro. Centro Universitario s/n, Colonia las Campanas. Querétaro, Querétaro. C. P. 76010. MÉXICO. Teléfono y Fax: 52–01 (442) 1–92–13–04. Correo–e: alvar@uaq.mx (*Autor para correspondencia).
2 Departamento de Ingeniería de Procesos Alimentarios, Universidad Tecnológica del Suroeste de Guanajuato. MÉXICO. Carretera Valle–Huanímaro km 1.2. Tel. 01 456 64 36265 ext 115.
Recibido: 3 de diciembre, 2009.
Aceptado: 17 de junio, 2011.
Resumen
La producción de frutas y hortalizas bajo invernadero se ha incrementado en México de 721 ha en 1996 a 9,500 ha en 2009. Recientemente se presentó en el pimiento (Capsicum annum L.) una enfermedad fungosa que afecta al pedúnculo del fruto en poscosecha y cuyo agente causal es Fusarium stilboides. Una alternativa para reducir el daño producido por este hongo es el uso de métodos de control biológico. Para evaluar el poder antagónico de cepas de levaduras de distinto origen en comparación con métodos químicos para el control de F. stilboides, se inocularon frutos de pimiento con una concentración conocida de levaduras (107 UFC·mL–1), en presencia de una suspensión de esporas (105 UFC·mL–1) de F. stiboides, o bien se sumergieron en soluciones de distintos fungicidas (benomyl, captán, bicarbonato de sodio y bicarbonato de potasio) a diversas concentraciones y se inocularon con la suspensión de esporas del hongo. Benomyl 0.6 g·L–1 mostró el más alto nivel de inhibición de la severidad en el pedúnculo (81 %), mientras que bicarbonato de sodio 30 g·L–1 resultó más efectivo a nivel del epicarpio (51 % de reducción del diámetro de la lesión). Las levaduras 22–25b y 18–1x de manzana, Avv, 5vtt (Candida incommunis) de velos de vino, 3d. RMA3 de pimiento redujeron el diámetro de la lesión en el epicarpio en 63, 54, 53, 47 y 45 %, respectivamente.
Palabras clave: Capsicum annuum L., levaduras antagónicas, fungicidas, poscosecha, severidad del daño.
Abstract
Greenhouse production of fruits and vegetables in Mexico has increased from 721 ha in 1996 to 9,500 ha in 2009. A fungal disease caused by Fusarium stilboides has recently appeared in pepper (Capsicum annum L.) that affects the fruit peduncle in the postharvest period. An alternative means of reducing the damage caused by this fungus is the use of biological control methods. To assess the antagonistic capacity of yeast strains of different origin to control F. stilboides and compare them with chemical methods, pepper fruits were inoculated with a known yeast suspension (107 CFU·mL–1) and a spore suspension of F. stilboides (105 CFU·mL–1), or they were immersed in different fungicidal solutions (benomyl, captan, sodium bicarbonate and potassium bicarbonate) at various concentrations and then inoculated with the fungal spore suspension. Benomyl at 0.6 g·L–1 showed the highest severity–inhibition level on the peduncle (81 %), while sodium bicarbonate at 30 g·L–1 was the most effective on the epicarp (51 % reduction in lesion diameter). Yeasts–25b and 18–1x from apple, Avv, 5vtt (Candida incommunis) from wine veils and 3d. RMA3 from pepper reduced lesion diameter on the epicarp by 63, 54, 53, 47 and 45 % respectively.
Key words : Capsicum annuum L., antagonistic yeasts, fungicides, postharvest, damage severity.
INTRODUCCIÓN
Durante los últimos años, el cultivo protegido de frutas y hortalizas se ha incrementado en México de 721 ha en 1996 a 9,500 ha en 2009 (SAGARPA, 2009), ya que permite la obtención de altos rendimientos fuera de temporada (Maroto, 2008). Uno de los cultivos de mayor importancia en este rubro es el chile morrón o pimiento (Capsicum annuum L.) para el cual México ocupó en 2007 el segundo lugar a escala mundial en superficie, destinándose el producto tanto al mercado nacional como a la exportación (FAOSTAT, 2007).
Durante los últimos años se ha observado en este cultivo, una enfermedad en poscosecha que afecta principalmente al pedúnculo del fruto y se manifiesta por el desarrollo de un micelio blanquecino, que se extiende con el paso del tiempo y culmina con la necrosis parcial o total del tejido. En 2008 este problema se manifestó en alrededor de 30 % de los embarques para exportación, lo que se tradujo en pérdidas económicas significativas para las empresas. El agente causal de esta enfermedad ha sido identificado en el laboratorio de Microbiología Sanitaria de la Universidad Autónoma de Querétaro como Fusarium stilboides, patógeno que fue reportado en café en Uganda, África, desde 1995 (Geiser et al., 2005).
Entre los principales métodos de control de las enfermedades en poscosecha se encuentra el uso de fungicidas químicos, aunque en los últimos años ha generado diversas controversias debido a su toxicidad al hombre y daños ambientales. Adicionalmente, pueden generar resistencia en cepas del patógeno (Barrera y Bautista, 2008).
Una medida alternativa es el control biológico, que se define como la manipulación directa o indirecta por parte del hombre de los agentes vivos que de forma natural tienen la capacidad de control. Esta manipulación provoca un incremento de su capacidad de inhibición de los patógenos en poscosecha (Nigam y Mukerji, 1988). En los últimos años ha sido objeto de estudio con resultados favorables en el control de algunas enfermedades en poscosecha, como es el caso de la levadura Candida sake, la cual colonizó rápidamente la superficie de manzanas (Malus sylvestris Mill), inhibiendo a P. expansum en 80 % después de 60 días a 1 °C (Usall et al., 2000). Zhang et al. (2005) encontraron que Cryptococcus laurentii tiene un efecto variable contra B. cinerea en pera (Pirus comunis L.) en función del momento de aplicación del inóculo. Chanchaichaovivat et al. (2007) reportaron que las levaduras Pichia guilliermondii, Candida musae, Issatchenkia orientalis y Candida quercitrusa reducen el daño por Colletotrichum capsici en chile en poscosecha.
En México se han aislado, seleccionado e identificado cepas antagónicas de Candida incommunis, Debaryomices hansenii, Cryptococcus albidus, Pichia membranaefaciens y Torulaspora spp. contra hongos en manzanas, y se ha evaluado su efectividad biológica actuando por sí solas (Sánchez et al., 2008) o en combinación con bicarbonato de sodio en distintos cultivares de manzana (Soto y Martínez, 2009).
Un antagonista deseable debe ser genéticamente estable, efectivo a bajas concentraciones, poco exigente en nutrimentos, adaptado a diferentes condiciones del medio, efectivo para una amplia gama de microorganismos patógenos en diversas frutas y hortalizas, fácilmente cultivable, manipulable, resistente a fungicidas, compatible con los procesos comerciales, no dañino para el hospedero y que no produzca sustancias nocivas para el humano (Spadaro y Lodovica, 2004). Así tenemos que las levaduras son organismos antagonistas potenciales, ya que pueden crecer a bajas temperaturas por tiempos prolongados (Usall et al., 2001).
El objetivo del presente trabajo fue evaluar la capacidad antagónica de distintas cepas de levaduras obtenidas de diversas fuentes, así como el efecto de algunos fungicidas de uso comercial contra F. stilboides en pimiento en poscosecha.
MATERIALES Y MÉTODOS
Material biológico
Se utilizaron frutos de pimiento cv. 'Baselga' color amarillo colectados en madurez fisiológica aparente, en los invernaderos de la empresa Fresh Mex, ubicada en Colón, Querétaro, México.
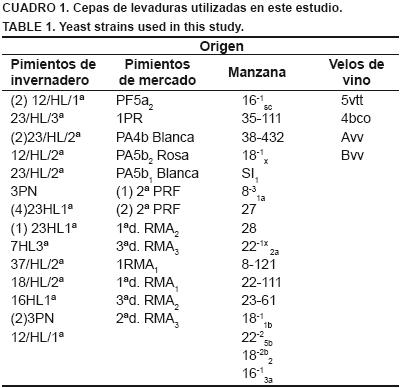
Se evaluaron 47 cepas de levaduras: 27 obtenidas de pimientos provenientes del mercado y de la empresa Fresh Mex, así como 16 de manzana y cuatro de velos de vino elaborados en el laboratorio (Cuadro 1), algunas de las cuales habían sido evaluadas previamente en Penicillium expansum en manzana (Sánchez et al., 2008; Soto et al., 2009).
La cepa del hongo Fusarium stilboides CFNL–2768 (Laboratorio de Micología, UANL) se aisló de frutos de pimiento con síntomas de la enfermedad. Ésta se identificó mediante el sistema automatizado Biolog® (MicroStationTM) y se mantuvo en papa–dextrosa agar (PDA) hasta su utilización.
Preparación de suspensiones microbianas
Se transfirió cada cepa de levadura a probar a tubos conteniendo 10 ml de caldo nutritivo, adicionado de extracto de levadura (0.5 %) y dextrosa (1 %) (NYDB) y se incubaron durante 72 h a 24 ± 1 °C y 200 rpm de agitación (Usall et al., 2001). Se realizaron dos transferencias sucesivas cada 72 horas, y las células de la última resiembra obtenidas por centrifugación (12,000 rpm, 10 min) se sembraron en cajas con agar nutritivo–dextrosa para levaduras (NYDA: 8 g de caldo nutritivo, 5 g de extracto de levadura, 10 g de dextrosa, 20 g de agar y 1000 ml de agua) y se incubaron durante 48 h a 24 ± 1 °C. Los inóculos se prepararon a partir de las colonias aisladas de cada cepa, las cuales se suspendieron en diluyente de peptona estéril. Se realizaron recuentos en la cámara de Neubauer y se ajustó la concentración a 107 UFC·mL–1. La viabilidad se comprobó mediante la técnica de extensión en superficie en medio NYDA (Nunes et al., 2001).
Para preparar el inóculo de F. stilboides, se recuperaron las esporas por barrido con solución salina estéril a 0.85 % sobre un cultivo extendido en medio PDA. La suspensión de esporas se filtró a través de dos capas de gasa de algodón esterilizada y se prepararon diluciones, las cuales se sembraron por vaciado en placa con PDA (Fernández, 2008). Las cajas se incubaron a 24 ± 1 °C, y por último se efectuó un recuento de conidios viables y se obtuvo la concentración requerida.
Bioensayos con fungicidas
Un total de 30 frutos de pimiento se lavaron y desinfestaron con hipoclorito de sodio (5 %) durante 2 min., se enjuagaron con agua destilada estéril y se dejaron secar bajo flujo laminar por 10 min. Posteriormente se sumergieron durante 2 min. en captán Ultra WP 50® (principio activo: captán 50 % (3aR,7aS)–2–[(trichloromethyl)sulfanylj–3a,4,7,7a–tetrahydro–1H–isoindole–1,3(2H)–dione) a 1.5 (C–1.5) o 2.5 g·L–1 (C–2.5), Antrak® (principio activo: benomilo 50 % Methyl [1–[(butylamino)carbonyl]–1H–benzimidazol–2–yl]carbamate) a 0.6 (B–0.6) o 1.2 g·L–1 (B–1.2), bicarbonato de sodio (NaHCO3) a 15 (BCS 15) o 30 g·L–1 (BCS 30) y bicarbonato de potasio a 10 (BCP 10), 20 (BCP 20) o 30 g·L–1 (BCP 30) y un testigo sin tratamiento fungicida inoculado únicamente con la suspensión del patógeno, usando tres frutos por tratamiento. Se realizaron 13 heridas superficiales de 3 mm de diámetro al fruto con un punzón estéril (10 en el epicarpio y tres en el pedúnculo), las cuales se inocularon con 10 |jl de la suspensión de esporas de F. stilboides ( 1000 células); los frutos se dejaron secar, se depositaron en frascos individuales de plástico previamente desinfestados con etanol a 70 % y se incubaron a 24 ± 1 °C. Al cabo de seis (6 d) y 12 días (12 d) se midieron el diámetro de crecimiento del patógeno en el epicarpio (Usall et al., 2001) y la severidad del daño en el pedúnculo de acuerdo a una escala donde 0=sin daño visible, 1=severidad baja (observación de poco micelio), 2=severidad media (desarrollo del micelio sin cubrir totalmente el pedúnculo) y 3=daño severo (micelio abundante cubriendo totalmente el pedúnculo).
1000 células); los frutos se dejaron secar, se depositaron en frascos individuales de plástico previamente desinfestados con etanol a 70 % y se incubaron a 24 ± 1 °C. Al cabo de seis (6 d) y 12 días (12 d) se midieron el diámetro de crecimiento del patógeno en el epicarpio (Usall et al., 2001) y la severidad del daño en el pedúnculo de acuerdo a una escala donde 0=sin daño visible, 1=severidad baja (observación de poco micelio), 2=severidad media (desarrollo del micelio sin cubrir totalmente el pedúnculo) y 3=daño severo (micelio abundante cubriendo totalmente el pedúnculo).
Bioensayos con levaduras
Se desinfestaron un total de 223 frutos y, como en el caso de los ensayos con fungicidas, se practicaron 10 heridas en el epicarpio y tres en el pedúnculo; cada herida se inoculó con 25 μl de la suspensión de levaduras antagónicas ( 250 000 células) y con la suspensión de esporas del patógeno en la forma antes descrita. Se incluyó un testigo inoculado sólo con la suspensión de esporas (sin levadura). Los frutos se incubaron y se determinó el diámetro de crecimiento del patógeno en el epicarpio y la severidad en el pedúnculo a 6 y 12 d de incubación.
250 000 células) y con la suspensión de esporas del patógeno en la forma antes descrita. Se incluyó un testigo inoculado sólo con la suspensión de esporas (sin levadura). Los frutos se incubaron y se determinó el diámetro de crecimiento del patógeno en el epicarpio y la severidad en el pedúnculo a 6 y 12 d de incubación.
Análisis de los datos
El diseño experimental para los dos casos fue completamente al azar con tres o cuatro repeticiones según el caso, con 47 tratamientos para las levaduras y nueve tratamientos para los fungicidas, siendo la unidad experimental un fruto de pimiento. Los datos se analizaron con el programa estadístico "STATGRAPHICS Centurion XVI.I" (Castaño y Domínguez, 2001).
RESULTADOS Y DISCUSIÓN
Ensayos con productos químicos
El bicarbonato de sodio a 30 g·L–1 redujo el diámetro de crecimiento del patógeno con respecto al testigo en el epicarpio del fruto en 51 % a 6 d (4.39 mm. vs. 8.89 mm.) y 43 % a 12 d (9.57 mm. vs. 16.79 mm.) de incubación (Cuadro 2). El resto de los tratamientos no mostró reducción importante del patógeno (menos de 22 %).
El bicarbonato de sodio ha sido utilizado con éxito en el control de podredumbres en poscosecha, y ha sido permitido sin restricciones por la regulación norteamericana y europea (Vero y Mondino, 1999). La acción del bicarbonato de sodio se debe a la inhibición de la expresión y secreción de las poligalacturonasas que provocan la maceración de los tejidos del fruto. La expresión de estas enzimas se ve favorecida a niveles bajos de pH. Los baños con bicarbonato provocan un aumento de pH en las heridas infectadas, disminuyendo de esa forma la producción de poligalacturonasas (Prusky et al., 2004). El bicarbonato de sodio a 4 % incrementó el desarrollo de P. expansum en manzanas, mientras que a 2 % potenció el efecto antagónico de algunas levaduras (Soto y Martínez, 2009).
En el caso del pedúnculo, B–0.6 y C–2.5 resultaron los más efectivos después de 6 d de incubación, reduciendo ambos la severidad del patógeno en 81 % con relación al testigo [0.33 (sin daño) vs 1.78 (severidad media)]. A 12 d de almacenamiento, no se encontraron diferencias entre los fungicidas. Los mejores tratamientos químicos aplicados al fruto fueron el BCS 30 y B–0.6, por lo que se incluyeron en un ensayo ulterior con las mejores levaduras evaluadas.
Los benzimidazoles se convierten en metil benzimidazol carbamato (MBC, carbendazim) en la superficie de las plantas, el cual interfiere en la división nuclear de los hongos. El género Fusarium es sensible a benomyl; sin embargo, es probable que este fungicida sea un agente mutagénico, que pudiera incrementar el grado de resistencia de los patógenos ante su efecto. Por su parte, el captán inhibe la síntesis de los compuestos que tienen los grupos –NH2 y –SH (aminoácidos y enzimas) (Agrios, 2006).
Ensayos de antagonismo con levaduras en fruto
Las levaduras evaluadas fueron agrupadas en distintas series con base en consideraciones prácticas. Basándonos en su comportamiento con relación a la inhibición del desarrollo del hongo en el epicarpio y en el pedúnculo, se seleccionaron las mejores de cada serie para una prueba confirmatoria de antagonismo.
En las Figuras 1 y 2 se observa el desarrollo de F. stilboides en el epicarpio en función de la cepa de levadura a 6 y 12 d de incubación, respectivamente, en cinco ensayos sucesivos. Ninguna levadura del grupo 1 disminuyó significativamente el diámetro de la lesión en el epicarpio en comparación con el testigo (8.87 mm) a 12 d de incubación. Sin embargo, se retuvo a (2)2a PRF para la prueba confirmatoria debido a que mostró el menor porcentaje de incidencia (17.5 vs. 90 % en el testigo, datos no mostrados).
La mayoría de las levaduras del grupo 2 inhibieron significativamente el desarrollo del patógeno en el epicarpio (de 20 a 40 %) después de 6 d de almacenamiento. La levadura 1RMA1 resultó la más efectiva para controlar al hongo inhibiendo en 50 % su crecimiento, mientras que a 12 d, cuatro de las cepas (4)23/HL/1a, Avv, 18–1x y 5vtt redujeron significativamente el desarrollo del patógeno con porcentajes superiores a 50 % de inhibición. Estas cuatro cepas se retuvieron para la prueba confirmatoria.
En el grupo 3 la levadura 16–1sc fue la más efectiva, reduciendo el crecimiento del patógeno en el epicarpio en 37 % (9.01 mm) con relación al testigo (14.22 mm) a 12 d de incubación, mientras que a 6 d no se encontraron diferencias significativas entre tratamientos (F = 1.51).
Para el grupo 4 el testigo no mostró el desarrollo que se esperaba en comparación con los demás tratamientos. Al no detectarse diferencias entre éste y las levaduras, se decidió seleccionar a las que mostraron los menores diámetros de crecimiento del patógeno, que resultaron 7/ HL/3a y 23–61 tanto a 6 d (4.25 y 4.51 mm) como a 12 d (8.67 y 8.81 mm) de incubación. La cepa 23–61 obtenida de frutos de manzana, había resultado sobresaliente contra P. expansum en manzana inhibiéndolo 23 % a 12 d de incubación. Esta cepa se sometió al sistema automatizado Biolog®, sin haber podido identificarse (Sánchez et al., 2008).
En el grupo 5, 3ad. RMA3, aislada de pimientos, inhibió el diámetro de crecimiento del patógeno en 65 % después de 6 d de incubación, mientras que las cepas 22–25b, 1ad. RMA2, 16/HL/1a, 8–121 y 3ad. RMA3 resultaron ser las mejores inhibiendo 54, 44, 40, 39 y 34 %, respectivamente a 12 d. Las cepas 3ad. RMA3, 16/HL/1a y 22–25b se retuvieron para la prueba confirmatoria, ya que además habían reducido sustancialmente la incidencia del patógeno (datos no mostrados).
En las Figuras 3 y 4 se observa el desarrollo de F. stilboides en el pedúnculo en función de la cepa de levadura a 6 d y 12 d de incubación, respectivamente, en cinco ensayos sucesivos. La levadura (2)12/HL/1a del grupo 1 propició en el pendúnculo el menor desarrollo (0.75 mm) del patógeno a 12 d de incubación y se sometió a la prueba confirmatoria, a pesar de que no hubo diferencias entre tratamientos (F = 1.24). Ninguna levadura del grupo 2 redujo el desarrollo del patógeno a los 6 d, mientras que Avv inhibió en 58 % al hongo (1.08 vs 2.58) a 12 d, lo que confirma su buen comportamiento en el epicarpio, donde la reducción fue de 57 %. En el grupo 3 nuevamente destaca la levadura 16–1sc al reducir la severidad del patógeno en 47 %, por lo cual se seleccionó para la prueba confirmatoria.
En el grupo 4 la levadura 23–61 produjo el menor desarrollo del hongo en el pedúnculo, tanto a 6 d como a 12 d de incubación (1 y 1.33, respectivamente) y se consideró para la prueba confirmatoria. Finalmente, en el grupo 5 no se encontraron diferencias estadísticamente significativas en ninguno de los tiempos evaluados.
Se probaron las 11 cepas de levadura que mostraron el mejor comportamiento en los ensayos previos. También se incluyeron los fungicidas BCS 30 y B–0.6, de acuerdo con la efectividad mostrada previamente en el epicarpio y en el pedúnculo (Cuadro 2). A 12 d, cinco cepas redujeron significativamente el daño del patógeno en el epicarpio (Cuadro 3) 22–25b, Avv, 5vtt, 3d. RMA3 y 18–1x con porcentajes de inhibición de 63, 54, 53, 47 y 45 %, respectivamente, con respecto al testigo (13.88 mm). El comportamiento mostrado por estas cepas fue muy similar al de los ensayos precedentes. Ninguno de los fungicidas incluidos en el ensayo mostró un efecto significativo en contra del patógeno.
La levadura 5vtt (Candida incommunis) había sido evaluada contra P. expansum en manzana por Sánchez et al. (2008) con un porcentaje de inhibición de 23 % a 12 d de incubación, mientras que en pimiento inhibió 53 % el desarrollo de F. stilboides al mismo tiempo de incubación. Por otro lado, Chand–Goyal y Spotts (1996) reportan una reducción significativa de la incidencia y la severidad del desarrollo de Penicillium expansum en manzanas por seis cepas de levaduras aisladas de peras, al aplicarse simultáneamente con el patógeno.
No se encontraron diferencias entre las levaduras para la severidad del desarrollo del hongo en pedúnculo (Cuadro 3). En general, se aprecia un mayor nivel de inhibición del hongo por las levaduras en el epicarpio que en el pedúnculo y un mayor desarrollo del patógeno en el epicarpio. Este resultado puede atribuirse a las diferencias de composición de estas dos partes del fruto, que propicia un mayor desarrollo del hongo en el primero cuando el tejido se hiere a nivel experimental. El hecho de que el patógeno se desarrolle preferentemente en el pedúnculo en condiciones de almacenamiento comercial, seguramente se debe a que este tejido es herido al cortar el fruto, a diferencia del epicarpio, que comúnmente se mantiene intacto.
De las 47 levaduras evaluadas 19 % redujo significativamente el crecimiento del patógeno en el epicarpio a 6 d, de las cuales 11 % lo inhibieron en más de 50 %, mientras que a 12 d, 21 % de la levaduras redujo significativamente dicho crecimiento y de las cuales 24 % lo inhibieron en más de 50 %.
Por el contrario, en el pedúnculo a 6 d ninguna levadura inhibió significativamente la severidad del hongo, mientras a 12 d sólo 4 % de las cepas fueron efectivas y de éstas sólo la mitad redujo el desarrollo del hongo en más de 50 %. Si comparamos estos resultados con los obtenidos por Sánchez et al. (2008), vemos que en este último estudio 39 % de las cepas probadas redujeron el crecimiento de P. expansum, pero con porcentajes de inhibición menores a 50, mientras Viñas et al. (1998) obtuvieron, después de siete días de incubación, 40 % de cepas con inhibición significativa del mismo patógeno de 933 probadas, 10 % de las cuales redujeron el crecimiento del hongo en más de 50 %.
CONCLUSIONES
La aplicación de Benomyl a 0.6 g·L–1 inhibió el desarrollo de F. stilboides en el pedúnculo de frutos de pimiento, en tanto que el bicarbonato de sodio a 30 g·L–1 se mostró efectivo en el epicarpio.
Dos cepas de levaduras aisladas de manzana, dos de velos de vino y una de pimiento resultaron efectivas para inhibir el hongo en el epicarpio de frutos de pimiento.
LITERATURA CITADA
AGRIOS GEORGE N. 2006. Protección directa mediante métodos de control químico, En: Fitopatología. 2da Ed. Limusa. D. F. México. pp. 209–234. [ Links ]
BARRERA–NECHA, L. L.; BAUTISTA–BAÑOS, S. 2008. Actividad antifúngica de polvos, extractos y fracciones de Cestrum nocturnum L. sobre el crecimiento micelial de Rhizopus stolonifer (Ehrenb. Fr.) Vuill. Revista Mexicana de Fitopatología 26(001): 27–31. [ Links ]
CASTAÑO, T. E.; DOMÍNGUEZ, D. J. 2001. Diseño de Experimentos para el Desarrollo Tecnológico y Mejora Industrial. Jit. Press. D.F. México. 312 p. [ Links ]
CHANCHAICHAOVIVAT, A.; RUENWONGSA, P.; PANIJPAN, B. 2007. Screening and identification of yeast strains from fruits and vegetables: Potential for biological control of postharvest chilli anthracnose (Colletotrichum capsici). Biological Control 42(3): 326–335. [ Links ]
CHAND–GOYAL, T.; SPOTTS, R. 1996. Postharvest biological control of blue mold of apple and brown rot of sweet cherry by natural saprophytic yeasts alone or in combination with low doses of fungicides. Biological Control 6: 253–259. [ Links ]
FAOSTAT. Food and Agriculture Organization of the United Nations. 2007. Disponible en: www.faostat.fao.org. Fecha de consulta: 4 de septiembre de 2010. [ Links ]
FERNÁNDEZ–ESCARTÍN, E. 2008. Microbiología e Inocuidad de los Alimentos 2da Ed. Universidad Autónoma de Querétaro, D. F. México, 967 p. [ Links ]
GEISER, D. M.; LEWIS–IVEY, M. L.; HAKIZA, G.; JUBA, J. H.; MILLER, S. A. 2005. Gibberella xylaroides (anamorph: Fusarium xylaroides), a causative agent of coffee wilt disease in Africa, is a previously unrecognized member of the G. fujikuroi species complex. Mycologia 97(1): 191–201. [ Links ]
MAROTO, J. V. 2008. Elementos de Horticultura General. 3ra Ed. Mundi–Prensa. Madrid, España. 480 p. [ Links ]
NIGAM, N.; MUKERJI, K. G. 1988. Biological control. Concepts and practice. In: Biocontrol of Plant Diseases. Vol. 1. MUKERJI, K. G.; GARG, K. L. (Eds.). CRC Press Boca Ratón. EE.UU. pp. 1–13. [ Links ]
NUNES, C.; USALL, J.; TEIXIDÓ, N.; MIRÓ, M.; VIÑAS, I. 2001. Nutritional enhancement of biocontrol activity of Candida sake (CPA–1) against Penicillium expansum on apples and pears. European Journal of Plant Pathology 107(5): 543–551. [ Links ]
PRUSKY, D.; McEVOY, J.; SAFTNER, R.; CONWAY, W; JONES, R. 2004. Relatioship between host acidification and virulence of Penicillium sp. on apple and citrus fruit. Phytopathology 94: 44–51. [ Links ]
SAGARPA. 2009. Estrategia Nacional de Agricultura Protegida. http://www.presidencia.gob.mx/prensa//sagarpa/. Fecha de consulta: 25 de enero de 2011. [ Links ]
SÁNCHEZ, E.; MARTÍNEZ, R. A.; CASTILLO, T. J.; FERNÁNDEZ, E. E. 2008. Antagonismo de levaduras nativas contra la pudrición azul (Penicillium expansum Link) en frutos de manzana. Revista Fitotecnia Mexicana 31(4): 359–366. [ Links ]
SOTO–MUÑOZ L.; MARTÍNEZ–PENICHE. R. A. 2009. Efecto de levaduras antagónicas y bicarbonato de sodio sobre Penicillium expansum Link en dos variedades de manzana. Revista Chapingo Serie Horticultura 15(2): 211–215. [ Links ]
SPADARO, D.; LODOVICA, G. M. 2004. State of the art and future prospect of biological control of postharvest fruit diseases. International Journal of Food Microbiology 91: 185–194. [ Links ]
USALL, J.; TEIXIDÓ, N.; FONS, E.; VIÑAS, I. 2000. Biological control of blue mould on apple by a strain of Candida sake under several controlled atmosphere conditions. International Journal of Food Microbiology 58: 83–92. [ Links ]
USALL, J.; TEIXIDÓ, N.; TORRES, R.; DE ERIBE, X. O.; VIÑAS, I. 2001. Pilot tests of Candida sake (CPA–1) applications to control postharvest blue mold on apple fruit. Postharvest Biology and Technology 21(2): 147–156. [ Links ]
VERO, S.; MONDINO, P. 1999. Control biológico Postcosecha. Medidas para conservar fruta y hortalizas. Horticultura Internacional. Año 7: 29–36. [ Links ]
VIÑAS, I.; USALL, J.; TEIXIDÓ, N.; SANCHIS, V. 1998. Biological control of major postharvest pathogens on apple with Candida sake. International Journal of Food Microbiology 40: 9–16. [ Links ]
ZHANG, H.; ZHENG, X.; FU, C.; XI, Y. 2005. Postharvest biological control of gray mold rot of pear with Cryptococcus laurentii. Postharvest Biology and Technology 35:79–86. [ Links ]














