Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.17 no.2 Chapingo may./ago. 2011
Inducción de antocianinas y compuestos fenólicos en cultivos celulares de jamaica (Hibiscus sabdariffa L.) in vitro
Induction of anthocyanins and phenolic compounds in cell cultures of Roselle (Hibiscus sabdariffa L.) in vitro
Alonso de Dios–López1; Efigenia Montalvo–González2; Isaac Andrade–González1; Juan Florencio Gómez–Leyva1*
1 Laboratorio de Biología Molecular. Instituto Tecnológico de Tlajomulco, Jalisco. km 10 Carretera a San Miguel Cuyutlán, Tlajomulco de Zúñiga, Jalisco. MÉXICO. Correo–e: jfgleyva@hotmail.com (*Autor para correspondencia).
2 Instituto Tecnológico de Tepic. Avenida Tecnológico Núm. 2595, Fraccionamiento Lagos del Country, C. P. 63175. Tepic, Nayarit, MÉXICO.
Recibido: 10 de octubre, 2010.
Aceptado: 11 de abril, 2011.
Resumen
Las antocianinas representan un grupo de metabolitos vegetales responsables de la pigmentación del cáliz de jamaica (Hibiscus sabdariffa L.). El cultivo de tejidos vegetales se ha utilizado para la producción de metabolitos secundarios; sin embargo, el potencial de los cultivos de células vegetales para la producción de antocianinas es todavía limitado. En el presente estudio, se evaluaron diferentes inductores fitorreguladores como: ácido naftalenacético, ácido 2,4–diclorofenoxiacético, cinetina, así como ácido salicílico, jasmonato de metilo; deficiencia de nitrógeno y estrés osmótico para estimular la producción de antocianinas y compuestos fenólicos, en callos y células en suspensión in vitro de tres variedades de jamaica (China, Reyna y Blanca). El mayor contenido de compuestos fenólicos se obtuvo en callos de la variedad Reyna con 670 mg de equivalentes de ácido gálico–100 g–1 de peso seco en condiciones de estrés osmótico. Se indujo la producción de antocianinas en callos de las variedades China y Reyna (94 y 161 μg·g–1 de peso fresco, respectivamente) establecidos en medio MS suplementado con 7.5 mM de nitrógeno inorgánico. Mediante un análisis por RT–PCR en los callos que presentaron producción de antocianinas, se evidenció la expresión transcripcional de los genes que codifica para la antocianina sintasa y la flavonona–3'–hidroxilasa, sugiriendo que la fuente de nitrógeno regula los pasos finales en la ruta de biosíntesis de antocianinas en cultivos celulares de jamaica in vitro.
Palabras clave: RT–PCR, estrés, fitohormonas, metabolitos secundarios.
Abstract
Anthocyanins are a group of plant metabolites responsible for the red pigmentation in calyx of roselle (Hybiscus sabdariffa L.. The plant tissue culture has been used for the production of secondary metabolites; however, the potential of plant cell cultures for the production of anthocyanins is still limited. In the present study, an evaluation was made of different inducers of plant growth regulators such as: naphthaleneacetic acid, 2,4–dichlorophenoxyacetic acid, kinetin and salicylic acid, methyl jasmonate, nitrogen deficiency and osmotic stress to stimulate the production of anthocyanins and phenolic compounds in callus and suspension cells in vitro of three varieties of rosette (China, Reyna and White). The highest content of phenolic compounds in callus was obtained from the variety Reyna with 670 mg of gallic acid equivalents–100 g–1 dry weight under osmotic stress conditions. It induced the production of anthocyanins in callus of the varieties China and Reyna (94 and 161 μg·g–1 fresh weight, respectively) established on MS medium supplemented with 7.5 mM of inorganic nitrogen. Using a RT–PCR analysis in the calluses that showed production of anthocyanin, the transcriptional expression was shown of genes coding for anthocyanin and flavones synthase 3'–hydroxylase, suggesting that the nitrogen source regulates the final steps in the biosynthetic pathway of anthocyanins in cell cultures of roselle in vitro.
Key words : RT–PCR, stress, phytohormones, secondary metabolites.
INTRODUCCIÓN
La jamaica (Hibiscus sabdariffa L.) pertenece a la familia de las Malvaceas, produce cálices rojos que pueden ser comestibles y empleados para la elaboración de bebidas (Clydesdale et al., 1979). En el cáliz de la jamaica se acumula una gran cantidad de compuestos fenólicos, ácidos orgánicos, proantocianidinas, flavonoles, flavonas, flavononas, isoflavononas y antocianinas; de estas últimas las que se encuentran en mayor proporción son el 3–sambubiósido de delfinidina y 3–sambubiósido de cianidina (Galicia–Flores et al., 2008). Las antocianinas son altamente reductoras, por lo que exhiben fuerte actividad antioxidante, su consumo puede proteger al organismo contra daños provocados por los radicales libres y la peroxidación de los lípidos (Tsai et al., 2002). Otros estudios han reportado que su ingesta inhibe el desarrollo de algunos tipos de cáncer, enfermedades coronarias, arteriosclerosis y disminución de triglicéridos en pacientes con síndrome metabólico (Chen et al., 2004; Hirunpanich et al., 2006, Gurrola–Díaz et al., 2010).
La biosíntesis de antocianinas y otros flavonoides sigue la ruta de los fenilpropanoides, que inicia con la condensación de la fenilalanina y acetato por acción de la enzima fenilalanina amonio liasa (PAL), para producir el 4–cumaroil CoA, posteriormente, la chalcona sintasa (CHS) condensa los precursores malonil CoA y 4–coumaril CoA para formar chalcona. Este compuesto intermediario C15 es transformado en una flavanona por la chalcona isomerasa (CHI) para producir la naringenina. Finalmente, la flavanona es transformada en la correspondiente antocianina por una reacción de hidroxilación en el carbono C3 seguido por una deshidratación (Zhang et al., 2004). La molécula de antocianina es estabilizada por glicosilación, por acción de una glicosil transferasa.
Existen dos clases de genes que regulan la expresión de antocianinas; los estructurales que codifican las enzimas que participan directamente en la formación de los compuestos fenólicos y los genes regulatorios que controlan la transcripción de los genes estructurales (Fennema, 2000). La regulación de ambos tipos de genes está dada por diferentes factores como la exposición a la luz, el régimen hormonal, estrés osmótico o la deficiencia de nitrógeno o fósforo (Hirasuna et al., 1991; Krisa et al., 1999; Cormier et al., 1990; Do y Cormier 1991).
El potencial de los cultivos de células vegetales in vitro para la producción de antocianinas es todavía limitado, debido fundamentalmente a factores que determinan una baja productividad de compuestos de interés. Este problema puede ser superado por la selección de líneas celulares altamente productivas, optimización de condiciones ambientales (temperatura, pH, luz), los componentes del medio (metales, sacarosa, sales, aminoácidos y fitorreguladores) provocando un estrés abiótico o la densidad del inóculo (Zhong y Yoshida, 1995; Luczkiewcz y Cisowski, 2001).
El objetivo del presente trabajo fue determinar el efecto de diferentes fitoreguladores y evocadores como estrés osmótico y la deficiencia mineral con la finalidad de incrementar la concentración de antocianinas y compuestos fenólicos empleando callos y células en suspensión de jamaica in vitro; así como evaluar la expresión transcripcional de algunos genes que codifican para las enzimas involucradas en la ruta de biosíntesis de antocianinas en jamaica.
MATERIALES Y MÉTODOS
Material vegetal
Se utilizaron tres variedades de jamaica: dos con pigmento rojo en cáliz (Reyna y China) del banco de germoplasma de la Facultad de Agronomía de la Universidad Autónoma de Nayarit y una variedad incolora (Blanca) del laboratorio de Biología Molecular del Instituto Tecnológico de Tlajomulco de Zúñiga, Jalisco.
Establecimiento de jamaica in vitro
Se tomaron 150 semillas de cada variedad y fueron lavadas con agua jabonosa por 20 min. Posteriormente, se adicionaron 50 mL de una solución de hipoclorito de sodio al 50 %, (v/v) en agitación por 2 h. Después de este proceso se enjuagaron tres veces con agua destilada estéril y se sembraron en el medio de MS (Murashige y Skoog, 1962) a pH 5.7, gelificado con 2 g·L–1 de gelRite®.
Producción del callo friable y establecimiento de células en suspensión
Se tomaron secciones de hoja de aproximadamente 5 mm2 de plántulas germinadas in vitro de las tres variedades y se colocaron en medio MS sólido suplementado con 2 mg·L–1 de 2,4–D y 0.5 mg·L–1 de 6–bencilaminopurina (BAP), como medio de mantenimiento de callos (MC). Los explantes se incubaron en una cámara de crecimiento a una temperatura de 25 °C y un fotoperiodo de 16 h luz. Se realizaron resiembras cada dos semanas hasta obtener callos friables (Gómez–Leyva et al., 2008). Para la producción de células en suspensión, se adicionaron 5 g de callos friables de las variedades rojas (China y Reyna) en 50 mL de medio MS líquido con la misma relación hormonal mencionada anteriormente y se mantuvieron en agitación constante a 100 rpm por tres semanas a 27 oC.
Inducción de antocianinas y compuestos fenólicos en callos y capa celular de jamaica in vitro.
Se realizaron dos ensayos diferentes para la inducción de antocianinas y fenoles: Ensayo 1. Se utilizó medio de MC adicionado con los siguientes estimuladores: sacarosa a una concentración de 60, 90 y 120 g·L–1; jasmonato de metilo a 10, 100 y 200 μM; ácido naftalenacético (ANA) a 1, 2 y 4 mg·L–1; ácido salicílico a 0.01, 0.1 y 1 mM y cinetina a 1, 5 y 10 mM. En cada caja se colocaron tres callos friables del mismo peso de cada una de las variedades de jamaica, teniendo como testigo los callos en el medio MC sin inductores.
Ensayo 2. El segundo ensayo consistió en la formación de callos a partir de una capa delgada de células, siguiendo la metodología propuesta por Santacruz–Ruvalcaba y Portillo (2009), para lo cual se tomó 1 mL de las células en suspensión de jamaica y se adicionaron al medio MC sólido los siguientes inductores: sacarosa a 60, 90 y 120 g·L–1; ácido salicílico a 0.01, 0.1 y 1 mM; nitrógeno inorgánico ajustado a 7.5, 15 y 30 mM y ácido 2,4–diclorofenoxiacético a 4, 6 y 8 mg·L–1. El tratamiento testigo, se preparó agregando 1 mL de las célula en el medio MC sin inductores.
Para el primer ensayo los datos se analizaron por variedad con un diseño experimental 3x5 con tres repeticiones. Para el segundo ensayo los datos se analizaron por variedad con un diseño experimental 3x4 con tres repeticiones. Todos los tratamientos se incubaron a 25 °C con un fotoperiodo de 16 h luz durante ocho semanas. Las variables evaluadas al final del tiempo de experimentación fueron: fenoles totales, antocianinas totales y el análisis de la expresión mediante RT–PCR de los genes antocianina sintasa (ans), flavonona–3'–hidroxilasa (f3'h), flavonona–3'5'–hidroxilasa (f3'5'h) y dihidrofavona–4–reductasa (dfr). Se realizó un análisis de varianza y prueba de medias con el método de Tukey a P<0.05 empleando el paquete estadístico SAS System versión 9.0.
Cuantificación de fenoles totales
Se emplearon 2 g de callos y 1mL del filtrado de células, las cuales fueron secadas a 45 °C por 24 h. La materia seca fue colocada separadamente en un tubo y se agregaron 10 mL de solución de extracción (metanol al 50 %) en relación 1:5 (p/v). La extracción se llevó a cabo durante 48 h a 4 °C en obscuridad (Vinson et al., 1999). El extracto obtenido se utilizó para la cuantificación de fenólicos totales mediante el método de Folin–Ciocalteu (Waterman y Mole, 1994), que consiste en mezclar 200 uL del extracto, 10 μL solución Folin–Ciocalteau (0,2 N) y 5 mL de Na2CO3 (75 g·L–1). La mezcla se homogeneizó y se mantuvo a 45 °C por 15 min; una vez fría se midió la absorbancia a 765 nm. La lectura de cada muestra fue comparada con una curva estándar de ácido gálico (40 a 200 mg·L–1). Los resultados fueron expresados como mg equivalentes de ácido gálico (EAG) por 100 gramos de peso seco.
Extracción y cuantificación de antocianinas
Dos gramos de tejido callosos pigmentado fueron macerados en nitrógeno líquido, al polvo obtenido se le adicionó metanol acidificado al 0.01 % con ácido clorhídrico en proporción 1:10, la mezcla se mantuvo en obscuridad por 24 h a 4 °C. Las antocianinas totales se cuantificaron empleando el método de diferencial de pH descrito por Giusti y Wrolstad (2001), en el cual se emplearon dos soluciones amortiguadoras (KCl, 0.025N pH 1.0 y CH3COONa3H2O 0.4M a pH 4.5). Dos diluciones (1:50) de cada extracto fueron preparadas en cada uno de los amortiguadores. Las diluciones se estabilizaron por 15 min y la absorbancia de cada dilución fue registrada a 520 y 700 nm. La concentración de antocianinas monoméricas se determinó mediante la siguiente ecuación:
Antocianinas totales (mg·L–1)= A. PM. FD.1000.ε–1
donde; PM = peso molecular de antocianina como 3–glucósido de cianindina, 449.2; FD = factor de dilución (50); ε = coeficiente de extinción 26,900 y el valor A se obtuvo con la ecuación: A = (A520–A700)pH1.0–(A520–A700) pH4.5. Los resultados fueron expresados en mg de antocianinas totales·g–1 de peso fresco.
Análisis de la expresión transcripcional
Para la extracción de ARN total, se trituraron 0.1 g de muestra pigmentada y no pigmentada con nitrógeno líquido y se adicionaron 750 μL de buffer de extracción (CTAB 2 %, PVP 2 %, Tris–HCl 100 mM (pH 8.0), EDTA 25 mM, NaCl 2.0 M, β–mercaptoetanol 10 mM), se incubó por 10 min a 65 °C, se centrifugó a 10,000 rpm por 10 min a 4 °C y se adicionó al sobrenadante una mezcla de cloroformo:alcohol isoamílico (24:1) en dos ocasiones. El sobrenadante obtenido se centrifugó a 13,000 rpm y se adicionó ¼ de volumen de LiCl 10 M. Se dejó precipitar toda la noche a 4 °C y el pellet formado se lavó con 500 uL de etanol absoluto frío; se centrifugó brevemente y se retiró el etanol. El ARN se redisolvió en 100 μL de buffer SSTE [NaCl 1 M, SDS 0.5 %, Tris–HCl 10 mM (pH 8.0), EDTA 1 mM (pH 8.0)] y se extrajo una vez más con una mezcla de fenol saturado pH 8.0:cloroformo:alcohol isoamílico (25:24:1 v/v/v) y una vez con cloroformo: alcohol isoamílico (24:1 v/v). Después se adicionaron dos volúmenes de etanol absoluto al sobrenadante, dejando precipitar a –20 °C por 2 h. Se centrifugó a 14,000 rpm por 20 min a 4 °C, se lavó el pellet con etanol al 70 % y se dejó secar al aire por 1 h. Por último el ARN se resuspendió en 300 μL de agua tratada con dietil pirocarbonato [DEPC] (Jaakola et al., 2001).
Síntesis de ADN complementario (ADNc)
Para la síntesis de ADNc se empleó el kit SuperScript® III First–Strand Synthesis System RT–PCR (Invitrogen). Se realizó una reacción de un volumen final de 10 μL, se mezclaron los siguientes componentes: ARN (100 ng), oligonucleótidos (dT) 5 μM y dNTP's 1 mM. La mezcla se incubó a 65 °C por 5 min y se enfrió en hielo por un minuto. Después se preparó la siguiente reacción hasta un volumen final de 10 ul: amortiguador RT 1X, MgCl2 2.5 mM, DTT 10 mM, ARNsa OUT 40U, Super Script III RT 200 U. Se mezclaron ambas reacciones y se incubaron por 50 min a 50 °C, la reacción se detuvo a 85 °C por 5 min y se enfrió en hielo por un minuto. Finalmente, se adicionó 1 μL de ARNasa H incubándose por 20 min a 37 °C.
Reacción en Cadena de la Polimerasa en Transcripción Reversa (RT–PCR)
La reacción de RT–PCR se realizó en un volumen final de 25 μL con los siguiente componentes en la mezcla de reacción: MgCl2 2 mM, dNTP 0.2 μM, 10 pmol de cada oligonucleótido (específicos para los genes: ans, f3h, f3'5'h y dfr), 2.5 U Taq ADN polimerasa y 2 μL de ADNc. La amplificación se realizó empleando el siguiente programa en un termociclador marca Techne PT–100: desnaturalización inicial a 94 °C por 2 min, seguido de 35 ciclos de desnaturalización a 94 °C por 1 min, alineamiento a 52 °C por 1 min, extensión a 72 °C por 2 min y una extensión final a 72 °C por 7 min. Los productos de amplificación fueron separados en un gel de agarosa al 1.2 % y teñidos con bromuro de etidio. Los oligonucleótidos empleados fueron diseñados con el programa PerlPrimer V1.1.15 basadas en regiones homólogas de las proteínas reportadas para cada gen:
f3'h (F 5'ATGAYDMAGAAYTAYGGHCC,R=5'CTTGDAHYTCHAYCCAARRD);
f3'5'h (F=5'GCWARAGCGTTCYTSAAAAC,R=5"ATAAKCATSAAHAGGKAGSCMW),
dfr (F=5'DTTTCAYRTGGHACDCCTYT,R=5'ACWGGRAYGTCRTRYTCYAT)
ans (F5'RGAVGCMGCNDTSGANTGGGG,R=5'AANACNGCCCAHGAAAYTMACC).
Donde: N=A, C, G, o T; K= G o T; V= A, C, ó G; B=C, G, ó T; R=A, o G; H=A, C, ó T; Y=C o T; D=A, G, ó T; S=C o G; M=A ó C; W=A ó T.
RESULTADOS Y DISCUSIÓN
Acumulación de compuestos fenólicos en callos friables de jamaica
Al emplear callos friables completos en el primer ensayo, no se indujo pigmentación en ninguno de los tratamientos; sin embargo, sí se indujo la producción de compuestos fenólicos (Cuadro 1). En los tratamientos testigo se encontraron 428.57, 322.34 y 421,49 mg EAG·100 g–1 de peso seco de las variedades China, Reyna y Blanca, respectivamente; mientras que el mayor contenido de fenoles totales se presentó en la variedad China con 642.28 mg EAG·100 g–1 peso seco al ser estimulado con cinetina a 1 mM; la variedad Reyna, 670.67 mg EAG·100 g–1 peso seco a una concentración de 60 g·L–1 de sacarosa, mientas que en la variedad Blanca se obtuvo 634.29 y 613.07 mg EAG·100 g–1 peso seco inducidos por jasmonato de metilo a 100 μM y ácido salicílico 0.01 mM, respectivamente. El efecto de las citocininas como la cinetina promueve el desarrollo celular y algunos reportes han demostrado que la acumulación de antocianinas es inversamente proporcional a la tasa de crecimiento celular, esto puede explicar el hecho de que no se hayan sintetizado pigmentos y que el metabolismo se haya dirigido hacia la producción de biomasa y compuestos fenólicos (Gleitz y Seitz, 1989). La sacarosa mostró ser un buen inductor de compuestos fenólicos, este efecto se debe a que la sacarosa aumenta la presión osmótica en el medio de cultivo, disminuyendo la captación de nutrientes por la célula y bloqueando algunas rutas metabólicas, dirigiendo el metabolismo hacia la biosíntesis de compuestos fenólicos (Cormier y Do, 1993). La producción de metabolitos secundarios en respuesta a la elicitación es un fenómeno fisiológico de respuesta contra el ataque de patógenos, donde el ácido salicílico y el jasmonato de metilo juegan un papel importante generando un aumento en el flujo del canal de Ca2+ citoplasmático que es una parte esencial de la ruta de transducción de señales de estrés abiótico, lo cual induce a la síntesis de antocianinas y ácidos orgánicos (Grassmann et al., 2002). Sin embargo, se ha demostrado también que el uso de jasmonato de metilo tiene un efecto negativo sobre la producción de antocianinas (Saigne–Soulard et al., 2006). El ANA no mostró efecto en la síntesis de antocianinas, ni en el aumento de la producción de fenólicos totales en las tres variedades de jamaica, ya que se encontró incluso una menor cantidad de compuestos fenólicos que el tratamiento testigo, debido probablemente al efecto antagónico con otras fitohormonas sintetizadas naturalmente por el tejido (Ozeki y Komamine, 1986).
Inducción de compuestos fenólicos y antocianinas en callos generados a partir de una capa de células
En el ensayo 2 se obtuvo una respuesta distinta al empleo de masas callosas. En general, los tratamientos de sacarosa y bajas concentraciones de nitrato (Cuadro 2) limitan la producción de compuestos fenólicos respecto a los testigos, mientras que el ácido salicílico y el 2,4–D tienden a incrementar entre un 60 a 70 % en promedio el contenido de compuestos fenólicos en las líneas celulares de jamaica de las variedades China y Reyna. En el caso de las auxinas como el 2,4–D, se ha observado que éstas inducen la diferenciación de la células y disminuye la tasa de crecimiento celular promoviendo la síntesis de fenoles (Kokubo et al., 2001).
Por otra parte, se observó una acumulación de antocianinas en callos de jamaica para las dos variedades rojas (Figura 1) al disminuir la concentración de nitrógeno inorgánico (NH4NO3 y KNO3) en el medio MS, de 30 mM a 7.5 Mm; mientras que el testigo no mostró pigmentación roja. La concentración de antocianinas en la variedad Reyna fue de 161 μg de antocianinas totales·g–1 de peso fresco, mientras que en la variedad China fue de 94.6 μg antocianinas·g–1 de peso fresco (Cuadro 2). El NH4+ está relacionado con el metabolismo secundario mientras que el NO3– tiene un efecto sobre la limitación del desarrollo celular, en este sentido la disponibilidad de amonio se convierte en un factor limitante, induciendo la acumulación de antocianinas cuando se disminuye la densidad celular (Rajendran et al., 1992). Debido a las limitaciones de nitrógeno, la ruta metabólica puede detenerse y dirigirse hacia la producción de antocianinas desde un estado de desarrollo celular. Konczak–Islam et al. (2001), demostraron que una reducción en los niveles de nitrógeno hasta 7.5 mM causa un cambio en el tipo de antocianinas disminuyendo la glucosilación y aumentando los derivados acilados.

Análisis de la expresión genética en callos de jamaica
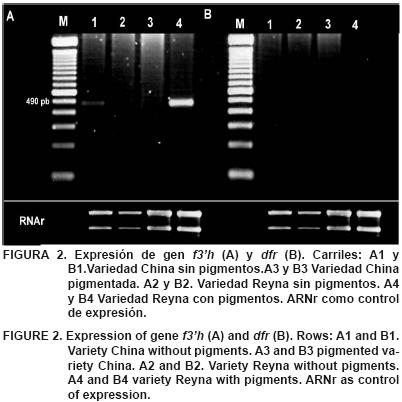
En el análisis por RT–PCR, se obtuvo un fragmento de 490 pb para el gen de la flavonona–3' hidroxilasa (f3'h), a partir del cDNA de la variedad China no pigmentada, mientras que en la variedad Reyna pigmentada se observó un fragmento de mayor intensidad (Figura 2). La alta expresión del gen de la f3'h en la variedad China coincide con la mayor acumulación del pigmento observada en los callos. Las enzimas flavonona–3'–hidroxilasa y flavono–3'5'–hidroxilasa catalizan la hidroxilación de las flavononas a dihidroflavonoles (Leguizamón et a/.; 2005); sin embargo, la expresión de estos genes en un tejido no pigmentado sugiere que la regulación de la pigmentación en la variedad China se lleva a cabo en etapas posteriores de la biosíntesis; por otro lado, el mismo gen se expresó en el tejido pigmentado de la variedad Reyna indicando que en esta variedad la pigmentación también puede estar regulada por la expresión de este gen, lo que hace aún más evidente las diferencias en la regulación genética entre las dos variedades.
En la expresión del gen que codifica para la antocianidina sintasa (ans) se obtuvo un fragmento de 400 pb (Figura 3) en células pigmentadas e incoloras de ambas variedades, mientras que ninguno de los tejidos mostró expresión para el gen de la enzima flavonon–3'5'hidroxilasa (f3'5'h). Este resultado sugiere que la pigmentación en jamaica puede estar controlada por genes regulatorios o estructurales implicados en las últimas etapas de la biosíntesis. Existe evidencia que el nitrógeno regula algunas rutas del metabolismo secundario incluyendo parte del metabolismo de los fenilpropanoides, flavonoides y antocianinas. En plantas de A. thaliana se demostró que la adición de nitrógeno en sus formas de KNO3 y NH4 NO3 reprimen rápidamente los genes de la biosíntesis de antocianinas junto con un descenso en los niveles de la fenilalanina (Scheible et a/., 2004), lo cual coincide con los resultados encontrados en las líneas celulares de jamaica. Se sabe que algunos factores de transcripción como PAP1 (Production Antocianin Pigment) están involucrados en la expresión de genes de la ruta de biosíntesis de antoncianinas y pueden ser estimulados por sacarosa, la cual actúa como molécula de señalización (Borevits et a/., 2000).

CONCLUSIONES
Se indujo la formación de callos de Jamaica a partir de segmentos de hojas y células en suspensión en el medio de cultivo MS adicionado con 2 mg·L–1 de 2,4–D y 0.5 mg·L–1 de BAP. La mayor cantidad de compuestos fenólicos en callo se presentó al emplear los inductores: cinetina (1 mM) para la variedad China, sacarosa (60 g·L–1) para la variedad Reyna, así como ácido salicílico (0.01 mM) y jasmonato de metilo (100 μM) para la variedad Blanca. La disminución en la concentración de nitrógeno inorgánico de 30 mM a 7.5 mM, estimuló la biosíntesis y acumulación de antocianinas en las variedades de jamaica China y Reyna. La expresión de los genes ans y f3h están relacionados con la disminución en la fuente de nitrógeno del medio y la acumulación de antocianinas en células de jamaica de las variedades China y Reyna.
AGRADECIMIENTOS
A la Dirección General de Educación Superior Tecnológica (DGEST) por el financiamiento del proyecto.
LITERATURA CITADA
BOREVITZ, J. O.; XIA, Y.; BLOUNT, J.; DIXON, R. A.; LAMB, C. 2000. Activation tagging identifies a conserved MYB regulator of phenylpropanoid biosynthesis. Plant Cell 12: 2383–2394. [ Links ]
CHEN, S. A.; ZHAO, B.; WANG, X.; YUAN, X.; WANG, Y. 2004. Promotion of the growth of Carotus sativus cells and the production of crovin by rare earth elements. Biotechnology Letters 26: 27–30 [ Links ]
CLYDESDALE, F. M.; MAIN, J. H.; FRANCIS, F. J. 1979. Roselle (Hibiscus sabdariffa L.) anthocyanin as colorants for beverages and gelatin desserts. Journal of Food Protection 42: 204–207. [ Links ]
CORMIER, F.; CREVIER, H. A.; DO, C. B. 1990. Effects of sucrose concentration on the accumulation of anthocyanins in grape (Vitis vinifera) cell suspension. Canadian Journal of Botany 68: 1822–1825. [ Links ]
CORMIER, F.; DO, C. B. 1993. Vitis vinifera L. (Grapevine): In vitro production of anthocyanins. Biotechnology in Agriculture and Forestry Medicinal and Aromatic Plants 24: 373–386. [ Links ]
DO, C. B.; CORMIER, F. 1991. Effects of low nitrate and high sugar concentrations on anthocyanin content and composition of grape (Vitis vinifera L.) cell suspension. Plant Cell 9: 500â504. [ Links ]
FENNEMA, O. R. 2000. Química de los Alimentos. Vol. 2. Editorial ACRIBIA, S.A. Zaragoza, España. 1280 p. [ Links ]
GALICIA–FLORES, L. A.; SALINA–MORENO, Y.; ESPINOSA–GARCIA, B. M.; SANCHEZ–FERIA, C. 2008. Caracterizacion fisicoquímica y actividad antioxidante de extractos de Jamaica (Hibiscus sabdariffa L.) nacional e importada Rev. Chapingo Serie Horticultura 12(2): 121–129. [ Links ]
GIUSTI, M. M.; WROLSTAD, R. E. 2001. Anthocyanins. Characterization and measurement of anthocyanins by UV–Visible spectroscopy. Current Protocols in Food Analytical Chemistry. John Wiley & Sons, Incorporation. New York, USA. 13 p. [ Links ]
GLEITZ, J.; SEITZ, H. U. 1989. Induction of chalcone synthase in cell suspension cultures of carrot (Daucus carota L. spp. sativus) by ultraviolet light: evidence for two different forms of chalcone synthase. Planta 179: 323–330. [ Links ]
GÓMEZ–LEYVA, J. F.; MARTINEZ–ACOSTA, L. A.; LÓPEZ–MURAIRA, I. G.; SILOS–ESPINO, H.; RAMIREZ–CERVANTES F.; ANDRADE–GONZÁLEZ, I.. 2008. Multiple shoot regeneration of roselle (Hibiscus sabdariffa L.) from a shoot apex culture system. International Journal of Botany, 4: 326–330. [ Links ]
GRASSMANN, J.; HIPPELI, S.; ELSTNER, E. F. 2002. Plants defense and its benefits for animals and medicine: role of phenolics and terpenoids in avoiding oxygen stress. Plant Physiology and Biochemistry 40: 471–478. [ Links ]
GURROLA–DÍAZ, C. M., GARCÍA–LÓPEZ, P. M., SÁNCHEZ–ENRÍQUEZ, S., TROYO–SANROMÁN R., ANDRADE–GONZÁLEZ I., GÓMEZ–LEYVAJ. F. 2010. Effects of Hibiscus sabdariffa extract powder and preventive treatment (diet) on the lipid profiles of patients with metabolic syndrome (MeSy). Phytomedicine: 17(7): 500–505. [ Links ]
HIRASUNA, T. J.; SHULER, M. L.; LACKNEY, V. K.; SPANSWICK, R. M. 1991. Enhanced anthocyanin production in grape cell cultures. Plant Science 78: 107–120. [ Links ]
HIRUNPANICH, V; UTAIPAT, A.; PHUMALA–MORALES, N.; BUNYAPRAPHATSARA, N.; SATO, H.; HERUNSALE, A.; SUTHISISANG, C. 2006. Hypocholesterolemic and antioxidant effects of aqueous from the dried calyx of Hibiscus sabdariffa L. in hypercholesterolemic rats. Journal of Enthnopharmacology 103: 252–260. [ Links ]
JAAKOLA, L.; PIRTTILA, A. M.; HALONEN, M.; HOHTOLA, A. 2001. Isolation of high quality ARN from the bilberry (Vaccinium myrtillus L.) fruit. Molecular Biotechnology 19: 201–203. [ Links ]
KOKUBO, T.; AMBE–ONO, Y.; NAKAMURA, M.; ISHIDA, H.; YAMAKAWA, T.; KODAMA, T. 2001. Promotive effect of auxins on UDP–glucose: flavonol glucosyltransferase activity in Vitis sp cell cultures. Journal of Bioscience and Bioengineering 91: 564–569. [ Links ]
KONCZAK–ISLAM, I.; NAKATANI, M.; YOSHINAGA, M.; YAMAKAWA, O. 2001. Effect of ammonium ion and temperature on anthocyanin composition in sweet potato cell suspension culture. Plant Biotechnology 18: 109–117. [ Links ]
KRISA, S.; VITRAC, X.; DECENDIT, A.; LARRONDE, F.; DEFFIEUX, G.; MÉRILLON, J. M. 1999. Obtaining Vitis vinifera cell cultures producing higher amounts of malvidin–3–O–glucoside. Biotechnology Letters 21: 497–500. [ Links ]
LEGIZAMON G. V.; LEON, A. G.; SAÑUDO R. B. 2005. Antocianinas en uva (vitis vinifera L.) y su relación con el color. Rev. Fitotec. Mexicana 28(4): 359–368. [ Links ]
LUCZKIEWCZ, M., CISOWSKI, W. 2001. Optimization of the second phase of a two phase growth system for anthocyanin accumulation in callus culture of Rudbeckia hirta. Plant Cell Tissue and Organ Culture. 65: 57–68. [ Links ]
MURASHIGE, T.; SKOOG, F. 1962. A revised medium for rapid growth and bioassay with tobacco tissue cultures. Physiologia Plantarum 15: 473–479. [ Links ]
OZEKI, Y.; KOMAMINE, A. 1986. Effects of growth regulators on the induction of anthocyanin synthesis in carrot suspension cultures. Plant Cell Physiol. 27(7): 1361–1368. [ Links ]
RAJENDRAN, L.; RAVISHANKAR, G. A.; VENKATARAMAN, L. V.; PRATHIBA, K. R. 1992. Anthocyanin production in callus cultures of Daucus carota as influenced by nutrient stress and osmoticum. Biotechnology Letters 14: 707–712. [ Links ]
SAIGNE–SOULARD, C.; RICHARD, T.; MÉRILLON, J. M.; MONTI, J. P. 2006. 13C NMR analysis of polyphenol biosynthesis in grape cells: impact of various inducing factors. Analytica Chimica Acta 563: 137–144. [ Links ]
SANTACRUZ–RUVALCABA, F.; PORTILLO, L. 2009. Thin cell suspension layer as a new methodology for somatic embryogenesis in Agave tequi/ana Weber cultivar azul. Industrial Crops and Products 29: 609–614. [ Links ]
SCHEIBLE, W. R.; MORCUENDE, R.; CZECHOWSKI, T.; FRITZ, C. , OSUNA, D.; PALACIOS–ROJAS, N.; SCHINDELASCH, D. ; THIMM, O.; UDVARDI, M. K.; STITT, M. 2004. Genome–wide reprogramming of primary and secondary metabolism, protein synthesis, cellular growth processes, and the regulatory infrastructure of Arabidopsis in response to nitrogen. Plant Physiol. 136: 2483–2499. [ Links ]
TSAI, P. J.; MCINTOSH, J.; PEARCE, P.; CAMDEN, B.; JORDAN, B. R. 2002. Anthocyanin and antioxidant capacity in roselle (Hibiscus sabdariffa L.) extract. Food Research Intearntional 35: 351–356. [ Links ]
VINSON, J.; JANG, J.; YANG, J.; DABBAGH, Y.; LIANG, X.; SERRY, M.; PROCH, J.; CAI, S. 1999. Vitamins and especially flavonoids in common beverages are powerful in vitro antioxidants which enrich low density lipoproteins and increase their oxidative resistance after ex vivo spikingin human plasma. Journal of Agricultural Food Chemistry, 47: 2502–2504. [ Links ]
WATERMAN P. G.; MOLE, S. 1994. Analysis of phoneolic Plant Metabolites. Methods in Ecology. Blackwell Scientific Publications. Oxford, UK.238 p. [ Links ]
ZHANG, W. C.; HIDENARI, K.; MASAYUKI, N. 2004. To stretch the boundary of secondary metabolite production in plant cell–based bioprocessing: anthocyanin as a case study. J. Biomed. Biotechnol 5: 264–271. [ Links ]
ZHONG, J. J., YOSHIDA, T. 1995. Highdensity cultivation of Periolla frutescens cell suspensions for anthocyanin production: Effects of sucrose concentration and inoculums size. Enzyme Microb. Technol. 17(12): 1073–1079. [ Links ]














