Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo. Serie horticultura
versão On-line ISSN 2007-4034versão impressa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.17 no.1 Chapingo Jan./Abr. 2011
Presencia de fitoplasmas en papayo (Carica papaya) en México
The presence of phytoplasmas in papayo (Carica papaya) in Mexico
Reyna I. Rojas–Martínez1*; Emma Zavaleta–Mejía; Patricia Rivas–Valencia
1 Instituto de Fitosanidad (IFIT) Programa de Fitopatología, Colegio de Postgraduados, Montecillo, Estado de México. C. P. 56230 (*Autor para correspondencia)
Recibido: 13 de septiembre, 2010.
Aceptado: 24 de febrero, 2011.
Resumen
Tejido de plantas de papayo con síntomas de mosaico y amarillamiento rugoso provenientes de los estado de Michoacán y Veracruz se procesaron para detectar la posible presencia de fitoplasmas mediante la reacción en cadena de la polimerasa (PCR) usando iniciadores derivados del RNA ribosomal 16S y 23S de fitoplasmas. La secuencia de los productos amplificados mediante PCR fue homóloga con secuencias de nucleótidos pertenecientes a fitoplasmas. Los patrones de restricción obtenidos a partir de la digestión del ADN amplificado evidenciaron la presencia de dos fitoplasmas en plantas con los síntomas de mosaico y amarillamiento rugoso, uno de ellos perteneciente al grupo del amarillamiento del áster grupo 1 16S subgrupo C. Los patrones del otro fitoplasma no correspondieron a ninguno de los patrones de restricción con los que se compararon. En el tejido con síntomas de mosaico y amarillamiento rugoso, se obtuvo reacción positiva con el flourocromo 4,6–diamidino–2–fenilindol (DAPI) que tiñe ADN y que sugiere la presencia de ácidos nucleicos de agentes bióticos en el floema.
Palabras clave: PCR, RFLP, secuenciación.
Abstract
Tissue samples of papayo plants with mosaic and yellow crinkle symptoms collected from Michoacan and Veracruz were examined to detect phytoplasma with polymerase chain reaction (PCR), using primers derived from ribosomal RNA 16S and 23S from phytoplasmas. The sequences of the amplified PCR products were homologous to polynucleotide sequences belonging to phytoplasmas. The restriction patterns obtained through digestion of the amplified DNA evidenced the presence of two phytoplasmas in plants showing mosaic and yellow crinkle symptoms. One of them matched the aster yellow group 1 16S subgroup C. The patterns of the other phytoplasmas did not match any of the restriction patterns up to now reported. Tissue from diseased plants reacted positively to the fluororochrome–4,6–dyamidino–2– phenylindol (DAPI) which stains DNA, therefore suggesting the presence of nucleic acids from biotic agents inside the phloem.
Key words: PCR , RFLP, sequentiation.
INTRODUCCIÓN
El papayo (Carica papaya) es nativo de los trópicos americanos; actualmente es cultivado en áreas subtropicales y tropicales de todo el mundo, por la alta demanda de su fruto y para la extracción de papaína (Rivas, 2003). En México, para 2002 la exportación nacional de papayo fue de 68,558 t y se generó un ingreso de 30,080 dólares, ubicando al papayo en el tercer lugar de frutos tropicales y subtropicales de exportación (Faostat, 2005). Los principales estados mexicanos productores son Michoacán, Chiapas, Oaxaca, Tabasco y Veracruz. En México, la principal limitante fitosanitaria de la producción de papayo la constituyen las enfermedades inducidas por virus, destacando por su importancia la mancha anular del papayo variante P (PRSV–P). Esta enfermedad reduce considerablemente la calidad y el rendimiento de la fruta (Téliz et al., 1991). Los síntomas que induce este virus son: mosaico, deformación foliar, amarillamiento, achaparramiento y manchas anulares en el fruto (Noa–Carranza et al., 2006).
En Australia y otros países se ha detectado la presencia de fitoplasmas en tejido de plantas de papayo con síntomas putativos a virus (Gibb et al., 1996; Gibb et al., 1998; Lui et al., 1996). En México, hasta ahora, los síntomas de mosaico y amarillamiento han sido atribuidos a la presencia de virus; no obstante, además de los síntomas típicos de virus, se han observado plantas con manchas acuosas dispuestas en bandas en los pecíolos de hojas superiores y una disminución en el flujo de látex en los pecíolos de hojas removidas, síntomas que se han asociado con la presencia de fitoplasmas (Gibb et al., 1996; Gibb et al., 1998; Lui et al., 1996). Por lo antes mencionado, la presente investigación tuvo por objetivo detectar la presencia de fitoplasmas en tejido de papayo con síntomas putativos a virus y caracterizarlos de acuerdo a sus patrones de restricción (RFLP).
MATERIALES Y MÉTODOS
De plantas de papayo con síntomas de mosaico y amarillamiento rugoso, así como de plantas asintomáticas, se colectaron hojas y se extrajeron segmentos de aproximadamente 0.4 cm de longitud de la nervadura principal. El tejido fue fijado en glutaldehído al 2 % en amortiguador de fosfatos con pH 7, como lo describen Schaper y Converse (1985). El tejido fijado se cortó con un micrótomo de congelación (modelo 880, American Optical Instrument Co. Buffalo, N. Y., U. S. A); las secciones se tiñeron con los colorantes 4,6–diamidino–2– fenilindol (DAPI) en amortiguador de fosfatos al 0.1 M con pH 7, que tiñe DNA, y azul de anilina, que tiñe calosa. La observación de los cortes se realizó en un microscopio Zeizz (AxTolab) equipado con filtros de epiflourescencia. La combinación de filtros para observar los cortes fue: filtros de excitación H365, HB50 y una lámpara de mercurio. De hojas de papayo de plantas asintomáticas y con síntomas, colectadas en campo y almacenadas a –80 °C hasta su utilización (Cuadro 1), se extrajeron los ácidos nucleicos totales siguiendo la técnica descrita por Ahrens y Seemüller (1992). Para determinar la calidad y estimar la cantidad del DNA extraído, éste se corrió en un gel de agarosa al 1 %, se tiñó con bromuro de etidio y se visualizó en un transiluminador de luz UV.

Para la reacción en cadena de la polimeras (PCR), se utilizó DNA sin diluir o diluido 1/100. La detección de fitoplasmas se realizó con los iniciadores P1/Tin. Los productos resultantes de la amplificación se sometieron a una segunda amplificación (PCR anidada) con los iniciadores R16F2/R16R2. La mezcla de reacción consistió de 200 mM de trifosfato de deoxinucleótidos y 0.4–1.0 mM de cada iniciador, MgCl2 a 2,5 mM, y 5 U/μl de ADN DNA polimerasa amplificasa BIOGENICA®. La PCR fue realizada en un termociclador automático (Perkin–Elmer Cetus–Norwalk, CT., U. S. A.) bajo las siguientes condiciones: primer ciclo de desnaturalización inicial a 94 °C/2 min; 35 ciclos posteriores a 94 °C/1 min de desnaturalización; 2 min de anillamiento a 55 °C, y una extensión de 2 min a 72 °C, y, al término de los ciclos una extensión final, de 10 min. En cada corrida de PCR se utilizó como testigo negativo agua y como testigo positivo DNA de Catharanthus roseus infectado con fitoplasmas.
Los productos de PCR fueron analizados por electroforesis en un gel de agarosa al 1 %, teñidos con bromuro de etidio y visualizados en un transiluminador de luz UV.
Para definir en qué grupo se ubican los fitoplasmas asociados con los síntomas de mosaico y amarillamiento rugoso, los fragmentos del DNAr 16S del fitoplasma, amplificado por PCR con los iniciadores R16F2 y R16R2, se sometieron a digestión con endonucleasas de restricción. Para ello, 5mg de cada ADN amplificado fueron digeridos separadamente con las siguientes enzimas de restricción de acuerdo a las indicaciones del fabricante: AluI, Msel, Rsa, Hpal, Hpall, Hhal y EcoRI (GIBCO BRL, Bervely, MA. U. S. A.). Los productos de restricción fueron separados por electroforesis en un gel de poliacrilamida al 5 %, teñidos y visualizados de la manera descrita con anterioridad. Los patrones de bandas obtenidos se compararon con los reportados por Lee et al. (1998b).
Los productos de PCR se limpiaron utilizando el producto comercial Wizard PCR Preps (Promega®) según las instrucciones del fabricante y se secuenciaron en el laboratorio de secuenciación (secuenciador ABI Prime 377 de Perkin–Elmer Applied Biosystem, CT. U. S. A.) del CINVESTAV unidad Irapuato, México. Las secuencias de nucleótidos fueron analizadas usando el paquete MegAlign®.
RESULTADOS Y DISCUSIÓN
El tejido con síntomas de mosaico y amarillamiento rugoso reaccionó positivamente con el colorante DAPI; nervaduras y pecíolos de plantas con síntomas, mostraron fluorescencia de color azul intenso en los tubos cribosos del floema, lo que evidenció la presencia de ácidos nucleicos ajenos a la planta. Con PCR directa, se amplificó la banda correspondiente a fitoplamas solamente en muestras provenientes de los ejidos de la Huacana, Michoacán. Cuando los productos amplificados por PCR directa con los iniciadores P1/Tin se sometieron a PCR anidada usando el par de iniciadores R16F2/R16R2, se detectó la presencia de fitoplasmas en todas las muestras de papayo con síntomas de mosaico y amarillamiento rugoso provenientes de todas las localidades (Figura 1).
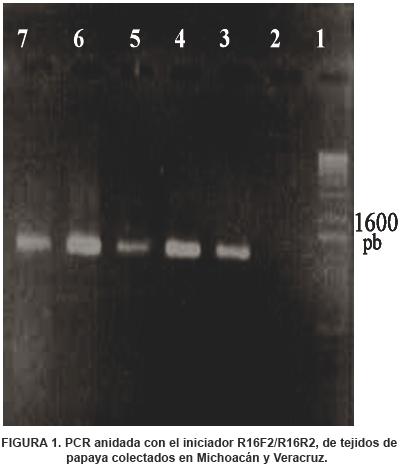
La digestión de los productos de PCR anidada con las siete enzimas de restricción utilizadas se analizaron tomando como referencia los patrones de restricción publicados por Lee et al. (1998b). Las restricciones obtenidas con las siete enzimas sugieren que los síntomas de mosaico y amarillamiento rugoso están asociados con dos fitoplasmas; la identidad de éstos sólo se pudo determinar para uno de ellos, y correspondió al grupo 16S I del amarillamiento del áster, subgrupo C, de acuerdo con el patrón de restricción obtenido con la enzima Alul (Figura 2). Los patrones de restricción del otro fitoplasma obtenido con las siete enzimas no correspondieron a ninguno de los reportados en la literatura (Figura 3).


Las secuencias parciales que se obtuvieron de los productos amplificados fueron depositadas en el GenBank con número de acceso AY081140; al comparar éstas con las secuencias depositadas en la base de datos, se encontró una homología del 98 % con el fitoplasma del grupo del amarillamiento del áster grupo 16SI, con número de acceso EU215425, AY249248.
DISCUSIÓN
Los síntomas observados en plantaciones de papayo en Veracruz y Michoacán son muy similares a los de la enfermedad comúnmente conocida como "amarillamiento rugoso" ("yellow crinkle") del papayo, que en otros países ha sido atribuida a la infección por fitoplamas (Gibb et al., 1996; Gibb et al., 1998; Harding y Teakle, 1988; Harding R. M. et al., 1991). En Australia, el fitoplasma asociado con la enfermedad llamada "amarillamiento rugoso" fue identificado como Yema Grande del Tomate (Greber, 1966). En el presente estudio ninguno de los dos fitoplasmas detectados en tejido de plantas enfermas correspondió al de Yema Grande del Tomate, y, de acuerdo con los patrones de restricción obtenidos, uno de ellos se caracterizó como amarillamiento del áster grupo 16SI subgrupo C.
Copias de segmentos de ADN del fitoplasma presente en muestras de DNA total son extensivamente amplificadas por PCR, lo cual ayuda y hace posible la detección de mezclas de fitoplasmas y de mezclas de fitoplasmas con otros fitopatógenos. La presencia de más de un fitoplasma en tejido de plantas enfermas así como la infección combinada con virus se ha reportado con cierta frecuencia en la literatura (Lee et al., 1998a; Holguín et al., 2007). Sin embargo, se desconoce por completo el efecto o impacto de estas infecciones múltiples sobre la expresión de síntomas y el metabolismo y fisiología del hospedante. En las muestras de papayo donde se detectaron fitoplasmas también estuvo presente el virus de la mancha anular del papayo (Rivas, 2003); consecuentemente, es difícil definir si la sintomatología presentada por las plantas de papayo enfermas es atribuible a los fitoplasmas o al virus, o si es el resultado de un efecto sinergista entre los patógenos detectados, ya que la expresión de síntomas depende de la concentración del patógeno en la planta, de la velocidad con que se reproduce, así como de las características inherentes al hospedante.
CONCLUSIONES
En tejido de hojas de papayo con síntomas de mosaico y amarillamiento rugoso provenientes de las regiones muestreadas en el estado de Veracruz se detectó la presencia del fitoplasma del grupo amarillamiento del áster (grupo (16SI) subgrupo C.
LITERATURA CITADA
AHRENS, U.; SEEMÜLLER, E. 1992. Detection of plant pathogenic mycoplasma–like organisms by polymerase chain reaction that amplified a sequences of the 16S rRNA gene. Phytopathology 82: 828–832. [ Links ]
FAOESTAT. 2005. http://apps.fao.org/faostat. Fecha de consulta: mayo de 2008. [ Links ]
GIBB, K. S.; PERSLEY, D. M.; SCHNEIDER, B.; THOMAS, J. E. 1996. Phytoplasmas associated with papayo disease in Australia. Plant Disease 80: 174–178. [ Links ]
GIBB K., S.; SCHNEIDER, B.; PADOVAN A., C.1998. Differential detection and genetic relatedness of phytoplasmas in papayo. Plant Pathology 47: 325–332. [ Links ]
GREBER, R. S. 1966. Identification of the virus causing papaw dieback disease in Australia. Queensland Journal of Agricultural and Animal Science 23: 147–153. [ Links ]
HARDING, R. M.; TEAKLE, D. S. 1988. Autoflourescence of necrotic phloem cell and laticifers, and a reduced latex flow: new symptoms for Papaw Dieback Disease in Australia. Australian Journal Agriculture Research 39: 857–862. [ Links ]
HARDING, R. M.; TEAKLE, D. S.; DALE, J. L. 1991. Double–stranded RNA in Carica papaya is not asssociated with dieback disease and likely to be of viral origin. Australian Journal Agriculture Research 42: 1179–1186. [ Links ]
HOLGUÍN P., R. J.; VÁZQUEZ J., R. C.; MARTÍNEZ S., J. P. 2007. First report of a 16SrI–B group phytoplasma associated with a yellows–type disease affecting tomato plants in the Baja California Peninsula of Mexico. Plant Disease 91: 328. [ Links ]
LEE, I. M.; GUNDERSON–RINDAL, D. E.; BERTACCINI, A. 1998a. Phytoplasma: Ecology and genomic diversity. Phytopathology 88: 1359–1366. [ Links ]
LEE, I. M.; GUNDERSEN–RINDAL, D. E.; DAVIS, E. D.; BARTOSZYK, M. I. 1998b. Revised classification scheme of phytoplasmas based on RFLP analyses of 16S rRNA and ribosomal protein gene sequences. International Journal of Systematic Bacteriology 48: 1153–1169. [ Links ]
LUI, B.; WHITE, T. D.; WALSH, B. K.; SCOTT, T. P. 1996. Detection of phytoplasmas in dieback, yellow crinkle, and mosaic diseases of papayo using polymerase chain reaction techniques. Australian Journal Agriculture Research 47: 387–394. [ Links ]
RIVAS, V. P., MORA AGUILERA, G; TÉLIZ ORTIZ, D.; MORA AGUILERA, A. 2003. Influencia de variedades y densidades de plantación de papayo (Carica papaya). Revista Mexicana de Fitopatología 21: 109–116. [ Links ]
SCHAPER, U.; CONVERSE, R. H. 1985. Detection of mycoplasmalike organisms in infected blueberry cultivars by DAPI technique. Plant Disease 69: 193–196. [ Links ]
TÉLIZ O., D.; MORA A., A.; NIETO A., D.; GONSALVES D.; GARCÍA P., E.; MATHEIS L., T.; ÁVILA, C., R.1991. Mancha anular del papayo en México. Revista Mexicana de Fitopatología 9: 64–68 [ Links ]
NOA–CARRANZA J. C.; GONZÁLEZ DE LEÓN D.; RUÍZ CASTRO B. S.; PIÑERO D.; SILVA ROSALES. 2006. Distribution of papaya ringspot virus and papaya mosaic virus in papaya plants (Carica papaya) in Mexico. Plant disease 90: 1004–1011. [ Links ]














