Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.17 no.1 Chapingo ene./abr. 2011
Cambios físicos y bioquímicos durante el desarrollo y senescencia de frutos de rambután (Nephelium lappaceum L.)
Physical and biochemical changes during the development and senescence of rambutan fruits (Nephelium lappaceum L.)
Juan Francisco Caballero–Pérez1; Lourdes Arévalo–Galarza1*; Carlos Hugo Avendaño–Arrazate2; Jorge Cadena–Iñiguez3; Guadalupe Valdovinos–Ponce1; Juan Francisco Aguirre–Medina2
1 Campus Montecillo. Colegio de Posgraduados. km 36.5 Carretera México–Texcoco. Montecillo, Estado de México. MÉXICO. Correo–e: larevalo@colpos.mx (*Autor para correspondencia).
2 Campo Experimental Rosario Izapa. INIFAP. km 18 Carretera Tapachula–Cacahoatán. Tuxtla Chico, Chiapas. MÉXICO.
3 Campus San Luis Potosí. Colegio de Postgraduados. Agustín de Iturbide Núm. 73. Salinas de Hidalgo, Salinas, San Luis Potosí. MÉXICO.
Recibido: 8 de octubre, 2010.
Aceptado: 24 de febrero, 2011.
Resumen
El objetivo de este estudio fue caracterizar los cambios físicos y bioquímicos durante el crecimiento, desarrollo y etapa postcosecha de los frutos de rambután de tres selecciones sobresalientes de Tuxtla Chico, Chiapas (RI–148, RI–115 y RI–104). Después de antesis se realizaron evaluaciones físicas y químicas en el crecimiento de los frutos y a la cosecha se evaluaron las características de calidad durante seis días a 22 ± 1 °C y humedad relativa de 65 %. Los resultados mostraron un patrón de crecimiento simple sigmoidal. Durante el desarrollo los frutos de las selecciones RI–148 y RI–115 tuvieron un peso fresco de 39.27 y 35.42 g y un contenido de arilo a la cosecha de 44.28 y 40.90 %, respectivamente, mientras que los del RI–104 fueron de menor tamaño (18.51 g), pero con mayor grosor de pericarpio, mostrando menor susceptibilidad a la oxidación. El número y longitud de espiternos del fruto no parecen determinar el grado de obscurecimiento de éste.
Palabras clave: Desarrollo de fruto, postcosecha, obscurecimiento, pericarpio.
Abstract
The aim of this research was to characterize the physical and biochemical changes during growth, development and postharvest of rambutan fruits in outstanding selections from Tuxtla Chico, Chiapas (RI–148, RI–115 and RI–104). After anthesis, chemical and physical parameters were evaluated in fruits; at harvest quality characteristics were evaluated at 22 ± 1 °C and 65 % RH. The results showed a sigmoidal pattern of growth. During development, fruits of the selections RI–148 and RI–115 had a fresh weight of 39.27 and 35.42 g and an aril content at harvest of 44.28 and 40.90 %, respectively, while those of the RI–104 were smaller (18.51 g) but with thicker pericarp, showing less susceptibility to oxidation. The number and length of spines does not seem to be the main factor related to fruit browning.
Key words: Fruit development, postharvest, browning, pericarp.
INTRODUCCIÓN
Nephelium lappaceum L. es un fruto tropical, originario de Malasia e Indonesia, apreciado por su sabor dulce, pulpa jugosa y contenido de vitamina C y riboflavina (Pérez y Jürgen, 2004). Tailandia es el principal productor mundial con 700,000 t, seguido por Indonesia con 350,000 t y Malasia con 70,000 t (Anónimo, 2004). Existen diferentes materiales a nivel mundial: en Malasia, R–134 y R–162; en Singapur, Jitlee, y en Tailandia, Rongrien (Lye et al., 1987), en los que se han realizado estudios de selección con fines de exportación, con base en variables químicas y físicas del fruto a la cosecha, como son forma, tamaño, color del pericarpio, proporción de arilo, sólidos solubles totales y acidez titulable (Nakasone y Paull, 1998; Vargas, 2003). Andrade et al. (2008) caracterizaron dos selecciones de rambután (B–03 y F–16) cultivadas en Brasil, con base en el tamaño del fruto, grosor del pericarpio, tamaño y peso de la semilla. En México, el cultivo de rambután fue introducido a la región del Soconusco, estado de Chiapas, entre 1950 y 1960, y a la fecha se estima una superficie cultivada de 2,000 hectáreas. En 2008 la producción de rambután fue de 865.6 t, con un valor total de 11.10 millones de pesos, siendo los principales estados productores Chiapas, Tabasco y Nayarit (SIAP, 2008). La aceptación en los mercados regionales y nacionales está posicionando al cultivo de rambután como alternativa económica en zonas frutícolas y cafetaleras del estado de Chiapas en áreas ubicadas entre los 100 y 700 m de altitud (Pérez y Jürgen, 2004). En los primeros materiales introducidos a la región de Tuxtla Chico, Chiapas, se realizaron trabajos de selección de genotipos, considerando el tamaño y peso del fruto, contenido de arilo y volumen de semilla al momento de la cosecha. Sin embargo, aun cuando se han detectado selecciones sobresalientes tales como la RI–148, RI–115 y RI–104, se desconocen sus características de crecimiento y las variables que determinan su calidad comercial (Fraire, 1999). Por lo anterior, el objetivo del presente trabajo fue caracterizar los cambios físicos y bioquímicos durante el crecimiento, desarrollo y senescencia de frutos de rambután de estos tres genotipos sobresalientes.
MATERIALES Y MÉTODOS
Localización del experimento y material vegetal
El experimento se llevó a cabo en el Campo Experimental Rosario Izapa, del Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP), en el municipio de Tuxtla el Chico, Chiapas, México, ubicado a los 14 °58' LN, 92° 9' LO, a una altitud de 435 m, con una temperatura media anual de 23.3 °C (INAFED, 2005), y suelo tipo andosol (Pérez y Jürgen, 2004). Se evaluaron los frutos de nueve árboles de 12 años de edad y en etapa reproductiva, injertados con las selecciones RI–148, RI–115 y RI–104 (tres árboles por selección). Cada 15 días después de la antesis (DDA) se midió el crecimiento y desarrollo de los frutos, considerando el diámetro y longitud de 90 frutos por selección (30 frutos por árbol). Por otro lado, cada 20 días se cosecharon 27 frutos por selección (nueve frutos por árbol) para determinar peso fresco, porcentaje de pericarpio y arilo, sólidos solubles totales y azúcares totales. Para evaluar su calidad se cosecharon 104 frutos por selección, en madurez de consumo (indicada por el pericarpio rojo brillante en el 80–90 % de la superficie del fruto) que se dividieron en tres grupos, de 72, 12 y 20 frutos, que se usaron para varias evaluaciones: 72 para medir las variables químicas (sólidos solubles totales, azúcares totales, acidez titulable y ácido ascórbico), considerando 12 frutos por día durante seis días; al grupo de 12 frutos se le midió durante seis días la pérdida de peso, intensidad respiratoria y grado de oxidación; finalmente, en el grupo de los 20 frutos se determinó la longitud y el número de espiternos. El almacenamiento de los frutos se hizo con una temperatura de a 22 ± 1 °C y una humedad relativa de 65 %.
Crecimiento y desarrollo del fruto
Durante el experimento se evaluaron las siguientes variables:
Diámetro y longitud del fruto. El diámetro se midió en la parte ecuatorial del fruto, en forma perpendicular a la sutura del pericarpio; la longitud se midió desde los extremos apical y basal del fruto con un vernier digital.
Peso fresco. Se determinó con una balanza electrónica (Ohaus Modelo AP210, New Jersey, USA).
Porcentajes de pericarpio y arilo. Se disectaron el pericarpio, el arilo y la semilla de cada fruto y se pesaron independientemente en una balanza electrónica (Ohaus Modelo AP210, New Jersey, USA).
Azúcares totales (AzT). Se utilizó el método de antrona descrito por Witham et al. (1971): para la solución madre se trituró 1 g de pulpa, se mezcló con 60 ml de etanol (80 %), y se colocó en ebullición por 10 min. De esta solución se tomó 1 ml para ser evaporado en baño maría; posteriormente, se diluyó en agua destilada (60–150 ml). Se tomó 1 ml de esta dilución y se ajustó el volumen a 3 ml con agua destilada en tubos de ensayo que se colocaron en baño de agua fría y se le agregaron 6 ml de la solución de antrona. Posteriormente, los tubos se colocaron en baño maría en ebullición por 3 min, se pusieron en agua fría y al final se leyó la absorbancia a 600 nm en un espectrofotómetro (Bausch & Lomb Modelo Spectronic 20, New York, USA), usando una curva estándar de glucosa como referencia.
Sólidos solubles totales (SST). Se raspó el arilo de cada fruto y se colocó en un cedazo para extraer el jugo, el cual se depositó en el refractómetro digital (Atago Modelo Palette 100, Tokio, Japón).
Cosecha y senescencia del fruto
El comportamiento postcosecha de los frutos fue evaluado a través del registro de las siguientes variables:
Número y longitud de espiternos. Se evaluaron al momento de la cosecha; la longitud se midió con un vernier digital, desde la base hasta el ápice.
Obscurecimiento del fruto. Se determinó diariamente durante seis días con base en una escala subjetiva: 1= oxidación total (100 %), 2= oxidación intensa (alrededor de 80 %), 3= oxidación media (alrededor de 50 %), 4= oxidación baja (alrededor de 30 %), 5= sin oxidación (<20 %).
Pérdida fisiológica de peso. Se calculó con la siguiente fórmula:
Pérdida fisiológica de peso (%) = [(Peso inicial–Peso final)/Peso inicial] x 100.
Intensidad respiratoria. Se determinó por cromatografía de gases, de acuerdo con el método estático (Salveit y Sharaf, 1992), utilizando un cromatógrafo de gases (Hewlett Packard Modelo 5890 Serie II, USA) equipado con un detector de conductividad térmica (TCD) y un detector de ionización de flama (FID). Se colocaron tres frutos por recipiente (unidad experimental) con volumen conocido y se cerró durante 1 hora. Posteriormente se tomó una muestra de 1 ml del espacio de cabeza y se inyectó en el cromatógrafo utilizando estándares de dióxido de carbono (492 mgL–1). Se realizaron cuatro repeticiones por selección.
Acidez titulable (AT). Se realizó con el método de la AOAC (1990).
Ácido ascórbico. Se determinó con base en el método del 2,6–diclorofenol indofenol (AOAC, 1990).
Análisis estadístico
Los datos obtenidos durante el crecimiento (diámetro y longitud), así como las de postcosecha (intensidad respiratoria, pérdida fisiológica de peso y contenido de ácido ascórbico) se graficaron en función del tiempo. Se consideró como tratamiento cada uno de los genotipos evaluados y un fruto como unidad experimental. A los resultados del contenido de pericarpio, arilo y semilla, así como a la pérdida de peso e intensidad respiratoria, se les realizó un análisis de varianza (diseño completamente al azar), y las medias se compararon con la prueba de Tukey con una P<0.05 (SAS Institute, 2002).
RESULTADOS Y DISCUSIÓN
Crecimiento y desarrollo del fruto
Diámetro y longitud de fruto. El crecimiento del fruto de rambután es de tipo sigmoidal, dividido en dos etapas. Las diferencias entre selecciones se deben principalmente a la duración de la etapa I, caracterizada por el crecimiento del pericarpio (Figuras 1: A y B). Las selecciones RI–115 y RI–148 mostraron mayor velocidad de crecimiento inicial que la selección RI–104.
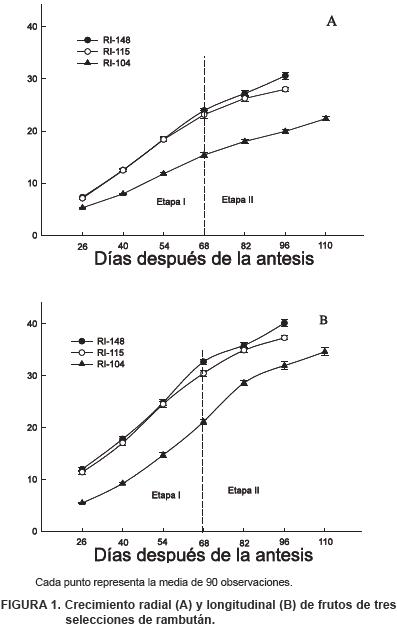
El periodo desde amarre hasta cosecha es similar a lo reportado por Van Welzen et al. (1988) en ciertos genotipos de rambután, con periodos de 107 a 111 DDA, pero menor con lo reportado por Landrigan et al. (1996), para el cultivar Rong Rein en la zona de producción del sureste asiático, cuyos frutos requieren de 105 a 126 DDA hasta la cosecha. En Tailandia, los frutos de rambután son cosechados desde los 90 hasta 120 días después de la floración (Kosiyachinda et al., 1987). Las diferencias en los periodos de crecimiento se atribuyen al estímulo del crecimiento (división y expansión celular) en los periodos iniciales de fruto, competencia por fuentes de carbohidratos o condiciones ambientales, como temperatura y humedad relativa (Schechter et al., 1993; Kóhne y Schutte, 1991; Ryugo, 1993).
Peso fresco. Con respecto a esta variable, las selecciones RI–148 y RI–115 mostraron un incremento notable y mayor que RI–104 a partir de los 46 DDA, alcanzando alrededor del 50 % de su peso total al día 75. En contraste, la selección RI–104 aceleró su crecimiento a partir del día 75, alcanzando 61 % de su peso a los 89 DDA y un peso fresco final de 18.51 g a los 103 DDA, el cual fue significativamente menor al de los frutos de RI–148 y RI–115; el incremento en la velocidad de crecimiento coincide con el crecimiento y desarrollo de las células del arilo (etapa II) (Figura 2).
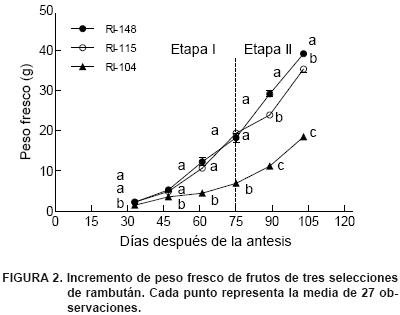
El tamaño del fruto depende de la velocidad de crecimiento durante la primera fase de la división celular del pericarpio, la cual se ve influida por la temperatura del aire que promueve un crecimiento temprano a través de los cambios en la tasa o ritmo de división celular (Nitsch, 1953); sin embargo, debido a que las tres selecciones se desarrollaron en el mismo ambiente, las diferencias pueden ser atribuidas mayormente a factores genéticos (Andrade et al., 2008).
Porcentajes de pericarpio y arilo. En cuanto al contenido de pericarpio, se observaron diferencias significativas entre las selecciones a partir de los 89 DDA. Al final de la evaluación (103 DDA), los frutos con mayor y menor contenido de pericarpio fueron las selecciones RI–104 y RI–148, respectivamente (Cuadro 1).
La semilla es detectable a partir de los 33 DDA (Cuadro 2). A los 103 DDA se observó que en la selección RI–104 la semilla representa casi el 20 % del peso del fruto; mientras que en las selecciones RI–148 y RI–115, su peso es de alrededor del 9 % del peso del fruto (Cuadro 2). Kawabata et al. (2007) señalan que el desarrollo de la semilla de frutos de rambután cv. Binjai inició antes de la sexta semana y terminó cuatro semanas después con el endurecimiento de los cotiledones.
La presencia de arilo se observó en los frutos de la selección RI–148 a partir de los 47 DDA; mientras que en las selecciones RI–115 y RI–104 fue a los 61 DDA. El contenido de arilo fue considerablemente mayor en los frutos de las selecciones RI–148 y RI–115 que en RI–104 (Cuadro 3). Andrade et al. (2008), muestran que hay diferencias notables en el contenido de arilo entre selecciones de rambután en Brasil, con 50.83 % en la selección B–03 y 18.04 % en la F–16.
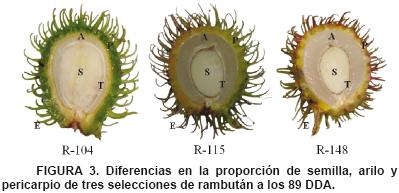
En la Figura 3 se muestran las diferencias morfológicas entre los componentes del fruto a los 89 DDA; en la selección RI–104 se presenta menor desarrollo del arilo con un pericarpio y testa de la semilla más gruesos, mientras que las selecciones RI–115 y RI–148 tienen mayor proporción de arilo, y en consecuencia pericarpio y testa con menor proporción.
Azúcares totales (AzT). El comportamiento de los azúcares totales (AzT) en los frutos, fue diferente entre selecciones y la acumulación máxima de AzT se presentó a los 103 DDA (Cuadro 4).
Sólidos solubles totales. Los resultados en cuanto a sólidos solubles totales son similares a los que se reportan en materiales de Costa Rica, como el R–134 con 18.3° Bx, o de Brasil con el genotipo B–67 con 19.5° Bx (Vargas, 2003; Andrade et al., 2008).
Cosecha y senescencia del fruto
Número y longitud de espitermos. En el Cuadro 5 se presentan los datos referentes a esta variable. El número de espitermos varió de 314 a 357, y la longitud de 10.7 a 11.9.
Oscurecimiento del fruto. El tiempo de oxidación de los frutos entre selecciones fue diferente. Los frutos de RI–115 mostraron el 30 % de oxidación a los dos días de la cosecha (DDC); los de RI–148, a los 3 DDC, y la selección RI–104 a los 4 DDC, manteniendo por más tiempo el color característico del fruto (Figura 4). El comportamiento de los frutos de la selección RI–104 se debió posiblemente a que presentó mayor grosor de pericarpio, el cual quizá contribuyó a reemplazar el agua perdida a través de los espiternos, mismos que se conectan vascularmente con el pericarpio. Al respecto Landrigan et al., (1996) mencionan que cuando el fruto muestra pérdidas de peso mayores a 20 %, la oxidación se hace evidente en los espiternos y entonces se extiende hacia el pericarpio en etapas avanzadas de deshidratación (Figura 4).

Pérdida fisiológica de peso. De lo mostrado en la Figura 5 se puede decir que la selección RI–115, aunque tiene menor número de espiternos con longitud intermedia, tiene mayores pérdidas de peso que los frutos de las selecciones RI–148 y RI–104 a los 4 DDC.

Intensidad respiratoria. Los patrones respiratorios de las tres selecciones fueron similares, y mostraron un comportamiento no climaterico con valores entre 26.07 y 52.4 ml·kg–1·h–1 de CO2 (Figura 6). Valores similares se reportan en frutos cv. Jit Lee, con 62 mg·kg–1·h–1 de CO2 a 25 °C, y para frutos del cv. Rongrien con 76.35 mg·kg–1·h–1 de CO2, con cuatro días de almacenamiento a 13 °C (McLauchlan et al., 1994; Wongs y Kanlayanarat, 2005).

Acidez titulable (AT). La AT expresada como porcentaje de ácido cítrico se mantuvo con poca variación (0.25–0.46%) durante el periodo postcosecha, con valores similares a lo reportado por Kader (2006) de 0.36 % (Cuadro 6).
Azúcares totales (AzT) y sólidos solubles totales (SST). El rambután no mostró variación fuerte en el contenido de AzT y SST durante el período postcosecha (Cuadro 6).
Ácido ascórbico. El contenido de ácido ascórbico entre la cosecha y el sexto día de almacenamiento varió de 31.15 a 16.33 mg–100 ml–1 para RI–148; de 25.12 a 14.91 mg–100 ml–1, para RI–115, y de 28.27 a 14.19 mg–100 ml–1, para RI–104. Al respecto, Paull y Chen (1987) reportan un comportamiento similar en rambután, con pérdidas del 61 % de ácido ascórbico entre la cosecha y seis días de almacenamiento.
CONCLUSIONES
El crecimiento de los frutos de rambután fue simple sigmoidal, característica de especies de la familia Sapindaceae. Durante el crecimiento de los frutos, las selecciones RI–148 y RI–115 fueron más precoces en alcanzar la madurez de consumo, tuvieron mayor tamaño y mayor acumulación de arilo, y presentaron menor porcentaje de volumen de semilla al momento de la cosecha, mientras que los frutos de RI–104 tuvieron mayor contenido de pericarpio y semilla. Los cambios en el contenido de azúcares y acidez de las tres selecciones son similares a las variedades comerciales reportadas para rambután. El número y tamaño de los espiternos del fruto no parece ser el factor determinante en la susceptibilidad a la oxidación del fruto. Después de la cosecha, los frutos de rambután muestran una tasa de respiración moderada, con cambios bioquímicos poco significativos. La selección RI–104 tiene menor susceptibilidad a la oxidación con un contenido de azúcares aceptable, pero con una proporción de arilo muy baja..
AGRADECIMIENTOS
A la Línea Prioritaria de Investigación en Inocuidad, Calidad de Alimentos y Bioseguridad (LPI–7), Campus Montecillo, Colegio de Posgraduados. Al Consejo Nacional de Ciencia y Tecnología (CONACYT) a través de la beca No. 166364 y al Campo Experimental Rosario Izapa del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), por el apoyo económico y técnico para la realización de la presente investigación.
LITERATURA CITADA
AOAC. 1990. Association of Official Analytic Chemists. William Horwitz (ed.). 12th edition. Washington, D. C., USA. 1094 p. [ Links ]
ANDRADE, R. A.; DE MACEDO, L. E. G.; GERALDO, M. A. B.; PAULA, R. C.; PITTA, J. J. L. 2008. Caracterização morfológica e química de frutos de rambután. Revista Brasileira de Fruticultura Jaboticabal–SP 30(4): 958–963. [ Links ]
ANÓNIMO. 2004. Compendio sobre las frutas tropicales. FAO. Organización de las Naciones Unidas para la Agricultura y la Alimentación. Roma, Italia. 16 p. [ Links ]
FRAIRE V., G. 1999. Informe Técnico del Campo Experimental Rosario Izapa. CIRPS–INIFAP–SAGDR. Campo Experimental Rosario Izapa. Tuxtla Chico, Chiapas, México. 34 p. [ Links ]
INAFED. 2005. Los municipios del estado de Chiapas. Instituto Nacional para el Federalismo y el Desarrollo Municipal. Enciclopedia de los municipios de México. www.inafed.gob.mx/work/templates/enciclo/chiapas/municipios/municipios.htm. (Consultado el 26 de julio, 2010). [ Links ]
KADER, A. A. 2006. Rambután (Mamón Chino) Recomendaciones para mantener la calidad postcosecha. University of California, Davis. Postharvest Technology Research & Information Center. Davis, California, USA. 2 p. [ Links ]
KAWABATA, A. M.; NAGO, M. A.; TSUMURA, T.; AOKI, D. F.; HARA, K. Y.; PENA, L. K. 2007. Phenology and Fruit Development of Rambutan (Nephelium lappaceum L.) Grown in Hawai'i. Journal Hawaiian Pacific Agriculture 14: 31–39. [ Links ]
KÖHNE, J. S.; SCHUTTE, J. M. 1991. Increasing Hass fruit size. South African Avocado Growers' Association Yearbook 14: 38–40. [ Links ]
KOSIYACHINDA, S.; LAM, P. F.; MENDOZA JR., D. B.; BROTO, W.; WANICHKUL, K. 1987. Maturity indices for harvesting of rambutan, pp. 32–37. In: Rambutan: Fruit Development, Postharvest Physiology, and Marketing in ASEAN. Lam, P. F.; Kosiyachinda, S. (eds.). ASEAN Food Handling Bureau. Jakarta, Indonesia. 82 p. [ Links ]
LANDRIGAN, M.; MORRIS, S. C.; EAMUS, D.; MCGLASSON, W. B. 1996. Postharvest water relationships and tissue browning of rambutan fruit. Scientia Horticulturae 66: 201–208. [ Links ]
LYE, T.; LAMSKI, S.; MASPOL, P.; YONG, S. K. 1987. Commercial Rambutan Cultivars in ASEAN. pp. 9–15. In: Rambutan: Fruit Development, Postharvest Physiology and Marketing in ASEAN. LAM P. F.; KOSIYANCHINDA S. (eds.). ASEAN Food Handling Bureau. Jakarta, Indonesia. 82 p. [ Links ]
MCLAUCHLAN, R. L.; BARKER, L. R.; PRASAD, A. 1994. Temperature effects on respiration of rambutan and carambola, pp. 38–39. In: Queensland Department of Primary Industries, Horticulture Postharvest Group Biennial Review. McLAUCHIAN, R; MEIRBURG, G.; BAGSHAW, J. (eds). Department of Primary Industries, Brisbane, Qld. [ Links ]
NAKASONE, H. Y; PAULL R. E. 1998. Tropical fruits. CAB International. New York. USA. 445 p. [ Links ]
NITSCH, J. P. 1953. The physiology of fruit growth. Annual Review of Plant Physiology 4: 199–236. [ Links ]
PAULL, R. E.; CHEN, J. N. 1987. Changes in longan and rambutan during postharvest storage. Hortscience 22(6): 1303–1304. [ Links ]
PÉREZ R., A.; JÜRGEN, P. A. 2004. Prácticas de cosecha y poscosecha del rambután en el Soconusco, Chiapas, México. Revista de Agroecología 20(3): 24–26. [ Links ]
RYUGO, K. 1993. Fruticultura ciencia y arte. AGT Editor S. A., D.F., México. 460 p. [ Links ]
SAS. 2002. SAS/STAT Guide for personal computers. Version 9. SAS Institute N. C. USA. 890 p. [ Links ]
SIAP. 2008. Sistema de Información Agroalimentaria de Consulta. Servicio de Información Agroalimentaria y Pesquera. www.siap.gob.mx (Consultado el 26 de julio, 2010). [ Links ]
SALVEIT, M. E.; SHARAF, A. R. 1992. Ethanol inhibits ripening of tomato fruit harvested at various degrees of ripeness without affecting subsequent quality. Journal of the American Society for Horticultural Science 117(5): 793–798. [ Links ]
SCHECHTER, I.; PROCTOR, J. T. A.; ELFVING, D. C. 1993. Characterization of seasonal fruit growth of 'Idared' apple. Scientia Horticulturae 54: 203–210. [ Links ]
VAN WELZEN, P. C.; LAMB, A.; WONG, W. W. W. 1988. Edible Sapindaceae in Sabah. Nature Malaysiana 13: 10–25. [ Links ]
VARGAS, A. 2003. Descripción morfológica y nutricional del fruto de rambutan (Nephelium lappaceum). Agronomía mesoamericana 14(2): 201–206. [ Links ]
WITHAM, F. H.; BLAYDES, D. F.; DEVLIN, R. M. 1971. Experiments in Plant Physiology. Van Nonstrand Reinhold C. New York, USA. 245 p. [ Links ]
WONGS, A. C.; KANLAYANARAT, S. 2005. CaCl2 applications on storage quality of rambutan. Acta Horticulturae 687: 213–217. [ Links ]














