Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.15 spe Chapingo ene. 2009
Encapsulación de embriones somáticos de Laelia anceps ssp. dawsonii para la producción de semilla sintética
Somatic embryoids encapsulation of Laelia anceps ssp. dawsonii to produce synthetic seed
H. E. Lee–Espinosa1*, J. Murguía–González1, A. Laguna–Cerda2, B. García–Rosas1, M. R. Gámez–Pastrana1, M. E. Galindo–Tovar1, I. Landero–Tórres1, L. Iglesias–Andreu3 y N. Santana–Buzzy4
1 Universidad Veracruzana. Facultad de Ciencias Biológicas–Agropecuarias, Laboratorio de Micropropagación Vegetal. Carretera Peñuela–Amatlán, km 1, Peñuela, municipio de Amatlán de los Reyes, Veracruz. México. Tel–Fax: (271)71–66410 y 66129. Correo–e: hlee@uv.mx (*Autor responsable).
2 Universidad Autónoma del Estado de México, Programa de Maestría y Doctorado en Ciencias Agropecuarias y Recursos Naturales, Centro Universitario "El Cerrillo", km 15 Carretera Toluca–Ixtlahuaca. México.
3 Laboraborio de Biotecnología y Ecología Aplicada (LABIOTECA), Universidad Veracruzana. Campus para la cultura, las Artes y el Deporte, Xalapa, Veracruz,C. P. 91001, México.
4 Unidad de Bioquímica y Biología Molecular de Plantas, Centro de Investigación Científica de Yucatán, Calle 43 Núm. 130, Chuburná de Hidalgo. Mérida, Yucatán, C. P. 97200, México.
Recibido: 29 de abri, 2009
Aceptado: 17 de septiembre, 2009
Resumen
Los embriones somáticos de Laelia anceps ssp. dawsonii, obtenidos a partir de semillas germinadas en un medio MS suplementado con ácido naftalen–acético (ANA), 6, bencilaminopurina (BAP) y ácido indol–3–acético (AIA), 2 mg·litro–1 de cada uno fueron encapsulados en matriz de alginato de sodio en complejo con cloruro de calcio (CaCl2·2H2O) 75 mM, para producir semillas sintéticas, como una estrategia de rescate y conservación. Para determinar el efecto de factores físicos y químicos tales como temperatura y tiempo de almacenamiento, consistencia de la matriz de alginato, concentración de nutrimentos minerales y reguladores del crecimiento vegetal, sobre el porcentaje y tiempo de germinación, así como viabilidad de las semillas sintéticas, se probaron concentraciones de alginato de sodio al 2.0, 3.0 y 4.0%, de sales de MS (37.5, 50 y 100%) y BAP (0.5, 1.0 y 2.0 mg·litro–1) adicionados a la matriz de encapsulación, además de diferentes temperaturas (4, 20 y 25 °C) y tiempos de almacenamiento (15 y 30 días). Se observó el 100% de germinación cuando las semillas fueron encapsuladas con 3% de alginato de sodio en complejo con CaCl2·2H2O a 75 mM; con las sales MS al 100 y 50% en la matriz de encapsulación, suplementando 2.0 mg·litro–1 de BAP, se logró un porcentaje de germinación del 64.54 y 62.77%, respectivamente, sin existir diferencia significativa entre ellas.
Palabras clave: Orchidaceae, semilla artificial, embriogénesis somática.
Abstract
Somatic embryoids obtained from germinated seeds in an MS culture media supplemented with naphthalene acetic acid (NAA), 6, bencylaminopurine (BAP) and indole–3–acetic acid (IAA), 2 mg·liter–1 each, were encapsulated in sodium alginate in complex with calcium chloride (CaCl2·2H2O) 75 mM matrix, to produce synthetic seeds, as a rescue and conservation strategy. In order to determinate the effect of physical and chemical factors, such as stored temperature and time, sodium alginate consistency, and mineral nutriments an plant growth regulators concentration on percentage and time for germination, and the viability of the synthetic seeds, different concentrations of: sodium alginate (2.0, 3.0 and 4.0%), MS salts (37.5, 50 and 100%) and BAP (0.5, 1.0 and 2.0 mg·liter–1) added to the encapsulation matrix, were tested at different temperatures (4, 20 and 25 °C) and incubation times (15 and 30 days). A hundred percent germination of synthetic seeds was obtained when 3% sodium alginate in complex with CaCl2·2H2O at 75 mM was used; MS salts at 100 and 50% and 2.0 mg·liter–1 BAP supplemented to the encapsulation matrix, achieved 64.54 y 62.77% germination rate, respectively. No meaningful difference was observed between concentrations.
Key words: Orchidaceae, artificial seed, somatic embryogenesis.
INTRODUCCIÓN
La propagación vegetal utilizando semilla sintética o artificial, desarrollada con embriones somáticos o cigóticos, abre una nueva visión en la agricultura. La semilla sintética constituye una técnica promisoria, pudiéndose aplicar a la propagación de plantas que no producen semillas, o poliploides con características élite y líneas vegetales con problemas de propagación (Redenbaugh, 1993). La tecnología de semilla sintética puede tener un impacto significativo en la producción de cultivos, tanto en los de propagación vegetativa como en los que se propagan por semilla. Para la propagación vegetativa de plantas, la semilla sintética permitiría la siembra directa de variedades clonadas y puede proveer un medio para el mantenimiento de germoplasma élite. De esta manera, la semilla sintética puede convertirse en una tecnología que posibilite el escalamiento extensivo requerido para la producción comercial de clones élite (Bornmann, 1993). La producción de semillas sintéticas por encapsulación de embriones somáticos y propágulos vegetativos está convirtiéndose rápidamente en una técnica aplicada con potencial para la propagación masiva de especies vegetales élite. Las ventajas del uso de la semilla artificial, incluyen la facilidad de manipulación, transportación y almacenamiento, potencial para el escalamiento y bajos costos de producción y subsecuente propagación (Ganapathi, 2001). En muchos sentidos el protocolo para la producción de semilla sintética imita el desarrollo cigótico, la producción de semilla, y la siembra en campo, lo cual no es sorprendente, ya que el objetivo de la tecnología de semilla sintética es producir análogos de semillas naturales (Redenbaugh, 1993).
Las atractivas características de la orquídea silvestre Laelia anceps ssp. dawsonii, han despertado gran interés, provocando su sobre colecta para venderla como planta para maceta, así como sus flores cortadas, por lo que actualmente se encuentra en peligro de extinción (Halbinger, 1993) y se incluye en la Norma Oficial Mexicana NOM–059–ECOL–2001. Aunado a esta situación, se encuentra su baja tasa de propagación, ya que al igual que en las demás orquídeas, sus semillas carentes de endospermo poseen baja capacidad de germinación (1–5%), relacionada con la obligatoria asociación micorrízica (Martin y Pradeep, 2003).
El desarrollo de metodologías que permitan la propagación eficiente de esta especie, representa una alternativa viable para su conservación y uso sustentable, así como una estrategia para evitar la colecta de ejemplares en la naturaleza. Debido a que los embriones somáticos (ESs) todavía no son tan robustos y vigorosos como los embriones cigóticos, ha sido imposible de manera rutinaria producir grandes cantidades de semillas sintéticas que pueden plantarse como semillas verdaderas con su característico desarrollo en el invernadero y campo; a la fecha se han desarrollado muchos de los más recientes conceptos para esta tecnología, por lo que científicos de todo el mundo han trabajado para el mejor entendimiento de la embriogénesis somática, la cual ha sido y sigue siendo la principal limitación para la comercialización de semilla sintética (Redenbaugh, 1993).
Hasta este momento, el sistema de semilla sintética más avanzado es el de alfalfa (Medicago sativa L.), debido principalmente a que es en esta especie, entre otras muy pocas, que se ha alcanzado calidad de los embriones, hasta el punto donde se acompaña de la plantación directa en campo. Se han logrado avances en embriogénesis somática para varias especies en los últimos diez años, sin embargo, no se han desarrollado nuevas cubiertas para semilla sintética desde inicios del decenio de 1980 cuando por primera vez fueron utilizados el polioxietileno y el alginato de sodio (Redenbaugh, 1993).
El uso de la tecnología de semilla artificial para el rescate y la conservación de Laelia anceps ssp. dawsonii, aún no ha sido desarrollado, sin embargo, se cuenta con el protocolo para su propagación por la ruta de la embriogénesis somática (Lee et al., 2007) que permite su propagación masiva y la obtención de material ideal para la encapsulación, por lo que en el presente estudio, se analizarán los factores que influyen en el mantenimiento de la viabilidad durante el almacenamiento, así como la germinación de embriones somáticos encapsulados en esta especie, para la creación de semilla sintética, como un sistema de rescate y conservación.
MATERIALES Y MÉTODOS
La presente investigación consistió en la encapsulación de embriones somáticos de Laelia anceps ssp. dawsonii, en estado de plúmula, en matriz de alginato en complejo con cloruro de calcio, y posteriormente el estudio del efecto que tiene ciertos factores físicos y químicos, como temperatura y tiempo de almacenamiento, concentración de alginato, concentración de sales MS y BAP, sobre el porcentaje y tiempo de germinación de los embriones encapsulados, a fin de desarrollar un sistema de producción de semilla sintética para esta especie. Los experimentos se llevaron a cabo en el laboratorio de Micropropagación Vegetal de la Facultad de Ciencias Biológicas y Agropecuarias, de Córdoba, Ver., Universidad Veracruzana, ubicada a 817 metros de altitud, 21°21'22''LN y 97°41'08''LW.
Encapsulación de los embriones somáticos
Fuente de embriones somáticos para encapsulación. Los embriones somáticos de Laelia anceps ssp. dawsonii, se obtuvieron de callo embriogénico desarrollado en embriones cigóticos maduros, en un medio de cultivo MS (1962) suplementado con 2 mg·litro–1 de ANA, BAP y AIA, de cada uno, en un período de aproximadamente tres meses a partir de la siembra in vitro. Estos embriones somáticos se utilizaron como explantes para la encapsulación y producción de semilla sintética. Con la finalidad de obtener resultados confiables, se seleccionaron aquéllos que se encontraban cercanos al estado de plúmula (Figura 1), carentes de raíz, los cuales se cosecharon a los 40 días de su desarrollo in vitro.

Preparación de la matriz de encapsulación. Para la encapsulación de los embriones somáticos se utilizó una matriz que contenía alginato de sodio (Compañía Química Sigma, St. Louis, MO) en complejo con cloruro de calcio di hidratado (CaCl2·2H2O). Las dos soluciones fueron preparadas como se describe a continuación:
1) Alginato de sodio en concentraciones de 2, 3 y 4% disuelto en solución de sales MS al 100, 50 y 37.5% sin cloruro de calcio (CaCl2 ·2H2O).
2) CaCl2 ·2H2O a una concentración de 75 mM disuelto en solución de sales MS al 100, 50 y 37.5% adicionadas con la concentración normal de cloruro de calcio di hidratado.
Proceso de encapsulación. Los embriones somáticos fueron colectados (Figura 2 A, B) de las cajas de petri (100 x 15 mm) y en condiciones asépticas, se suspendieron en la solución de alginato de sodio, y con micro pipeta de 5.0 – 500 μl, se tomaron y suspendieron en la solución de cloruro de calcio (Figura 2 C), contenida en un matraz erlenmeyer de 500 ml, goteándolos de manera individual. Una vez suspendidos, se colocó el matraz erlenmeyer en un agitador rotatorio, a 150 rpm durante 30 min para ayudar a dar forma esférica al cotiledón de la semilla sintética. Para la recuperación de las semillas se decantó el cloruro de calcio y se efectuaron dos lavados con agua destilada esterilizada. Las semillas sintéticas se almacenaron en cajas de petri previamente esterilizadas (Figura 2 D) y se sellaron, manteniéndolas en refrigeración a 3.0 ± 1 °C.

Condiciones de incubación. Los experimentos para la determinación de viabilidad, desarrollo, porcentaje y tiempo de germinación, se llevaron a cabo utilizando cajas de petri (100 x 15 mm) previamente preparadas con papel filtro Núm. 541, humedecido con agua destilada esterilizada al momento del establecimiento de las semillas, preparadas de acuerdo a los diferentes experimentos establecidos; una vez que las semillas fueron sembradas, las cajas de petri se sellaron y colocaron en cuarto de incubación a fotoperiodo de 16 h y flujo fotónico de 33.78 μm·m–2·s–1 en las diferentes temperaturas probadas para cada uno de los experimentos.
Efecto de la concentración de alginato de sodio y BAP sobre el desarrollo y germinación de embriones somáticos encapsulados de Laelia anceps ssp. dawsonii
Para determinar la consistencia adecuada de la matriz de encapsulación de las estructuras somáticas, que permitiera su germinación y desarrollo para facilitar el transporte y distribución de las mismas, se probaron concentraciones de alginato de sodio al 2, 3 y 4% en combinación con BAP a 0.5, 1.0 y 2.0 mg·litro–1, en un diseño completamente al azar con arreglo factorial y 15 repeticiones por tratamiento, considerando como unidad experimental a cada embrión somático encapsulado. Se utilizó el medio de cultivo MS suplementado con 5 ml·litro–1 de solución de vitaminas MS, 100 mg·litro–1 de myo–inositol y 1.0 mg·litro–1 de ANA.
Se utilizaron embriones somáticos en la fase de plúmula no desarrollada, los cuales una vez encapsulados con el tratamiento correspondiente fueron colocados en cajas de petri de 100 x 15 mm conteniendo papel filtro Núm. 541, humedecido con agua destilada esterilizada. Se evaluó el porcentaje de germinación y el tiempo en días requerido para la iniciación de la primera hoja y la primera raíz, en 15 semillas sintéticas por tratamiento, efectuando el registro del incremento en masa embrionaria con ayuda de un microscopio estereoscópico Motic® modelo: SMZ–143. También se registraron los cambios de coloración durante el desarrollo y germinación de los embriones somáticos.
Efecto de la concentración de sales minerales, temperatura y tiempo de almacenamiento sobre el desarrollo y germinación de embriones somáticos encapsulados de Laelia anceps ssp. dawsonii
Para determinar la concentración de nutrimentos minerales, el tiempo y la temperatura de almacenamiento óptimos para la conservación y eventual viabilidad de las estructuras encapsuladas, se estableció un experimento completamente al azar, arreglo factorial 3 x 3 x 2 y tres repeticiones consistentes cada una en cuarenta y cinco semillas sintéticas, donde se probaron tres concentraciones de las sales inorgánicas de Murashige y Skoog: 100, 50 y 37.5%, tres temperaturas de incubación: 4, 20 y 25 °C y dos tiempos de almacenamiento: 15 y 30 días, sobre el desarrollo y la viabilidad de los embriones somáticos de Laelia anceps ssp. dawsonii.
Para realizar las evaluaciones, se observó el proceso de germinación en las semillas sintéticas, a los 15 y 30 días de su desarrollo in vitro bajo las condiciones particulares de cada uno de los tratamientos probados, con ayuda de microscopio estereoscópico Motic® modelo SMZ–143, realizando el registro fotográfico correspondiente, y considerando para el recuento, la aparición del primer primordio foliar en cada semilla sintética.
Condiciones de cultivo
El experimento se llevó a cabo en todos los casos bajo condiciones de fotoperiodo de 16 h y flujo fotónico de 33.78 μm·m–2·s–1. Para la matriz de encapsulación se utilizó alginato de sodio al 3% (P/V), previamente determinado como concentración óptima, disuelto en el medio líquido de MS a las concentraciones probadas, y suplementado con 1 mg·litro–1 de BAP y 1 mg·litro–1 de ANA, que probó ser la mejor combinación de reguladores de crecimiento para la germinación de las semillas sintéticas, en el experimento anterior.
Análisis estadístico de los datos
Los datos fueron procesados mediante un análisis de varianza, utilizando el paquete estadístico SAS System, 1989–1997, Versión 6.12, SAS Institute INC. Cary, NC, USA, y discriminados con la prueba de comparación de medias de Tukey P≤0.05 (Steel y Torrie, 1980).
RESULTADOS
Efecto de la concentración de alginato de sodio y BAPsobre el desarrollo y germinación de embriones somáticos encapsulados de Laelia anceps ssp. dawsonii.
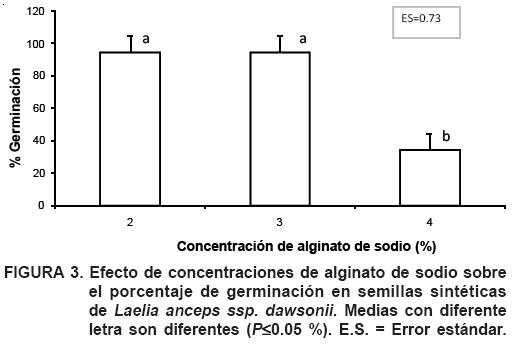
Se encontró una relación directa entre la concentración de BAP y el porcentaje de germinación; y una relación inversa entre la concentración de alginato y el porcentaje de germinación. En el primer caso, a medida que aumentó la concentración de alginato de sodio a 4%, disminuyó el porcentaje de germinación a 30% (Figura 3). Conforme la concentración de BAP aumentaba, se observó un incremento en el porcentaje de germinación, independientemente de la concentración de alginato (Figura 4); se encontró diferencia significativa entre 0.5 mg·litro–1 de BAP, con un 66.6%, de germinación, y las concentraciones de 1.0 y 2.0 mg·litro–1, con el 76.6 y 80% de germinación, respectivamente, aunque entre éstas no hubo diferencia significativa.

El análisis de la interacción entre los factores, permitió constatar, que 2.0 mg·litro–1 de BAP, estimularon un 100% de germinación de las semillas, cuando la concentración de alginato era del 2 y 3%, disminuyendo a 97%, al bajar la concentración de BAP a 1.0 mg·litro–1, cuando se utilizó el 2% de alginato de sodio, sin embargo, esta diferencia no fue estadísticamente significativa (5.644, 18,0.004).
Una concentración del 3% de alginato de sodio en la matriz de encapsulación, indujo igualmente, el 100% de germinación de las semillas sintéticas, cuando se utilizaban 1.0 y 2.0 mg·litro–1 de BAP. Cuando se utilizó el alginato de sodio al 2%, únicamente se lograba el 100% de germinación con 2.0 mg·litro–1 de BAP, disminuyendo al 97% cuando la concentración de BAP descendía a 1.0 mg·litro–1, sin apreciarse diferencias significativas entre estos cuatro tratamientos; sin embargo, a la concentración de alginato de 4%, independientemente de la concentración de BAP, el porcentaje de germinación descendió a un 30, 31 y 41.6% con 0.5, 1.0 y 2.0 mg·litro–1 de BAP, respectivamente (Figura 5).

El alginato fue el factor que tuvo mayor influencia sobre el porcentaje de germinación, existiendo diferencias significativas entre estos tres últimos tratamientos y todos los tratamientos que contenían 2 y 3% de alginato de sodio en la matriz de encapsulación (7532, 18,0.001). De igual forma, en relación al tiempo requerido para la germinación se detectó una interacción entre las concentraciones de alginato de sodio con la concentración de BAP utilizada en la matriz de encapsulación; así, se observó que a mayor dureza de la cápsula (% alginato de sodio), aumentó el tiempo de germinación a 57 días en combinación con 0.5 mg·litro–1 de BAP y hasta 54 días con 2.0 mg·litro–1 de BAP. En contraste, cuando se utilizó un 2% de alginato de sodio, en combinación con 1.0 y 2.0 mg·litro–1 de BAP en la matriz de encapsulación, el tiempo de germinación fue de 14 y 12 días, respectivamente (2.254,18,0.104). La concentración de alginato de sodio utilizada al 3% indujo la germinación de las semillas sintéticas en 25, 31 y 37 días, cuando se utilizaron concentraciones de BAP de 2.0, 1.0 y 0.5 mg·litro–1, respectivamente (Cuadro 1).

Influencia de la concentración de sales minerales, temperatura y tiempo de almacenamiento sobre el desarrollo y germinación de embriones somáticos encapsulados de Laelia anceps ssp. dawsonii.
Se observó interacción entre el porcentaje de germinación y la temperatura y tiempo de almacenamiento; el 100% de las semillas germinaron a 25 °C, que fue la temperatura más alta, a los 11 días de incubación, con las sales MS al 100% de concentración, lo cual demuestra que las mayores concentraciones de éstas, produjeron mayores porcentajes de germinación, disminuyendo a medida que la concentración de sales era menor, a excepción del tratamiento con 37.5% de sales MS y 4 °C, en que se observó una diferencia en el tiempo de germinación, que fue desde 9 y 10 días con las sales MS al 100%, hasta 28 y 25 días con las sales al 37.5% en períodos de almacenamiento de 15 y 30 días, respectivamente (Cuadro 2).
Los resultados indican que las concentraciones de 100 y 50% de las sales MS, estimularon los mayores porcentajes de germinación de 64.54 y 62.77%, respectivamente, sin existir diferencia significativa entre ellas; sin embargo, en la Figura 6 se puede apreciar que cuando la concentración de sales MS disminuyó al 37.5%, el porcentaje de germinación también disminuyó hasta el 51.55%, existiendo diferencia significativa respecto a las mayores concentraciones de 100 y 50% (0.136, 36,0.992)). Una tendencia similar a la anterior se observó con las diferentes temperaturas de incubación, es decir, a mayor temperatura se eleva el porcentaje de germinación; en la Figura 7 se puede apreciar que la mayor temperatura (25 °C), tuvo 85.8% de germinación en las semillas sintéticas; a medida que la temperatura disminuyó hasta 4 °C, se observó un descenso en el porcentaje de germinación a 18.5%; con una temperatura de 20 °C, se registró un 74.3% de germinación.


La temperatura de incubación fue el factor determinante sobre el porcentaje de germinación de las semillas sintéticas, con una casi imperceptible diferencia en su desarrollo, en función del tiempo de almacenamiento. Los embriones somáticos encapsulados mostraron una apariencia translúcida y poco vigor cuando se almacenaron a 4 °C aunque en este caso las sales MS al 37.5% de su concentración tuvieron un mejor efecto sobre el desarrollo de los embriones encapsulados. Se puede apreciar el desarrollo de semillas sintéticas cuando fueron incubadas a 20 °C durante 15 y 30 días, donde se observa la proyección de las primeras hojas a los 15 días de cultivo y su desarrollo posterior a los 30 días (Figura 8) lo que permite definir posteriormente el criterio a seguir en cuanto a la temperatura que debe utilizarse para desarrollar sistemas de conservación.

Germinación de semillas sintéticas de Laelia anceps ssp. dawsonii
Los embriones encapsulados continuaron su desarrollo con la conversión a plántula, y una vez desarrolladas las primeras hojas, se transfirieron a un sustrato, compuesto por peat moss y agrolita en proporción 1:1 y desinfectado con vapor de agua durante 15 minutos, contenido en cajas de petri de 150 x 15 mm, que previamente fueron esterilizadas, y bajo condiciones asépticas, continuaron su desarrollo hasta plantas completas, observándose la aparición de la primera raíz eficiente, a los diez días a partir del trasplante (Figura 9 A).

Aclimatización de plantas de Laelia anceps ssp. dawsonii
Las plantas desarrolladas, mostrando hojas y raíces eficientes, fueron transferidas al mismo sustrato utilizado durante la germinación de las semillas sintéticas, contenido en macetas de 12.5 cm de diámetro, y bajo condiciones de invernadero, a una temperatura de 30 °C con humedad relativa de ~90%, fueron aclimatizadas durante seis semanas ( ≈ 4 cm de altura), periodo en que se observó la aparición de la primera hoja eficiente; en este momento se efectuó su transferencia a condiciones de vivero, aplicando riegos manuales durante su posterior desarrollo (Figura 9 B).
DISCUSIÓN
Se encontró que el material de encapsulación y su consistencia influyen sobre el tiempo de germinación y la conservación de las semillas sintéticas, como lo indican Barbotin et al., 1993, quienes han demostrado que la dureza de la cápsula puede variar con la concentración de alginato y la concentración de la solución de cloruro de calcio, influyendo de manera importante sobre la germinación.
Así, cuando la consistencia de la cápsula es blanda, se facilita la germinación temprana de las semillas sintéticas en condiciones de vivero comercial, sin embargo, cuando se eleva la concentración de alginato, se pueden diseñar sistemas eficientes de conservación a mediano plazo, para mantener los embriones somáticos viables durante periodos considerables, pues de acuerdo a nuestros resultados, cuando el porcentaje de alginato de sodio se eleva al 4%, también aumenta el tiempo de germinación.
Onishi et al., 1994, sugirieron la utilización de alginato de sodio como material de encapsulación, trabajando con embriones somáticos encapsulados de apio y zanahoria. Ellos encontraron que el alginato de sodio es un hidrogel seleccionado como componente de la matriz de encapsulación de semillas sintéticas, debido a sus características, como viscosidad moderada, baja toxicidad y rápida gelificación, esta última muy importante cuando se utiliza el método de endurecimiento por goteo.
Patel (2000), evaluó el método de encapsulación en camas huecas, donde el material vegetal, consistente en embriones somáticos de Daucus carota es suspendido en una solución de carboximetilcelulosa y cloruro de calcio dihidratado, y posteriormente se deja caer en una solución de alginato de sodio en agitación, la cápsula producida por éste método, contenía una cubierta rígida y el centro permanecía en estado líquido, con lo cual lograban la germinación del 100% de las semillas dentro de la cubierta, después de 14 días en cultivo, y solamente el 13% de las mismas rompió las cápsulas al germinar; comparativamente, la encapsulación utilizando únicamente alginato de sodio en la matriz de encapsulación en complejo con cloruro de calcio di hidratado, estimula la germinación hacia el exterior de la cubierta, acortando los periodos de germinación al material aún poco desarrollado y frágil; el método de camas huecas, resulta ventajoso por brindar una mayor protección al material vegetal encapsulado, y más aún, esta técnica de encapsulación permitió el desarrollo de callo embriogénico y la formación de embriones somáticos a partir del mismo, aún dentro de la cubierta, debido a una protección que por el método convencional de encapsulación no se logra, provocando que el callo se separe de la cubierta en fases tempranas de su desarrollo, sin ocurrir la formación de embriones somáticos. M.B.A.
Reportó que la germinación de semillas sintéticas y su conversión a plántulas todavía no se compara con la que posee la semilla natural, ya que los principales obstáculos parecen ser la ausencia de tejido nutritivo equivalente al endospermo de las semillas naturales y la dificultad para la emergencia de brote y raíz a través de las cápsulas de alginato.
Sin embargo, el presente estudio no se encontró esta situación, en principio debido a que no utilizaron callos embriogénicos como material de encapsulación, además de lograr una germinación adecuada de los embriones somáticos encapsulados, principalmente en embriones encapsulados con 2% de alginato de sodio en la matriz de encapsulación, sin que ocurriera su separación prematura de la cápsula.
Por otra parte, existen estudios (Saiprasad, 2002) acerca del efecto de la temperatura de almacenamiento sobre la germinación, en diferentes géneros de orquídea; así, a 4 °C los protocormos encapsulados en una matriz de encapsulación constituida por alginato de sodio al 3% en complejo con 75 mM de cloruro de calcio dihidratado, y suplementada con 0.1 mg·litro–1 de BAP, lograron el 100% de germinación después de 60 días de almacenamiento para Dendrobium 'Sonia', después de 45 días para Oncidium 'Grower Ramsay' y después de 15 días para Cattleya leopoldii.
En todos los casos, a medida que se incrementaba la duración del almacenamiento, los porcentajes de germinación descendían considerablemente. Un efecto similar se observó en este estudio, con la misma temperatura de incubación, es decir, a 4 °C, se logró retrasar la germinación de las semillas sintéticas hasta 57 días, únicamente aumentando la concentración de alginato de sodio al 4% y disminuyendo la concentración de BAP a 0.5 mg·litro–1; aunque el porcentaje de germinación, en este último caso, fue del 30%, se logró elevar hasta 41% aumentando la concentración de BAP a 2.0 mg·litro–1 en la matriz de encapsulación, y adicionalmente, fue notorio el efecto de la menor concentración de sales MS (37.5%) en la matriz de encapsulación, la cual mejoró el porcentaje de germinación, respecto a la concentración media (50%) de sales MS, a la temperatura de 4 °C.
Al parecer, el efecto de la temperatura y el periodo de almacenamiento dependen de la especie en estudio, de acuerdo a Bapat y Rao (1988), quienes germinaron unos cuantos embriones encapsulados de Santalum album almacenados durante 45 días a 4 °C en el medio MS, y embriones de Medicago sativa, madurados en acido abscísico y almacenados a esta misma temperatura durante dos meses, sin detectar pérdida de viabilidad, lo cual coincide con los reportes de Barbotin (1993), quien afirma que la germinación rápida de las semillas sintéticas, depende en particular de la fisiología de los embriones y células inmovilizados.
CONCLUSIONES
Se logró determinar la influencia de los factores que afectan el desarrollo y germinación de embriones somáticos para la producción de semilla sintética de Laelia anceps ssp. dawsonii, encontrando que mediante la variación en las concentraciones de alginato de sodio en complejo con cloruro de calcio, es posible la conservación de germoplasma. La concentración de 4% de alginato de sodio en la matriz de encapsulación en combinación con 0.5 mg·litro–1 de BAP, a 37 °C de temperatura de almacenamiento, permitió la conservación de semillas sintéticas de L. anceps ssp. dawsonii durante periodos de tiempo de hasta 57 días, manteniendo la viabilidad de las semillas. El alginato de sodio a 2 y 3% en la matriz de encapsulación en combinación con 1.0 y 2.0 mg·litro–1 de BAP a temperatura de almacenamiento de 25 °C resultó la combinación más apropiada para la inducción de germinación rápida en las semillas sintéticas de L. anceps ssp. dawsonii, en períodos de 15 días. El manejo adecuado de combinaciones de factores físicos y químicos, permite la producción de semillas sintéticas de Laelia anceps ssp. dawsonii, en condiciones de laboratorio, probando su germinación eficiente. Es recomendable realizar experimentos de germinación en diferentes sustratos, con endospermos adicionados con nutrientes, fungicidas y bactericidas, para demostrar su germinación en condiciones de invernadero.
AGRADECIMIENTOS
Los autores desean agradecer al Biólogo Antonio Bustos Melgarejo, por proporcionar las plantas de Laelia anceps ssp. dawsonii utilizadas como fuente de explantes en este estudio, a la Universidad Veracruzana por el soporte financiero para la realización del presente trabajo y a la ayuda del PROMEP como patrocinador de la beca para estudios doctorales.
LITERATURA CITADA
BAPAT, V. A.; RAO, P. S. 1988. Sandalwood plantlets from 'synthetic seeds'. Plant Cell Reports (7): 434–436. [ Links ]
BARBOTIN, J. N; NAVA, S. J. E.; BAZINET, C.; KERSULEC, A.; THOMASSET, B.; THOMAS, D. 1993. Immobilization of whole cells and somatic embryos: coating process and cell–matrix interactions, pp. 65–95. In: Synseeds: Applications of Synthetic Seeds to Crop Improvement. REDENBAUGH, K.; C. R. C. Press (eds.). Boca Ratón, FL. [ Links ]
BORNMANN, C. 1993. Maturation of somatic embryos, pp. 105–114. In: Synseeds: Applications of Synthetic Seeds to Crop Improvement. REDENBAUGH, K.; C. R. C. Press (eds.). Boca Ratón, FL. [ Links ]
GANAPATHI, T. L. 2001. Regeneration of plants from alginate–encapsulated somatic embryos of banana cv. rasthali (Musa spp. AAB group). In Vitro Cell. Dev. Biol. Plant. (37): 178–181. [ Links ]
HALBINGER, F. 1993. Laelias de México. Pp. 71. Asociación Mexicana de Orquideología, A.C. (Ed.) México, D.F. [ Links ]
LEE, E. H.; LAGUNA, A.; MURGUÍA, J.; ELORZA, P. ; IGLESIAS, L.; GARCÍA, B.; BARREDO, F. A.; SANTANA, N. 2007. Regeneración in vitro de Laelia anceps ssp dawsonii. Revista UDO Agrícola 7(1): 58–67. [ Links ]
MARTIN, K. P. ; PRADEEP, A. K. 2003. Simple strategy for the in vitro conservation of Ipsea malabarica an endemic and endangered orchid of the Western Ghats of Kerala, India. Plant Cell, Tissue and Organ Culture. 74: 197–200. [ Links ]
NORMA OFICIAL MEXICANA NOM–059–ECOL–2001.2002. Protección ambiental–especies nativas de México de flora y fauna silvestres: Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio: Lista de especies en riesgo. Diario Oficial (6 de marzo 2002), México, D.F. [ Links ]
ONISHI, N. Y. 1994. Synthetic seeds as an application of mass production of somatic embryos. Plant Cell, Tissue and Organ Culture (39): 137–145. [ Links ]
PATEL, A. I. W. 2000. A novel encapsulation technique for the production of artificial seeds. Plant Cell Reports (19): 868–874. [ Links ]
REDENBAUGH, K. 1993. Synseeds: application of synthetic seeds to crop improvement. Primera ed. CRC Press, Inc. (Ed). Corportate Blvd., Boca Raton, Florida, Estados Unidos de Norteamérica. 129 p. [ Links ]
SAIPRASAD, G. Y. 2002. Propagation of three orchid genera using encapsulated protocorm–like bodies. Indian Journal of Plant Physiology, 42–48. [ Links ]
SAS SYSTEM. 1989–1997. Version 6.12, SAS Institute Inc., Cary, NC, USA. [ Links ]
STEEL, R. G.; TORRIE, J. H. 1980. Principles and Procedures of Statistics a Biometrical Approach. 2nd Mc Graw Hill (Eds.). New York. 633 p. [ Links ]




![Efecto del ácido salicílico y dimetilsulfóxido en la floración de [Chrysanthemum morifolium(Ramat) Kitamura] en Yucatán](/img/es/prev.gif)









