Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Chapingo. Serie horticultura
On-line version ISSN 2007-4034Print version ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.15 n.2 Chapingo May./Aug. 2009
Características del intercambio de gases en hojas de guayabo (Psidium guajava L.)
Gas exchange characteristics of guava (Psidium guajava L.) leaves
A. Damián Nava1, 2, I. Ramírez Ramírez1, C. B. Peña Valdivia1, G. Díaz Villaseñor2 y V. A. González Hernández1*
1 Postgrado en Recursos Genéticos y Productividad–Fisiología Vegetal, Colegio de Postgraduados, Campus Montecillo. Km 36.5 Carretera México–Texcoco. Montecillo, Estado de México. C. P. 56230. México. Tel. (52–55) 5804–5900, Ext. 1584. Correo–e: vagh@colpos.mx (*Autor responsable)
2 Unidad Académica de Ciencias Agropecuarias y Ambientales, Universidad Autónoma de Guerrero. Periférico Poniente s/n, Iguala, Guerrero. C. P. 40100. México.
Recibido: 20 de enero, 2008
Aceptado: 18 de mayo, 2009
Resumen
De la guayaba (Psidium guajava L.) se conoce poco acerca de los procesos fisiológicos involucrados en el intercambio de gases. En este estudio se cuantificaron las tasas de asimilación neta (A), de respiración y de transpiración foliar (E), y la conductancia estomática (gs), en dos estados de desarrollo foliar (maduras e inmaduras) en árboles de 3.5 años y en dos condiciones de humedad edáfica (riego y sequía), en un huerto ubicado en Iguala, Guerrero, México. También se determinaron las cinéticas fotosintéticas en respuesta al CO2 intercelular (Ci) y a la radiación fotosintéticamente activa (RFA) incidente. Las mediciones se hicieron con dos aparatos portátiles de fotosíntesis, uno equipado con aditamentos para dosificar la RFA y el CO2, manteniendo constantes a las demás condiciones ambientales. Las hojas inmaduras presentaron menor tasa fotosintética pero mayor tasa respiratoria que las hojas maduras. La sequía inducida redujo la gs en 50% y A en 55%, e inhibió por completo a E. Los parámetros fotosintéticos del guayabo correspondieron a los de una planta C3, porque en respuesta al Ci la saturación fotosintética ocurrió a 540 μmol·mol–1 y el punto de compensación a 69.2 μmol·mol–1. En respuesta a la RFA, la fotosaturación se alcanzó con 700 mmol fotón·m–2·s–1 y el punto de compensación por luz con 70 μmol fotón·m–2·s–1.
Palabras clave: Psidium guajava, fotosíntesis, transpiración, respiración, intercelular CO2 (Ci).
Abstract
Little is known about the physiological processes involved in gas exchange of guava (Psidium guajava L.) leaves. In this research, the rates of CO2 net assimilation (A), respiration, and transpiration (E), and the stomatal conductance (gs), were measured in two stages of leaf development (mature and immature leaves) and in two levels of soil moisture (irrigated and drought stressed plants), on 3.5 years old guava trees planted in Iguala, Guerrero, México. The photosynthetic parameters in response to the intercellular concentration of CO2 (Ci) and to the photosynthetic active radiation (PAR) were also determined. Measurements were done with two portable photosynthesis apparatus, one of them equipped with devises for regulating PAR and Ci, keeping constant other environmental variables. It was found that immature leaves showed a lower A but higher respiration rate than mature leaves, and that the induced drought stress diminished gs by 50% and A by 55%, while E was completely inhibited. The photosynthetic parameters of guava leaves corresponded to a C3 plant since in response to Ci, A became saturated at 540 μmol·mol–1 and the compensation point occurred at 69.2 μmol·mol–1. In response to PAR, leaves reached photosaturation at 700 μmol photon·m–2·s–1 and the compensation point at 70 mmol photon·m–2·s–1.
Key words: Psidium guajava, photosynthesis, transpiration, respiration, intercellular CO2 (Ci).
INTRODUCCIÓN
Los procesos primarios que determinan primordialmente el crecimiento vegetal son los que involucran el intercambio de gases con el aire circundante, como fotosíntesis, respiración y transpiración (Taiz y Zeiger, 2006), que también influyen en la distribución de biomasa entre órganos y en el rendimiento de fruto (Ho et al., 1989). El intercambio de gases se lleva a cabo a través de los estomas, cuya conductancia de gases se controla por cambios en la turgencia de las células oclusivas y responde a diversos factores ambientales, entre los que destacan la luz, humedad y concentración de CO2 (Assmann y Gershenson, 1991).
Así, al aumentar la concentración de CO2 también aumenta la tasa de asimilación neta hasta alcanzar el nivel de saturación, con una cinética propia para cada especie. El conocimiento de dicha cinética permite determinar parámetros importantes del mecanismo fotosintético, como:
1) El punto de compensación por CO2 (Γ), que indica la concentración de CO2 en la que la absorción y liberación CO2 son iguales y la tasa de asimilación neta (A) es cero;
2) El punto de saturación por CO2 (PS), en la que A alcanza su máximo valor; y 3) La eficiencia de carboxilación por la enzima Rubisco, o tasa de captura enzimática del CO2 (Farquhar y Sharkey, 1982; Taiz y Zeiger, 2006). Estos parámetros también permiten clasificar a las plantas en función de sus mecanismos fotosintéticos, ya sean C3 o C4.
En especies C3 los valores de Γ varían entre 30 y 70 μL·litro–1 y los de PS entre 700 y 1,200 μL·litro–1 de CO2, respectivamente; en contraste, en plantas C4 tales parámetros fluctúan de 0 a 10 μL·litro–1 para Γ y de 1,800 a 2,000 μL·litro–1 para PS (Taiz y Zeiger, 2006). Por ejemplo, en naranja (Citrus sinensis L. Osbeck) cv. Pera, una planta C3, se registraron valores de Γ de 43 y 84 μL·litro–1, y valores de PS de 700 y 700 μL·litro–1, en plantas sanas e infectadas por el virus de los cítricos, respectivamente (Habermann et al., 2003). Una alta concentración del CO2 en el aire también ocasiona un incremento del CO2 intercelular (Ci) en las hojas, como lo demostró (Juárez, 2002) en Quercus ilex, una especie C3. El aumento del Ci a su vez provoca reducción de la fotorrespiración en este tipo de plantas, porque mantiene ocupada a la enzima Rubisco con una cantidad adicional de CO2 en el estroma de los cloroplastos, como se demostró al aplicar 1,200 μmol·mol–1 de CO2 en tomate de cáscara (Physalis ixocarpa Brot.) durante la fase de crecimiento del fruto, lo cual se reflejó en el mayor número de frutos por planta (Soldevilla–Canales et al., 1997). El valor de Ci depende de la demanda de CO2 en los cloroplastos de la hoja y de la tasa de suministro de CO2 al interior de la hoja, ésta determinada a su vez por la conductancia estomática; por tanto, sería de esperarse que con una mayor conductancia haya mayor disponibilidad de este gas en los espacios intercelulares de la hoja.
Las condiciones de estrés ocasionadas por factores ambientales también influyen en los procesos del intercambio de gases a nivel de hoja. Así, una planta sometida a estrés de sequía o salinidad presenta disminución de la fotosíntesis y de transpiración, cierre estomático y reducción del área foliar (Webb y Mansfield, 1992); ello puede significar cambios en parámetros fotosintéticos. En guayabo (Psidium guajava L.) la salinidad causa cierre estomático o disminución de la eficiencia fotoquímica del cloroplasto, en ambos casos con reducción de A (Ali–Dinar et al., 1999; Ebert et al., 2002). Según (González, 1989), la tasa de transpiración foliar del guayabo prácticamente es nula cuando el potencial hídrico baja hasta –3.0 MPa, debido a que la conductancia estomática (gs) decrece rápidamente conforme el déficit hídrico aumenta.
Sin embargo, en guayabo se desconocen sus cinéticas fotosintéticas en respuesta al CO2 y a la radiación fotosintéticamente activa (RFA), y sus respectivos parámetros fotosintéticos, los cuales servirían para establecer si esta especie es C3 o C4. Las principales plantaciones de guayabo en México se ubican en los estados de Aguascalientes, Michoacán y Zacatecas con 93% de las 19,722 ha plantadas en 2001 (González et al., 2002). En el estado de Guerrero hay áreas de producción de guayabo integradas al mercado regional en numerosos sitios turísticos ubicados en ambientes de trópico seco, cuyos efectos fisiológicos es necesario investigar.
El presente estudio tuvo como objetivo determinar las cinéticas de la asimilación neta del guayabo en respuesta a concentraciones crecientes de CO2 y flujos crecientes de RFA, así como caracterizar el intercambio de gases en hojas de guayabo en diversas épocas y condiciones de humedad edáfica en Iguala, Gro., una localidad representativa del clima tropical seco donde se llevó a cabo esta investigación.
MATERIALES Y MÉTODOS
Ubicación, condiciones edafoclimáticas y manejo del cultivo
Iguala, Guerrero se encuentra ubicada a 18° 20' 45'' LN, 99° 24' 40'' LO y una altitud de 735 m. La precipitación pluvial acumulada de junio a septiembre del 2001, año que inició el estudio, fue de 1,050 mm; las plantas no se regaron de octubre a noviembre y no se cuantificó la magnitud de la sequía; la temperatura máxima fue de 30 °C a lo largo del año, excepto de octubre a febrero en el que descendió a 25 °C (Estación Meteorológica del Campo Experimental de Iguala, del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias). El suelo del sitio experimental es profundo de color pardo oscuro con 40% de arcilla, pH de 8.2, con 1.5% de materia orgánica, 0.30% de N total, 15 mg·g–1 de P y 2 cmol·kg–1 de K (González, 2004).
Se utilizaron árboles sanos de guayabo del cv. Media China plantados a una distancia de 6 x 6 m. Al iniciar esta investigación, los árboles tenían 3.5 años de edad. Al huerto se le aplicó un riego mensual desde diciembre del 2001 a abril del 2002; no se aplicaron fertilizantes ni podas. La maleza fue controlada con herbicida 2,4–D y Faena®, del grupo de los glifosatos, en dosis de 10 mL·litro–1 cada una y la mosca de la fruta (Anastrepha spp) se controló con una aplicación semanal de Malatión® (2 mL·litro–1), adicionado con proteína hidrolizada (10 mL·litro–1) como surfactante.
Efecto de edad de la hoja
Para comparar los cambios diurnos del intercambio de gases de hojas inmaduras (expansión a 70%) vs. hojas maduras (expansión a 100%), en el mes de agosto de 2001 se hicieron mediciones con un aparato LI–6200 (LICOR, Inc.; Lincoln, NE, EE. UU.), en condiciones naturales, sin controlar temperatura, luz ni CO2. Así, a las 8, 11, 14, 17 y 19:30 h, se midieron las tasas de asimilación neta (A), respiratoria (Rs) y transpiratoria (E), de conductancia estomática (gs), concentración intercelular de CO2 (Ci), la diferencia entre la temperatura foliar y la del ambiente, y la radiación fotosintéticamente activa (RFA) incidente en cada hoja medida, en seis árboles con fruto en crecimiento de una cosecha secundaria, como la descrita para este huerto por Damián et al. (2004).
Efecto de la humedad edáfica y posición de la hoja
Para determinar el perfil de intercambio de gases a través del dosel en condiciones de déficit hídrico, el día 8 de noviembre de 2001 se midieron las mismas variables referentes al intercambio de gases antes descritas; las mediciones se hicieron durante el día (8:30, 11:30, 14:30 y 17:30 h), en hojas verdes totalmente expandidas de tres estratos de la copa (superior, intermedio e inferior) de seis árboles, con el aparato LI–6200 antes descrito y sin controlar temperatura, luz ni CO2. Las mediciones en condiciones de riego se hicieron el día 19 de enero del 2002, en etapa de emergencia de brotes, hojas y flores, también a lo largo del día (8:30, 11:30, 14:30 y 17:30 h).
Cinéticas fotosintéticas
El 13 de enero del 2006, durante la etapa de floración, en tres repeticiones (hojas) se registraron las cinéticas fotosintéticas de hojas maduras jóvenes de un árbol de guayabo representativo de la huerta en condiciones de riego, en respuesta a diversas intensidades de RFA y varios niveles de Ci; también se evaluó la gs. La cinética en respuesta al Ci se hizo de las 11 a las 13 h, manteniendo constante la RFA incidente en la hoja (800 μmol·m–2·s–1) y la temperatura (28 °C) de la cámara de asimilación, y variando los niveles de Ci desde 0 hasta 1,600 μmol CO2·mol–1 (en el siguiente orden: 400, 200, 100, 50, 0, 400, 400, 700, 1,000, 1,300 y 1,600 μmol CO2·mol–1, con intervalos de 2 min por nivel de CO2), con humedad relativa de 23 ± 2%. La cinética en respuesta a la RFA se efectuó de las 13 a las 15 h, manteniendo constante la concentración del CO2 (400 μmol mol–1) y la temperatura de la cámara de asimilación (28 °C), a una humedad relativa de 19 ± 2%, ante niveles de RFA que oscilaron desde 0 a 1500 μmol·m–2·s–1 (en el orden:1,500, 1,300, 1,100, 900, 700, 500, 300, 100 y 0 μmol CO2·m–2·s–1, con lapsos de 2.5 min por cada nivel de RFA). Para ambas cinéticas se usó un aparato portátil de fotosíntesis LI–6400 (Licor, Inc.; Lincoln, NE, EE. UU.), el cual permite controlar la temperatura de la cámara de asimilación, la radiación incidente en la hoja mediante una lámpara programable (6400–02B LED Light source) y la concentración de CO2 con un aditamento dosificador de este gas (6400–01 CO2 Mixer); además, permite fijar el máximo coeficiente de variación aceptable para cada registro, que en este caso se fijó en 2% (Licor, 1999).
Análisis de datos
El comportamiento fotosintético de hojas jóvenes se comparó con el de hojas maduras, con los datos registrados en agosto y se analizaron mediante un diseño completamente al azar con seis repeticiones (seis árboles) y una hoja por árbol como unidad experimental, en un arreglo factorial con dos factores: tipo de hoja (hojas de crecimiento intermedio o expansión intermedia y hojas de crecimiento máximo) y horario de muestreo (8, 11, 14, 17 y 19:30 h).
Para comparar los árboles sometidos a estrés hídrico con los testigos sin estrés hídrico, se usó el mismo diseño factorial en el que los factores y niveles fueron: condición hídrica (estrés por sequía en noviembre y sin estrés de sequía en enero), el estrato (superior, medio e inferior) y el horario de evaluación (8:30, 11:30, 14:30 y 17:30 h); también hubo seis repeticiones y una hoja por árbol como unidad experimental.
Con los datos obtenidos en las cinéticas de A en respuesta al Ci y a la RFA, provenientes de tres repeticiones, se graficaron los promedios y las desviaciones estándar, en cada nivel de esos factores ambientales, mediante el paquete Excel de Microsoft 2003®. En la cinética del Ci se determinaron tres parámetros fisiológicos: punto de compensación y punto de saturación por CO2, y se estimó la eficiencia de la enzima Rubisco con base en la pendiente inicial de la cinética obtenida (Farquhar y Sharkey, 1982); en la cinética de la RFA se determinaron los puntos de compensación y de saturación por luz (Licor, 1999).
Los análisis estadísticos consistieron en análisis de varianza y pruebas de medias (Tukey, 0.05), mediante el paquete "Statistical Analysis System v8" (SAS Institute, 2000), y ecuaciones de regresión lineal mediante el programa Excel de Microsoft versión 2003.
RESULTADOS Y DISCUSIÓN
Efecto del déficit de humedad, de ubicación de las hojas y de la hora del día
La condición hídrica produjo efectos significativos (P≤0.06) en todas las variables de intercambio de gases medidas en hojas maduras del guayabo (Cuadro 1). El estrato foliar afectó (P≤0.06) solamente al Ci, asociado con los niveles de CO2 diferenciales que se establecen en el dosel, ya que en la parte alta de un dosel vegetal se presenta una tasa elevada de asimilación de CO2 (A) que reduce la concentración del bióxido de carbono más que en la parte inferior en donde dicha tasa es baja (Gardner et al., 1985). El efecto del horario y la interacción condición hídrica x horario causaron diferencias significativas (P≤0.05) en todas las variables, excepto en respiración (Rs), lo que muestra que en contraste con el efecto en A y transpiración (E), la respiración foliar no depende de la posición de la hoja madura en el árbol ni de la luz que reciba, pero sí del horario y de la condición hídrica foliar. La interacción condición hídrica x estrato sólo tuvo efecto significativo (P≤0.07) para la Ci.

Efecto de estrés hídrico y de la hora del día. En ausencia de sequía (i. e., en enero) el guayabo abre sus estomas temprano en el día y luego se van cerrando paulatinamente hasta llegar a una gs de casi cero a las 18 h (Figura 1D). Por ello A es relativamente alta a las 8:30 h, y luego continúa aumentando hasta alcanzar su valor máximo del día aproximadamente a la 12 h, para después declinar hasta cero a las 18 h (Figura 1A). La E y respiración también son relativamente altas a las 8:30 h, y luego aumentan hasta alcanzar sus máximos valores a las 14:30 h, 2 h después del máximo gradiente de temperatura entre el aire y hoja (Figura 1, B y C).

En sequía la gs muestra una cinética similar que sin sequía, pero con valores mucho más pequeños (Figura 1D). Por ello, las tasas de A y E (Figura 1, A y C) solamente ocurren durante unas 3 h de la mañana y son continuamente decrecientes, lo que conduce a una severa reducción de fotosíntesis y transpiración. Comportamientos similares observaron Schussler y Westgate (1988) en maíz (Zea mays L.), Pinheiro (2004) en Spondias tubertosa Arr. Cam. y Romero et al. (2004) en almendro (Prunus dulcis Mill.). Se postula entonces que en hojas de guayabo los estomas cierran al elevarse el déficit de presión de vapor para así reducir la pérdida de agua por transpiración, como ocurre en otras especies (Webb y Mansfield, 1992); en consecuencia, la Ci aumenta en ese mismo lapso (Figura 1E). Destaca que la respiración foliar es mayor en sequía que en humedad, probablemente como mecanismo de defensa para proveer de CO2 al aparato fotosintético y evitar la fotoinhibición. Sin mencionar sus características fotosintéticas, Knox (1988) considera al guayabo como una de las especies vegetales tolerantes a sequía en Florida, EE. UU.
Efecto de la edad de la hoja y hora del día. El tipo de hoja tuvo efecto significativo (P≤0.05) sólo en la tasa respiratoria, mientras que el horario de medición presentó diferencias significativas (P≤0.01) en todas las variables, excepto en transpiración. La interacción entre el tipo de hojas y el horario de muestreo (Cuadro 2) no fue significativa (P≤0.05).

En ausencia de sequía la A es casi nula a las 8 h tanto en hojas inmaduras (con 70% de crecimiento) como en las maduras totalmente expandidas (100% de crecimiento), para luego aumentar rápidamente hasta alcanzar sus máximos valores entre las 11 y 14 h, con 16 y 18 μmol CO2·m–2·s–1 respectivamente; en horas posteriores A disminuye hasta llegar a su mínimo a las 19:30 h (Figura 2A). El mayor valor de A en las hojas maduras que en las inmaduras, al igual que ocurre en otras especies (Chaumont et al., 1994; Ruan, 1993), confirma que las hojas maduras son la fuente más importante de fotoasimilados en el guayabo, como también observaron (Acosta, 1998) y González et al. (1994) en Carica papaya L., una especie con mecanismo fotosintético C3. En plantas de Spondias sin sequía, los máximos valores de A, E y gs se registraron a las 10 h (Pinheiro, 2004).

La tasa respiratoria en ambos tipos de hojas (con 70 y 100% de crecimiento) es muy baja al amanecer y anochecer (8 y 19:30 h), y su máximo valor se alcanza entre 14 y 17 h con 4.5 y 2.5 μmol CO2·m–2·s–1, respectivamente (Figura 2B). Es decir, las hojas jóvenes respiran casi el doble de rápido que las hojas maduras, comportamiento que es atribuible a que las hojas jóvenes tienen altas tasas metabólicas y son en las que el mayor consumo de energía se ocupa para que las hojas efectúen crecimiento, mientras que las hojas maduras sólo hacen respiración de mantenimiento (Sívori et al., 1993).
La E y la gs presentan un comportamiento similar al de fotosíntesis; a las 8 h tienen valor de cero, y luego van incrementando hasta alcanzar su máximo valor a las 11 h en hojas con 70% de crecimiento, y hasta las 14 h en hojas totalmente expandidas; después de alcanzar tales picos ambas variables disminuyen hasta llegar a cero a las 19:30 h (Figura 2C). La reducción vespertina de A y E en relación a las tasas matutinas, se atribuye al incremento de temperatura asociado con un aumento en el déficit de presión de vapor en los espacios intercelulares de la hoja que ocasiona una disminución en la gs, como Pons y Welschen (2003) indican que ocurre en árboles tropicales.
La concentración del CO2 intercelular (Ci) en ambos tipos de hojas muestra un comportamiento opuesto a la tasa fotosintética; así, a las 8 y 19:30 h es alta (entre 350 y 390 mmol·mol–1·de CO2), mientras que entre 14 y 17 h es baja (entre 100 y 200 mmol·mol–1 de CO2) (Figura 2E). Este comportamiento se debe a que al bajar A se incrementa la Ci porque el CO2 es menos utilizado por el proceso fotosintético.
Ambos tipos de hojas de guayabo mantienen su temperatura debajo de la ambiental en casi todo el día, lo que significa capacidad de enfriamiento por transpiración; sin embargo, a las 14 h las hojas inmaduras se calientan en 0.4 °C por arriba de la temperatura del ambiente (Figura 2F). En hojas totalmente expandidas la temperatura foliar solamente se iguala con la del ambiente hasta las 17 h. Además, las hojas maduras alcanzan los máximos valores de temperatura, A, E y gs, 3 h después que las hojas en crecimiento, lo que sugiere que las hojas jóvenes inician el cierre estomático más temprano con la consecuente disminución anticipada de las tasas de intercambio de gases. Resultados similares encontraron Amistage y Vines (1983) en geranio (Pelaronium peltatum).
Cinéticas y parámetros fotosintéticos
En respuesta a Ci. La cinética de A en el guayabo se representó en función de la concentración intercelular de CO2 (Ci), porque ésta es la disponible para fotosíntesis en los cloroplastos (Figura 3). Dicha cinética revela que con una RFA constante de 800 μmol fotón·m–2·s–1, el punto de saturación (Γ ) de la fotosíntesis ocurre a una Ci de 540 μmol·mol–1 de CO2, con una tasa de A de 22 mmol CO2·m–2·s–1 (Figura 3A), igual a la registrada por Estrada–Luna et al. (2000) en plántulas de 18 meses de la misma especie crecidas en invernadero, y superior en 83% a la tasa de 12 mmol CO2·m–2·s–1 reportada en plantas adultas de guayabo (Ali–Dinar et al., 1999). Con esa misma RFA, el punto de compensación (Γ ) que representa la concentración de CO2 en la que la fotosíntesis iguala a la respiración, es de 69.2 mmol·mol–1 (Figura 3B), valor muy cercano a 70 mmol·mol–1, máximo reportado para especies C3 (Taiz y Zeiger, 2006). La eficiencia de carboxilación del guayabo (equivalente a la pendiente de la recta trazada con los puntos registrados de 0 a 200 μmol CO2·mol–1) es de 78.6 mmol CO2·mol–1, valor superior en 66% al registrado en hojas de naranjo sano (47 mmol CO2·mol–1), lo que indica que la Rubisco del guayabo es más eficiente en la captura del CO2 que la misma enzima de esa otra especie C3.
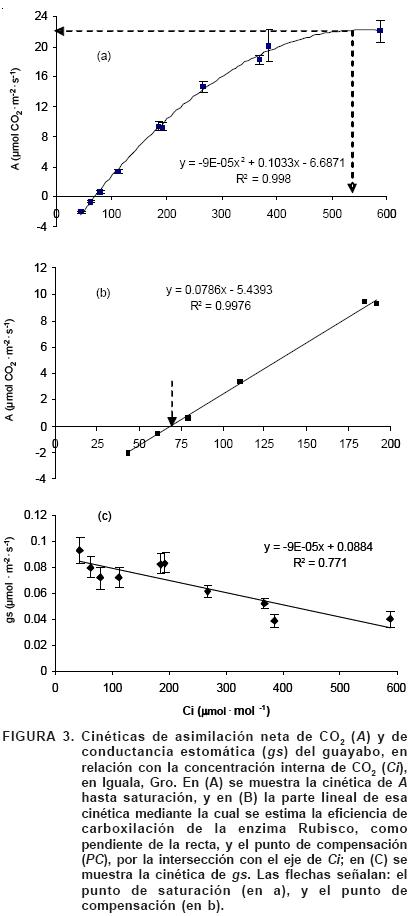
La conductancia estomática (gs) del guayabo decrece lentamente en forma lineal conforme aumenta Ci (Figura 3C), a una tasa promedio de 90 pmol CO2·m–2·s–1 por cada unidad de aumento en Ci. De la ecuación correspondiente se infiere que en esas condiciones ambientales, esta variedad de guayabo alcanzaría su máxima gs (0.088 mmol CO2·m–2·s–1) en ausencia de CO2 y que sus estomas se cerrarían por completo con una Ci de 982 mmol·mol–1. En Quercus ilex y Q. faginea, la gs también disminuye a medida que se incrementa la concentración de CO2 del aire (Juárez, 2002).
En respuesta a RFA. La cinética de A en función de la luz (RFA) se muestra en la Figura 4. En este caso, a una concentración constante de CO2 de 400 μmol·mol–1 el guayabo alcanza la fotosaturación con 700 mmol fotón·m–2·s–1, que equivale a casi un tercio de la máxima RFA posible, con una tasa de A cercana a 10 mmol CO2·m–2·s–1; esta A máxima es menor que la mitad de la máxima registrada con 540 μmol·mol–1 de Ci. El punto de compensación por luz ocurre con 70 mmol fotón·m–2·s–1 con una A de cero porque es cuando la fotosíntesis se iguala con la respiración. Los valores de estos parámetros fotosintéticos corresponden a los de una planta C3, al igual que en la cinética en respuesta a Ci, por lo que se infiere que el guayabo posee el mecanismo fotosintético de plantas C3.

CONCLUSIONES
En Iguala, Gro., las hojas inmaduras de guayabo (70% de expansión) presentaron menor tasa fotosintética y mayor tasa de respiración que las hojas maduras totalmente expandidas; es decir, las hojas maduras resultaron la fuente más importante de fotoasimilados en guayabo mientras que las hojas en crecimiento gastan más energía que las maduras. En ausencia de sequía, las tasas de asimilación neta y de transpiración fueron imperceptibles a las 8 y 19:30 h, debido a que los estomas estuvieron cerrados en estos horarios; tales tasas alcanzaron sus valores máximos del día entre las 11 y las 14 h. La sequía redujo en 50% a la conductancia estomática, lo que inhibió por completo a la transpiración y redujo la tasa fotosintética a 55%. Las hojas de guayabo iluminadas con 800 μmol fotón·m–2·s–1 alcanzaron la saturación fotosintética con 540 μmol·mol–1 de CO2, un punto de compensación por CO2 de 69.2 mmol·mol–1, y una eficiencia de carboxilación por la enzima Rubisco de 78 mmol CO2·mol–1. En respuesta a cambios de intensidad luminosa y a una concentración constante de CO2 de 400 μmol·mol–1, la hoja del guayabo alcanzó la fotosaturación con 700 mmol fotón·m–2·s–1 y su punto de compensación por luz con 70 mmol fotón·m–2·s–1. Los valores de estos parámetros indican que las hojas de guayabo realizan el mecanismo fotosintético C .
LITERATURA CITADA
ACOSTA Z., C. 1998. Biología floral y relaciones fuente demanda en papaya (Carica papaya L.).Tesis Doctoral. Colegio de Postgraduados. Montecillo, Texcoco, México. 113 p. [ Links ]
ALI–DINAR, H.; EBERT G., M.; LÜDDERS, P. 1999. Biomass production and partitioning of guava (Psidium guajava L.) in response to salinity and nitrogen nutrition. Angewandte Botanik 72: 56–60 [ Links ]
AMISTAGE A., M.; VINES M., H. 1983. Water relations and net photosynthesis in hybrid geranium. J. Amer. Soc. Hort. Sci. 108:300–314. [ Links ]
ASSMANN S., M.; GERSHENSON, A. 1991. The cinetics of stomatal responses to VPD in Vicia faba: electrophysiological and water relations models. Plant Cell 14:455–465. [ Links ]
CHAUMONT, M.; MOROT–GAUDRY, J. F.; FOLLEY C., D. H. 1994. Seasonal and diurnal changes in photosynthesis and carbon partitionin in Vitis vinifera leaves in vines with and without fruit. J. Exp. Bot. 278:1235–1243. [ Links ]
DAMIÁN N., A.; GONZÁLEZ H., V. A.; SÁNCHEZ G., P.; PEÑA V., C. B.; LIVERA M., M.; BRITO G., T. 2004. Crecimiento y fenología del guayabo (Psidium guajava L.) cv. Media China en Iguala, Guerrero. Rev. Fitotec. Méx. 27: 349–358. [ Links ]
EBERT, G.; EBERLE, J.; ALI–DINAR, H.; LÜDDERS, P. 2002. Ameliorating effects of Ca(NO3)2 on growth, mineral uptake and photosynthesis of NaCl–stressed guava seedlings (Psidium guajava L.). Sci. Hort. 93:125–135. [ Links ]
ESTRADA–LUNA, A.; DAVIES, F. T.; EGILLA, J. N. 2000. Micorrhizal fungi enhancement of growth and gas exchange of micropropagated guava plantlets (Psidium guajava L.) during ex vitro acclimatization and plant establishment. Mycorrhiza 10: 1–8. [ Links ]
FARQUHAR G., D.; SHARKEY D., T. 1982. Stomatal conductance and photosynthesis. Ann. Rev. Plant. Physiol. 33:317–345. [ Links ]
GARDNER P., F.; PEARCE, R. B.; MICHTEL, R. L. 1985. Physyology of Crop Plants. Iowa State University Press. Iowa, USA. 327 p. [ Links ]
GONZÁLEZ H., V. A.; TÉLIZ O., D.; NIETO–ANGEL, D. 1994. Effect of papaya ringspot on leaf gas exchange rates of papaya. Rev. Mex. Fitopatol. 12:174–177. [ Links ]
GONZÁLEZ L., M. 1989. Efecto del déficit hídrico sobre algunos aspectos fisiológicos y del desarrollo en guayabo (Psidium guajava L.). Tesis de Maestría Especialidad de Fruticultura. Colegio de Postgraduados. Montecillo, México. [ Links ]
GONZÁLEZ G., E.; PADILLA R., J.; REYES M., L.; PERALES DE LA C., M. A.; ESQUIVEL V., F. 2002. Guayaba; su Cultivo en México. INIFAP. Campo Experimental Pabellón. Libro Técnico No. 1. Pabellón, Ags., Méx. 182 p. [ Links ]
GONZÁLEZ M., R. 2004. Profesor Investigador especialista en Edafología. Universidad Autónoma de Guerrero. Iguala, Gro. [ Links ]
HABERMANN, G.; CARUSO M., E.; DOMINGOS R., J.; LÁZARO M., C. 2003. CO2 assimilation, photosynthetic curves, and water relations of 'Pera' sweet orange plants infected with Xylella fastidiosa. Braz. J. Plat Physiol. 15: 79–87. [ Links ]
HO, L. C.; GRANGE, R. I.; SHAW, A. F. 1989. Source/sink regulation. In: Transport of Photoassimilates. D. A. Baker (Ed.). Logman Scientific & Tecnical. Essex, England. pp:306–343. [ Links ]
JUÁREZ L., J. F. 2002. Respuesta de la fotosíntesis a la concentración de CO2: limitaciones estomáticas y bioquímicas de la fotosíntesis en Quercus ilex Subs. ballota y Q. faginea. Tesis de doctorado. Facultad de Biología. Universidad de Salamanca. España. [ Links ]
KNOX, G. W. 1988. Drought Tolerant Plants for North and Central Florida. Circular 807, Department of Environmental Horticulture, Florida Coop. Extension Service, Institute of Food and Agricultural Sciences, University of Florida (http://hammock.ifas.ufl.edu). [ Links ]
LI–COR. 1999. Using the LI–6400, Portable Photosynthesis System (Software version 3.3). LI–COR, Inc. Publication Number 9806–122. Linclon, NE. s/n p. [ Links ]
PINHEIRO L., J. M. 2004. Gas exchange of the umbu tree under semi–arid conditions. Rev. Bras. Frutic. Joboticabal–SP 26:206–208. [ Links ]
PONS, T. L.; WELSCHEN A., M. 2003. Midday depression of net photosynthesis in tropical rainforest tree Eperua grandiflora: contributions of stomatal and internal conductances, respiration and Rubisco functioning. Tree Physiol. 23:937–947. [ Links ]
ROMERO, P.; NAVARRO, J. M.; GARCÍA, F.; BOTIA O., P. 2004. Effects of regulated deficit in irrigation during the pre–harvest period on gas exchange, leaf development and yield of mature almond trees. Tree Physiol. 24:303–312. [ Links ]
RUAN, Y. L. 1993. Fruit set, young fruit and leaf growth of Citrus unshiu in relation to assimilate supply. Sci. Hort. 53:99–107. [ Links ]
SAS INSTITUTE. 2000. SAS/STAT User's Guide. Release 6.03. Cary, NC. USA. 75 p. [ Links ]
SCHUSSLER, J. R.; WESTGATE E., M. 1988. Relationship between water deficits, photosynthesis and kernel number in maize. Plant Physiol. Suppl. 86–75. [ Links ]
SÍVORI E., M.; MONTALDI E., R.; CASO O., Y. H. 1993. Fisiología Vegetal. Ed. Hemisferio Sur. Buenos Aires, Argentina. 680 p. [ Links ]
SOLDEVILLA–CANALES, S.; PEÑA–LOMELÍ, A.; SOLÍS–MENDOZA, F.; VÁZQUEZ–ROJAS, T. R.; COLINAS L., T. 1997. Aplicación radical de bióxido de carbono en tomate de cáscara (Physalis ixocarpa Brot.). Rev. Chapingo S. Hort. 3:17–23. [ Links ]
TAIZ, L.; ZEIGER, E. 2006. Plant Physiology. 4th ed. Sinauer Associates, Inc. Publishers. Sunderland, Massachussets. USA. 764 p. [ Links ]
WEBB A., A. R.; MANSFIELD T., A. 1992. How do stomata work? J. Biolog. Educ. 26:19–26. [ Links ]














