Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.15 no.1 Chapingo ene./abr. 2009
Sustratos y hongos micorrízicos arbusculares en la producción de nochebuena
Substrates and arbuscular mycorrhizal fungi in the production of poinsettia
B. A. Callejas–Ruiz1, A. M. Castillo–González1*, M. T. Colinas–León1, M. del C. González–Chávez2, J. Pineda–Pineda3 y L. A. Valdez–Aguilar1
1 Departamento de Fitotecnia, Universidad Autónoma Chapingo. Km 38.5 Carretera México–Texcoco. Chapingo, Estado de México. C. P. 56230. México. Correo–e: anasofiacasg@hotmail.com (*Autor responsable).
2 Orientación Edafología, Campus Montecillo, Colegio de Posgraduados. Montecillo, Estado de México. C. P. 56230. México.
3 Departamento de Suelos, Universidad Autónoma Chapingo. Km. 38.5 Carretera México–Texcoco. Chapingo, Estado de México. C. P. 56230. México.
Recibido: 21 de septiembre, 2006
Aceptado: 14 de noviembre, 2008
Resumen
Este trabajo tuvo como objetivos determinar el efecto de tres sustratos en el establecimiento de la asociación micorrízica de dos cepas de hongos micorrízicos arbusculares (Glomus mosseae BEG–25 y G. mosseae BEG–132) en nochebuena, determinar el efecto de la inoculación sobre el desarrollo y calidad de las plantas, y comparar la respuesta de las plantas a la micorrización y fertilización que los productores utilizan. Los sustratos fueron: S1 = mezcla de tierra de hoja de encino + tezontle + turba + agrolita (9:3:2:2 v/v); S2 = turba + vermiculita (2:1 v/v) y S3 = tezontle. La fertilización consistió de dos niveles: sin fertilización y con fertilizante comercial Peters® 8–45–14 (N–P2O5–K2O) durante los primeros 20 días, y con Peters® 7–40–17 en las etapas siguientes. La mayor altura (40.8 cm), número de hojas (63.4), peso seco aéreo (26.3 g), área foliar (2,518.8 cm2) y área de la inflorescencia principal (de brácteas) (1,163.1 cm2) se obtuvieron en plantas que crecieron en el S1 más fertilización. El mayor peso seco radical se presentó en plantas que crecieron en el S1 y se inocularon con G. mosseae BEG–132 y en el S2 más fertilización. El S1 adelantó en 6 y 3 días la floración, respecto al S2 y S3. Los porcentajes de colonización más altos se alcanzaron en plantas que crecieron en el S1 y se inocularon con G. mosseae BEG–25 (66%) y G. mosseae BEG–132 (80%). Sin embargo, las raíces de plantas sin inoculación (testigo) que crecieron en el S1 se colonizaron en 56%, lo que mostró que este sustrato contenía hongos arbusculares nativos. La inoculación con las cepas micorrízicas no mejoró la nutrición de las plantas. El mejor sustrato para el establecimiento de la asociación micorrízica fue el S1, pero el mejor tratamiento para el crecimiento y calidad de las plantas fue la combinación de S1 y fertilización con Peters®.
Palabras clave: crecimiento, Euphorbia pulcherrima Willd. ex Klotzch, concentración nutrimental, floración, pigmentación, micorriza arbuscular.
Abstract
The objectives of the present research were to determine the effect of three substrates on establishment of mycorrhizal symbiosis between Glomus mosseae BEG–25 and G. mosseae BEG–132 and poinsettia plants and on plant development and quality, and to compare plant response to inoculation with commercial fertilization practiced by growers. The substrates consisted of: S1=a mixture of leaf mould+ volcanic rock + peat moss + perlite (9:3:2:2, v/v); S2=peat moss + vermiculite (2:1, v/v) and S3=volcanic rock. Fertilization treatments consisted of non–fertilized plants and plants fertilized with Peters® 8–45–14 (N–P2O5–K2O) during the initial 20 days, and with Peters® 7–40–17 thereafter. Plants growing on S1 plus fertilization had the highest plant height (40.8 cm), number of leaves (63.4), shoot dry weight (26.3 g), leaf area (2,518.8 cm2) and bract area of the main inflorescence (1,163.1 cm2), while the highest root dry weight was observed in G. mosseae BEG–132 inoculated plants on S1 and those from S2 plus fertilization. Anticipated flowering, 6 – 3 days, was observed in plants on S1 compared with plants grown on S2 and S3. The highest root colonization was observed not only in plants inoculated with G. mosseae BEG–25 (66%) and G. mosseae BEG–132 (80%), but also in non–inoculated plants (56%), all of them in S1, suggesting that this substrate contained native mycorrhizal fungi. However, none of the mycorrhizal treatments improved plant nutrition. S1 was the best substrate for the establishment of mycorrhizal symbiosis. Fertilization with Peters® in S1 was the best treatment for plant growth and quality.
Key words: plant growth, Euphorbia pulcherrima Willd. ex Klotzch, nutrimental concentration, flowering, plant pigmentation, arbuscular mycorrhiza.
INTRODUCCIÓN
Euphorbia pulcherrima Willd. ex Klotzch, conocida como nochebuena, es una planta nativa de México. De las especies del género Euphorbia, esta especie es la de mayor importancia económica (Grueber, 1985) porque se usa mundialmente como planta de ornato durante la época decembrina (Galicia–Jiménez et al., 2001).
Debido a los altos costos de producción y a los efectos del uso indiscriminado de fertilizantes en el ambiente, es necesario buscar alternativas que sean económica, social y ecológicamente aceptables en la producción de nochebuena. Una alternativa es el uso de hongos micorrízicos arbusculares (HMA), que establecen simbiosis mutualista con la mayoría de las raíces de plantas superiores; dicha simbiosis proporciona beneficios a ambos organismos. En las plantas se incrementa la eficiencia en el uso del agua y en la absorción y translocación de nutrimentos (González–Chávez, 1993; Scagel, 2004). Esto se debe al incremento de la superficie radical por las hifas de los hongos asociados, lo que permite la exploración de mayores volúmenes de suelo (Clark y Zeto, 2000). Las hifas de estos hongos normalmente transportan minerales de distancias más lejanas de las zonas de agotamiento, de lo que las raíces pueden hacerlo (Jakobsen, 1995). Los hongos permiten la incorporación de elementos esenciales poco móviles en el suelo como P (primordialmente), Zn y Cu (Burket y Robson, 1994), con una consecuente reducción en el costo de fertilizantes fosforados. Esto repercute en ahorro de insumos en el vivero florícola y menor impacto ecológico al sistema suelo–planta (González–Chávez y Ferrera–Cerrato, 1995). Las plantas micorrizadas, generalmente, incrementan su peso, altura, diámetro y número de brotes en comparación con las de plantas no micorrizadas (Atkinson et al., 1994; Graham y Eissenstat, 1998; González–Chávez et al., 2000; Pedraza–Santos et al., 2001).
El hongo, por su parte, obtiene carbohidratos y otras fuentes de carbono para su metabolismo (Eissenstat et al., 1993). Sin embargo, la expresión benéfica de la simbiosis depende del tipo de sustrato, ya que su naturaleza y propiedades físicas y químicas afectan el establecimiento y comportamiento de los HMA (González–Chávez et al., 2000). Dentro de algunas propiedades físicas benéficas para el establecimiento de la colonización, como para el cultivo en maceta se encuentran: adecuada aireación, drenaje, capacidad de retención de agua y baja densidad aparente (Cabrera, 1999; González–Chávez, et al., 2000). Las bajas concentraciones de oxígeno en el sustrato pueden inhibir severamente la germinación de las esporas de los HMA y su colonización radical (Wang et al., 1993). Por lo que el sustrato ideal para favorecer la colonización micorrízica debe permitir el suministro de agua y oxígeno balanceado.
La calidad del sustrato elegido es el principal factor del cuál depende el éxito de un cultivo en contenedor. Los sustratos empleados para el cultivo de plantas en maceta tienen una composición muy variable, desde suelo mineral u otros componentes inorgánicos, hasta materiales orgánicos naturales o sintéticos; comúnmente se usan mezclas de ambos tipos de ingredientes, en proporciones variables (Ansorena, 1994; Cabrera, 1999). Un medio de cultivo o sustrato debe diseñarse para aumentar al máximo su contenido de agua y aire (Cabrera, 1999), ya que el drenaje y aireación son esenciales para permitir un riego abundante, asegurar un sistema radical saludable y crecimiento vigoroso de la parte superior. Las propiedades físicas de un sustrato como aireación, drenaje, retención de agua y densidad aparente, son consideradas como las más importantes debido a que si la estructura física es inadecuada, difícilmente se podrá mejorar una vez que se ha establecido el cultivo. Los niveles óptimos de estas propiedades son: capacidad de aireación, 10 a 20%; retención de agua, 55 a 70%; granulometría de 0.25 a 2.25 mm; densidad aparente <0.4 g·cm–3; agua fácilmente disponible de 20 a 30% y espacio poroso total de 70 a 85% (Bunt, 1988; Cabrera, 1999).
Las características químicas del sustrato son importantes ya que influyen en la nutrición de los cultivos, entre ellas destacan pH de 5.2 a 6.3, CE de 0.75 a 3.49 dS·m–1 y contenido de materia orgánica >80% (Ansorena, 1994). Los materiales orgánicos son los componentes que contribuyen mayormente a la química de los sustratos, debido a la formación y presencia de las sustancias húmicas; el producto final más importante de la descomposición de la materia orgánica (Abad y Noguera, 2000).
El presente estudio tuvo como objetivos: a) determinar el efecto de tres sustratos en el establecimiento de la asociación micorrízica de dos hongos (Glomus mosseae BEG–25 y BEG–132) en plantas de nochebuena cv. Supjibi Red; b) determinar el efecto de los sustratos y micorrizas en el desarrollo y calidad de las plantas; y c) comparar el efecto de la inoculación con HMA con la fertilización tradicional aplicada por los productores sobre los mismos aspectos de la planta.
MATERIALES Y MÉTODOS
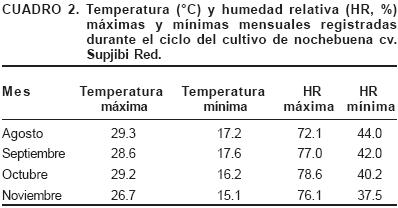
El experimento se realizó en un invernadero de cristal tipo capilla del Instituto de Horticultura de la Universidad Autónoma Chapingo, México, localizado entre los 19° 31' de latitud norte y los 98° 53' de longitud oeste, a una altitud de 2,353 m (García, 1988). Se utilizaron esquejes enraizados de nochebuena cv. Supjibi Red con altura promedio de 8 cm y con dos a tres hojas desarrolladas. Los esquejes se transplantaron en macetas de 6" de diámetro. Se establecieron 12 tratamientos con 10 repeticiones cada uno, la unidad experimental fue una planta. El diseño experimental fue completamente al azar, con arreglo factorial 3 x 4 (tres sustratos y cuatro formas de nutrición). Los sustratos que se usaron no se esterilizaron y estos fueron: S1, mezcla de tierra de hoja de encino + tezontle + turba + agrolita (9:3:2:2 v/v); S2, turba + vermiculita (2:1 v/v); y S3, tezontle rojo solo (tamaño de partícula 1 a 2 mm). En el Cuadro 1 se presentan las características químicas y físicas de los sustratos. Los hongos arbusculares fueron: G. mosseae BEG–25 y G. mosseae BEG–132. Se colocaron 22 g de inóculo en el orificio de transplante de las plantas (38 esporas de G. mosseae BEG–25 y 31 de G. mosseae BEG–132 por g de inóculo). Se manejaron dos niveles de fertilización: con y sin fertilización. Se utilizó el fertilizante comercial Peters® en concentraciones de 3.75 g·litro–1 (8–45–14, N–P2O5–K2O) y 1 g·litro–1 (7–40–17). La fórmula 8–45–14 se aplicó cada tercer día hasta los primeros 20 días; posteriormente, se usó 7–40–17, la cual se aplicó diariamente hasta el final del estudio. En todos los casos se aplicaron 100 ml por planta. El agua utilizada en el invernadero contenía (meq·litro–1): 2.05 SO42–, 0.5 Cl, 2 HCO3–, 0.2 K, 1.21 Ca, 1.67 Mg, 1.03 Na y 0.045 B. Para inducir la floración, se manejó un fotoperíodo de 10 h:14 h luz:obscuridad, a partir de los 66 días después del trasplante (ddt), para lo cual se utilizó plástico negro calibre 600 de alta densidad. Las temperaturas máximas y mínimas y la humedad relativa fueron registradas diariamente con un termo–higrómetro digital (Control Company), los promedios mensuales se presentan en el Cuadro 2. Las variables respuesta evaluadas al final del experimento (150 ddt) incluyeron la altura de planta (n = 10), área foliar total y área de brácteas de la inflorescencia principal (n = 3). La longitud del brote más alto se consideró como la altura de planta. El área foliar y de brácteas se midieron con un integrador de área foliar de rodillo LI–COR modelo LI–3100. Se registró el número de flores, de hojas y de brotes por planta (n = 10). Se evaluó el peso seco aéreo y radical (n = 3), para ello se separó la parte aérea de la raíz y éstas se secaron en una estufa con aire forzado a 70 °C por 48 h. Se determinó el peso específico en las hojas de tres plantas por tratamiento, mediante la relación peso seco foliar/área foliar. Se registró el inicio de pigmentación (n = 10) que se consideró cuando aparecieron las primeras manchas rojizas en las hojas de transición, y de floración (n = 10) cuando aparecieron los primeros estambres, para lo que se contabilizaron los días a partir del trasplante. Se evaluó el porcentaje de colonización micorrízica (n = 3) por el método descrito por González–Chávez (1993). La concentración nutrimental se evaluó en las hojas que se utilizaron para evaluar el área foliar (n = 3). La concentración de nitrógeno se determinó por el método de MicroKjeldahl; el fósforo por el método del molibdovanadato amarillo; el potasio por flamometría con un fotómetro de llama Corning 400; las concentraciones de calcio, cobre, magnesio, zinc y manganeso se determinaron en un espectrofotómetro de absorción atómica modelo UNICAM 989 AA Spectrometer, todos ellos descritos por Alcántar y Sandoval (1999). La concentración de boro se determinó por fotocolorimetría con el método de Azometina–H (Chapman y Pratt, 1973).

Para el análisis estadístico se usó el programa SAS versión 8, se realizó análisis de varianza para un arreglo factorial, comparación de medias de Tukey (P≤0.05) y análisis de correlación de Pearson.
RESULTADOS
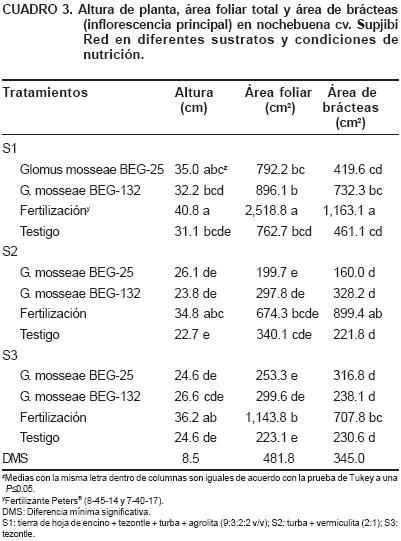
Altura de planta, área foliar y área de brácteas de la inflorescencia principal
Las plantas más altas se obtuvieron con los tratamientos con fertilización para cada sustrato (40.8, 34.8 y 36.2 cm para S1, S2 y S3, respectivamente) seguido del S1 + G. mosseae BEG 25 (35 cm). La mayor área foliar se presentó en plantas que se desarrollaron en S1 con fertilización (2,518.8 cm2), superando significativamente a las plantas de los otros sustratos. Las plantas con la mayor área total de brácteas se presentaron en los tratamientos con fertilización en cada uno de los sustratos que se evaluaron; sin embargo, la combinación de S1 y fertilización estimuló el desarrollo del área de la inflorescencia, hasta 1,163.1 cm2 (Cuadro 3).
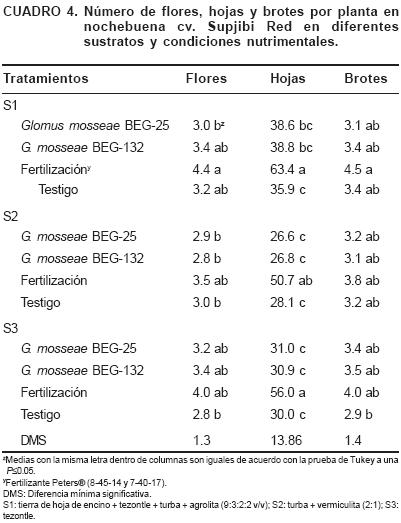
Número de flores, hojas y brotes por planta
El mayor número de flores (4.4) se obtuvo con el S1 más fertilización. Los valores más bajos se presentaron en los tratamientos con S1 inoculado con G. mosseae BEG–25, S2 inoculado con los dos HMA y su respectivo testigo y en el testigo del S3. El mayor número de hojas se observó en el S1 y S3 con fertilización (63.4 y 56, respectivamente). El mayor número de brotes (4.5) se observó en el S1 con fertilización y el menor (2.9) en el testigo del S3 (Cuadro 4).
Peso seco de la parte aérea, raíz y peso específico foliar
Las plantas con mayor peso seco de la parte aérea se presentaron en el S1 con fertilización (26.3 g), superando significativamente al resto de los tratamientos (Cuadro 5). Los tratamientos con fertilización tendieron a incrementar este peso seco con respecto a los testigos y a las plantas inoculadas. El peso seco de la parte aérea se correlacionó positivamente con el número de hojas, el área foliar y el área de brácteas (r = 0.85, 0.88 y 0.81, respectivamente).
El sustrato que favoreció el crecimiento de las plantas fue el S1 (mezcla de tierra de hoja de encino + tezontle + turba + agrolita). Las plantas que crecieron en el S1 fueron las que presentaron mayor acumulación de peso seco radical comparadas con las de los otros dos sustratos; no obstante, el mayor peso (5.3 g) se obtuvo en el S1 con Glomus mosseae BEG–132. El más alto peso específico foliar (4.2 mg·cm–2) se obtuvo con el S2 más fertilización, los valores más bajos (2.5 a 2.7 mg·cm–2) se presentaron en el S1 inoculado con los dos HMA y en el S2 y S3 inoculados con G. mosseae BEG–25 (Cuadro 5).
Inicio de pigmentación y de floración
Las plantas establecidas en el S2 con fertilización fueron las que tardaron más en iniciar la pigmentación (99.7 días), seguidas por las plantas que crecieron en S3 y fertilización (92.4 días). El resto de los tratamientos fueron estadísticamente similares entre ellos y presentaron la pigmentación entre los 85 y 88 días después del transplante. No se presentaron efectos significativos por la inoculación micorrízica (Cuadro 5). El sustrato mostró efecto significativo en esta variable, el S1 fue el que promovió antes la pigmentación, con un adelanto de 6 y 3 días respecto al S2 y S3 (Cuadro 6).
El sustrato también tuvo efecto altamente significativo en el inicio de la floración. Las plantas desarrolladas en el S1 la presentaron a los 106 días, en el S2 a los 111.8 días y el S3 a los 109 días, con diferencias estadísticas entre los tres sustratos (Cuadro 6).

Porcentaje de colonización
Hubo un efecto altamente significativo del sustrato en el porcentaje de colonización. El mayor porcentaje se obtuvo en plantas inoculadas con G. mosseae BEG–132 (80.2%) y con G. mosseae BEG–25 (65.6%) que crecieron en el S1. Sin embargo, todos los tratamientos en este sustrato presentaron colonización incluso las raíces de plantas no inoculadas, testigo (56.1%) y con sólo fertilización (11.8%). Este sustrato no se esterilizó, que es la forma como lo usan los productores, lo cual indica que éste contenía hongos micorrízicos nativos. Los porcentajes de colonización en S2 y S3 fueron muy bajos (de 1 a 7%) (Cuadro 7).

Concentración nutrimental
En la concentración nutrimental se presentaron diferencias estadísticas entre tratamientos. La mayor concentración de N en las hojas se obtuvo con los tratamientos S2 y S3 con fertilización (2.9 y 1.92%, respectivamente) seguidos del S1 también con fertilización (1.41%); el resto de tratamientos tuvieron estadísticamente las mismas concentraciones (Cuadro 8). El efecto de la fertilización sobre la concentración de N se observa en el Cuadro 9. Las más altas concentraciones de P se presentaron con el S1 más fertilización (0.22%), S2 con G . mosseae BEG 132 y su testigo (0.19%) y S3 con G . mosseae BEG 25 y su testigo (0.20 y 0.19%, respectivamente); el porcentaje más bajo se obtuvo con el S2 con BEG 25 (0.06%). No se observó efecto de los HMA en la concentración de P, ya que no superaron la del testigo (Cuadro 9). La concentración de K estadísticamente mayor S2 con G. mosseae BEG 25, en tanto que los porcentajes menores se presentaron en el S1 y S2 ambos con G. mosseae BEG 132 (0.39 y 0.37%, respectivamente) y en el S3 con G. mosseae BEG 25 (0.40%) y su testigo (0.39%). Las mayores concentraciones de Ca se observaron en el S1 con G. mosseae BEG 25 (2.26%) y en el testigo del S2 (2.14%); la concentración menor (1.24%) se encontró con el S3 más fertilización (Cuadro 8); también se observó un efecto significativo del sustrato, el mejor sustrato para la concentración de este elemento fue el S1 seguido del S2 (1.97 y 1.80%), respectivamente (Cuadro 11). Para el caso del Mg no se encontraron diferencias estadísticas entre tratamientos (Cuadro 8), pero si se presentó un efecto significativo de la fertilización al sustrato (Cuadro 9). Las concentraciones de N, P y K registradas en todos los tratamientos fueron bajos comparados con los reportados como de suficiencia para plantas de nochebuena de buena calidad por Dole y Wilkins (2005) (4 a 6 para N, 0.3 a 0.6 para P y 1.5 a 3.5% para K); sin embargo, las plantas no manifestaron síntomas de deficiencia, lo que puede deberse al cultivar ya que los autores no especifican el cultivar sobre el cual se hicieron las determinaciones. En el caso del Ca y Mg los valores fueron de suficiencia dado que se encontraron en los rangos de 0.7 a 1.8 y 0.3 a 1.0%, respectivamente, según los mismos autores.

Las mayores concentraciones de Fe en las hojas se obtuvieron con el S2 y S3 más fertilización (204 y 163.67 mg·kg–1); la concentración más alta de Cu (26.67 mg·kg–1) se presentó con el S1 más G. mosseae BEG 132 y la más baja (5.5 mg·kg–1) en el testigo del S3; las concentraciones mayores de Zn se presentaron en todos los tratamientos con el S1 y en el testigo del S2; en tanto que la concentración más baja (8 mg·kg–1) se presentó en el testigo del S3; en tanto que en este mismo tratamiento, se registró la mayor concentración de B (110.56 mg·kg–1) (Cuadro 10). El Zn y el B fueron elementos cuya concentración tuvo un efecto significativo del sustrato, el S1 promovió mayor concentración de Zn (14.17 mg·kg–1) y el S3 la mayor de B (68.78 mg·kg–1) (Cuadro 11). La concentración de Mn presentó efecto significativo del tipo de nutrición (Cuadro 9), la fertilización fue la que promovió mayor concentración en los tres tipos de sustratos (Cuadro 10). La fertilización en el S2 y S3 fueron los únicos tratamientos que condujeron a concentraciones de Fe adecuados (entre 100 y 300 mg·kg–1), las concentraciones de Cu en todos los tratamientos fueron de suficiencia (2 a 10 mg·kg–1), en tanto que las de Zn fueron bajos (valores de suficiencia 25 a 60 mg·kg–1). Las concentraciones de Mn fueron de suficiencia (60 a 300 mg·kg–1) con los tres sustratos más fertilización, el testigo del S2 y el S3 con G. mosseae BEG 25. Todos los tratamientos, con excepción del S1 más fertilización y el testigo del S2, presentaron concentraciones de B de suficiencia (25 a 75 mg·kg–1), todos los valores de suficiencia citados son los indicados por Dole y Wilkins (2005). En ningún tratamiento se mostraron síntomas visuales de deficiencia.
DISCUSIÓN
Existen evidencias de que la inoculación con HMA incrementa el crecimiento de la planta (González–Chávez et al., 2000; Pedraza–Santos et al., 2001; Alarcón y Ferrera–Cerrato, 2003); sin embargo, en este trabajo la micorrización no mejoró significativamente las variables de crecimiento como altura de la planta, área foliar, área de brácteas de la inflorescencia principal, número de hojas y de flores y la acumulación de peso seco aéreo. El efecto sobre estas variables de los HMA utilizados en este trabajo, fue superado por la fertilización en los tres sustratos. Esto se debe al suministro constante de minerales en los tratamientos fertilizados, lo cual generó condiciones de alta fertilidad en los sustratos e incrementó todos los parámetros de crecimiento (Davies, 1987).
Al comparar los sustratos en relación a la colonización de HMA, los mejores resultados se obtuvieron con el S1, cuyas propiedades (Cuadro 1) favorecieron el establecimiento de la simbiosis entre la raíz y los HMA en estudio. En este sustrato se tuvieron porcentajes altos de micorrización, aunque la colonización no fue resultado exclusivo de las dos cepas de Glomus inoculadas, sino también de la colonización por cepas nativas de HMA que colonizaron en 56% las raíces de plantas testigo. No obstante, la fertilidad del S1 combinada con la aplicación del fertilizante Peters® usado por los productores, promovió mayor crecimiento de las plantas y superaron el crecimiento de plantas inoculadas y testigo.
La colonización tan baja de las raíces en los S2 y S3 se puede deber a las características fisicoquímicas de estos sustratos. La naturaleza y propiedades del sustrato son determinantes para el establecimiento de la simbiosis y para el comportamiento de los HMA (González–Chávez et al., 2000). Propiedades como pH, temperatura y cantidad de agua en el sustrato pueden limitar o inhibir la esporulación de los hongos (Smith y Gianinazzi–Pearson, 1988). Baja capacidad de aireación conduce a concentraciones de oxígeno tan bajas que inhiben la germinación de las esporas de los HMA (Wang et al., 1993). Algunos trabajos han indicado que concentraciones de oxígeno entre 12 y 16% son idóneas para la micorrización y expresión benéfica de la simbiosis en el crecimiento de la planta (Saif, 1981). La turba es un sustrato que se caracteriza por presentar alta capacidad de retención de agua (hasta 90%) dependiendo del tipo y grado de humificación (Adams, 2004). Esto podría en parte, explicar la escasa colonización en las plantas que crecieron en el S2, cuyo componente principal fue la turba. Este sustrato presentó alta capacidad de retención de agua (75%) y por lo tanto, baja capacidad de aireación (1.1%, Cuadro 1). En el caso del S3 (tezontle) presentó baja capacidad de retención de agua (27.1%) y buena capacidad de aireación (22.4%, Cuadro 1). Estos factores no favorecieron la micorrización y el desarrollo radical, Saif (1981) mencionó que un sustrato ideal para el establecimiento de una simbiosis micorrízica eficiente debe proveer concentraciones de oxígeno entre 12 y 16%.
El mayor peso seco de raíz, al contrario del peso seco de la parte aérea, se obtuvo en los tratamientos cuyas raíces estaban colonizadas; es decir, en el S1 con inoculación con las dos cepas de Glomus y el testigo, que también presentó colonización por las cepas nativas que se encontraban en el sustrato. Atkinson et al. (1994) mencionaron que los HMA no influyen en la longitud de las raíces, pero pueden incrementar la intensidad de ramificación de las mismas y el peso seco radical. Lo que puede explicar este aumento de peso seco radical en los tratamientos inoculados. En cambio, el peso seco de la parte aérea fue favorecido por la fertilización a los tres sustratos, pero sobre todo en el S1 cuyo peso fue el más alto. Esto pudo deberse al efecto favorable de los hongos sobre el crecimiento de la raíz y a un efecto desfavorable de éstos sobre el crecimiento de la parte aérea, provocado por cambios en la producción y distribución de fotosintatos como lo observaron en cítricos Syvertsen y Graham (1990); de tal manera, que los fotosintatos de la parte aérea de la planta son translocados a la raíz y a los HMA, los que demandan una gran cantidad de estos para su metabolismo (Bago et al., 2000), en lugar de ser utilizados en el crecimiento de la parte aérea. Además del efecto positivo de los HMA sobre el peso seco radical, la acumulación de materia seca en la raíz con el S1 pudo deberse también a sus propiedades físicas y químicas, como fertilidad, capacidad de aireación (10.28%) y de retención de agua (52.5%), factores que promovieron el desarrollo radical, dado que los valores de estas características son considerados como adecuados para plantas en maceta (Cabrera, 1999).
La fertilización en S2 y S3 retrasó el inicio de pigmentación (99.7 a 92.4 días), el resto de tratamientos presentaron un tiempo más corto (85 a 88 días) (Cuadro 5), independientemente de si había o no micorrización; en el Cuadro 6 se observa que hubo efecto significativo del sustrato más que de la inoculación en la pigmentación y en la floración. Estos resultados no coinciden con los observados por otros autores en algunas ornamentales, ya que reportan que los HMA inducen adelanto de la floración en gerbera (Wang et al., 1993), arlequín (Scagel, 2004) y Callistephus chinensis (Gaur y Adholeya, 2005). Este adelanto en pigmentación y floración que se obtuvo, sobre todo con el S1, implica una salida al mercado más temprana. Esto repercute en la economía del floricultor con ahorro en los costos de producción, ya que habrá disminución en el costo de fertilizantes, así como en el uso de calefacción (si es el caso), riegos, número de jornales en el cuidado de las plantas y riesgo de incidencia de patógenos. En este último aspecto Pythium y otros hongos patógenos radicales se presentan cuando la temperatura desciende y hay exceso de humedad en el sustrato. En consecuencia también se tiene la disminución en la liberación de contaminantes al medio.
La fertilización de los sustratos promovió mayor calidad de plantas de nochebuena (mayor altura, floración, número de hojas, brotes). Sin embargo, resulta importante mencionar que ante la diversidad de gustos del comprador de estas flores, tanto las plantas grandes y frondosas, así como las pequeñas, obtenidas con la inoculación de los HMA, se venden. El aspecto más relevante de la comercialización y de este trabajo puede ser que las plantas que crecieron en el S1 que además estuvieron colonizadas, llegarían al mercado antes que las plantas fertilizadas del S2 y S3.
No se observó una correspondencia entre altos porcentajes de micorrización y mayor concentración nutrimental en las hojas, sobre todo con la de P, dado que las plantas de los tratamientos sin micorrización como las del testigo del S2 y S3 presentaron las mismas concentraciones de P que aquéllas con micorrización (Cuadro 8). En las plantas micorrizadas se incrementa la eficiencia en el uso del agua y en la absorción y translocación de nutrimentos (González–Chávez, 1993; Scagel, 2004). Los HMA permiten la incorporación de elementos esenciales poco móviles en el suelo como P, Zn y Cu (Burket y Robson, 1994), con una consecuente reducción en el costo de fertilizantes fosforados. Sin embargo, en este trabajo la concentración de P no estuvo exclusivamente relacionada con la colonización de HMA, ya que los tratamientos con inoculación tuvieron el mismo efecto en la concentración que los testigos de S2 y S3 y el S1 con fertilización (Cuadro 8). En la concentración foliar de Zn se observó un efecto significativo del sustrato más que de la inoculación (Cuadro 11). La concentración foliar de Cu no se vio claramente favorecida por la inoculación, ya que estos tratamientos no superaron a los tratamientos con fertilización, ni a los testigo del S1 y S2 (Cuadro 10). Estos resultados se deben a que las mezclas utilizadas como sustratos contenían minerales disponibles para la planta (Cuadro 1) y la fertilidad del sustrato es un factor que afecta la capacidad de absorción de elementos poco móviles y/o insolubles. El éxito en el establecimiento de la simbiosis y la consecuente mejoría en la nutrición de la planta, depende del grado de fertilidad del suelo o sustrato y de las especies de HMA, presentándose los mejores resultados en condiciones de baja fertilidad (Guadarrama et al., 2004). Davies (1987) observó que los HMA tuvieron mayor efecto sobre la absorción nutrimental a niveles intermedios de fertilidad del sustrato (1.2 kg·m–3 de la fórmula 18N–6P–12K). El fertilizante comercial Peters® que el floricultor utiliza resulta eficiente para el crecimiento de las plantas de nochebuena y en el S1 su efecto fue significativo. Dado que el fertilizante aplicado sólo aportaba N–P–K, estos tres y el resto de nutrimentos fue aportado por el S1 que los contenía (Cuadro 1) y por el agua de riego que contenía Ca, Mg, Na, K, Cl, SO4 y B. Esto también ayuda a explicar los resultados obtenidos en el tratamiento testigo del S1, S2 y S3 los cuales sólo se regaron con agua.
CONCLUSIONES
El mejor sustrato para el establecimiento de la asociación micorrízica fue el S1 (mezcla de tierra de hoja de encino + tezontle + turba + agrolita), pero el mejor tratamiento para el crecimiento y calidad de las plantas fue con este sustrato y con la fertilización con Peters® que normalmente hacen los productores. La inoculación con las cepas micorrízicas no mejoró el estado nutrimental de las plantas.
LITERATURA CITADA
ABAD B., M.; NOGUERA M., P. 2000. Sustratos para el cultivo sin suelo. pp. 287–342. In: Fertirrigación. Cultivos Hortícolas y Ornamentales. 2ª. Edición. CADAHIA L., C. (ed.). Ediciones Mundi–Prensa, Madrid, España. [ Links ]
ADAMS, P. 2004. Aspectos de nutrición mineral en cultivos sin suelo en relación al suelo, pp. 95–104. In: Tratado de Cultivo sin Suelo. URRESTARAZU, M.G. (ed.). Ediciones Mundi–Prensa, Madrid, España. [ Links ]
ALARCÓN, A.; FERRERA–CERRATO, R. 2003. Aplicación de fósforo e inoculación de hongos micorrízicos arbusculares en el crecimiento y estado nutricional de Citrus volkameriana Tan & Pasq. Terra. 21: 91–99. [ Links ]
ALCÁNTAR, G. G.; SANDOVAL, V. M. 1999. Manual de Análisis Químico de Tejido Vegetal. Guía de Muestreo, Preparación, Análisis e Interpretación. Publicación Especial Núm. 10 de la Sociedad Mexicana de la Ciencia del Suelo, A. C. Chapingo, México. 155 p. [ Links ]
ANSORENA, M. J. 1994. Sustratos propiedades y caracterización. Ediciones Mundi–Prensa. Barcelona, España. 172 p. [ Links ]
ATKINSON, D.; BERTA, G.; HOOKER, J. F. 1994. Impact of mycorrhizal colonization on root architecture root longevity and the formation of growth regulators, p. 93. In: Impact of Arbuscular Mycorrhizas on Sustainable Agriculture and Natural Ecosystems. S. GIANINAZZI; H. SCHÜEPP. (eds.). Birkhäuser, Alemania. [ Links ]
BAGO, B.; PFEFFER, P. E.; SHACHAR–HILL, Y. 2000. Carbon metabolism and transport in arbuscular mycorrhizas. Plant Physiol. 124: 949–958. [ Links ]
BUNT, A. C. 1988. Media and Mixes for Container. Grown Plants. Unwin Hyman. London, Great Britain. 309 p. [ Links ]
BURKERT, B.; ROBSON, A. 1994. Zn uptake in subterranean clover (Trifolium subterraneum L.) by three vesicular–arbuscular mycorrhizal fungi in a root–free sandy soil. Soil Biol. Biochem. 26: 1117–1124. [ Links ]
CABRERA I., R. 1999. Propiedades, uso y manejo de sustratos de cultivo para la producción de plantas en maceta. Revista Chapingo Serie Horticultura 5: 5–11. [ Links ]
CHAPMAN, H. D.; PRATT, P. E. 1973. Métodos de Análisis para Suelos, Plantas y Aguas. Editorial Trillas, México. D. F. 195 p. [ Links ]
CLARK, R. B.; ZETO, S. K. 2000. Mineral acquisition by arbuscular mycorrhizal plants. J. Plant Nutrition 23: 867–902. [ Links ]
DAVIES, F. T. JR. 1987. Effects of VA–mycorrhizal fungi on growth and nutrient uptake of cuttings of Rosa multiflora in two container media with three levels of fertilizer application. Plant Soil 104: 31–35. [ Links ]
DOLE, J. M.; WILKINS, H. F. 2005. Floriculture. Principles and Species. 2nd. Edition. Pearson Prentice Hall. New Jersey, USA. 1023 p. [ Links ]
EISSENSTAT, D. M.; GRAHAM. J. H.; SYVERTSEN, J. P.; DROUILLARD, D. L. 1993. Carbon economy of sour orange in relation to mycorrhizal colonization and phosphorus status. Ann. Botany 71: 1–10. [ Links ]
GALICIA–JIMÉNEZ, A. B.; TREJO, C.; VALDEZ–AGUILAR, L. A.; RODRÍGUEZ–GONZÁLEZ, M. T.; PEÑA–VALDIVIA, C. B. 2001. Shade intensity and its effect in morphology and physiology of poinsettia (Euphorbia pulcherrima Willd). Revista Chapingo Serie Horticultura 7: 143–149. [ Links ]
GARCÍA, E. 1988. Modificaciones al Sistema de Clasificación Climática de Köppen. México, D. F. 219 p. [ Links ]
GAUR, A.; ADHOLEYA, A. 2005. Diverse response of five ornamental plant species to mixed indigenous and single isolate arbuscular–mycorrhizal inocula in marginal soil amended with organic matter. J. Plant Nutrition 28: 707–723. [ Links ]
GONZÁLEZ–CHÁVEZ, M. C. 1993. La endomicorriza vesículo–arbuscular, pp: 53–92. In: Manual de Agromicrobiología. FERRERA–CERRATO, R. (ed.). Editorial Trillas. México, D. F. [ Links ]
GONZÁLEZ–CHÁVEZ, M. C.; FERRERA–CERRATO, R. 1995. La endomicorriza vesículo arbuscular. Asociación simbiòtica entre hongos para la producción de frutales. Agroproductividad No. 3: 11–17. [ Links ]
GONZÁLEZ–CHÁVEZ, M. C.; FERRERA–CERRATO, R.; VILLEGAS–MONTER, A.; OROPEZA, J. L. 2000. Selección de sustratos de crecimiento en microplántulas de cítricos inoculadas con Glomus sp. Zac–19. Terra 18: 369–378. [ Links ]
GRAHAM, J. H.; EISSENSTAT, D. M. 1998. Field evidence for the carbon cost of citrus mycorrhizas. New Phytol. 140: 103–110. [ Links ]
GRUEBER, K .L .1985. Euphorbia pulcherrima, pp:488–495. In: Handbook of Flowering Vol. II. HALEVY, A. H. (ed.). CRC Press, Inc. Boca Raton. Florida, USA. [ Links ]
GUADARRAMA, P.; ÁLVAREZ–SÁNCHEZ, J.; ESTRADA–TORRES, A. 2004. Phosphorus dependence in seedlings of a tropical pioneer tree: the role of arbuscular mycorrhizae. J. of Plant Nutr. 27: 2159–2174. [ Links ]
JAKOBSEN, I. 1995. Transport of phosphorus and carbon in VA mycorrhizas, pp: 297–324. In: Mycorrhiza: Structure, Function, Molecular Biology and Biotechnology. VARMA, A.; HOCK, B. (eds.). Springer–Verlag. Berlin, Germany. [ Links ]
PEDRAZA–SANTOS, M.; JEAN–CONTRERAS, D.; GUTIÉRREZ–ESPINOZA, A.; COLINAS–LEÓN, T. LÓPEZ–PERALTA, C. 2001. Crecimiento y nutrición de microplantas de gerbera inoculadas con hongos micorrízicos arbusculares. Agrociencia 35: 149–158. [ Links ]
SAIF, S. R. 1981. The influence of soil aeration on the efficiency of vesicular–arbuscular mycorrhizae. I. Effect of soil oxygen on the growth and mineral uptake of Eupatorium odoratum L. inoculated with Glomus macrocarpus. New Phytol. 88: 649–659. [ Links ]
SCAGEL, C. F. 2004. Inoculation with vesicular–arbuscular micorrhizal fungi and rhizobacteria alters nutrient allocation and flowering of harlequin flower. HorTechnology 14: 39–48. [ Links ]
SMITH, S. E.; GIANINAZZI–PEARSON, V. 1988. Physiological interaction between symbionts in vesicular–arbuscular mycorrhizal plants. Annu. Rev. Plant Physiol. Mol. Biol. 39: 221–244. [ Links ]
SYVERTSEN, J. P.; GRAHAM, J. H. 1990. Influence of vesicular arbuscular mycorrhizae and leaf age on net gas exchange of Citrus leaves. Plant Physiol. 94: 1424–1428. [ Links ]
WANG, H.; PARENT, S.; GOSSELIN, A.; DESJARDINS, Y. 1993. Vesicular– arbuscular mycorrhizal peat–based substrates enhance symbiosis establishment and growth of three micropropagated species. J. Amer. Hort. Sci. 118: 896–901. [ Links ]




![Comportamiento de dos cultivares de limón mexicano [Citrus aurantifolia (Christm) Swingle] en portainjertos desarrollados en suelos con dos profundidades](/img/es/prev.gif)









